二氧化钛纳米粒子联合LED光照射对口腔变异链球菌的抑制作用及其机制
闫琳琳,朱 琳,赵远航,宋嘉卓,邹馨颖,刘 新,赵 红,张志民,张 红
(1.吉林大学口腔医院牙体牙髓科,吉林 长春 130021;2.吉林省口腔生物医学国际联合研究中心,吉林 长春 130021;3.吉林大学 超分子结构与材料国家重点实验室,吉林 长春 130012)
龋病是一种以特定细菌及其毒性产物为首要原因引起的多因素慢性感染性疾病,会造成牙体硬组织脱矿和渐进性破坏[1]。变异链球菌(Streptococcus mutans)是革兰阳性细菌,是公认的引起龋病的主要细菌,可通过代谢碳水化合物产生有机酸,并对低pH值环境有较强适应能力[2]。变异链球菌还能够产生葡糖基转移酶(glucosyltransferases, GTFs), 促 进 胞 外 多 糖(extracellular polysaccharides,EPS)的合成,造成细菌在牙齿表面有效定植,从而形成有较强致龋性的菌斑生物膜[3]。因此,抑制变异链球菌是预防和控制龋病的有效方法[4]。
目前,纳米技术推动了纳米抗菌材料的快速发展,纳米材料具有较大比表面积,能明显提高材料表面的化学反应性[5]。金属和金属氧化物纳米颗粒作为有效的新型抗菌剂越来越受到重视[6],其中二氧 化 钛 (TiO2) 纳 米 粒 子 (TiO2nanoparticles,TiO2NPs)具有较好生物安全性、较低成本、丰富产量和优越的化学性能,尤其因具备较好的光催化杀菌活性而引起广泛关注[7]。TiO2是一种化学性质稳定的材料,在光照下可持续发挥抗菌作用,在消毒、清洁水、除臭和控制污染等方面广泛应用。然而,由于TiO2禁带较宽,通常只有紫外光照射才能将其激发。为了减少紫外光带来的危害,研究者通过掺杂技术成功将TiO2改性,使其吸收波长扩大至可见光范围[8]。IBRAHIM 等[9]制备了银掺杂的TiO2(Ag-TiO2)薄膜,结果表明:Ag-TiO2能有效灭活大肠杆菌和金黄色葡萄球菌。ZANE等[10]合 成 了 氮 (nitrogen, N) 掺 杂 的TiO2(N-TiO2),其在蓝光照射60 min后对大肠杆菌有明显的抗菌效果。虽然上述研究确定了金属掺杂TiO2和非金属掺杂TiO2有明显的抗菌作用,但尚无研究明确金属与非金属共掺杂TiO2联合LED光照射对变异链球菌有抑制作用。本实验采用六水合硝酸锌和氨水分别作为锌(zinc,Zn)和N的来源,通过溶胶-水热法对TiO2进行共掺杂,制备了新型Zn和N共掺杂TiO2NPs(Zn-N-TiO2nanoparticles,Zn-N-TiO2NPs),在牙科发光二极管(light emitting diode,LED)光固化灯光照激发Zn-N-TiO2NPs的条件下,明确其对变异链球菌的抑制作用,并初步探讨其抗菌机制,以期为Zn-NTiO2NPs在预防龋病领域的应用提供理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器
变异链球菌(UV159,中国科学院),BHI培养基(英国Oxoid公司),琼脂(德国BioFroxx公司),N-乙酰半胱氨酸(N-acetylcysteine,NAC)和1,3-二 苯 基 异 苯 并 呋 喃 (1,3-diphenylisobenzofuran,DPBF)(上海Aladdin公司),钛酸丁酯(天津市光复精细化工研究所),无水乙醇、六水合硝酸锌和氨水(国药集团化学试剂有限公司),去离子水(实验室自制)。磁力搅拌器(河南省巩义市予华仪器有限责任公司),电热鼓风干燥箱(上海一恒科学仪器有限公司),高速离心机(安徽中科中佳科学仪器有限公司),超声仪(江苏省昆山市超声仪器有限公司),真空干燥箱(上海森信实验仪器有限公司),马弗炉(安徽省合肥科晶材料技术有限公司),CO2恒温细胞培养箱(日本SANYO公司),牙科LED光固化灯(瑞士义获嘉伟瓦登特公司),Cure Rite辐 射 仪 (美国DENSPLY公司),X射线多晶衍射仪(德国布鲁克公司),扫描电子显微镜(scanning electron microscope,SEM)(日本日立公司),LabRAM ARAMIS智能拉曼光谱仪(法国HORIBA Jobin Yvon公司),紫外可见分光光度计(南京菲勒仪器有限公司),多功能酶标仪(美国BioTek仪器公司)。
1.2 纳米粒子的制备
采用溶胶-水热法制备TiO2NPs,具体方法如下:取5 mL钛酸丁酯和5 mL无水乙醇混合得A溶液,取20 mL无水乙醇、5 mL水和1 mL浓硝酸混合得B溶液,将A溶液缓慢滴加进入剧烈搅拌的B溶液。滴加完成后,继续搅拌混合溶液120 min得到淡黄色透明溶胶。将溶胶移至水热釜中,160℃条件下加热360 min后,将产物浸泡于无水乙醇中超声震荡处理30 min,高速离心10 min,抽真空60℃条件下将离心后的产物干燥24 h获得TiO2NPs前驱体,将前驱体置于马弗炉内450℃焙烧120 min得到TiO2NPs。
根据设计掺杂比例分别添加适量六水合硝酸锌和氨水至B溶液,使Zn与钛(titanium,Ti)的摩尔比分别为1%∶1、3%∶1、5%∶1和7%∶1,N与Ti的摩尔比为3%∶1,其他实验条件不变,得到不同掺杂浓度的Zn-N-TiO2NPs:1%Zn-3%NTiO2NPs(Zn1)、 3%Zn-3%N-TiO2NPs(Zn3)、5%Zn-3%N-TiO2NPs (Zn5) 和 7%Zn-3%NTiO2NPs(Zn7)。
1.3 纳米粒子的表征
1.3.1 X射线衍射法(X-ray diffraction,XRD)和拉曼光谱检测纳米粒子的晶体结构和粒径 采用XRD法分析合成的TiO2NPs和Zn-N-TiO2NPs的晶体结构。根据Scherrer公式计算TiO2NPs和Zn-N-TiO2NPs晶体粒径,D=Kλ/Bcosθ(D 为晶体粒径,K为谢乐常数,λ为X射线波长,B为半峰高宽度,θ为布拉格角),分别取适量TiO2NPs和Zn-N-TiO2NPs置于清洁的石英玻璃片上,在氦氖(He-Ne)激光器激发波长633 nm激光线和10 s/次条件下采集拉曼光谱。
1.3.2 SEM观察纳米粒子的形态和分布 取适量TiO2NPs和Zn-N-TiO2NPs分别溶解于无水乙醇中,超声仪超声震荡处理溶液30 min后,取10 μL溶液滴加于硅片表面,待自然干燥后采用SEM进行扫描观察。
1.3.3 紫外-可见光吸收光谱(ultraviolet-visible spectroscopy,UV-vis)检测纳米粒子对可见光吸收度值 采用丙二醇为溶剂配制质量浓度为0.02%的丙二醇/TiO2NPs和丙二醇/Zn-N-TiO2NPs悬浊液,置于紫外-可见分光光度计内,设置光照射波长范围为250~800 nm,增量为2 nm,检测纳米粒子对紫外-可见光的吸收度,即吸光度(A)值。
1.4 采用Cure Rite辐射仪检测LED光固化灯的功率密度
检测前先将固化时间设置为20 s。打开光固化灯静置10 s后将光导棒放置于感光窗,稳定后记录辐射仪数值。间歇60 s后按照以上操作继续读取数值,测试3次后取均值作为LED光固化灯的功率密度值。
1.5 平板菌落计数法检测纳米粒子联合LED光照射抑制变异链球菌实验中各组平板菌落数
采用灭菌环挑取变异链球菌单个菌落接种于BHI培养液,37℃厌氧条件下孵育24 h,采用分光光度计测定菌液浓度,配置2×107CFU·mL-1浓度实验菌液待用。实验分组为空白对照组、单独LED光照组、TiO2NPs组、Zn1组、Zn3组、Zn5组和Zn7组。用BHI培养液将TiO2NPs、Zn1、Zn3、Zn5和 Zn7配制为浓度 4.0 g·L-1纳米粒子溶液待用。取96孔细胞培养板,加入50 μL上述各组纳米粒子溶液,每孔再加50 μL实验菌液,使每组纳米粒子终浓度均为2.0 g·L-1,变异链球菌浓度为1×107CFU·mL-1。摇匀后,采用牙科LED光固化灯(波长385~515 nm,光导棒有效工作面积63.5 mm2)对每组液体进行照射,照射时间分别为1、3和5 min,为使样本均匀需确保LED灯头始终与96孔细胞培养板平齐。单独LDE光照组:配制同空白对照组菌液加入96孔细胞培养板后LED光分别照射1、3和5 min;空白对照组:取50 μL实验菌液加入96孔细胞培养板后加入50 μL BHI培养基。以上各组菌液均在37℃厌氧条件下避光培养24 h。将各孔菌液梯度稀释,取100 μL均匀涂布于BHI平板,37℃厌氧培养36 h后进行菌落计数。
1.6 采用DPBF探针检测各组纳米粒子活性氧(reactive oxygen species,ROS)释放量
取DPBF溶液1 mL,加入Zn3配制浓度为2.0 g·L-1的Zn3-DPBF溶液,混合均匀后分别取100 μL移入96孔细胞培养板内,设置4孔。用LED光分别照射0、1、3和5 min,每组光照结束后采用多功能酶标仪以2 nm为增量检测300~600 nm波长范围内各组溶液的A值,并观察在波长410 nm处A值峰值变化,此波长处A值越小表示ROS释放量越大。
1.7 采用平板菌落计数法检测加入NAC后各组变异链球菌菌落数
采用平板菌落计数法检测加入ROS清除剂NAC和LED光照射5 min后,各组变异链球菌的生长情况。实验分为对照组、NAC组、Zn3组和NAC+Zn3组。取96孔细胞培养板,设置4孔,每孔加50 μL实验菌液,第1孔加入BHI培养液50 μL,第2孔加入5 mmol·L-1NAC和BHI培养液50 μL,第 3孔加入 4.0 g·L-1Zn3 溶 液 50 μL, 第4孔加入 5 mmol·L-1NAC和 4.0 g·L-1Zn3溶液50 μL。各组混匀后LED光照射5 min,避光培养24 h后将各孔菌液梯度稀释,取100 μL均匀涂布于BHI平板,37℃厌氧培养36 h后进行菌落计数。
1.8 统计学分析
采用SPSS 22.0统计软件进行统计学分析。各组变异链球菌菌落数均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 纳米粒子的XRD谱
TiO2NPs、Zn1、Zn3、Zn5和 Zn7的 XRD谱见图1。参照PDF标准卡片,图谱中均对应为锐钛矿相TiO2的衍射峰,并未见新的晶相。根据Scherrer公式计算TiO2NPs、Zn1、Zn3、Zn5和Zn7的平均晶体粒径分别为15.6、11.3、9.8、9.4和7.3 nm。
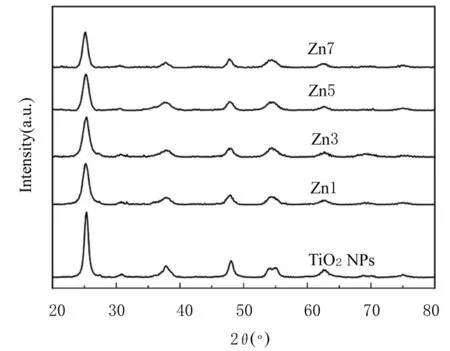
图1 TiO2NPs和Zn-N-TiO2NPs的XRD谱Fig.1 XRD spectra of TiO2NPs and Zn-N-TiO2NPs
2.2 纳米粒子的拉曼光谱
450℃处理温度下TiO2NPs和Zn-N-TiO2NPs的拉曼光谱见图2。在144、396、517和639 cm-1附近出现典型锐 Ti矿相 TiO2拉曼峰[11],其中144 cm-1附近的峰强度最大,是Eg对称类型,属于O-Ti-O变角振动峰。
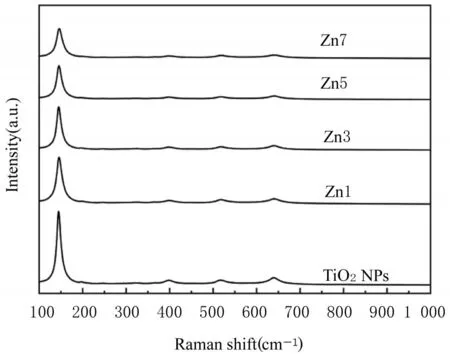
图2 TiO2NPs和Zn-N-TiO2NPs的拉曼光谱Fig.2 Raman spectra of TiO2NPs and Zn-N-TiO2NPs
2.3 纳米粒子的形态和分布
在SEM下观察,制备的TiO2NPs和Zn-NTiO2NPs为分布均匀的球形纳米颗粒。见图3。

图3 SEM观察TiO2NPs和Zn-N-TiO2NPs的形态和分布(Bar=500 nm)Fig.3 Morphology and distribution of TiO2NPs and Zn-N-TiO2NPs observed by SEM(Bar=500 nm)
2.4 纳米粒子的UV-vis谱
与TiO2NPs比较,在设置的波长范围内Zn-N-TiO2NPs的A值明显升高,其中Zn3组在400~500 nm波长范围内A值最高。见图4。
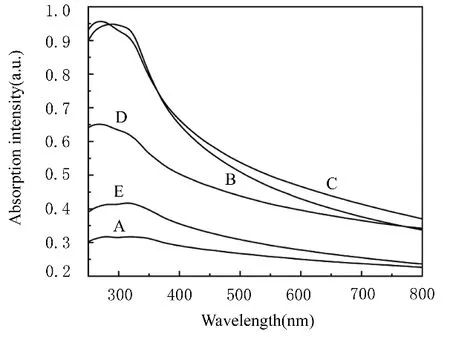
图4 TiO2NPs和 Zn-N-TiO2NPs的UV-vis谱Fig.4 UV-vis spectra of TiO2NPs and Zn-N-TiO2NPs
2.5 LED光固化灯的功率密度值
通过Cure Rite辐射仪测试得出LED光固化灯的平均功率密度值为1 167 mW·cm-2,参考LED光照射样品时间为1、3和5 min,按照公式:功(J·cm-2) = 功 率 密 度 (W·cm-2) × 照 射 时 间(s),计算每组光照时间对应的作用功分别为70、210 和 350 J·cm-2。
2.6 纳米粒子联合LED光抑制变异链球菌实验中各组变异链球菌菌落数
LED光照时间分别为1、3和5 min时,空白对照组、单独 LED光照组、TiO2NPs组、Zn1组、Zn5组和Zn7组变异链球菌菌落数明显高于相同光照时间Zn3组(P<0.05)。Zn1组、Zn3组、Zn5组和Zn7组随着LED光照时间增加,各组变异链球菌菌落数均呈逐渐下降趋势。与空白对照组比较,除单独LED光照组光照时间为1 min时差异无统计学意义(P>0.05)外,其余各组变异链球菌菌落数差异均有统计学意义(P<0.05)。与相同照射时间单独LED光照组比较,TiO2NPs、Zn1、Zn3、Zn5和Zn7组变异链球菌菌落数差异均有统计学意义(P<0.05)。见表1。
表1 纳米粒子联合LED光照射抑制变异链球菌实验中各组变异链球菌菌落数Tab.1 Number of colonies of Streptoccus mutans in various groups in experiment of nanoparticles combined with LED lightillumination in inhibiting Streptococcus mutans (n=3,±s)
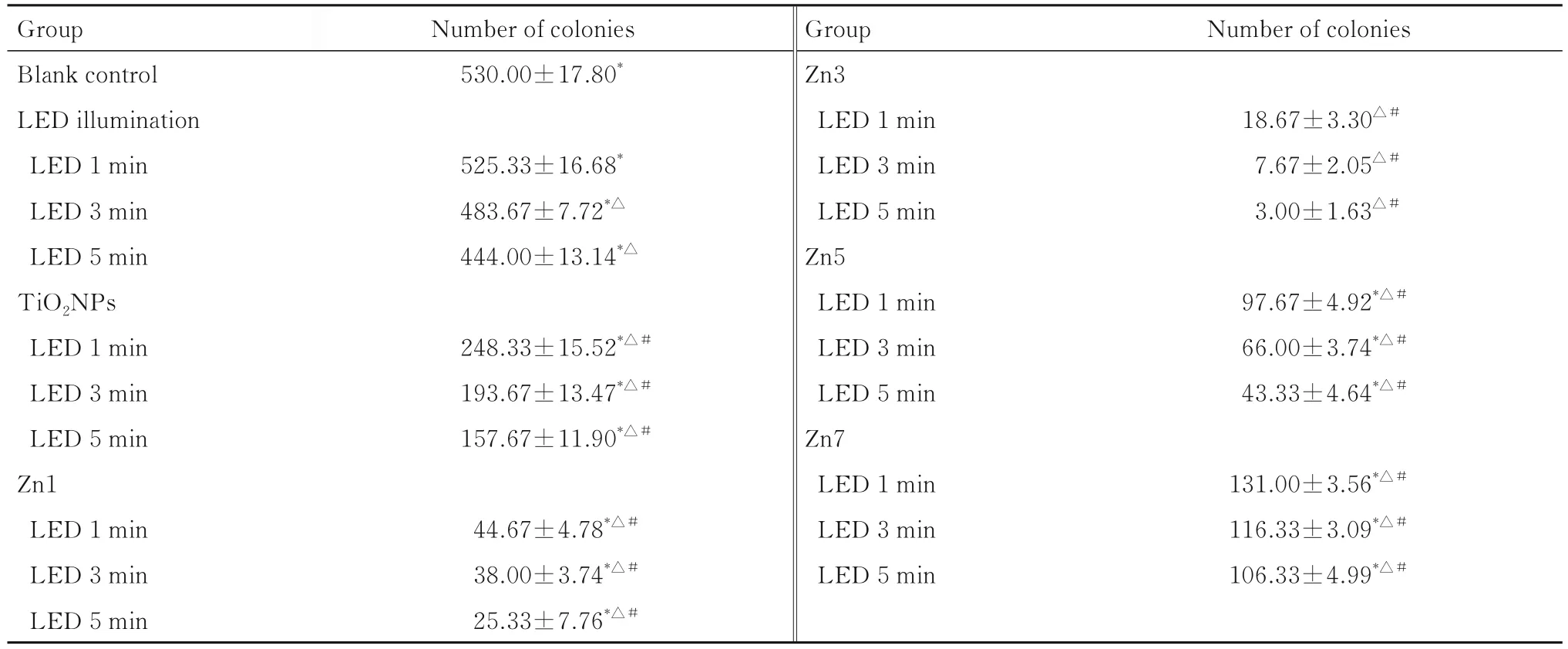
表1 纳米粒子联合LED光照射抑制变异链球菌实验中各组变异链球菌菌落数Tab.1 Number of colonies of Streptoccus mutans in various groups in experiment of nanoparticles combined with LED lightillumination in inhibiting Streptococcus mutans (n=3,±s)
*P<0.05 compared with Zn3 group;△P<0.05 compared with blank control group;#P<0.05 compared with LED illumination group.
Number of colonies Group Blank control LED illumination LED 1 min LED 3 min LED 5 min TiO2NPs LED 1 min LED 3 min LED 5 min Zn1 LED 1 min LED 3 min LED 5 min Number of colonies 530.00±17.80*525.33±16.68*483.67±7.72*△444.00±13.14*△18.67±3.30△#7.67±2.05△#3.00±1.63△#248.33±15.52*△#193.67±13.47*△#157.67±11.90*△#97.67±4.92*△#66.00±3.74*△#43.33±4.64*△#44.67±4.78*△#38.00±3.74*△#25.33±7.76*△#Group Zn3 LED 1 min LED 3 min LED 5 min Zn5 LED 1 min LED 3 min LED 5 min Zn7 LED 1 min LED 3 min LED 5 min 131.00±3.56*△#116.33±3.09*△#106.33±4.99*△#
2.7 各组纳米粒子ROS释放量
DPBF属于ROS检测探针,在410 nm处达到吸收峰值,DPBF与ROS反应后410 nm处A值降低。利用DPBF探针检测ROS释放实验结果见图5。随着LED光照射时间的延长,溶液在410 nm处的A值逐渐降低,表明各组纳米粒子溶液的ROS释放量随光照时间延长而逐渐增加。
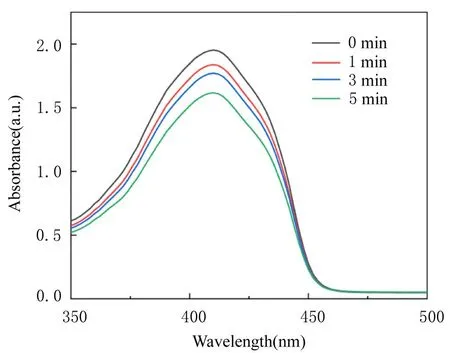
图5 牙科LED光照射不同时间后TiO2NPs的DPBF吸收曲线Fig.5DPBF absorption curves of TiO2NPs after dental LED light illumination for different time
2.8 加入NAC后各组变异链球菌菌落数
与Zn3组比较,NAC+Zn3组变异链球菌菌落数明显增加(P<0.05)。见图6。
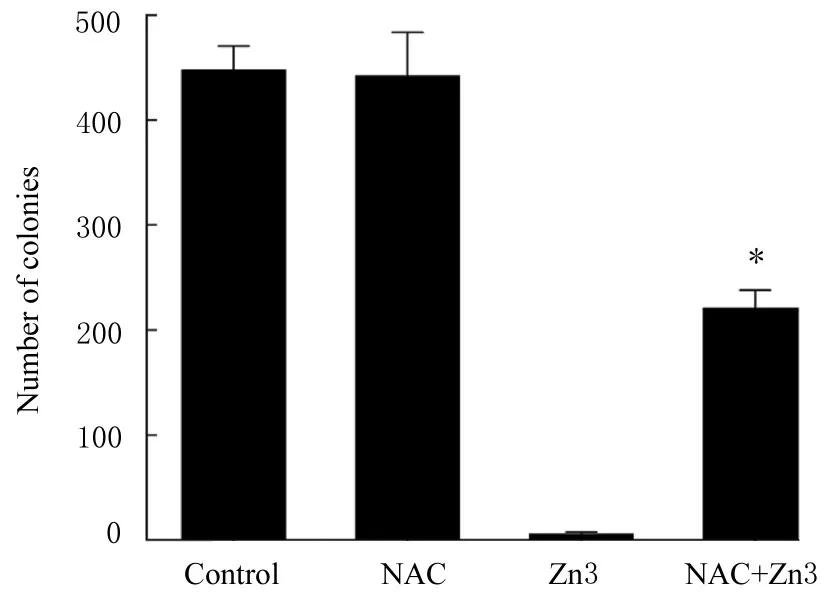
图6 加入NAC后各组变异链球菌菌落数Fig.6Number of colonies of Streptococcus mutans in various groups after added with NAC
3 讨 论
变异链球菌是引起龋病的主要细菌之一,开发新型有效抗菌剂抑制变异链球菌对降低龋病发病率具有重要意义[12]。在众多纳米抗菌剂中,因TiO2NPs有较好生物安全性和抗菌性等优势受到广泛关注[13]。
根据晶型TiO2分为锐钛矿相、金红石相和板钛矿相[14-15]。本研究中XRD结果与TiO2的XRD标准卡片JCPDSNo.99-0008比较可知:在2θ=25.3°时出现了很明显的衍射峰,对应于锐钛矿相(101)晶面[16],说明本研究所得产物均为锐钛矿相TiO2,且未观察到金红石相和氧化锌相,说明Zn和N掺杂未使TiO2晶型发生变化,分析其原因为Zn和N掺杂浓度较低,或Zn和N元素均匀的分布于TiO2晶体表面;另外随着掺杂浓度的提高,TiO2晶粒尺寸不断减小,提示Zn和N的掺入可抑制TiO2晶粒粒径增大。本研究采用拉曼光谱观察Zn和N掺杂对TiO2NPs拉曼谱峰的影响,结果显示:Zn和N掺杂后的TiO2拉曼谱峰位置未产生明显变化,说明Zn和N的掺入对TiO2晶格畸变影响较小;但144 cm-1附近处拉曼峰强度却随着掺杂元素浓度的增加而逐渐减弱,分析其原因为Zn和N掺入引起了晶格常数改变所致。
锐钛矿相TiO2在适当光能和波长条件(波长385 nm、3.2 eV)下与光产生作用后,价带中的基态电子将被激发进入导带,价带产生带正电的电子空穴。自由电子和电子空穴可迁移至TiO2表面参与氧化还原反应,进一步产生ROS[17]。由光催化原理可知,由于禁带宽度较大,TiO2只有在紫外光照射时才能产生ROS[18]。但紫外光占太阳光不到5%[19],故在可见光条件下TiO2难以发挥最大的抗菌作用。为了提高可见光利用率,扩大TiO2可用范围,研究者[7]采用向TiO2中掺杂金属元素[铁(Fe)、铜(Cu)和铈(Ce)等]和(或)非金属元素[N、硫(S)和氟(F)等]以达到缩小TiO2禁带宽度和促进TiO2对可见光吸收增强的目的。研究[20]表明:用金属元素和非金属元素对TiO2共掺杂后,由于金属粒子与非金属粒子间的协同改性效应,共掺杂TiO2光催化效果比单掺杂TiO2更好,故本研究选用Zn和N元素对TiO2进行共掺杂。为了考察Zn和N掺杂对TiO2NPs光学性能的影响,本研究进行了UV-vis吸收光谱的检测,结果显示:在可见光波长400~500 nm范围内,掺杂后的TiO2NPs光吸收强度明显提高,并且在此波长范围内Zn3组的光吸收强度最高。分析其原因为,在掺杂过程中,由于N原子半径与O原子半径相近且Zn离子半径与Ti离子半径相近,N取代了TiO2晶格中部分O,Zn取代了TiO2晶格中部分Ti,从而缩小禁带宽度,抑制晶粒尺寸增大,增加比表面积,提高了TiO2对光的吸收强度[21-22]。
根据本研究中Zn-N-TiO2NPs结合LED光抑制变异链球菌实验的菌落计数结果推断:Zn-NTiO2NPs产生抗菌作用的主要原因是其在LED光照条件下产生了ROS。ROS攻击微生物膜表面多不饱和磷脂后进一步引起蛋白质和电子介质变性,进而细胞膜破坏,胞质泄露,细胞死亡[23]。同时本研究结果显示:当Zn∶Ti≤3%∶1时,随着Zn掺杂浓度的提高,平板菌落计数逐渐下降;当Zn∶Ti>3%∶1时,随着Zn掺杂浓度的提高,平板菌落计数逐渐升高。分析其原因为,当Zn掺杂浓度较低时,自由电子与电子空穴未产生有效分离,导致TiO2的光催化活性较低;当Zn的掺杂浓度逐渐增加,Zn成为了自由电子和电子空穴的复合中心,提高了电子-空穴复合率,造成TiO2光催化活性下降;当Zn掺杂浓度适宜时,电子-空穴的分离与复合之间产生平衡,此时Zn-N-TiO2NPs光催化活性最强。上述原因引起各组Zn-N-TiO2NPs产生的ROS释放量发生变化,进一步引起菌落计数结果的变化。
根据光催化原理,TiO2需在适当光源条件下才能有效发挥抗菌作用,然而本实验菌落计数结果表明:TiO2NPs也具有一定的抗菌效果。研究[24-25]表明:黑暗条件下TiO2也会对细菌产生毒性作用,TiO2NPs通过疏水效应及自身电荷与细菌表面电荷相互吸引,从而黏附于细菌表面改变其胞膜通透性,同时在细菌表面重新排列,进一步使胞内物质发生聚集,出现细菌生长延迟和失活现象[26-27],该结论也是本研究中TiO2NPs具备一定抗菌作用的原因。同时有研究[28]结果显示:蓝光照射本身对细菌也有抑制作用,该现象在本实验中也有所体现,但其抗菌能力较微弱。
本研究选用的牙科LED光固化灯(Bluephase N型)是在口腔临床操作过程中树脂材料固化步骤的必须设备。将Zn-N-TiO2NPs与牙科LED光固化灯联合使用,可结合两者优势提高设备利用率和Zn-N-TiO2NPs的抗菌性能,为Zn-N-TiO2NPs的应用提供必要条件。
为了明确纳米粒子联合LED光能否产生ROS以明确其抗变异链球菌机制,本研究采用DPBF检测ROS释放量,结果显示,光照1 min组、3 min组和5 min组DPBF-Z3溶液在410 nm处的峰值逐渐下降,说明纳米粒子联合LED光可产生ROS,且随着光照时间延长,ROS释放量逐渐增加。
NAC是一种强抗氧化物质,能够干扰ROS生成和清除ROS[29]。为了进一步明确Zn3联合LED光在抗变异链球菌过程中的作用机制,本研究选用NAC对菌落计数最少组(Zn3组)进行处理,结果显示:加入NAC后平板菌落计数明显增加,验证了在ROS释放实验中Zn3在LED光照条件下可产生ROS的结论。此外,LED光照时间(5 min)相比实际的牙科树脂固化时间略长,在今后的研究中本课题组将在缩短LED光照时间方面进行深入研究,以更有利于实际的临床操作。
综上所述,本实验制备的3%Zn-3%NTiO2NPs能够在LED光照射下通过光催化作用有效抑制变异链球菌的生长。

