铜绿假单胞菌信号分子3-O-C12-HSL与PPARγ-LBD的结合特性研究
张云燕,马刘合一,陈敏怡,李有强,刘润梅,罗冬元
铜绿假单胞菌(pseudomonas aeruginosa,PA)是临床上常见的院内感染条件致病菌。N-3-氧代十二烷酰-L-同型丝氨酸内酯(N-3-oxododecanoyl-Lhomoserine lactone,3-O-C12-HSL)是PA 密度感应系统分泌的重要的信号分子之一[1],可调节免疫细胞的免疫功能,介导免疫逃逸[2-3]。过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)是细胞核内受体转录因子超家族成员,由PPARγ C 末端的配体结合区域(ligand binding domain,LBD)与配体结合后形成二聚体而活化,将各种环境、炎症等刺激转变为胞内信号,调节细胞脂质代谢、分化、免疫等[4]。本课题组前期发现3-O-C12-HSL 可能通过结合PPARγ 抑制人单核细胞衍生树突状细胞成熟和功能[5-6],但3-O-C12-HSL结合PPARγ的具体特性尚不清楚。为此,本研究采用分子对接和表面等离子体共振技术探讨3-O-C12-HSL 与PPARγ的结合及结合强度,为筛选两者结合的抑制剂提供实验依据。
1 材料与方法
1.1 实验材料 3-O-C12-HSL和对照分子2-氯-5-硝基-N-苯基 苯 甲 酰 胺(GW9662)购自Sigma 公 司;2×TransStart FastPfu PCR SuperMix(-dye)购自TransGen Biotech;PET28b质粒为本实验室保存;T4 DNA Ligase和DH5α感受态细胞购自TransGen Biotech;质粒小提中量试剂盒购自天根生物技术有限公司;OpenSPRTM 仪器和芯片购自Nicoya。异丙基-β-D-硫代半乳糖苷(IPTG)、内切酶、纯化柱、His抗体购自普健生物科技有限公司。
1.2 方法
1.2.1 3-O-C12-HSL 与PPARγ 分子对接 将PPARγ、3-OC12-HSL 和GW9662 输入Pubchem 数据库(http://zinc.docking.org/),查询获得三者的成分结构,优化结构并保存为mol 格式。从RCSB Protein Data Bank(PDB,https://www.rcsb.org/)数据库下载核心靶点的3D 结构,保存为PDB 格式,使用PyMol软件删除蛋白结构的水分子和小分子配体,并导入AutoDockTools进行加氢等预处理。对接参数:ga_num_evals=1 200 000,ga_pop_size=120,ga_run=12,rmsd=2.0,分子对接采用软件Autodock 4.2。结合能越低,表明结合力越强,结合能≤-5.0 kJ/mol的分子与靶点具有较好的结合活性。
1.2.2 PPARγ-LBD 表达载体的构建 通过uniprot(https://www.uniprot.org/uniprot/P37231#sequences)找 到PPARγ 的LBD 区(aa238-530),通过NCBI 数据库获取目的基因序列,全基因合成获得目的基因的cDNA,用Primer Premier 5.0 软件添加酶切位点,引物设计及合成引物,C 端添加6×His 标签,进行目的基因的克隆,见图1。将目的基因和载体酶切、回收、连接,将连接产物转化DH5α 细胞,涂板,37 ℃培养过夜。挑取8 个克隆进行菌落PCR 鉴定,鉴定成功后挑选2 个阳性克隆进行测序。

Fig.1 PPARγ-LBD expression vector图1 PPARγ-LBD表达载体
1.2.3 PPARγ-LBD肽段的表达形式分析 阳性克隆质粒经转化DH5α细胞、菌种活化及诱导表达后,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)验证表达情况。从平板上挑取含重组质粒的单菌落,接种于含卡那霉素(50 mg/L)的5 mL LB培养基中,37 ℃过夜培养。取200µL接种于含卡那霉素的20 mL LB 培养基中,37 ℃培养至培养液600 nm 吸光度值为0.6左右。菌液中加入IPTG,于37 ℃培养4 h进行IPTG诱导的优化。超声裂菌,离心后收集上清液,SDS-PAGE及抗His标签抗体通过Western blot检测大肠杆菌感受态2号菌株和7号菌株中目的肽段。
1.2.4 PPARγ-LBD 肽段的表达与纯化 在2 号菌株中加入1 mmol/L IPTG,37 ℃培养4 h,培养200 mL菌液,离心收集诱导表达后的菌株,加入10 mL PBS,超声处理。超声时间2 s,间隔2 s,功率20 kHz,总计30 min。离心后收集上清液,Brandford 法检测肽段浓度,SDS-PAGE 及抗His 标签通过Western blot检测目的肽段。
1.2.5 表面等离子共振技术(SPR)检测3-O-C12-HSL 与人PPARγ结合的动力学特性 安装NTA芯片,以150µL/min流速检测缓冲液PBS信号。信号达到基线后,将咪唑和NiCl2溶液注入NTA 芯片,将1.00 g/L 的PPARγ-LBD 肽段200µL 注入NTA 芯片相互作用4 min。分别注入300 µmol/L 的3-OC12-HSL和GW9662,检测两者与PPARγ-LBD 肽段的最大结合力。将流速提高到150µL/min,注入再生缓冲液去除3-OC12-HSL和GW9662。分别将10、20、40、60、80、160µmol/L的GW9662 和25、50、100、200、300 µmol/L 的3-O-C12-HSL 以20µL/min上样,肽段与配体结合时间240 s,自然解离420 s,用分析软件TraceDrawer(Ridgeview Instruments ab,Sweden)和1∶1分析方法完成模型分析。
2 结果
2.1 3 -O-C12-HSL 与PPARγ 的对接构象分析 3-O-C12-HSL 与PPARγ 结合能为-10.11 kJ/mol,低于对照分子GW9662 的-8.29 kJ/mol,3-O-C12-HSL 较GW9662 有更强的结合能力。对照分子GW9662 与Tyr327、Tyr473 以及Cys285 形成氢键,苯环侧链与Leu330 形成疏水结合。3-O-C12-HSL 与PPARγ 的结合与GW9662 类似,也与Tyr473 和Tyr327 形成氢键,其末端柔性碳链与Met329、Leu330 等残基形成疏水结合,见图2。

Fig.2 Molecular docking analysis of 3-O-C12-HSL with PPARγ图2 3-O-C12-HSL与PPARγ的分子对接
2.2 构建PPARγ-LBD 表达载体 将PET28b-PPARγ-LBD 测序序列与NCBI 中PPARγ-LBD 序列进行比对,显示与PPARγ-LBD区aa238-530的基因序列(870 bp)完全一致,见图3。成功构建了PET28b-PPARγ-LBD表达载体。
2.3 PPARγ-LBD 肽段表达形式分析 SDS-PAGE分析2 号和7 号菌株中PPARγ-LBD 的表达形式,发现PPARγ-LBD 肽段在上清液和包涵体均有表达,以包涵体表达为主。Western blot 实验发现2 号和7号菌株上清液和包涵体中25~35 ku均出现预期的蛋白印迹条带,见图4。

Fig.3 Results of positive clone sequencing图3 阳性克隆测序序列的比对结果
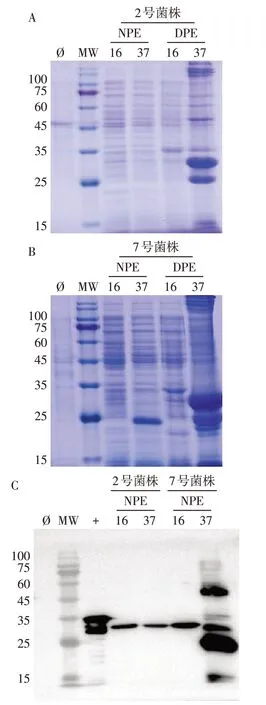
Fig.4 Expression analysis of PPARγ-LBD peptide segment图4 PPARγ-LBD肽段的表达形式分析
2.4 PPARγ-LBD 肽段的表达与纯化 纯化2 号菌株上清液中PPARγ-LBD 肽段,纯化后肽段质量浓度为1 g/L。SDS-PAGE及Western blot检测抗His标签的抗体发现在25~35 ku 均有一条蛋白的印迹,见图5,与PPARγ-LBD的分子质量一致。
2.5 3 -O-C12-HSL 与PPARγ-LBD 的亲和常数 3-O-C12-HSL与PPARγ-LBD结合的亲和常数为1.65×10-4mol/L,结合速率常数为1.06×102/ms,解离速率常数为1.75×10-2/s。GW9662 与PPARγ-LBD 结合的亲和常数为1.06×10-4mol/L,结合速率常数为1.19×102/ms,解离速率常数为1.27×10-2/s,见图6。3-O-C12-HSL可与PPARγ-LBD结合,与分子对接结果一致。

Fig.5 Analysis of purified PPARγ-LBD protein by SDS-PAGE and Western blot assay图5 纯化PPARγ-LBD肽段SDS-PAGE及Western blot结果

Fig.6 Dynamic binding curves of PPARγ-LBD with 3-O-C12-HSL,GW9662图6 PPARγ-LBD与3-O-C12-HSL、GW9662浓度梯度结合曲线
3 讨论
3-O-C12-HSL 是PA 群体密度感应系统分泌的一种重要的病原体相关分子模式。3-O-C12-HSL可调节宿主树突状细胞、巨噬细胞等功能[7]。前期研究发现3-O-C12-HSL 可通过与PPARγ 结合来调节人单核细胞衍生树突状细胞的成熟和功能[5-6],提示PPARγ可作为治疗PA感染的靶点,但3-O-C12-HSL与PPARγ结合的具体特性尚未明确。
PPARγ 是核受体中的一个重要的成员,在细胞免疫、脂质代谢等方面具有重要功能。PPARγ-LBD是PPARγ的一个重要激活区域,该区域由12个α螺旋结构域组成,LBD 通过与配体结合来诱导转录激活[8-9]。LBD 被组装在一个三层反向平行的螺旋形“三明治”里,构成疏水腔,称为配体结合袋。PPARγ的配体结合袋较大,允许结合不同大小的配体。3-O-C12-HSL 分子式为C16H27NO4,相对分子质量297.39。本研究用生物信息学预测3-O-C12-HSL 与PPARγ 的分子对接位点,发现3-O-C12-HSL 疏水的尾巴深入到PPARγ 的配体结合袋中,与Tyr473 和Tyr327 形成氢键,末端柔性碳链与Met329、Leu330等残基形成疏水结合。氢键的形成增强了3-O-C12-HSL与PPARγ的结合能力,能更好地激活PPARγ。
SPR 是一项利用生物传感芯片进行分析的技术,该技术将分析样品固定在SPR传感器上,利用光学测量的折射率变化来检测分子的结合情况。SPR可以实时并快速对蛋白、小分子等进行定性和定量分析,可以连续监测吸附和解离过程,进行成分间相互作用的研究[10]。本实验使用SPR 实时监测了3-O-C12-HSL与PPARγ-LBD的结合和解离的过程,测得两者结合的亲和力常数为1.65×10-4mol/L,结合速率常数为1.06×102/ms,解离速率常数为1.75×10-2/s,显示两者具有较好的亲和力,与分子对接的结果一致。
综上所述,本研究成功制备获得了PPARγ-LBD肽段,应用SPR 证实3-O-C12-HSL 与PPARγ-LBD结合能力强,进而发挥免疫调节功能,为临床预防和治疗PA 感染提供了实验依据。下一步本课题组拟筛选3-O-C12-HSL 与PPARγ-LBD 结合抑制剂,阻断两者结合,以指导PA感染的预防和治疗用药。
志谢
感谢广州市妇女儿童医疗中心儿研所刘明博士给予对接构象分析实验的指导。

