高强度聚焦超声通过TRIF介导的ERK通路增强乳腺癌的顺铂化疗敏感性
伊万萍,马德寿
乳腺癌是女性最常见的恶性肿瘤,虽然近年来乳腺癌的治疗已取得了极大的进步,但患者预后仍然很差[1]。化疗是目前治疗乳腺癌的一种有效手段,但顺铂(cisplatin,DDP)等化疗药物的长期使用会产生耐药性,因此寻找克服化疗药物耐药性的方法十分重要[2]。高强度聚焦超声(high-intensity focused ultrasound,HIFU)作为一种无创性的新兴治疗技术,可利用超声波靶向肿瘤实体,在不损伤邻近组织的情况下诱导肿瘤组织蛋白质变性及凝固坏死,已用于良恶性肿瘤的治疗[2]。近期有研究发现,HIFU 能够通过渗透细胞膜增强DDP 向癌组织的传递,增强肺癌细胞对DDP的敏感性[3]。但关于HIFU对DDP 耐药乳腺癌细胞的作用及机制尚未阐明。研究显示,下调β干扰素TIR结构域衔接蛋白(TIRdomain- containing adaptor inducing interferon- β,TRIF)表达或抑制其所介导的途径激活是超声热增强口腔鳞状细胞癌对化疗药物敏感性的机制之一[4]。细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)通路是细胞内的一个重要信号转导途径,在耐药肿瘤细胞中被显著激活[5],而TRIF则可通过抑制该途径减轻巨噬细胞炎症反应[6]。但关于TRIF 调控该通路在肿瘤化疗耐药性中作用的相关研究少见报道。本研究旨在探究HIFU 通过TRIF 介导的ERK 通路在乳腺癌患者对DDP 化疗敏感性中的作用,为寻找克服乳腺癌化疗耐药性的方法提供参考。
1 材料与方法
1.1 实验动物 购自南方医科大学的6周龄BALB/c裸鼠20只,SPF级,体质量20~22 g,于通风良好且12 h/12 h昼夜交替环境中饲养1周,许可证号SCXK(粤)2016-0041。
1.2 试剂和仪器 乳腺癌细胞系MDA-MB-231、MCF-7(上海盖宁生物科技有限公司);RPMI-1640培养基(上海博尔森生物科技有限公司);顺铂(广东岭南制药有限公司,国药准字H20143124);Annexin V-FITC/PI 细胞凋亡检测试剂盒(上海晶风生物科技有限公司);CCK-8试剂盒(深圳纽邦生物技术有限公司);蛋白提取试剂盒(北京雅安达生物技术有限公司);BCA蛋白检测试剂盒[攸碧艾(上海)贸易有限公司];辣根过氧化物酶(HRP)标记的IgG 二抗、兔抗TRIF、多药耐药基因1(multidrug resistance 1,MDR1)、Bcl-2 关联X 蛋白(Bcl-2 associated X protein,Bax)、GAPDH、ERK1/2、p-ERK1/2抗体(Cell Signaling Technology);兔抗B 淋巴细胞瘤-2 基因(B-cell lymphoma-2,Bcl-2)、Ki-67 抗体(Proteintech);兔抗p-糖蛋白(p-glycoprotein,p-gp)抗体(上海柯雷生物科技有限公司);漆黄素(fisetin,西安旭煌生物技术有限公司)免疫组化染色试剂盒(上海茁彩生物科技有限公司);BD FACSCANTO Ⅱ流式细胞仪(上海基泰生物科技有限公司);GelView 1500Plus智能凝胶成像系统(广州博鹭腾生物科技有限公司)。
1.3 方法
1.3.1 MDA-MB-231及MCF-7细胞培养 在含有100 U/mL青霉素、100 mg/L链霉素和10%胎牛血清的RPMI-1640培养基中接种MDA-MB-231 及MCF-7 细胞后,培养于37 ℃、5%CO2培养箱,直至细胞融合度达80%左右。
1.3.2 DDP 耐药细胞系的建立 将已培养至对数生长期的MDA-MB-231及MCF-7细胞经胰酶消化后接种到培养瓶培养24 h,然后加入1µmol/L DDP 再培养48 h 后弃培养液,用不含DDP的培养液培养细胞直至MDA-MB-231及MCF-7细胞能够稳定生长并进行传代。继续使用含1µmol/L DDP 的细胞培养液培养细胞,如此反复3次,增加0.2µmol/L DDP的细胞培养液进行培养,依次增加DDP 浓度,当细胞在含3µmol/L DDP 的细胞培养液中能够稳定生长、传代时,即可得DDP耐药细胞MDA-MB-231/DDP及MCF-7/DDP。
1.3.3 CCK-8 检测各组细胞活力 将亲本MDA-MB-231、MCF-7 细胞及MDA-MB-231/DDP 和MCF-7/DDP 细胞(2×103个/孔,100µL/孔)接种至96孔板中培养,分别使用1、2、4、8、16、32、64 和128µmol/L DDP 处理细胞48 h(3 个复孔),添加10µL CCK-8 溶液培养4 h 后,于450 nm 波长处检测光密度(OD),并计算半数抑制浓度(IC50);细胞存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%。
MDA-MB-231/DDP、MCF-7/DDP细胞(2×103个/孔)接种至96 孔板中培养(5 个复孔),经培养24 h 后将MDA-MB-231/DDP、MCF-7/DDP细胞分为control组、HIFU组、HIFU+二甲基亚砜(DMSO)组(5 µmol/L DMSO)、HIFU+fisetin 组(5 µmol/L ERK通路激活剂fisetin)。将除control组外的其他3 组的MDA-MB-231/DDP、MCF-7/DDP 细胞置于试管中,并以频率1.048 MHz、超声强度1 000 W/cm2的HIFU暴露9 s后,用5µmol/L DMSO及fisetin分别处理相应组细胞,检测0、24、48和72 h的OD值及计算IC50。
1.3.4 集落形成实验检测各组细胞增殖情况 在6孔板中接种处理48 h 后的各组细胞(500 个/孔),培养1 周后使用结晶紫溶液染色(500µL),显微镜观察并记录菌落数(50 个细胞以上记为1个菌落),实验重复3次。
1.3.5 流式细胞术检测各组细胞周期及凋亡情况 细胞周期检测:转移细胞(1×106个/mL)至离心管,PBS洗涤后乙醇固定过夜,1 000 r/min 离心5 min,弃上清,PBS 洗涤,添加PI 染色30 min后流式仪检测细胞周期,实验重复3次。细胞凋亡检测:将经PBS 洗涤后的细胞中添加Binding Buffer(100µL)重悬,添加5 µL 的Annexin-V-FITC 及5 µL 的PI,避光孵育15 min后,流式细胞仪检测细胞凋亡情况,实验重复3次。
1.3.6 Western blot 检测细胞TRIF 蛋白、耐药相关蛋白及ERK 通路蛋白表达 收集细胞及肿瘤组织,RIPA 蛋白裂解液裂解细胞及组织以提取总蛋白,14 000 r/min 离心15 min,弃细胞碎片,BCA 法定量蛋白质浓度;取约50µg 的蛋白,通过SDS-PAGE分离,转移到PVDF膜(0.22µm),5%脱脂奶粉溶液40 mL封闭1 h,滴加兔抗TRIF、p-gp、MDR1、Bax、Bcl-2、GAPDH、ERK1/2、p-ERK1/2抗体(1∶1 000),4 ℃下过夜,洗涤后滴加HRP偶联的IgG二抗(1∶1 000),孵育2 h,ECL试剂显色,凝胶成像仪观察各条带,Quantity One 软件分析灰度值,计算TRIF、p-gp、MDR1、Bax、Bcl-2、ERK1/2、p-ERK1/2 蛋白表达量,实验重复3次。
1.3.7 体内成瘤实验 将处理48 h后的MCF-7/DDP各组细胞以6×106个注入BALB/c裸鼠皮下(每组5只),常规饲养,每周测量1 次肿瘤体积,4 周后处死小鼠,取出瘤体,称质量。本动物实验经过青海大学附属医院动物伦理委员会批准。
1.3.8 免疫组化法检测肿瘤组织Ki-67的表达 将所得肿瘤组织制成常规石蜡切片,烤片60 min 后脱蜡、水化,使用3%H2O2处理去除内源性过氧化物酶活性,滴加枸橼酸缓冲液热修复抗原,牛血清白蛋白封闭20 min 后添加Ki-67一抗(1 h),PBS 洗涤后添加生物素标记的二抗(30 min),经DAB液染色、苏木素复染及HCl分化后进行冲洗、脱水,二甲苯透明、封片观察(×200),棕黄色为Ki-67 阳性细胞,实验重复5次,Image-Pro Plus 6.0软件分析Ki-67 OD值。
1.4 统计学方法 采用Graph Pad Prism 8.0软件进行数据分析,计量数据以±s描述,采用t检验进行2 组间均数比较,one-way ANOVA 进行多组间比较,SNK-q检验进行多重比较,P<0.05为差异有统计学意义。
2 结果
2.1 亲本细胞株与耐药细胞株细胞活力比较 与亲本MDA-MB-231 及MCF-7 细胞相比,MDA-MB-231/DDP 及MCF-7/DDP 细胞活力在相同浓度DDP处理下更高,且MDA-MB-231/DDP 细胞IC50显著高于MDA-MB-231(单位:µmol/L;41.60±4.76vs.6.71±1.08,n=3,t=12.381,P<0.05),MCF-7/DDP 细胞IC50显著高于MCF-7(单位:µmol/L;30.94±3.28vs.5.29±0.85,n=3,t=11.112,P<0.05),表示稳定的MDAMB-231/DDP 及MCF-7/DDP 细胞系建立成功,见图1。

Fig.1 Comparison of cell viability between parental cell lines and drug resistant cell lines图1 亲本细胞株与耐药细胞株细胞活力比较
2.2 HIFU 对MDA-MB-231/DDP 及MCF-7/DDP 细胞增殖的影响 与control 组相比,HIFU 组MDAMB-231/DDP 及MCF-7/DDP 细胞IC50、OD450值、克隆细胞数显著降低(P<0.05);与HIFU 组相比,HIFU+DMSO 组细胞IC50、OD450值、克隆细胞数差异无统计学意义(P>0.05),HIFU+fisetin 组细胞IC50、OD450值、克隆细胞数显著增加(P<0.05),见表1,图2、3。
2.3 HIFU 对MDA-MB-231/DDP 及MCF-7/DDP 细胞周期的影响 与control 组相比,HIFU 组MDAMB-231/DDP及MCF-7/DDP细胞G0/G1期细胞百分比显著增加,S期细胞百分比显著降低(P<0.05);与HIFU 组相比,HIFU+DMSO 组G0/G1 期、S 期细胞百分比差异无统计学意义(P>0.05),HIFU+fisetin 组G0/G1期细胞百分比显著降低、S期细胞百分比显著增加(P<0.05),见表2、图4。
Tab.1 Comparison of IC50 and clone number of MDA-MB-231/DDP and MCF-7/DDP cells between the four groups表1 各组MDA-MB-231/DDP及MCF-7/DDP细胞IC50及克隆细胞数比较 (n=3,±s)
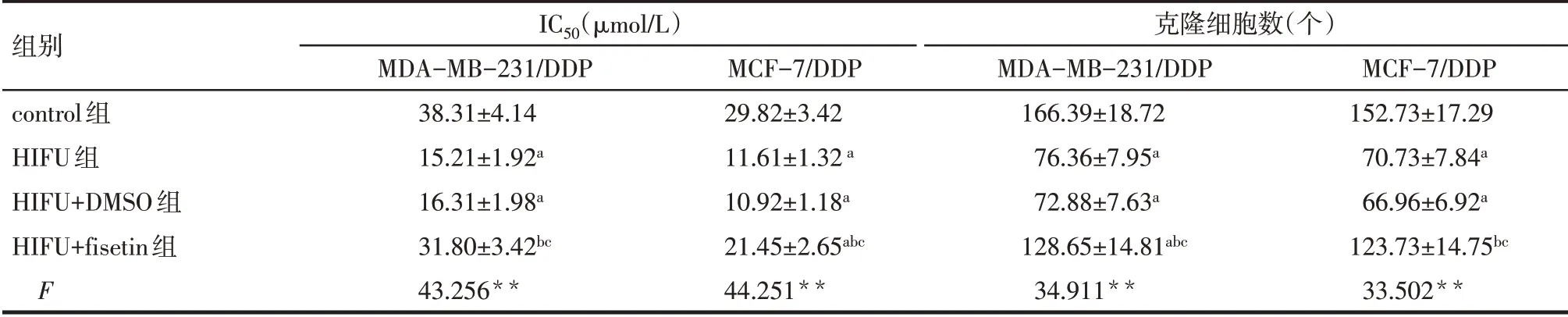
Tab.1 Comparison of IC50 and clone number of MDA-MB-231/DDP and MCF-7/DDP cells between the four groups表1 各组MDA-MB-231/DDP及MCF-7/DDP细胞IC50及克隆细胞数比较 (n=3,±s)
**P<0.01;a与control组比较,b与HIFU组比较,c与HIFU+DMSO组比较,P<0.05。
组别control组HIFU组HIFU+DMSO组HIFU+fisetin组F IC50(µmol/L)MDA-MB-231/DDP 38.31±4.14 15.21±1.92a 16.31±1.98a 31.80±3.42bc 43.256**MCF-7/DDP 29.82±3.42 11.61±1.32a 10.92±1.18a 21.45±2.65abc 44.251**克隆细胞数(个)MDA-MB-231/DDP 166.39±18.72 76.36±7.95a 72.88±7.63a 128.65±14.81abc 34.911**MCF-7/DDP 152.73±17.29 70.73±7.84a 66.96±6.92a 123.73±14.75bc 33.502**
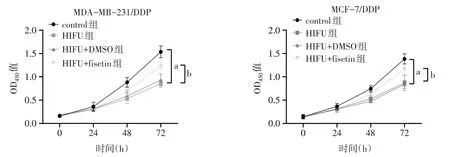
Fig.2 Effects of HIFU on OD450 value of MDA-MB-231/DDP and MCF-7/DDP cells图2 HIFU对MDA-MB-231/DDP及MCF-7/DDP细胞OD450值的影响
2.4 HIFU 对MDA-MB-231/DDP 及MCF-7/DDP 细胞凋亡及Bax、Bcl-2 表达水平的影响 与control 组相比,HIFU 组MDA-MB-231/DDP 及MCF-7/DDP 细胞凋亡率、Bax 表达水平显著增加,Bcl-2 表达水平显著降低(P<0.05);与HIFU 组相比,HIFU+DMSO组细胞凋亡率、Bax及Bcl-2表达水平差异无统计学意义(P>0.05),HIFU+fisetin 组细胞凋亡率、Bax 表达水平显著降低,Bcl-2 表达水平显著增加(P<0.05),见表3,图5、6。
2.5 HIFU 对MDA-MB-231/DDP 及MCF-7/DDP 细胞TRIF蛋白、耐药相关蛋白及ERK通路蛋白表达的影响 与control组相比,HIFU组MDA-MB-231/DDP及MCF-7/DDP 细胞TRIF、p-gp、MDR1、p-ERK1/2/ERK1/2 表达水平显著降低(P<0.05);与HIFU 组相比,HIFU+DMSO 组TRIF、p-gp、MDR1、p-ERK1/2/ERK1/2表达水平差异无统计学意义(P>0.05),HIFU+fisetin 组TRIF、p-gp、MDR1、p-ERK1/2/ERK1/2 表达水平显著增加(P<0.05),见表4、5,图7。
Tab.2 Comparison of cell cycle between MDA-MB-231/DDP and MCF-7/DDP in each group表2 各组MDA-MB-231/DDP及MCF-7/DDP细胞周期比较 (n=3,%,±s)
**P<0.01;a与control组比较,b与HIFU组比较,c与HIFU+DMSO组比较,P<0.05。
组别control组HIFU组HIFU+DMSO组HIFU+fisetin组F MDA-MB-231/DDP G0/G1期54.09±6.12 79.16±8.76a 78.12±8.15a 60.14±6.32bc 9.360**S期32.18±3.72 7.80±0.97a 10.06±1.32a 26.12±3.09bc 65.941**G2/M期13.73±1.65 12.84±1.52 11.82±1.38 13.44±1.76 0.852 MCF-7/DDP G0/G1期50.17±5.83 71.47±7.61a 72.85±7.69a 56.37±6.16bc 9.308**S期34.87±4.09 15.99±2.15a 13.96±1.87a 28.48±3.26bc 33.981**G2/M期14.96±1.75 12.54±1.36 13.19±1.48 15.14±1.82 1.921

Fig.4 The cell cycle detected by flow cytometry图4 流式细胞术检测各组细胞周期
Tab.3 Comparison of apoptosis rate and Bcl-2 and Bax protein expression of MDA-MB-231/DDP and MCF-7/DDP cells between the four groups表3 各组MDA-MB-231/DDP及MCF-7/DDP细胞凋亡率及Bcl-2、Bax蛋白表达水平比较 (n=3,±s)
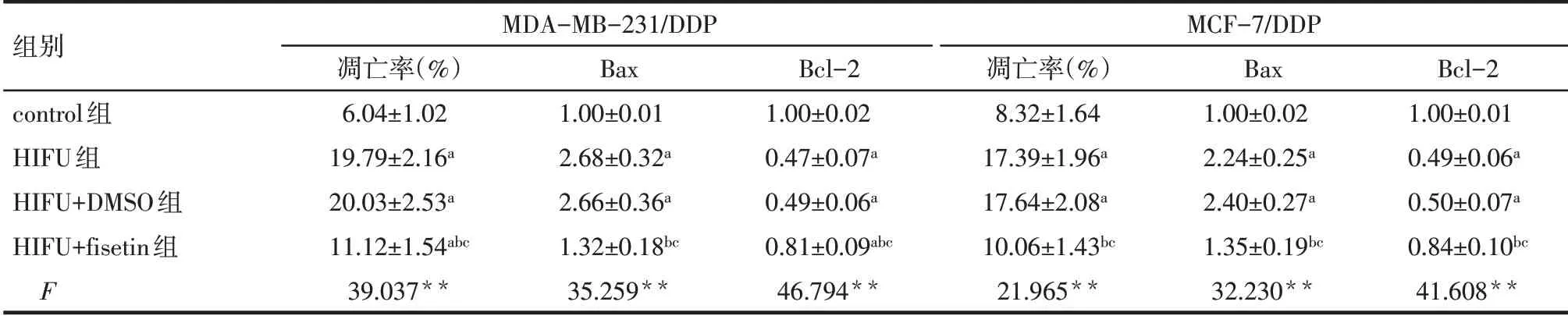
Tab.3 Comparison of apoptosis rate and Bcl-2 and Bax protein expression of MDA-MB-231/DDP and MCF-7/DDP cells between the four groups表3 各组MDA-MB-231/DDP及MCF-7/DDP细胞凋亡率及Bcl-2、Bax蛋白表达水平比较 (n=3,±s)
**P<0.01;a与control组比较,b与HIFU组比较,c与HIFU+DMSO组比较,P<0.05。
组别control组HIFU组HIFU+DMSO组HIFU+fisetin组F MDA-MB-231/DDP凋亡率(%)6.04±1.02 19.79±2.16a 20.03±2.53a 11.12±1.54abc 39.037**Bax 1.00±0.01 2.68±0.32a 2.66±0.36a 1.32±0.18bc 35.259**Bcl-2 1.00±0.02 0.47±0.07a 0.49±0.06a 0.81±0.09abc 46.794**MCF-7/DDP凋亡率(%)8.32±1.64 17.39±1.96a 17.64±2.08a 10.06±1.43bc 21.965**Bax 1.00±0.02 2.24±0.25a 2.40±0.27a 1.35±0.19bc 32.230**Bcl-2 1.00±0.01 0.49±0.06a 0.50±0.07a 0.84±0.10bc 41.608**

Fig.5 Effects of HIFU on apoptosis of MDA-MB-231/DDP and MCF-7/DDP cells图5 HIFU对MDA-MB-231/DDP及MCF-7/DDP细胞凋亡的影响
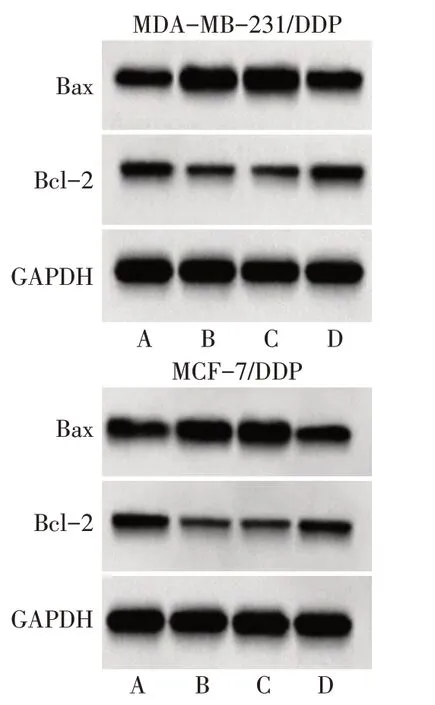
Fig.6 Effects of HIFU on apoptosis related proteins of MDA-MB-231/DDP and MCF-7/DDP cells图6 HIFU对MDA-MB-231/DDP及MCF-7/DDP细胞凋亡相关蛋白的影响
2.6 HIFU 对肿瘤生长及蛋白表达的影响 与control 组相比,HIFU 组肿瘤质量、TRIF 及p-ERK1/2/ERK1/2表达水平、肿瘤体积、Ki-67阳性表达显著降低(P<0.05);与HIFU 组相比,HIFU+DMSO 组肿瘤体积、肿瘤质量、TRIF 及p-ERK1/2/ERK1/2 表达水平差异无统计学意义(P>0.05),Ki-67 阳性表达无明显变化;HIFU+fisetin 组肿瘤体积、肿瘤质量、TRIF 及p-ERK1/2/ERK1/2 表达水平、Ki-67 阳性表达显著增加(P<0.05),见表6,图8-10。
Tab.4 Comparison of TRIF protein,drug resistancerelated protein and ERK pathway protein expression between the four groups of MDA-MB-231/DDP cells表4 各组MDA-MB-231/DDP细胞TRIF蛋白、耐药相关蛋白及ERK通路蛋白表达水平比较(n=3,±s)
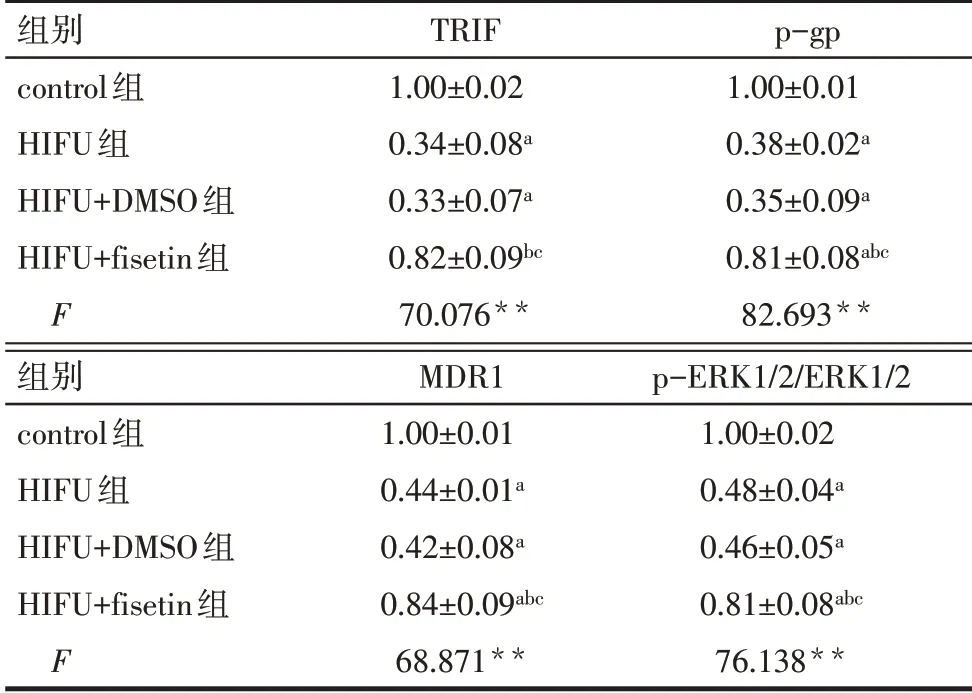
Tab.4 Comparison of TRIF protein,drug resistancerelated protein and ERK pathway protein expression between the four groups of MDA-MB-231/DDP cells表4 各组MDA-MB-231/DDP细胞TRIF蛋白、耐药相关蛋白及ERK通路蛋白表达水平比较(n=3,±s)
**P<0.01;a与control 组比较,b与HIFU 组比较,c与HIFU+DMSO组比较,P<0.05。
组别control组HIFU组HIFU+DMSO组HIFU+fisetin组F TRIF 1.00±0.02 0.34±0.08a 0.33±0.07a 0.82±0.09bc 70.076**p-gp 1.00±0.01 0.38±0.02a 0.35±0.09a 0.81±0.08abc 82.693**组别control组HIFU组HIFU+DMSO组HIFU+fisetin组F MDR1 1.00±0.01 0.44±0.01a 0.42±0.08a 0.84±0.09abc 68.871**p-ERK1/2/ERK1/2 1.00±0.02 0.48±0.04a 0.46±0.05a 0.81±0.08abc 76.138**
Tab.5 Comparison of TRIF protein,drug resistancerelated protein and ERK pathway protein expression between the four groups of MCF-7/DDP cells表5 各组MCF-7/DDP细胞TRIF蛋白、耐药相关蛋白及ERK通路蛋白表达水平比较 (n=3,±s)
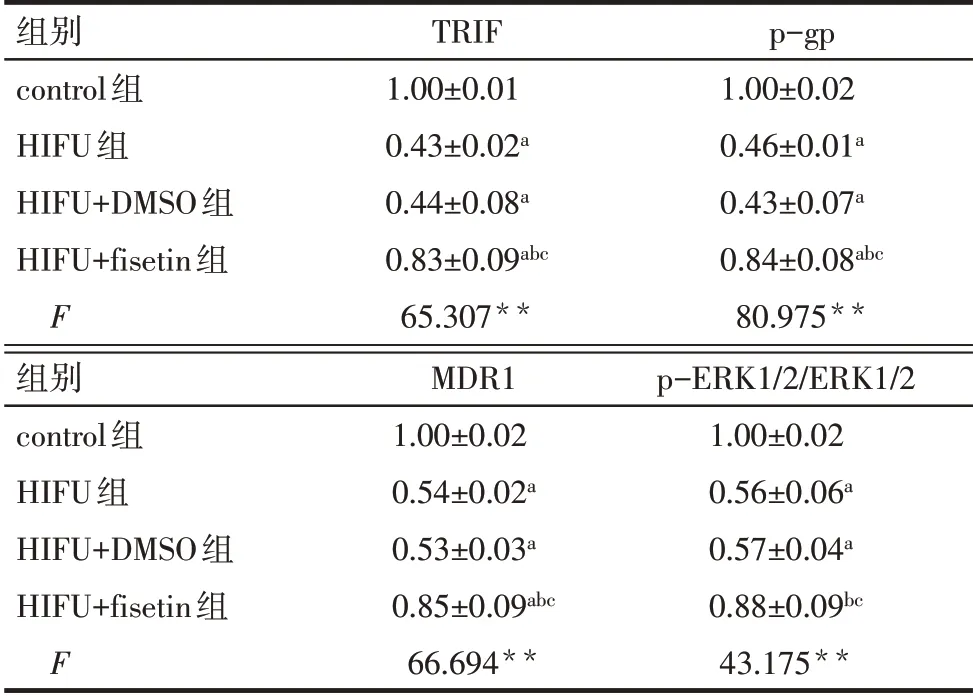
Tab.5 Comparison of TRIF protein,drug resistancerelated protein and ERK pathway protein expression between the four groups of MCF-7/DDP cells表5 各组MCF-7/DDP细胞TRIF蛋白、耐药相关蛋白及ERK通路蛋白表达水平比较 (n=3,±s)
**P<0.01;a与control 组比较,b与HIFU 组比较,c与HIFU+DMSO组比较,P<0.05。
组别control组HIFU组HIFU+DMSO组HIFU+fisetin组F TRIF 1.00±0.01 0.43±0.02a 0.44±0.08a 0.83±0.09abc 65.307**p-gp 1.00±0.02 0.46±0.01a 0.43±0.07a 0.84±0.08abc 80.975**组别control组HIFU组HIFU+DMSO组HIFU+fisetin组F MDR1 1.00±0.02 0.54±0.02a 0.53±0.03a 0.85±0.09abc 66.694**p-ERK1/2/ERK1/2 1.00±0.02 0.56±0.06a 0.57±0.04a 0.88±0.09bc 43.175**
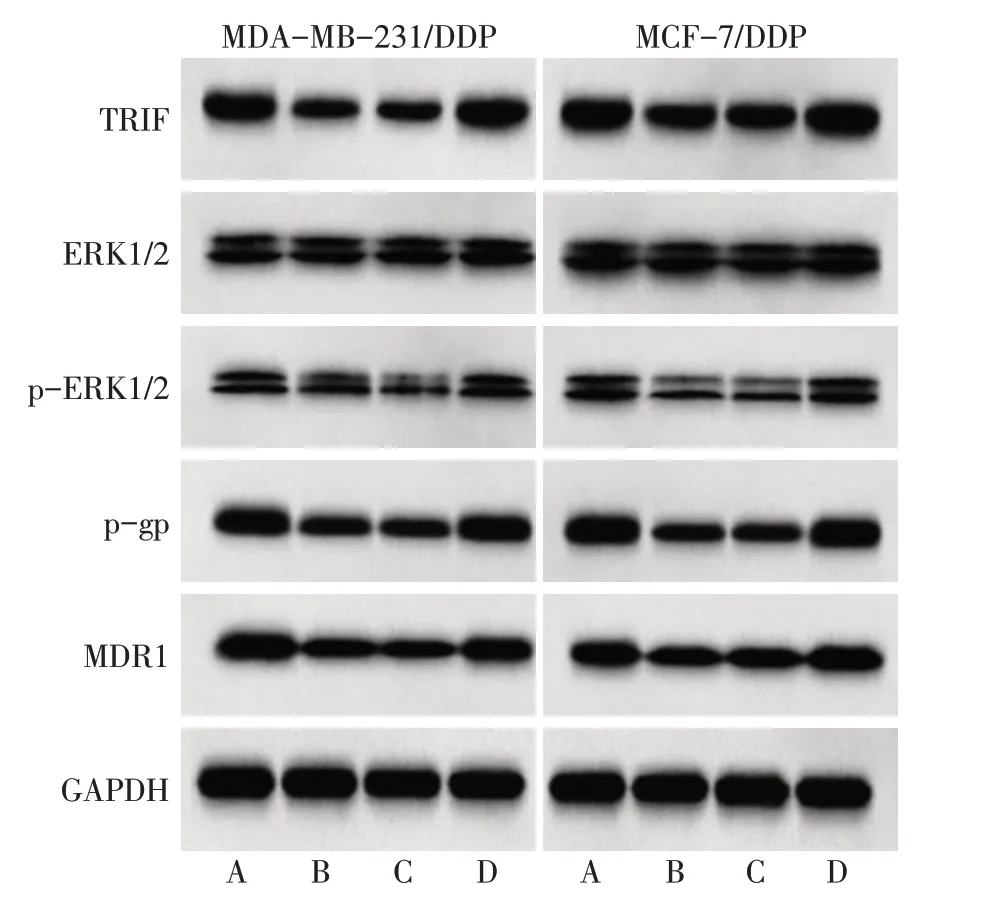
Fig.7 Effects of HIFU on the expression of MDA-MB-231/DDP and MCF-7/DDP cell related proteins图7 HIFU对MDA-MB-231/DDP及MCF-7/DDP细胞相关蛋白表达的影响
3 讨论
乳腺癌是目前女性死亡率最高的癌症,尽管已有了有效的治疗方法,但仍有许多患者无法得到完全治愈[7]。DDP 作为一种有效的化疗药物,已被广泛用于乳腺癌的治疗[8],其可通过促进MCF-7 细胞DNA损伤来加速细胞凋亡,从而起到抗癌作用[9],但由于患者产生DDP 耐药可降低癌细胞内的DDP 积聚,引起抗凋亡蛋白及促凋亡蛋白表达失调,造成多数患者癌症复发,严重影响患者预后[3]。而目前对DDP 耐药机制的认知尚不清楚,因此有必要进行探讨,并寻找可提高乳腺癌对DDP 化疗敏感性的方法。
Tab.6 Comparison of tumor mass and tissue protein expression between the four groups表6 各组肿瘤质量及组织蛋白表达水平比较(n=5,±s)
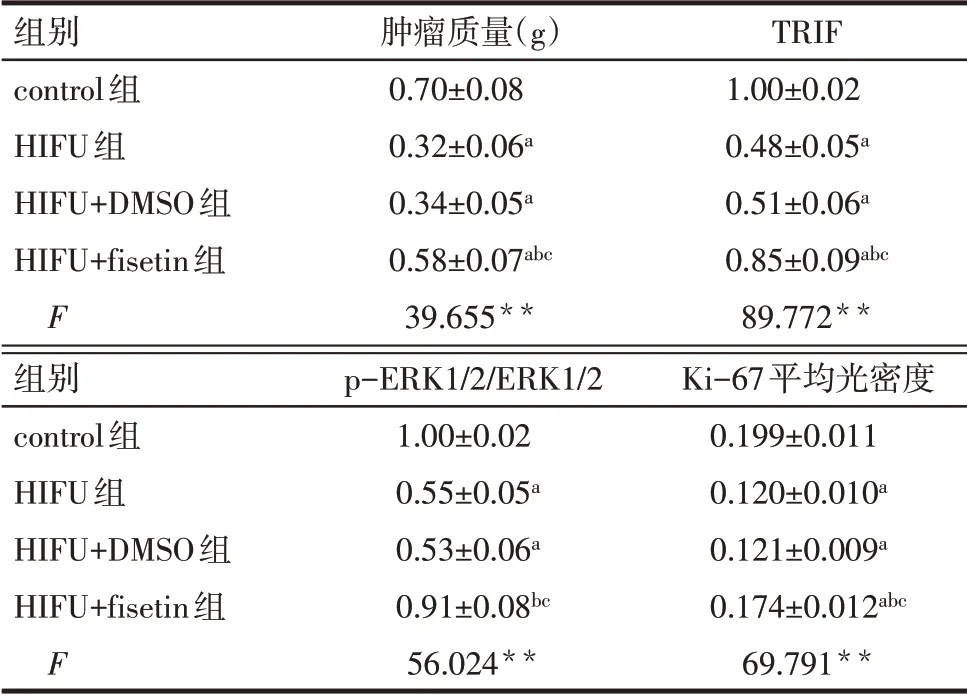
Tab.6 Comparison of tumor mass and tissue protein expression between the four groups表6 各组肿瘤质量及组织蛋白表达水平比较(n=5,±s)
**P<0.01;a与control 组比较,b与HIFU 组比较,c与HIFU+DMSO组比较,P<0.05。
组别control组HIFU组HIFU+DMSO组HIFU+fisetin组F肿瘤质量(g)0.70±0.08 0.32±0.06a 0.34±0.05a 0.58±0.07abc 39.655**TRIF 1.00±0.02 0.48±0.05a 0.51±0.06a 0.85±0.09abc 89.772**组别control组HIFU组HIFU+DMSO组HIFU+fisetin组F p-ERK1/2/ERK1/2 1.00±0.02 0.55±0.05a 0.53±0.06a 0.91±0.08bc 56.024**Ki-67平均光密度0.199±0.011 0.120±0.010a 0.121±0.009a 0.174±0.012abc 69.791**
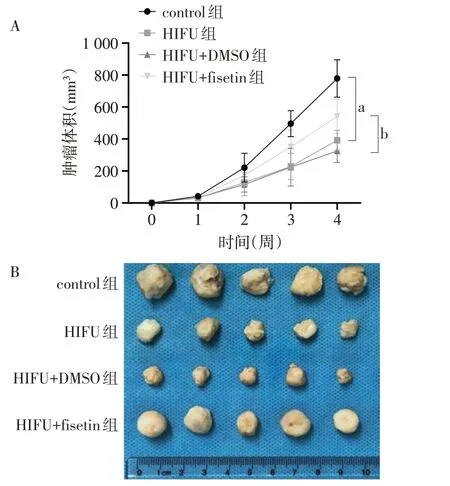
Fig.8 Effects of HIFU on tumor growth图8 HIFU对肿瘤生长的影响

Fig.9 Effects of HIFU on the expression of TRIF protein and ERK pathway protein in tumor tissue图9 HIFU对肿瘤组织TRIF蛋白及ERK通路蛋白表达的影响
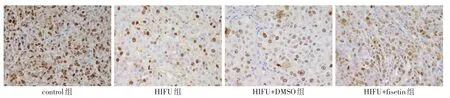
Fig.10 Effects of HIFU on the positive expression of Ki-67 in tumor tissues(×200)图10 HIFU对肿瘤组织Ki-67阳性表达的影响(×200)
3.1 HIFU在肿瘤治疗中的应用效果 HIFU作为一种微创消融技术,可通过聚焦高能量的超声靶向破坏癌细胞,使肿瘤组织凝固性坏死,具有降低麻醉风险、保留乳房完整性、避免临近组织破坏以及简化操作过程的优点,已被应用于乳腺癌的治疗[10-11]。与单独使用动脉粥样硬化斑块特异性肽-1 包裹DDP治疗多形性胶质母细胞瘤相比,其与聚焦超声联合化疗抑制瘤体生长的效果更佳[12]。HIFU 已被证实可通过阻滞细胞周期进程、抑制抗凋亡蛋白表达来诱导肺癌A549/DDP细胞凋亡[3],还可通过降低p-gp蛋白表达来抑制A549 细胞对DDP 的耐药性[13]。本研究通过构建稳定的MDA-MB-231/DDP及MCF-7/DDP 耐药细胞,发现HIFU 可有效抑制MDA-MB-231/DDP 及MCF-7/DDP 细胞增殖及肿瘤生长,阻滞细胞周期,促进细胞凋亡,降低细胞对DDP 的耐药性,与Zhang等[3]得出的HIFU抑制细胞增殖、肿瘤生长研究结果相似。
3.2 TRIF 在肿瘤中的作用机制 TRIF 信号通路作为一个重要的炎症信号介质[14],与前列腺癌[15]、乳腺癌[16]等的发生有关。抑制TRIF 表达可减轻胰腺癌恶病质模型小鼠的癌症恶病质[14]。姜黄素可通过下调TRIF 信号通路激活抑制乳腺癌细胞(MCF-7、MDA-MB-231)活力及细胞炎症反应[16]。还有研究表明,超声热疗能够通过抑制TRIF途径促进口腔鳞状细胞癌(CAL-27和SCC-4细胞)的化疗敏感性[4]。TRIF 能够介导其下游多个信号途径参与癌症的进程。ERK通路是其下游信号途径之一,TRIF可通过抑制该通路来降低巨噬细胞的炎症反应[4]。ERK由ERK1和ERK2组成,与肿瘤细胞存活、增殖、转移及癌症药物敏感性有关,阻断该通路是促使细胞死亡的有效途径[17]。有研究报道ERK 信号的激活能够使乳腺癌细胞MDA-MB-231产生抵抗放疗的作用,获得抗放疗的细胞系,抑制该通路可诱导MDAMB-231 细胞死亡,降低细胞放射抗性[18]。雌激素受体-α(estrogen receptor-α,ER-α)36 可通过激活ERK 信号通路降低乳腺癌小鼠及MCF-7 和MDAMD-231 细胞对DPP 的敏感性[19]。本研究发现,HIFU可显著降低MDA-MB-231/DDP及MCF-7/DDP细胞及体外肿瘤组织中TRIF、p-ERK1/2/ERK1/2 表达水平;此外,还发现ERK通路激活剂fisetin可逆转HIFU增强MCF-7和MDA-MD-231细胞及乳腺癌小鼠对DDP 敏感性的效应,表明HIFU 可抑制TRIF 介导的ERK 通路的激活,并且HIFU 对乳腺癌细胞DDP化疗敏感性的增强作用可能与抑制该通路激活有关。
综上所述,HIFU 可通过抑制TRIF 表达来抑制其介导的ERK 通路,从而促进乳腺癌细胞凋亡,抑制细胞增殖,增强DDP 化疗敏感性。本研究为了解乳腺癌对DDP 化疗耐药性的机制提供了参考,有助于寻找克服DDP 化疗耐药性的新方法,但HIFU 对ERK 通路下游机制的影响还未进行深入探讨,这将成为今后研究的方向。

