罗替加肽抑制糖尿病大鼠胃平滑肌自主收缩运动的实验研究
孙海贝,包伊特格乐,张默函
糖尿病胃动力障碍是一种常见的糖尿病并发症,常表现为呕吐、腹胀、腹痛[1]。长期的高血糖作用被认为是其主要的诱发因素,但具体发病机制尚未明确。胃平滑肌的自主收缩运动是胃动力的来源,而胞内Ca2+增加是该运动的重要机制。胞内Ca2+主要来源于细胞内质网与胞外Ca2+摄入,其中胞外Ca2+除了受细胞膜的Ca2+通道调控外,缝隙连接(gap junction,GJ)也是重要的调控因素。研究证实,胃平滑肌细胞间存在丰富的GJ[2]。GJ主要由6个连接蛋白(connexin,Cx)构成,以Cx43的表达最广泛。Cx43是一种分子质量为43 ku的4次跨膜蛋白[3],属于α-Cx亚族。Cx43构成缝隙连接半通道,其数量和磷酸化形式具有调节GJ 通透性的作用[4]。研究发现,Cx43 参与形成Ca2+可渗透的半通道,促进Ca2+内流[5]。Cx43 丝氨酸368 位点(Cx43 Ser368)磷酸化能够降低通道开放程度,调节胞内Ca2+的水平[6-7]。Cx43 的磷酸化依赖其上游蛋白激酶C(PKC)调控,其中PKCα具有调控Cx43的功能[8]。罗替加肽是一种GJ 调节剂。研究发现罗替加肽能够通过激活PKC促进心肌Cx43磷酸化,进而稳定急性心肌梗死心肌缝隙连接传导正常化[9]。因此,该药被认为在预防缺血-再灌注诱导的室性心律失常和缺血性室性心动过速方面有一定的应用前景[10-11]。而关于其对胃平滑肌自主收缩运动,尤其是糖尿病胃肠道的作用效果及机制至今少见报道。本实验旨在探讨罗替加肽对糖尿病胃平滑肌自主收缩运动的作用和可能的相关机制,为其临床应用提供理论基础和实验依据。
1 材料与方法
1.1 实验材料 成年雄性SD大鼠12只,体质量(200±20)g,购于延边大学实验动物中心。链脲佐菌素(Streptozotocin,STZ,美国Sigma 公司)。罗替加肽(美国MCE 公司),Cx43 抗体、p-Cx43 Ser368抗体、PKCα 抗体、p-PKCα Thr497抗体(英国Abacm 公司),β-actin 抗体(美国Sigma 公司),辣根过氧化物酶标记的IgG二抗(美国SantaCruz公司),细胞膜蛋白与细胞浆蛋白提取试剂盒,BCA 蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 糖尿病模型制备与实验分组 用柠檬酸盐缓冲液(0.1 mol/L,pH=4.0)配制0.5%的STZ 溶液。大鼠单笼饲养,相对湿度50%~80%,室温18~25 ℃,自由饮水和进食,12 h明暗循环。采用随机数字表法将大鼠分为模型组与正常对照组,每组6只。模型组大鼠禁食不禁水12 h,称质量后一次性腹腔注射65 mg/kg STZ,饲养条件不变。给药7 d后尾静脉取血,大鼠血糖>16.7 mmol/L 提示糖尿病造模成功。6只正常对照组大鼠一次性腹腔注射等量的柠檬酸盐缓冲液。实验周期为8周。
1.2.2 离体肌条实验观察大鼠胃平滑肌自主收缩运动 大鼠禁食不禁水24 h后行安乐死,然后迅速剖取全胃,并立即放入4 ℃的氧饱和Kreb’s 液(NaCl 118 mmol/L、KCl 4.75 mmol/L、CaCl22.54 mmol/L、KH2PO41.2 mmol/L、MgSO41.2 mmol/L、NaHCO325 mmol/L、葡萄糖10 mmol/L)中,漂洗出胃内容物。小心剥离浆膜与黏膜,剪取胃窦部(其余胃组织液氮保存备用),制备2.0 cm×0.2 cm 的肌条。肌条放置于装有Kerb’s 液的垂直灌流槽内(恒温37 ℃,持续供给95%O2和5%CO2的混合气体),一端固定在铂丝钩上,另一端连接张力换能器。每次实验开始调节肌张力为1 g,平衡5 min,张力传感器记录肌力变化。待张力曲线产生且稳定后加入罗替加肽(3 mmol/L),观察并记录正常对照组和模型组离体肌条的收缩运动变化。将加入罗替加肽处理后的肌条分别设为正常对照+罗替加肽组与模型+罗替加肽组,每组6 例,再次记录张力曲线的变化。单位时间内各组肌肉收缩的次数(波峰数目)为频率,每次肌肉收缩的强度(波峰高度)为振幅。每一轮药物实验后,将罗替加肽作用后的离体肌条放置于液氮中保存备用。
1.3 Western blot 检测膜蛋白、浆蛋白中相应蛋白表达 分别取适量正常对照组、模型组以及模型+罗替加肽组的胃平滑肌组织,按照细胞膜蛋白与细胞浆蛋白提取试剂盒要求进行操作。向装有实验用组织的离心管加入膜蛋白提取液A,充分混合后匀浆,冷藏10 min后,4 ℃、13 500 r/min离心30 min,提取上清液即为浆蛋白;继续向该离心管加入膜蛋白提取液B,冷藏10 min后,4 ℃、13 500 r/min离心30 min,提取上清液即为膜蛋白。将提取的膜蛋白与浆蛋白分别于预冷的磷酸盐缓冲液(PBS)中洗2遍,加入100~200µL预冷的裂解液,室温吹打均匀,于冰上放置30 min 以使其充分裂解,96 孔板每孔加样2µL待测蛋白、18µL双蒸水和200µL蛋白浓度测定工作液(BCA工作液),测定蛋白样品浓度。取待测蛋白煮沸2 min,40µg/孔加样,10%十二烷基苯磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,利用半干转移法将分离胶内的蛋白转移到PVDF膜。滴加Cx43(1∶1 000)、p-Cx43 Ser368(1∶1 000)、PKCα(1∶1 000)、p-PKCα Thr497(1∶1 000)及β-actin(1∶500)抗体,4 ℃过夜,洗涤后加入辣根过氧化物酶标记的山羊抗兔IgG(1∶1 000),室温下孵育1 h,洗膜。凝胶成像分析系统曝光并分析图像,以β-actin为内参,计算膜蛋白和浆蛋白中Cx43、PKCα,膜蛋白中p-Cx43 Ser368、p-PKCα Thr497的相对表达水平。
1.4 统计学方法 采用SPSS 21.0软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 胃平滑肌频率与振幅的比较 与正常对照组比较,模型组胃平滑肌自主收缩运动的振幅和频率均降低(P<0.05)。正常对照组与罗替加肽处理后的正常对照+罗替加肽组比较胃平滑肌自主收缩运动振幅和频率无明显变化;而罗替加肽处理后的模型+罗替加肽组的胃平滑肌自主收缩运动振幅和频率较模型组均降低(P<0.05),见表1、图1。
Tab.1 Comparison of frequency and amplitude of gastric smooth muscle in muscle strip experiment between the four groups表1 各组大鼠离体肌条实验中胃平滑肌频率及振幅的比较(n=6,±s)
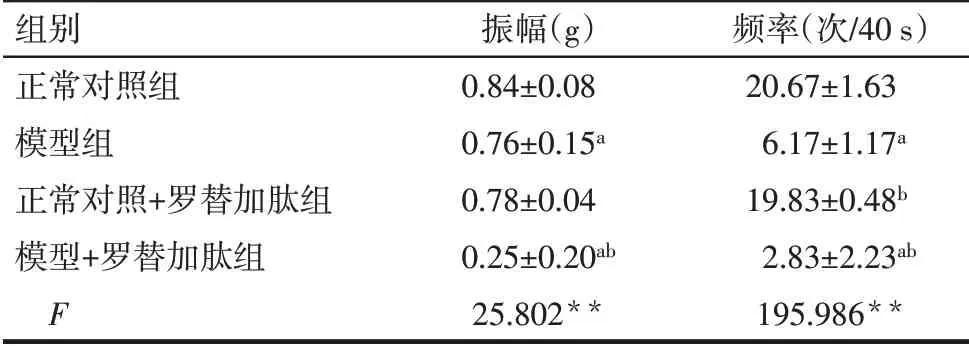
Tab.1 Comparison of frequency and amplitude of gastric smooth muscle in muscle strip experiment between the four groups表1 各组大鼠离体肌条实验中胃平滑肌频率及振幅的比较(n=6,±s)
**P<0.01;a 与正常对照组比较,b 与模型组比较,P<0.05;表2、3同。
组别正常对照组模型组正常对照+罗替加肽组模型+罗替加肽组F振幅(g)0.84±0.08 0.76±0.15a 0.78±0.04 0.25±0.20ab 25.802**频率(次/40 s)20.67±1.63 6.17±1.17a 19.83±0.48b 2.83±2.23ab 195.986**
2.2 胃平滑肌Cx43 的相对表达量 与正常对照组比较,模型组膜蛋白Cx43 含量增加,浆蛋白Cx43 含量降低,Cx43的膜浆比增加(均P<0.05),膜蛋白p-Cx43 Ser368含量增加(P<0.05);与模型组相比,模型+罗替加肽组膜蛋白Cx43 含量降低,浆蛋白Cx43含量增加,Cx43的膜浆比降低(均P<0.05),膜蛋白p-Cx43 Ser368含量变化差异无统计学意义(P>0.05),见图2、表2。
2.3 胃平滑肌PKCα的相对表达量 与正常对照组比较,模型组膜蛋白PKCα 含量降低,浆蛋白PKCα含量增加,PKCα的膜浆比降低(均P<0.05),膜蛋白p-PKCα Thr497含量降低(P<0.01)。与模型组比较,模型+罗替加肽组膜蛋白PKCα 含量、浆蛋白PKCα含量以及PKCα的膜浆比差异均无统计学意义(P>0.05),而膜蛋白p-PKCα Thr497含量增加(P<0.05),见图3、表3。
3 讨论
胃平滑肌细胞中的部分细胞具有起搏细胞功能,该细胞的兴奋能够通过细胞间广泛存在的GJ向周围的平滑肌细胞扩散,进而使这些平滑肌细胞随着一起运动,形成一个运动单元[12]。胃平滑肌的自主收缩运动是胃动力的主要来源,而频率和振幅则是胃平滑肌自主收缩运动的主要表现形式。长期的高血糖是导致糖尿病胃动力障碍的主要原因。Cai等[13]研究认为,糖尿病大鼠存在胃动力障碍,主要表现为胃平滑肌自主收缩运动的频率变慢,而振幅不变。这与本实验研究结果部分相同,考虑可能与糖尿病大鼠病程不同有关。

Fig.1 Frequency and amplitude of gastric smooth muscle in in vitro strip experiment in each group图1 各组离体肌条实验中胃平滑肌频率及振幅

Fig.2 The expression levels of Cx43 in gastric smooth muscle of rats detected by Western blot assay in the three groups图2 Western blot检测各组大鼠胃平滑肌中Cx43的含量
Tab.2 Comparison of the expression levels of Cx43 in gastric smooth muscle of rats between the three groups表2 各组大鼠胃平滑肌中Cx43的表达水平比较(n=6,±s)
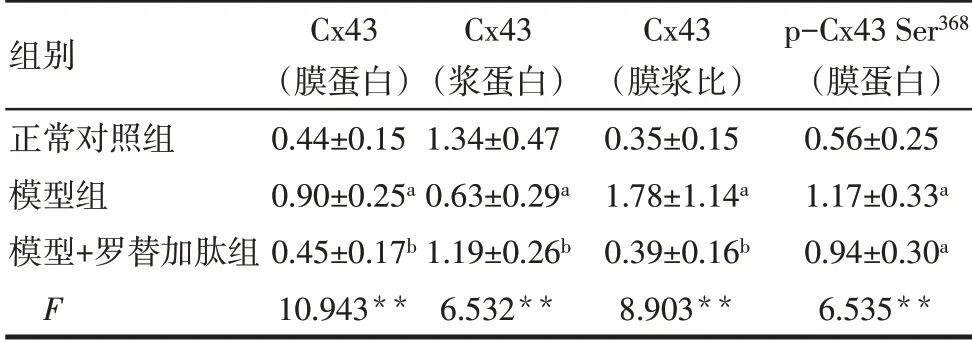
Tab.2 Comparison of the expression levels of Cx43 in gastric smooth muscle of rats between the three groups表2 各组大鼠胃平滑肌中Cx43的表达水平比较(n=6,±s)
组别正常对照组模型组模型+罗替加肽组F Cx43(膜蛋白)0.44±0.15 0.90±0.25a 0.45±0.17b 10.943**Cx43(浆蛋白)1.34±0.47 0.63±0.29a 1.19±0.26b 6.532**Cx43(膜浆比)0.35±0.15 1.78±1.14a 0.39±0.16b 8.903**p-Cx43 Ser368(膜蛋白)0.56±0.25 1.17±0.33a 0.94±0.30a 6.535**
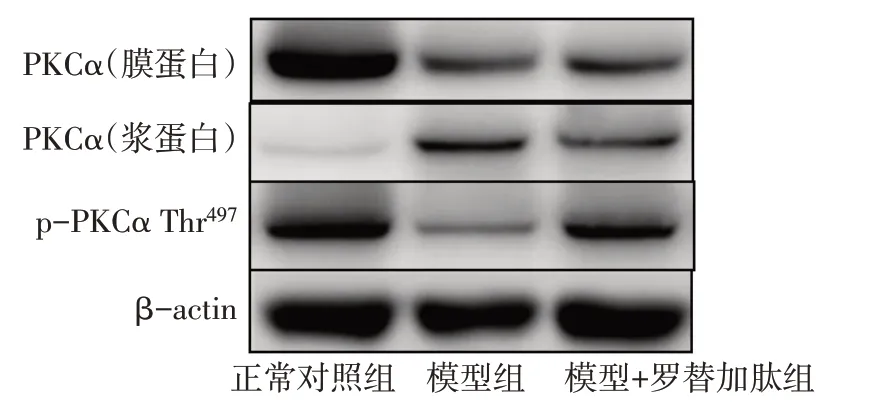
Fig.3 The expression levels of PKCα and p-PKCα Thr497 protein detected by Western blot assay in each group图3 Western blot检测各组PKCα和p-PKCα Thr497蛋白的表达
Tab.3 Comparison of PKCα protein expression levels in gastric smooth muscle of rats between the three groups表3 各组大鼠胃平滑肌中PKCα蛋白的表达水平比较(n=6,±s)
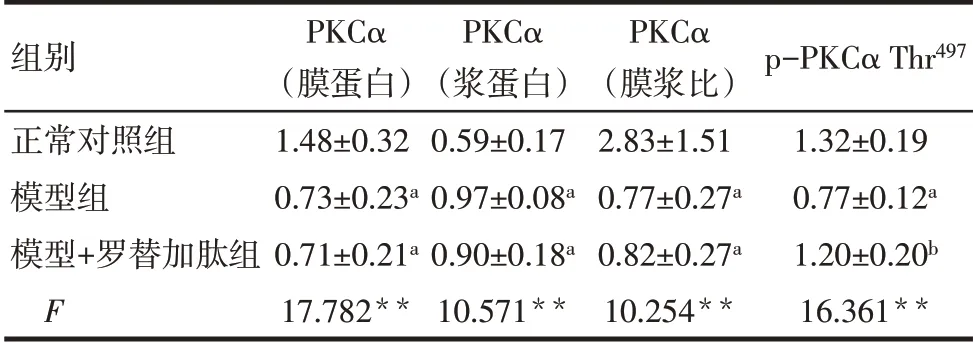
Tab.3 Comparison of PKCα protein expression levels in gastric smooth muscle of rats between the three groups表3 各组大鼠胃平滑肌中PKCα蛋白的表达水平比较(n=6,±s)
组别正常对照组模型组模型+罗替加肽组F PKCα(膜蛋白)1.48±0.32 0.73±0.23a 0.71±0.21a 17.782**PKCα(浆蛋白)0.59±0.17 0.97±0.08a 0.90±0.18a 10.571**PKCα(膜浆比)2.83±1.51 0.77±0.27a 0.82±0.27a 10.254**p-PKCα Thr497 1.32±0.19 0.77±0.12a 1.20±0.20b 16.361**
PKCα 是经典型蛋白激酶C 家族亚型。经典PKC 又称为Ca2+依赖型PKC,依赖Ca2+活化,也参与Ca2+通道的开放,影响胞外Ca2+的内流,对细胞内Ca2+浓度的变化影响较大。研究认为,PKC 活化后通过上调细胞膜上Ca2+受体促进Ca2+内流[14]。细胞膜上p-PKCα Thr497的磷酸化与PKCα 的比值水平可反映PKCα的活性。本研究发现,高血糖可能通过抑制细胞膜PKCα 活性,导致Ca2+的内流下降,抑制平滑肌细胞收缩。细胞膜Cx43半通道数量可表现出对Ca2+的高渗透性[15]。Cx43 膜浆比可反映GJ 半通道的数量,Cx43 Ser368的磷酸化水平则反映GJ 半通道的开放率,而GJ半通道的开放率能够反映细胞间物质和信息传递情况。本研究认为,高血糖能够增加胃平滑肌细胞间的GJ半通道的数量,可能为通过增加细胞间物质和信息传递以及细胞外物质进入胞内来调节微环境的改变;但由于Cx43 Ser368磷酸化水平的增加降低了GJ 半通道的开放,导致细胞外Ca2+的摄入下降,进而使胃平滑肌自主收缩受到抑制。
罗替加肽是Cx43活性的重要调节剂,能够阻止Cx43介导的缝隙连接解耦联,临床上常被用于多种心脏疾病的治疗。Axelsen等[16]研究发现,罗替加肽可通过调节PKCα 活性改变Cx43 的磷酸化水平,进而改善心律失常。Kjølbye 等[9]认为,应激状态下罗替加肽通过与其下游蛋白PKCα 作用,保护心肌细胞中Cx43磷酸化状态,应对心肌缺血时缝隙连接解偶联。这表明罗替加肽主要通过Cx43 调控心肌细胞间的缝隙连接治疗心脏疾病。胃平滑肌细胞间存在丰富的缝隙连接,而罗替加肽是否对糖尿病导致的胃动力障碍具有治疗作用,少见文献报道。本研究发现,罗替加肽对糖尿病胃动力障碍非但不具有治疗作用,反而还加剧抑制胃平滑肌自主收缩运动,直至运动停止。
细胞内Ca2+增加是胃平滑肌细胞发生自主收缩运动的必需条件。Ca2+增加主要依靠细胞内的Ca2+库的释放及胞外Ca2+摄入。内质网作为细胞内的Ca2+库,在胃平滑肌细胞自主收缩运动中发挥作用。研究认为,高糖条件下胃平滑肌细胞存在内质网应激现象[17]。这表明高糖状态下胃平滑肌细胞的自主收缩运动所依赖的胞内Ca2+只能依靠胞外Ca2+的摄入。罗替加肽能够促进PKCα 的活化,而活化的PKCα 可通过磷酸化Cx43 调节GJ 的生物学功能。结合本研究结果,推测糖尿病状态下罗替加肽通过活化胃平滑肌细胞膜PKCα,下调细胞膜Cx43 Ser368位点的磷酸化水平,进而下调GJ 半通道的开放率,同时降低GJ 半通道的数量;且PKCα 的这种通过Cx43抑制胞外Ca2+内流的作用强于通过上调细胞膜上Ca2+受体促进Ca2+内流的作用。
综上所述,罗替加肽能够通过PKC-Cx43 通路下调GJ 数量及GJ 开放率,减少胞外Ca2+内流,进而抑制高糖状态下胃平滑肌自主收缩运动。由于罗替加肽可用于多种心律失常的治疗,本研究为探究罗替加肽的进一步临床应用价值提供了一定的实验依据和理论依据。同时,本研究结果也表明罗替加肽应用于糖尿病患者的心脏疾病治疗过程中应注意预防潜在的胃肠道不良反应。

