扶正化瘀方含药血清对肝星状细胞activinA/smad信号通路活化的影响
陈黎旭,熊佳,谢昆,朱挺德,钟志英,官亮,潘永平△
肝纤维化是细胞外基质(ECM)降解和生成失衡导致ECM在肝内过度积聚,形成纤维性瘢痕的一种病理表现[1]。80%的原发性肝癌以“肝纤维化-肝硬化-肝癌”进展为特征[2]。世界卫生组织国际癌症研究机构发布的数据显示,肝癌是全球癌症相关死亡的第二大原因,在我国肝癌也是第二大致命性癌症[3]。肝星状细胞(HSC)是肝脏中主要的胶原生成细胞,当肝脏受到损害时,HSC 可被激活,合成并分泌大量ECM,促进肝纤维化形成,因此,活化的HSC在肝纤维化中起重要作用[4]。扶正化瘀方由丹参、虫草菌粉、桃仁、绞股蓝、松花粉和五味子组成,是国家食品药品监督管理局批准的抗肝纤维化中药方剂[5]。已有研究表明肝祖细胞中的激活素A(activinA)-smad-结缔组织生长因子(CTGF/CCN2)轴可能是肝纤维化的潜在治疗靶点[6]。也有研究表明扶正化瘀方可通过抑制HSC 中的转化生长因子(TGF)-β1/smads 信号通路来发挥抗肝纤维化作用[7]。但有关扶正化瘀方通过影响HSC activinA/smad信号通路从而实现抗纤维化作用的研究较少。本研究采用扶正化瘀方含药血清干预大鼠的HSC,探究其改善肝纤维化的可能机制,为临床治疗肝纤维化提供依据。
1 材料与方法
1.1 材料 大鼠HSC-T6 购于中国科学院昆明细胞库。20只雄性SPF级SD大鼠购于湖南斯莱克景达实验动物有限公司,体质量250~280 g,7 周龄,动物许可证号:SCXK(湘)2016-0002。本研究经江西中医药大学实验动物科技中心动物实验伦理委员会审查批准(批准号JZLLSC2018-0131)。扶正化瘀胶囊(上海黄海制药公司,3 mg/粒,批号190312);兔多克隆核因子-κB(NF-κB)p65 抗体购于美国Origene 公司;兔源胱天蛋白酶-3(caspase-3)抗体、smad3 单克隆抗体购于美国CST 公司;兔源activinⅡA 受体(ActRⅡA)抗体、辣根过氧化物酶(HRP)标记的山羊抗兔IgG、化学发光试剂盒购于爱必信生物科技有限公司;鼠源β-肌动蛋白(β-actin)抗体购于华安生物科技有限公司;PI 细胞凋亡周期试剂盒、山羊抗鼠免疫球蛋白G(IgG)购于联科生物科技有限公司;线粒体膜电位检测试剂盒(JC-1)购于上海翊圣生物科技有限公司;活性氧检测试剂盒购于碧云天生物技术有限公司;Chemi Doc XRS型凝胶成像仪(美国Bio-Rad公司);5810R型冷冻离心机(德国Eppendorf 公司);Gallios 型流式细胞仪(美国Beckman 公司);Spectra Max i3 型酶标仪(德国Molecular Devices公司)。
1.2 含药血清制备 将扶正化瘀胶囊中药物粉末取出,称质量,参考文献[7-9]设定0.75 g/kg、1.5 g/kg、3.0 g/kg 扶正化瘀药物剂量,根据大鼠灌胃容积10 mL/kg,用蒸馏水配制对应浓度药物溶液给大鼠进行灌胃。大鼠在温度23 ℃洁净动物房适应性喂养1周。将大鼠按随机数字表法分成4组,每组5只,分别为对照组、扶正化瘀(Fzhy)-低剂量含药血清组(0.75 g/kg)、Fzhy-中剂量含药血清组(1.5 g/kg)、Fzhy-高剂量含药血清组(3.0 g/kg)。大鼠灌胃1 次/d,连续3 d,对照组灌服等体积的蒸馏水。末次给药前禁食不禁水,给药1 h后,眼眶取血,室温静置,3 000 r/min离心10 min,取上层血清,56 ℃水浴灭菌30 min,0.22µm微孔滤膜过滤,-80 ℃保存备用。
1.3 细胞培养 采用含10%胎牛血清RPMI-1640 培养基(添加1%青霉素/链霉素)于37 ℃、5%CO2恒温培养箱中培养HSC-T6细胞,待细胞生长至融合度达到80%~90%时进行传代,取生长状态良好的细胞用于后续实验。
1.4 CCK-8 法检测细胞存活率及分组 在96 孔板中接种HSC-T6 细胞悬液,每孔100µL,细胞密度为1×105个/mL,培养24 h后吸去孔中培养基,加入5%、10%、20%不同体积分数的各组含药血清[7-8]。培养24 h后,向每孔加入10µL CCK-8原液,放置培养箱中孵育1~2 h,用酶标仪检测450 nm波长处的吸光度。细胞存活率(%)=(处理组吸光度值-调零组吸光度值)/(正常对照组吸光度值-调零组吸光度值)×100%。根据CCK-8结果,选取细胞存活率在50%左右的体积分数重新分组后进行后续实验:Fzhy-低剂量含药血清组(Fzhy-低剂量组)、Fzhy-中剂量组和Fzhy-高剂量组,设置对照组,将对数生长期的细胞按3×106/孔接种入6孔板中,培养24 h后,按照上述分组并给药。
1.5 流式细胞仪检测 (1)细胞周期及凋亡率。在37 ℃、5%CO2培养箱中培养各组细胞,孵育24 h后,收集细胞,用乙醇固定2 h,PBS 清洗2 次,每组加入0.5 mL 配制好的PI 染色工作液,混匀细胞,37 ℃避光孵育30 min,流式细胞仪检测细胞周期及细胞凋亡率。(2)细胞线粒体膜电位变化。取0.5 mL的JC-1工作液重悬各组细胞,室温避光孵育20 min后,再用JC-1 染色缓冲液(1×)洗涤2 次,用0.5 mL JC-1 染色缓冲液(1×)重悬细胞。流式细胞仪检测细胞线粒体膜电位水平。(3)细胞ROS 水平。收集各组细胞,按照活性氧检测试剂盒说明书每孔加0.5 mL 浓度为10 µmol/L 的荧光染料DCFHDA,避光37 ℃孵育20 min,用无血清细胞培养液洗涤细胞3次,用胰蛋白酶消化收集细胞,离心弃上清液,PBS 重悬细胞,流式细胞仪检测细胞ROS水平。
1.6 实时荧光定量聚合酶链反应(qPCR)检测mRNA 水平收集各组细胞,用Trizol 法提取细胞中总RNA,将RNA 反转录为cDNA,置于-20 ℃保存备用。采用qPCR 法检测activinA、smad3、samd7、NF-κB mRNA表达,引物由南京金斯瑞生物科技有限公司合成。引物序列见表1。使用SYBR Select Master Mix 配制PCR 反应体系(20 µL),PCR 仪进行cDNA 扩增,反应条件:95 ℃10 min,95 ℃10 s,58 ℃30 s,72 ℃10 s,共40 个循环。用2-ΔΔCt法计算activinA、NF-κB、smad7、smad3 mRNA相对表达量。

Tab.1 The primer sequence for qPCR表1 qPCR引物序列
1.7 Western blot 检测蛋白表达 收集各组细胞,200 µL RIPA裂解液提取总蛋白。将样品放在沸水中加热至蛋白完全变性,取出样品冷却至室温,各组取等量的蛋白进行SDSPAGE电泳,PVDF膜转印。5%脱脂牛奶室温封闭1 h,分别加入ActRⅡA(1∶500),smad3、NF-κB p65、caspase-3(1∶1 000)一抗,4 ℃孵育过夜,TBST洗膜后室温孵育二抗(1∶2 000),化学发光法显影处理、拍照,以β-actin 作为内参蛋白。ImageJ(v1.7.0)软件对条带进行定量分析,蛋白相对表达量=目标蛋白灰度值/参照蛋白灰度值。
1.8 统计学方法 使用GraphPadPrism 7.0 软件进行数据分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间多重比较采用Tukey Kramer检验。所有数据均为3次独立重复实验的平均值,P<0.05为差异有统计学意义。
2 结果
2.1 扶正化瘀方对细胞存活率的影响 5%Fzhy-低、中、高剂量含药血清组细胞存活率分别为(84.75±5.25)%、(79.59±2.93)%和(79.54±6.02)%;10%Fzhy-低、中、高剂量含药血清组细胞存活率分别 为(72.56±8.10)% 、(59.63±7.48)% 和(59.23±8.90)%;20%Fzhy-低、中、高剂量含药血清组细胞存活 率 分 别 为(51.52±1.93)%,(57.86±14.72)%和(40.23±4.84)%;对照组细胞存活率为(102.50±7.07)%。各扶正化瘀含药血清组的细胞存活率均低于对照组(n=3,F=17.890,P<0.05)。选择体积分数为10%的含药血清进行后续实验。
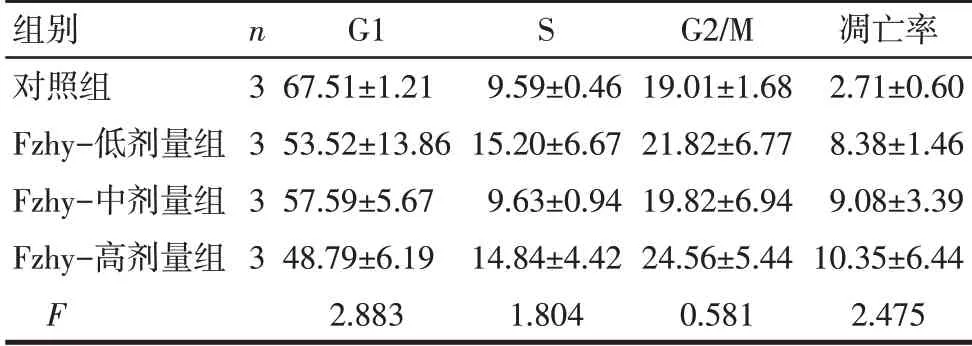
2.2 扶正化瘀方对HSC-T6细胞周期及凋亡率的影响 对照组和各扶正化瘀方含药血清组细胞周期和凋亡率差异均无统计学意义。见表2、图1。
Tab.2 Comparison of HSC-T6 cell cycle and apoptosis rate between the four groups表2 各组HSC-T6细胞周期及凋亡率比较(%,±s)
Tab.2 Comparison of HSC-T6 cell cycle and apoptosis rate between the four groups表2 各组HSC-T6细胞周期及凋亡率比较(%,±s)
均P>0.05。
组别对照组Fzhy-低剂量组Fzhy-中剂量组Fzhy-高剂量组F n3 3 3 3 G1 67.51±1.21 53.52±13.86 57.59±5.67 48.79±6.19 2.883 S 9.59±0.46 15.20±6.67 9.63±0.94 14.84±4.42 1.804 G2/M 19.01±1.68 21.82±6.77 19.82±6.94 24.56±5.44 0.581凋亡率2.71±0.60 8.38±1.46 9.08±3.39 10.35±6.44 2.475
2.3 扶正化瘀方对HSC-T6 细胞ROS 水平的影响 对照组及Fzhy-低、中、高剂量组细胞内ROS 水平分别为0.86±0.07、1.49±0.16、4.26±0.88 和8.92±0.94。与对照组相比,Fzhy-低、中、高剂量组细胞内ROS水平明显升高,Fzhy-低、中、高剂量组细胞内ROS水平逐次升高(n=3,F=95.910,P<0.05)。见图2。
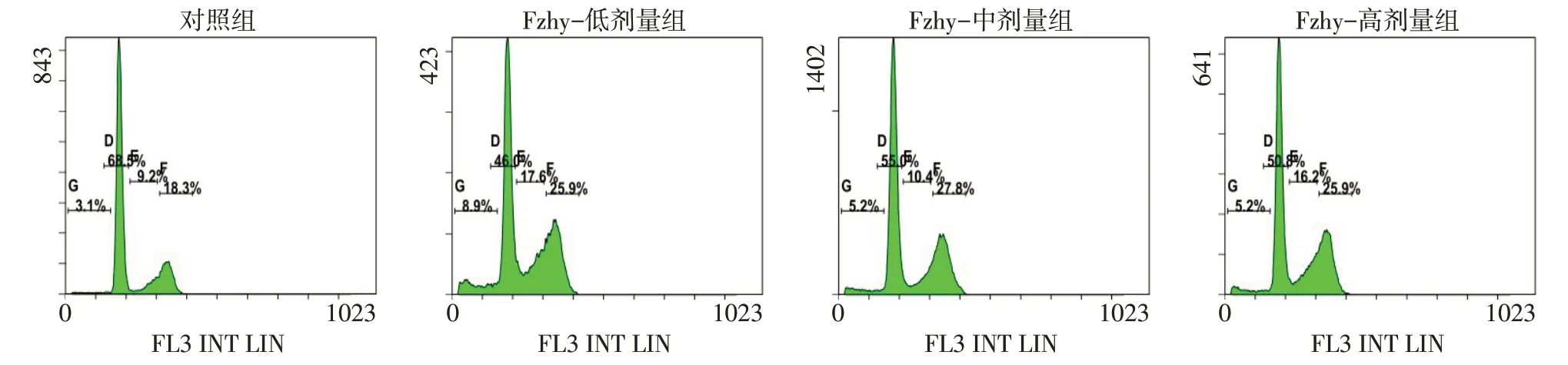
Fig.1 HSC-T6 cell cycle diagram of the four groups图1 4组HSC-T6细胞周期
2.4 扶正化瘀方对HSC-T6细胞线粒体膜电位水平的影响 对照组及Fzhy-低、中、高剂量组细胞线粒体膜电位水平降低比例分别为(13.90±0.82)%、(37.93±0.67)%、(42.87±0.70)%和(49.80±1.02)%。与对照组相比,Fzhy-低、中、高剂量组线粒体膜电位水平降低比例明显升高(P<0.05)。Fzhy-低、中、高剂量组线粒体膜电位水平降低比例逐次升高(n=3,F=1 107.000,P<0.05)。见图3。
2.5 各组activinA/smad 信号通路相关基因表达水平比较 与对照组比较,Fzhy-中、高剂量组smad3 mRNA 表达水平降低,smad7 mRNA 升高,Fzhy-低、中、高剂量组NF-κB、activinA mRNA 表达水平降低(P<0.05);与Fzhy-低剂量组相比,Fzhy-中、高剂量组smad3 mRNA 表达水平降低,Fzhy-中剂量组activinA、smad7 mRNA 升高(P<0.05)。Fzhy-低、中、高剂量组NF-κB mRNA 表达水平差异无统计学意义。见表3。
2.6 各组activinA/smad 信号通路相关蛋白及caspase-3 表达水平比较 与对照组比较,Fzhy-低、中、高剂量组smad3、NF-κB p65、ActRⅡA蛋白表达水平降低,Fzhy-低剂量组、中剂量组caspase-3蛋白表达水平升高(P<0.05)。Fzhy-低、中、高剂量组间smad3、NF-κB p65、ActRⅡA 蛋白表达水平差异无统计学意义。与Fzhy-低、中剂量组比较,Fzhy-高剂量组caspase-3 蛋白表达水平降低(P<0.05),见图4、表4。
Tab.3 Comparison of mRNA expression levels of activinA/smad signaling pathway in HSC-T6 cells between the four groups表3 各组HSC-T6细胞activinA/smad信号通路相关mRNA表达水平比较 (n=3,±s)

Tab.3 Comparison of mRNA expression levels of activinA/smad signaling pathway in HSC-T6 cells between the four groups表3 各组HSC-T6细胞activinA/smad信号通路相关mRNA表达水平比较 (n=3,±s)
*P<0.05;a与对照组比较,b与Fzhy-低剂量组比较,P<0.05。
组别对照组Fzhy-低剂量组Fzhy-中剂量组Fzhy-高剂量组F smad3 1.00±0.05 0.88±0.12 0.38±0.03ab 0.36±0.03ab 68.390*NF-κB 0.98±0.11 0.14±0.05a 0.26±0.08a 0.30±0.18a 32.700*activinA 1.00±0.01 0.09±0.03a 0.52±0.09ab 0.32±0.20a 30.430*smad7 1.03±0.28 1.58±0.08 2.27±0.09ab 1.90±0.35a 15.500*
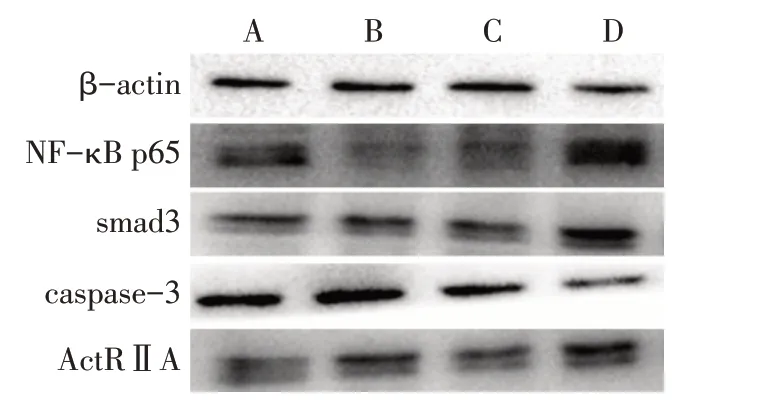
Fig.4 Effects of Fzhy on NF-κB p65,smad3,caspase-3,ActRⅡA protein expressions in HST-T6 cells图4 扶正化瘀方对肝星状细胞中NF-κB p65、smad3、caspase-3、ActRⅡA蛋白表达的影响
Tab.4 Comparison of NF-κB p65,smad3,caspase-3,ActRⅡA protein expression levels of HSC-T6 cells between the four groups表4 各组HSC-T6细胞NF-κB p65、smad3、caspase-3、ActRⅡA蛋白表达水平比较 (±s)

Tab.4 Comparison of NF-κB p65,smad3,caspase-3,ActRⅡA protein expression levels of HSC-T6 cells between the four groups表4 各组HSC-T6细胞NF-κB p65、smad3、caspase-3、ActRⅡA蛋白表达水平比较 (±s)
*P<0.05;a与对照组比较,b与Fzhy-低剂量组比较,c与Fzhy-中剂量组比较,P<0.05。
组别对照组Fzhy-低剂量组Fzhy-中剂量组Fzhy-高剂量组F n3 3 3 3 NF-κB p65 3.08±0.21 2.55±0.17a 2.15±0.12a 2.12±0.21a 18.230*smad3 2.68±0.18 1.92±0.11a 1.89±0.20a 1.79±0.31a 11.540*caspase-3 0.71±0.09 1.50±0.21a 1.28±0.25a 0.67±0.25bc 11.600*ActRⅡA 2.74±0.20 1.98±0.09a 1.80±0.26a 1.65±0.20a 17.930*
3 讨论
HSC-T6 细胞为活化的HSC,人与动物的HSC形态学、生长特点、标记物相似[10]。HSC-T6 在培养过程中表现出活化HSC 的特征,可作为抗肝纤维化药物的细胞模型[8,11]。扶正化瘀方具有活血化瘀、益肾滋阴、养肝解毒的功效,是治疗肝纤维化、肝硬化的临床用药。研究表明,扶正化瘀方的抗肝纤维化作用存在多成分、多效应、多靶点[12]。本研究探讨了扶正化瘀方含药血清对肝星状细胞activinA/smad信号通路活化的影响。
ROS 为分子氧产生的自由基,是氧正常代谢的副产物,氧化应激是细胞内抗氧化能力和ROS 水平之间的失衡[13]。HSC 被ROS 激活后可产生一系列反应,最终导致肝纤维化的发生[14]。ROS 既可以直接促进肝纤维化的发生发展,又可以与炎症反应、细胞自噬、细胞凋亡等病理生理过程相互作用,共同参与肝纤维化的发生发展[15]。高水平的ROS 可触发细胞内的氧化应激,导致线粒体内膜的通透性增加,线粒体膜电位降低,腺苷三磷酸合成受到抑制,进而导致细胞内ROS水平明显增加,反复循环,引发多种级联反应,包括激活细胞凋亡信号通路,引发细胞凋亡[15]。本研究发现扶正化瘀含药血清可促进HSC的氧化应激,升高线粒体膜电位水平降低比例。随着扶正化瘀剂量的增加,HSC的ROS水平增加,氧化应激也越严重,细胞线粒体膜电位降低比例也升高。扶正化瘀含药血清也可以降低HSC 的存活率,抑制其增殖。
caspase 家族在凋亡过程中必不可少,可分为起始者和执行者,caspase 执行者包括caspase-3、caspase-6 和caspase-7,可水解其靶蛋白,诱发细胞凋亡。同时caspase可作用于线粒体,在即将凋亡的细胞中形成一个线粒体-caspase-线粒体的正反馈放大回路,放大凋亡信号[16]。研究表明,抑制肝脏氧化应激及HSC活化、促进HSC凋亡是当前抗肝纤维化治疗的有效策略[17]。本研究发现扶正化瘀含药血清可激活caspase-3 参与的HSC 凋亡通路,但Fzhy-高剂量组与对照组差异无统计学意义。因扶正化瘀方抗纤维化作用存在多成分、多效应、多靶点,因此考虑高剂量的扶正化瘀方可能不是主要通过凋亡通路参与抗肝纤维化,而是激活了细胞内其他信号转导通路,故需要进一步实验探索不同扶正化瘀方剂量对细胞内其他信号转导通路的影响。同时本研究中经含药血清干预后,各组细胞周期和细胞凋亡率差异无统计学意义,考虑可能为给药时间较短,后续可延长细胞给药时间,进一步观察细胞周期与凋亡情况。
activin 是具有广泛生物学活性的细胞因子,与TGF-β 属同一超级家族成员,有多种亚型,其中以activinA与肝脏疾病关系最为密切[18]。activinA主要通过增加HSC 的ECM 基因表达和翻译或刺激HSC增殖、分化起作用[19]。研究表明activinA 可以通过刺激HSC 增殖参与肝纤维化的形成。activinA 可通过与激活素Ⅱ型受体(ActRⅡA 和ActRⅡB)的初始相互作用以及随后激活Ⅰ型受体B(ActRⅠB)来激活典型的smad 信号,参与肝纤维化的形成,因此ActRⅡA 型受体是激活素信号传导调控的关键。smad2、3是受体调节型smads,其能与激活素Ⅰ型受体结合,促进肝纤维化的形成[6,20]。smad7 是TGFβ1/Smad 信号转导通路的抑制因子,具有抗肝纤维化的作用[21]。NF-κB 是介导炎症反应的关键调节因子,可刺激肝巨噬细胞产生各种炎性因子,这些因子可扩大肝脏炎症反应,也可促进HSC活化,进而加速肝纤维化形成[22]。本研究发现,扶正化瘀方能抑制activinA mRNA以及ActRⅡA蛋白的表达,也能抑制smad3、NF-κB蛋白,上调smad7 mRNA的表达,减轻炎症反应,延缓肝纤维化进程,但各含药血清组ActRⅡA、smad3、NF-κB 蛋白的表达差异无统计学意义,考虑含药血清对细胞干预时间较短,可延长实验时间,观察各组含药血清对activinA、ActRⅡA、smad3、smad7、NF-κB 的蛋白及mRNA 表达水平的影响。
综上所述,扶正化瘀方含药血清可通过影响HSC-T6细胞增殖,参与HSC-T6氧化应激以及调节activinA/smad 信号转导通路来实现抗纤维化作用,本研究为扶正化瘀方应用于肝纤维化的治疗提供了参考依据。

