Mtb感染Ⅱ型肺泡上皮细胞来源外泌体通过miR-145对巨噬细胞极化的影响
李建军,吴素方,白丰玺
肺结核(pulmonary tuberculosis,PTB)是一种由结核分枝杆菌(mycobacterium tuberculosis,Mtb)感染引起的慢性呼吸系统传染病[1-2]。肺泡巨噬细胞(alveolar macrophage,AM)是肺内主要的免疫细胞,可对Mtb进行免疫调节和免疫清除[3-4]。AM与肺结构细胞存在密切联系,特别是Ⅱ型肺泡上皮细胞(type Ⅱalveolar epithelial cell,AECⅡ)能够以接触依赖性或非接触依赖性方式调节肺中AM的免疫反应[5];AECⅡ和AM之间的相互作用可调节和(或)塑造AM 的 表 型,以 应 对 损 伤[6]。另 外,外 泌 体(exosomes,Exos)在细胞间信号的传递中起着关键作用。近年来,Exos 中的微小RNA(microRNA,miRNA 或miR)成为研究热点[7]。研究显示,用脂多糖处理AEC 可上调AEC 来源Exos 中miR-92a-3p的表达,进而通过将炎症信号传递给活化的AM 来引发肺内炎症反应[8]。Exos介导的miRNA递送是一种治疗肺部炎症反应的新方法[9]。本研究使用miRNA 测序对正常AECⅡ来源的Exos(AEC-Exos)和Mtb 感染AECⅡ来源的Exos(Mtb-AEC-Exos)中差异表达的miRNAs 进行鉴定,并筛选出与炎症反应有关的miR-145,进一步评估了miR-145 在Mtb-AEC-Exos中的表达及其对AM极化的影响。
1 材料与方法
1.1 主要试剂与仪器 Mtb 毒株H37Rv 购自中国兽药检验所;FITC标记的抗CD86抗体和PE标记的抗CD163抗体均购自美国Becton Dickinson 公司;绿色荧光蛋白(green fluorescent protein,GFP)表达质粒购自南京双领生物科技有限公司;CD63、CD81和热休克蛋白70(HSP70)抗体均购自英国Abcam 公司;EdU 细胞增殖检测试剂盒、DiO(细胞膜绿色荧光探针)、BCA 蛋白浓度测定试剂盒、RIPA 裂解液购自碧云天生物科技公司;TRITC标记鬼笔环肽(粉末)购自北京百奥莱博科技有限公司;miRNA cDNA 合成试剂盒购自美国Thermo 公司;TRIzol 试剂、逆转录试剂盒、SYBR Green PCR Master Mix 和miRNA 荧光定量检测试剂盒均购自日本TaKaRa 公司;白细胞介素(interleukin,IL)-6、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(ELISA)试剂盒购自上海酶联生物科技有限公司。Leica confocal 118 SP5共聚焦显微镜(德国Leica 公司);Hitachi H-600 透射电子显微镜(日本Hitachi 公司);ZetaView 纳米颗粒跟踪分析仪(德国Particle Metrix公司);Coulter Optima TM L-80XP 超速离心机、Cytomics FC500 流式细胞仪(美国贝克曼库尔特有限公司);ABI Prism®7500型荧光定量PCR仪(美国应用生物系统公司);iMark680 多功能酶标仪(美国Bio-Rad公司)。大鼠肺泡巨噬细胞NR8383(CL-0172)和大鼠Ⅱ型肺泡上皮细胞RLE-6TN(CP-R003)购自武汉普诺赛生命科技有限公司。
1.2 实验1 Mtb-AEC-Exos的鉴定
1.2.1 细胞培养 NR8383培养于含有15%胎牛血清的Ham's F-12K培养基中,RLE-6TN在含有10%胎牛血清、100 IU/mL青霉素和100 mg/L 链霉素的DMEM 培养基中,于5%CO2、37 ℃的培养箱中培养。隔天换液,当细胞密度融合至80%左右时进行传代。
1.2.2 Mtb毒株H37Rv培养 所有与Mtb H37Rv菌株相关的实验均在生物安全三级(BSLⅢ)实验室进行。Mtb H37Rv细菌在含有10%Middlebrook ADC 增菌液和0.05%Tween 80 的Middlebrook 7H9培养基中于37 ℃下培养。在对数生长期收取细菌,并以1×108个杆菌/mL 的浓度在DMEM/F-12 培养基中沉淀并重悬。然后将其等分成6 份,并储存在-80 ℃作为工作原液备用。
1.2.3 Mtb感染AECⅡ 为了可视化Mtb感染,将AECⅡ接种在盖玻片上,并以1∶50感染复数(multiplicity of infection,MOI)感染GFP标记的Mtb(Mtb-GFP),命名为Mtb-AECⅡ组,另设AECⅡ组(正常培养不进行感染),并在37 ℃5%CO2培养箱中培养。72 h 后,用磷酸盐缓冲液(PBS)洗涤AECⅡ3 次并用4%多聚甲醛固定20 min,再次用PBS 洗涤AECⅡ3次,用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色,在共聚焦显微镜下观察。此外,在感染72 h后,使用EdU 细胞增殖检测试剂盒在Mtb 感染的AECⅡ中检测细胞增殖水平[10],使用共聚焦显微镜拍摄图像。
1.2.4 Mtb-AEC-Exos 的分离与鉴定 AEC Ⅱ于无血清DMEM 中在Mtb 存在的情况下培养72 h后,收集来自AECⅡ的细胞培养基,并在4 ℃下以300×g离心10 min、2 000×g离心20 min(弃沉淀,除去细胞)和10 000×g离心30 min(弃沉淀,除去亚细胞成分);收集上清液用0.22µm 规格过滤器过滤,在超速离心机中4 ℃100 000×g离心70 min,沉淀Exos;Exos颗粒用无菌PBS洗涤,继续在4 ℃,100 000×g离心70 min;沉淀的Exos在无菌PBS中重悬,并储存在-80 ℃冰箱中,命名为Mtb-AECⅡ组。从正常AECⅡ培养上清液中提取的Exos(AEC-Exo)用作对照,命名为AECⅡ组。随后使用透射电子显微镜(TEM)和纳米粒子追踪分析(NTA)观察Exos形态,检测Exos 的数量和大小;并使用流式细胞术鉴定Exos 表面特征标志物CD63、CD81和HSP70,3个指标同时有表达即表示Exos的存在;使用RIPA裂解液分离Exos中的蛋白质,并使用BCA蛋白质测定试剂盒检测Exos的蛋白质含量。
1.2.5 Exos的miRNA微阵列检测 miRNA微阵列研究Mtb-AEC-Exos 和AEC-Exo 之间差异表达的miRNA。使用miRNeasy Mini Kit 提取和纯化总RNA。Exos miRNA 微阵列杂交、数据生成和归一化由上海生工生物工程技术服务有限公司完成。为了全面分析微阵列数据,筛选出两者中基因变化倍数≥2 的miRNA。在miRNA 微阵列检测后,使用miRNA cDNA 合成试剂盒合成cDNA 样本并采用miRNA 荧光定量PCR(qPCR)检测试剂盒进行检测,使用2-ΔΔCt方法计算归一化为U6后miRNA的相对表达量。
1.2.6 Mtb-AEC-Exos 在巨噬细胞中的作用 为了评估Mtb-AEC-Exos 对AM 活化的影响,用亲脂性染料DiO 标记Exos,用TRITC-鬼笔环肽标记AM 的细胞骨架。AM(1×105个)接种在盖玻片上,分为AECⅡ组和Mtb-AECⅡ组,分别与标记的Exos(AEC-Exos、Mtb-AEC-Exos)共培养24 h后,将用Exos 处理的巨噬细胞在4%多聚甲醛中固定,用0.1%Triton X-100渗透,用3%胎牛血清白蛋白封闭。然后,取200µL现配的TRITC-鬼笔环肽染色工作液,完全覆盖盖玻片上的细胞,室温避光孵育30 min。用DAPI 对细胞核进行染色。抗荧光淬灭剂封片,在共聚焦显微镜下观察。ELISA检测细胞培养上清液中TNF-α、IL-6和IL-10的水平。
1.3 实验2 Mtb-AEC-Exos对AM极化的影响及分子机制
1.3.1 细胞转染 由上海GenePharma 公司合成miR-145 模拟物(mimic)、miR-145 沉默序列(inhibitor)及其相应的阴性对照(mimic-NC和inhibitor-NC)慢病毒载体。为了获得过表达或沉默miR-145的Exos,用过表达或沉默miR-145的慢病毒以20 MOI 转染AECⅡ。实验分为:对照组、mimic-NC 组、miR-145 mimic 组、inhibitor-NC 组、miR-145 inhibitor 组。然后,参照1.2.3 和1.2.4 步骤用Mtb 感染AECⅡ并分离Exos,qPCR 检测转染的Mtb-AECⅡExos 中miR-145mRNA 水平。最后,将NR8383细胞分别与上述各组中的Exos(含终浓度为80 mg/L Exos的培养基)共同孵育24 h,以诱导M1或M2巨噬细胞极化。
1.3.2 流式细胞术检测巨噬细胞M1型标志物(CD86)、M2型标志物(CD163)表达 采用流式细胞术分析CD163 和CD86阳性巨噬细胞的百分比。NR8383细胞重悬于PBS中并调整浓度为1×106个/mL,加入5 µL FITC-CD86 抗体或5 µL PECD163 抗体,在室温下孵育30 min。使用流式细胞仪分析CD86和CD163巨噬细胞的百分比。
1.3.3 qPCR 检测巨噬细胞中miR-145、TNF-α、诱导型一氧化氮合酶(iNOS)、精氨酸酶1(Arg-1)和IL-10的mRNA 水平 使用TRIzol试剂从细胞中分离总RNA,使用逆转录试剂盒将RNA 逆转录为cDNA。在Prism®7500 荧光定量PCR 仪上使用SYBR Green PCR Master Mix 进行qPCR。反应条件:95 ℃30 s;95 ℃5 s,60 ℃30 s,40 个循环。U6用作miR-145的内参,mRNA水平用β-肌动蛋白(β-actin)的mRNA水平进行标准化,并表示为倍数变化。引物序列见表1。基因的相对表达水平用2-ΔΔCt法表示。

Tab.1 The primer sequence of qPCR表1 qPCR的引物序列
1.4 统计学方法 采用GraphPad Prism 8.0软件进行数据分析。符合正态分布计量数据以±s表示。2 组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 实验1
2.1.1 Mtb感染AECⅡ与Exos的鉴定 共聚焦显微镜成像结果显示,Mtb 被AECⅡ吸收,见图1。EdU检测结果显示,与正常培养的AECⅡ相比,Mtb感染不影响AECⅡ的增殖(P>0.05),见表2,图2。Exos分离后,TEM 和NTA 分析结果显示,Mtb-AEC 组和AECⅡ组均分泌直径约为100 nm 的球形囊泡,见图3;Mtb-AECⅡ组Exos 的数量高于AECⅡ组(P<0.01),见表2。流式细胞术结果显示,Exos中CD63、CD81、HSP70 均呈阳性表达,见图4。此外,与AECⅡ组相比,Mtb-AECⅡ组Exos 中蛋白质含量增加(P<0.01),见表2。
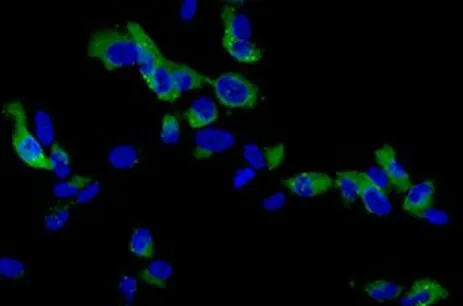
Fig.1 Image showing that Mtb was absorbed by AECⅡ图1 Mtb被AECⅡ吸收
Tab.2 Comparison of AECⅡproliferation activity,Exos quantity and protein content between the two groups表2 2组间AECⅡ增殖活性、Exos数量和蛋白质含量的比较 (n=3,±s)
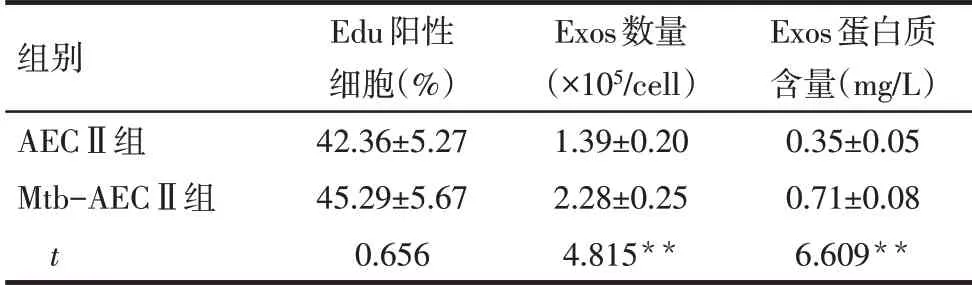
Tab.2 Comparison of AECⅡproliferation activity,Exos quantity and protein content between the two groups表2 2组间AECⅡ增殖活性、Exos数量和蛋白质含量的比较 (n=3,±s)
**P<0.01。
组别AECⅡ组Mtb-AECⅡ组t Edu阳性细胞(%)42.36±5.27 45.29±5.67 0.656 Exos数量(×105/cell)1.39±0.20 2.28±0.25 4.815**Exos蛋白质含量(mg/L)0.35±0.05 0.71±0.08 6.609**
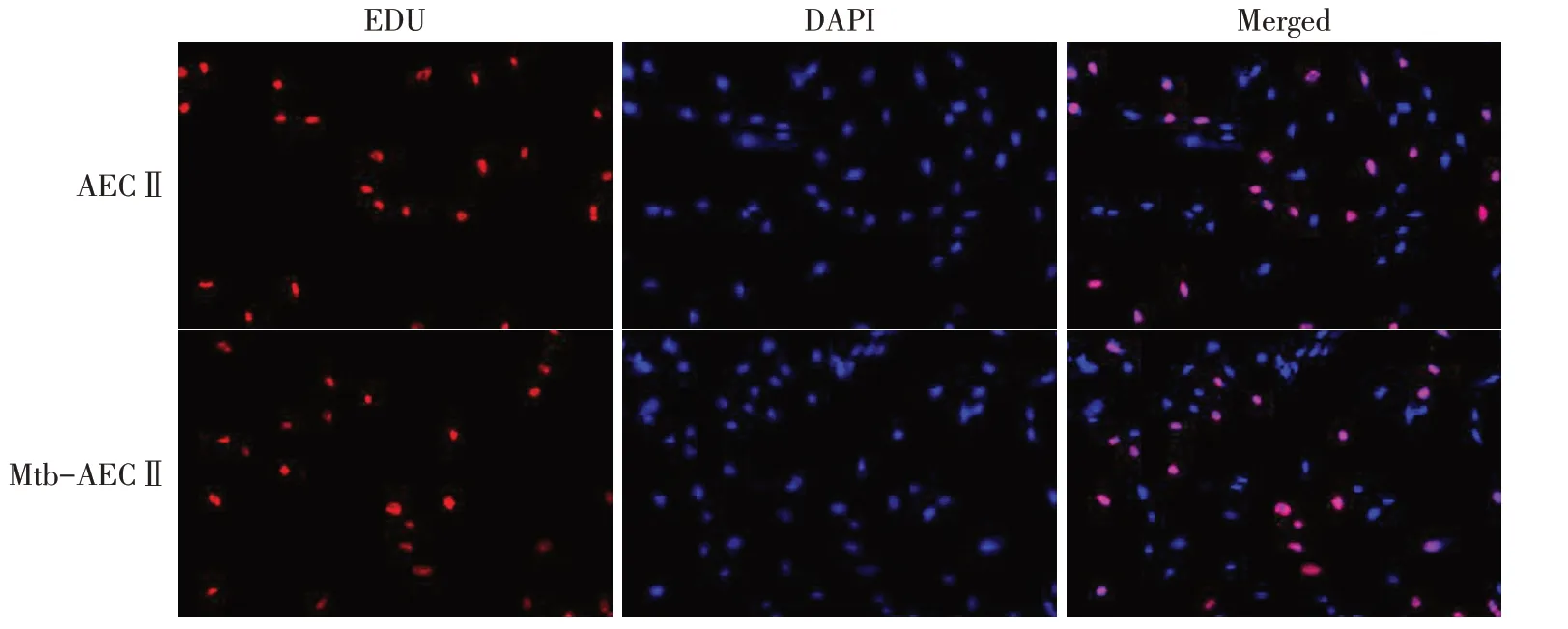
Fig.2 The effect of Mtb infection on the proliferation of AECⅡ图2 Mtb感染对AECⅡ增殖的影响
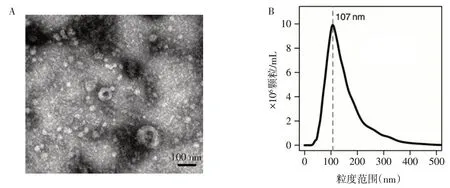
Fig.3 Morphology and particle size distribution of Mtb-infected AECⅡ-derived Exos图3 Mtb感染的AECⅡ来源Exos的形态和粒径分布

Fig.4 Flow cytometry showing positive expression of Exos surface markers CD63,CD81 and HSP70图4 流式细胞术检测示Exos表面标志物CD63、CD81、HSP70阳性表达
2.1.2 Exos 的miRNA 微阵列检测 总共评估了3 604 个Exos miRNA(图5A),并鉴定了一组差异表达的miRNA(倍数变化>2)。前5 个差异表达的Exos miRNA 分 别 为miR-574-5p、miR-145、miR-6124、miR-6165、miR-6760-5p(图5B),通过qPCR验证了4个上调miRNA的表达水平,结果显示miR-145的表达水平增加最多,见图5C。
2.1.3 Mtb-AEC-Exos 促进AM 活化 共聚焦显微镜结果显示,AECⅡ组和Mtb-AECⅡ组中均可见绿色DiO 标记的Exos 被巨噬细胞内化,见图6。与AECⅡ组相比,Mtb-AECⅡ组巨噬细胞培养上清液中IL-10 水平增加,TNF-α 和IL-6 的水平降低(均P<0.01),见表3。
2.2 实验2
2.2.1 转染后各组Mtb-AECⅡExos 中miR-145水平比较 与对照组相比,mimic-NC 组和inhibitor-NC 组Mtb-AECⅡExos 中miR-145水平差异无统计学意义(P>0.05),miR-145 mimic 组miR-145水平升高,miR-145 inhibitor 组miR-145水平降低(P<0.05),见表4。
2.2.2 各组CD86 和CD163 阳性巨噬细胞百分比的比较 与对照组相比,mimic-NC 组和inhibitor-NC组的CD86 阳性和CD163 阳性巨噬细胞百分比差异无统计学意义(P>0.05),miR-145 mimic组CD86阳性巨噬细胞百分比降低,CD163 阳性巨噬细胞百分比升高(P<0.05),miR-145 inhibitor组CD86阳性巨噬细胞百分比升高,CD163 阳性巨噬细胞百分比降低(P<0.05),见表4、图7。
2.2.3 各组巨噬细胞中miR-145、TNF-α、iNOS、Arg-1和IL-10的mRNA 水平比较 与对照组相比,mimic-NC 组 和inhibitor-NC 组miR-145、TNF-α、iNOS、Arg-1和IL-10的mRNA 水平差异无统计学意义(P>0.05),miR-145 mimic组TNF-α、iNOSmRNA表达水平降低,miR-145、Arg-1和IL-10mRNA表达水平升高(P<0.05),miR-145 inhibitor 组TNF-α、iNOSmRNA 表达水平升高,miR-145、Arg-1和IL-10mRNA表达水平降低(P<0.05),见表5。
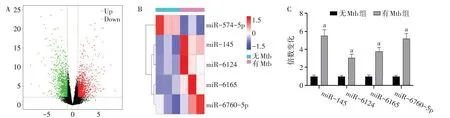
Fig.5 Exos miRNA microarray detection图5 Exos的miRNA微阵列检测

Fig.6 Images showing that Mtb-AEC-Exos were internalized by macrophages图6 Mtb-AEC-Exos被巨噬细胞内化
Tab.3 Comparison of TNF-α,IL-6 and IL-10 levels in macrophages between the two groups表3 2组巨噬细胞培养上清液中TNF-α、IL-6和IL-10水平的比较 (n=3,ng/L,±s)
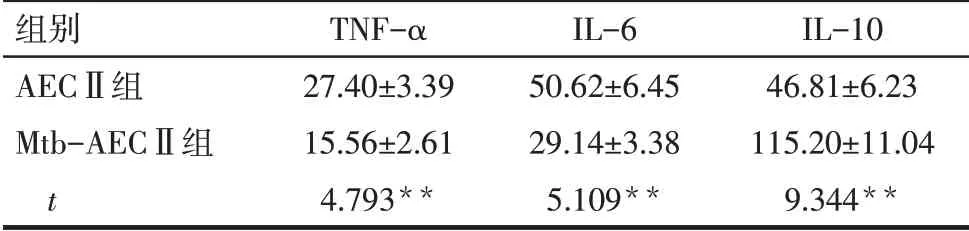
Tab.3 Comparison of TNF-α,IL-6 and IL-10 levels in macrophages between the two groups表3 2组巨噬细胞培养上清液中TNF-α、IL-6和IL-10水平的比较 (n=3,ng/L,±s)
**P<0.01。
组别AECⅡ组Mtb-AECⅡ组t TNF-α 27.40±3.39 15.56±2.61 4.793**IL-6 50.62±6.45 29.14±3.38 5.109**IL-10 46.81±6.23 115.20±11.04 9.344**
Tab.4 Comparison of miR-145 levels and the percentages of CD86-positive and CD163-positive macrophages between the five groups表4 各组miR-145 水平与CD86阳性和CD163阳性巨噬细胞百分比比较 (n=3,±s)
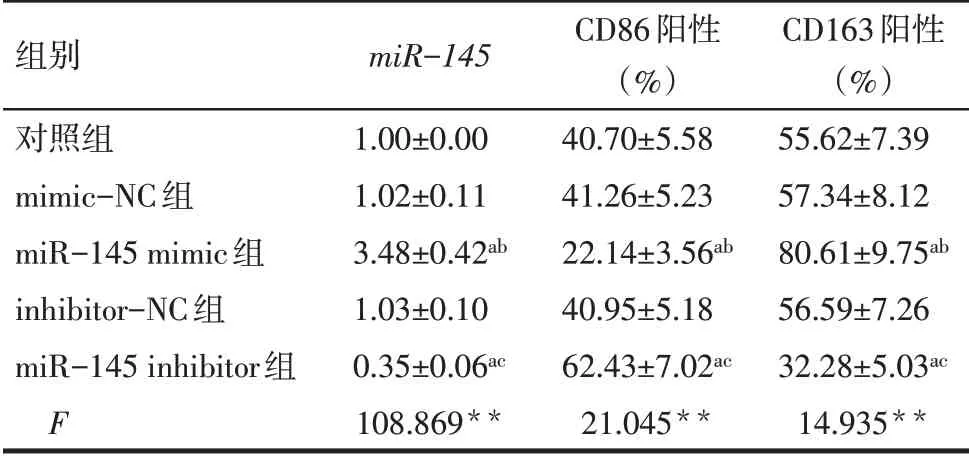
Tab.4 Comparison of miR-145 levels and the percentages of CD86-positive and CD163-positive macrophages between the five groups表4 各组miR-145 水平与CD86阳性和CD163阳性巨噬细胞百分比比较 (n=3,±s)
**P<0.01;a与对照组比较,b与mimic-NC组比较,c与inhibitor-NC组比较,P<0.05。
组别对照组mimic-NC组miR-145 mimic组inhibitor-NC组miR-145 inhibitor组F miR-145 1.00±0.00 1.02±0.11 3.48±0.42ab 1.03±0.10 0.35±0.06ac 108.869**CD86阳性(%)40.70±5.58 41.26±5.23 22.14±3.56ab 40.95±5.18 62.43±7.02ac 21.045**CD163阳性(%)55.62±7.39 57.34±8.12 80.61±9.75ab 56.59±7.26 32.28±5.03ac 14.935**
Tab.5 Comparison of mRNA levels of miR-145,TNF-α,iNOS,Arg-1 and IL-10 between the five groups of macrophages表5 各组巨噬细胞中miR-145、TNF-α、iNOS、Arg-1和IL-10的mRNA水平比较 (n=3,±s)

Tab.5 Comparison of mRNA levels of miR-145,TNF-α,iNOS,Arg-1 and IL-10 between the five groups of macrophages表5 各组巨噬细胞中miR-145、TNF-α、iNOS、Arg-1和IL-10的mRNA水平比较 (n=3,±s)
**P<0.01;a与对照组比较,b与mimic-NC组比较,c与inhibitor-NC组比较,P<0.05。
组别对照组mimic-NC组miR-145 mimic组inhibitor-NC组miR-145 inhibitor组F iNOS 1.00±0.00 1.01±0.13 0.62±0.08ab 1.03±0.10 2.28±0.24ac 66.299**Arg-1 1.00±0.00 1.01±0.10 2.87±0.31ab 1.03±0.12 0.51±0.08ac 98.544**IL-10 1.00±0.00 1.02±0.15 3.25±0.27ab 1.01±0.11 0.46±0.07ac 158.444**组别对照组mimic-NC组miR-145 mimic组inhibitor-NC组miR-145 inhibitor组F miR-145 1.00±0.00 1.01±0.14 2.60±0.25ab 1.04±0.13 0.52±0.10ac 86.639**TNF-α 1.00±0.00 1.03±0.12 0.54±0.09ab 1.02±0.11 3.15±0.20ac 212.628**
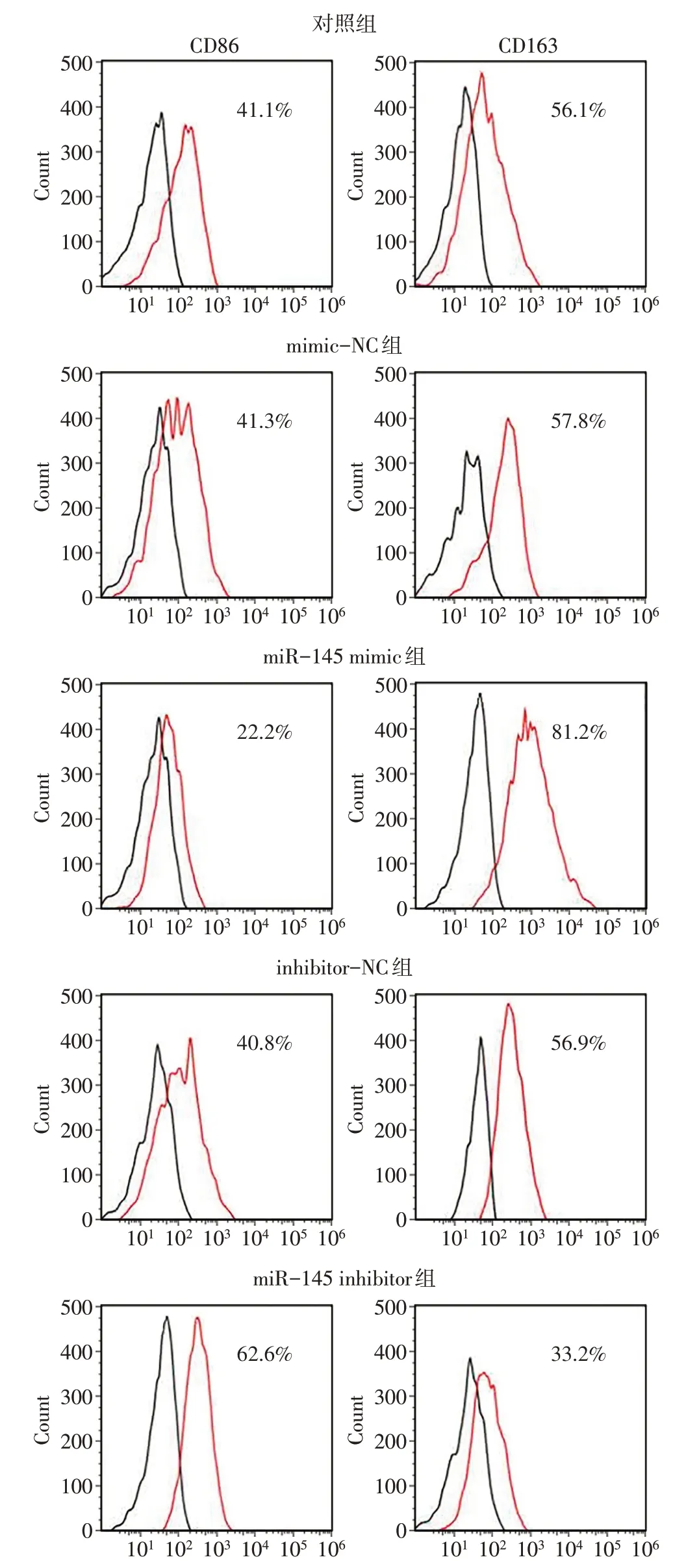
Fig.7 CD86 and CD163 positive expression of macrophages in each group(flow cytometry)图7 各组巨噬细胞CD86阳性和CD163阳性表达(流式细胞术)
3 讨论
Mtb 感染可激活宿主的免疫防御,涉及先天免疫细胞,导致IL-1β 和TNF-α 等各种炎性细胞因子的分泌增加[11]。巨噬细胞是抵抗Mtb感染的第一道屏障,了解Mtb-巨噬细胞相互作用的潜在机制可能为结核病治疗提供新的策略。除了AM,AEC最近也被认为是Mtb 感染的主要目标,其不仅具有上皮屏障功能,还可作为非专业性免疫细胞在感染反应中发挥免疫调节作用[12]。AEC可通过对感染的直接反应或调节专业免疫细胞(如AM)免疫反应的间接作用,在宿主对Mtb 感染的保护反应中发挥重要作用[13-14]。另有研究认为,AM极化参与结核病的发病过程[15-16]。AM 极化具有M1 和M2 两个阶段:M1 型的特征是炎症反应激活,包括但不限于TNF-α类的促炎细胞因子的表达水平升高;M2型的特点是通过增加抗炎细胞因子(如IL-10)的表达来发挥抗炎作用。研究已证实,在外部刺激(包括Mtb)下,AEC可通过分泌细胞因子和介质,调节AM表型或活化[17]。目前,有关源自AEC 的Exos 对AM 极化的影响研究少见。本研究结果显示,与AECⅡ组相比,Mtb感染AECⅡ促进了Exos 的产生,但对AECⅡ的增殖水平没有影响;Mtb-AECⅡ被巨噬细胞吸收后可通过增加IL-10 水平,减少TNF-α 和IL-6 的产生来诱导AM 的抗炎反应;表明Mtb 刺激AEC 来源的Exos 可诱导AM 向M2 极化,但其对AM 极化的调控机制尚不清楚。
Exos 可携带lncRNA、miRNA、mRNA 和其他分子,是不同细胞之间的重要信使,在包括结核病在内的许多疾病的发展中发挥关键作用。研究显示,感染Mtb 会导致Exos 中部分miRNA 表达水平发生显著 变 化[18-19]。然而,目前有关Mtb-AEC-Exos 和Mtb-AEC-Exos miRNA 在AM 极化中的作用尚不明确。研究显示,在结核病患者血清和Mtb 感染后人类巨噬细胞中miR-145 表达水平下调,且其表达水平与炎性细胞因子表达水平呈负相关;Mtb 感染后巨噬细胞中miR-145的过表达可抑制感染诱导的炎症反应[20-21]。本研究结果亦显示,Mtb感染AECⅡ来源的Exos 中,其miR-145的表达水平与正常AECⅡ来源的Exos 相比存在差异,表明Mtb-AEC-Exos 的作用可能是通过miR-145 介导的,提示Mtb-AECExos对AM极化的影响可能与miR-145有关。
为了进一步阐述miR-145 在AM 响应Mtb 感染中的作用,本研究采用慢病毒载体转染AECⅡ以上调或抑制Exos 中miR-145 表达。CD86 和CD163 分别是M1 巨噬细胞和M2 巨噬细胞的标志物,TNF-α和iNOS是M1极化巨噬细胞的代表性指标,Arg-1和IL-10 是M2 极化巨噬细胞的代表性指标。结果显示,上调miR-145 后,Mtb-AECⅡExos 和巨噬细胞中miR-145水平均升高,同时CD163阳性细胞、Arg-1和IL-10的mRNA 表达升高,CD86阳性细胞、iNOS和TNF-α的mRNA 表达降低,而下调miR-145 表现出相反的作用,表明Mtb-AECⅡExos中miR-145的高表达促进了M2 巨噬细胞极化,限制了M1 巨噬细胞极化,提示Mtb 刺激AECⅡ衍生的Exos 可能通过miR-145 促进巨噬细胞M2 极化并抑制M1 极化而实现。
综上所述,Mtb 感染AECⅡ来源Exos 可能通过miR-145刺激巨噬细胞向M2型极化,对抗炎症。本研究表明Mtb感染AECⅡ来源Exos中的miR-145介导了AEC 和巨噬细胞之间的作用,但具体的调控机制仍有待进一步明确。

