体外降胆固醇活性柠檬内生菌的分离筛选及鉴定
冯瑞章,田 婧,韩睿康,陈文凤,刘艳丽,魏 琴,梁寒峭*,张勇波
1宜宾学院生命科学与食品工程学院 香料植物资源开发与利用四川省高校重点实验室,宜宾 644000;2北京城市学院生物医药学部,北京 100083;3宜宾市龙茂柠檬种植有限公司,宜宾 644000
随着科技的发展和人们生活水平的提高,人们对高脂血症和高胆固醇问题的关注日益广泛。据统计,全世界每天因高脂血症引发的心血管疾病死亡人数近4 000人之多,我国每年因高血脂引起的动脉粥样硬化、冠心病、高血压、脑中风等心脑血管疾病所导致的死亡人数以每年12%的速度递增[1]。为了减少由于肥胖导致的诸多并发症的产生,近年来开始有更多研究偏向于通过食疗方式降低血脂从而减少引发的疾病,国外文献研究[2]尝试用乳酸菌结合饮食来调节脂肪代谢异常等问题,同时另有研究得出结论[3],有益乳酸可以直接改善脂肪质量和葡萄糖不耐受的合并健康问题,从而改善肥胖问题。
据多项研究结果表明微生物中的不同种类的益生菌具有降胆固醇和改善肠道菌群的作用[4],例如TMC3115可以改善老年人的肠道微生物和糖脂谱[5]。且证实降脂作用和改善肠道菌群的作用直接或间接与微生物作用有关,其中的降脂活性与微生物的种类有关[6]。例如通过对非酒精性脂肪性肝病患者肠道菌群的研究发现,药物治疗仍然是现在最主要的方法,但是双歧杆菌三联活菌联合其他药物也可以对改善肠道菌群从而降低胆固醇起到良好的效果而且在目前来看,在治疗非酒精性脂肪性肝病(NAFLD)方面的报道较少[7]。
柠檬(Citruslimon(L.)Burm.f.),为双子叶植物纲芸香科柑橘属植物,又叫益母果,来源于东南亚,现四川宜宾为国内主产区之一。柠檬无论作为中药材还是水果食用,口感都较酸涩,通过发酵形式制作成发酵汁后食用较容易被接受。国内对于酵素研究近几年刚刚兴起,并不断出台新政策和法律法规,但是对于中药材直接加工为饮品的方式研究几乎为空白。本实验拟采用微生物技术,将柠檬运用发酵手法进行加工,对其中的益生菌培养分离,并对分离出的菌种进行鉴定以及降脂活性的筛选,以达到优选得到具有降脂功能的益生菌目的。可为后期降胆固醇益生菌的应用进行理论依据的提供[8]。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
新鲜柠檬(采自四川宜宾高县主产区)。
1.1.2 实验仪器与药品
PHS-3C型数显pH计(上海仪电科学仪器股份有限公司);GSP-9080MBE恒温培养箱(上海博迅实业有限公司);台式离心机(EPPENDORFF公司);岛津LC-16高效液相色谱仪(SPD-16紫外可见双波长检测器,岛津公司);PCR扩增仪(赛默飞世尔公司);双目电子显微镜(南京伊若达仪器设备有限公司);KQ5200超声波清洗器(昆山市超声仪器有限公司);AB204-N万分之一电子天平(瑞士梅特勒仪器有限公司);不同规格移液枪(大龙兴创实验仪器有限公司)。牛胆盐、胆固醇(上海源叶生物科技有限公司),琼脂糖等其余实验试剂均为分析纯。
1.1.3 培养基
MRS固体培养基:蛋白胨10 g,牛肉粉8 g,酵母粉4 g,葡萄糖20 g,磷酸氢二钾2 g,柠檬酸氢二铵2 g,乙酸钠5 g,硫酸镁0.2 g,硫酸锰0.04 g,吐温-80 1 mL,琼脂18 g,蒸馏水1 000 mL,pH值调至5.5~5.9之间,高压灭菌(101 kPa,121℃)30 min,备用。
MRS液体培养基:蛋白胨10 g,牛肉粉8 g,酵母粉4 g,葡萄糖20 g,磷酸氢二钾2 g,柠檬酸氢二铵2 g,乙酸钠5 g,硫酸镁0.2 g,硫酸锰0.04 g,吐温-80 1 mL,蒸馏水1 000 mL,pH值调至5.5~5.9之间,高压灭菌(101 kPa,121 ℃)30 min,备用。
高胆固醇MRS-CHOL培养基:选择培养基的配置,参考Liu等[9]的体外试验文献,每100 mL MRS培养液为准,准确称量胆固醇0.1 g至于50 mL小烧杯中,加入0.2 g胆盐、0.1 g蔗糖酯、1 mL吐温-80搅拌均匀,再移取5 mL冰乙酸于小烧杯中,加热溶解。把溶解液用超声波处理15 min后,快速加入到配置好的MRS液体培养基当中,边加入边搅拌,使其形成均匀稳定的胶体溶液。
1.2 内生菌分离培养
柠檬内生菌分离培养方法参照Wu[10]的试验方法进行修改。取四川宜宾鲜柠檬样品,无菌水表面清洗后采用无菌滤纸吸干,再用酒精擦拭柠檬表皮后紫外灯照射30 min,使其表皮无菌。用灭菌刀切开柠檬,用灭菌手动榨汁器榨汁得柠檬汁。吸取柠檬汁,分别采用稀释法、酸碱稀释法[11]处理。
以无菌水梯度稀释柠檬汁时,取一支无菌试管,加入9 mL无菌水。然后吸取1 mL柠檬汁加入到9 mL无菌水当中,充分摇匀。即得1×10-1倍稀释溶液,重复2、3、4次,分别得到浓度为1×10-2、1×10-3、1×10-4g/mL的柠檬汁溶液,各取1 mL进行涂布。
酸碱稀释法处理柠檬汁时,取一个50 mL无菌烧杯,加入适量柠檬汁。用数显pH计进行酸碱度的调节。向柠檬汁中逐滴加入无菌1 mol/L的NaOH溶液,边加边搅拌,调节pH值分别为6、7、8时,各取1 mL进行涂布。
不同方法稀释后的溶液,涂布于MRS固体培养基中。放置于37 ℃恒温培养箱中恒温培养24~48 h。
1.3 内生菌的分离纯化
观察涂布培养菌种的生长情况,选取外形多样、生长良好的菌种,用八区平板划线法将挑选出的菌株划线于MRS培养基上,放置于37 ℃恒温培养箱中培养24 h,后反复划线分离纯化,得到纯化菌株后置于甘油冻存管中低温保存。
1.4 MRS培养液培养
从-80 ℃冰箱取出冻存保藏菌种,室温下解冻。取一支10 mL试管,直接加入5 mL MRS培养液作为空白对照组。另取一只10 mL试管,先加入5 mL MRS培养液,而后将冻存管中的菌种样品,用移液枪移取100 μL加入到培养液当中,37 ℃恒温摇床培养24 h,取出后将试管底部菌种摇匀。
1.5 高胆固醇培养基培养
将高胆固醇MRS-CHOL培养基分装于多个10 mL灭菌离心管当中。取出一支离心管直接加入4 mL高胆固醇培养液并转入1 mL培养24 h后的空白对照MRS培养液,混匀后作为高胆固醇培养液空白对照组,重复三次;其余每个试管当中先加入4 mL高胆固醇培养液,再用移液枪移入步骤“1.4”中培养24 h后的菌液1 mL,在37 ℃恒温摇床消化48 h。
1.6 胆固醇标准曲线的绘制
1.6.1 胆固醇标准溶液配置
胆固醇标准储备液:精密称取标准胆固醇0.100 0 g,用无水乙醇定容于50 mL棕色容量瓶中,浓度为0.002 g/mL。
1.6.2 标准曲线测定
通过参考Zhang[12]的文献,采用高效液相色谱法测定体外降胆固醇的结果较为准确,邻苯二甲醛法和浓硫酸法结果影响因素较大,考虑到本实验测定的降胆固醇活性较高,因此采用高效液相色谱法。用胆固醇标准储备液配成浓度为1、0.2、0.1、0.05、0.025、0.012 5、0.006 25 mg/mL的系列使用液,分别进样100 μL进行色谱测定,以胆固醇浓度x为横坐标,峰面积y为纵坐标,绘制标准曲线。
1.7 菌种对胆固醇降解率筛选
参考Li[13]对胆固醇的测定方法,采用高效液相色谱法分析。将在高胆固醇MRS-CHOL培养液中培养48 h后的菌种取出,放入离心机,以1 500 r/min的转速离心15 min。用1 mL针筒取上清液1 mL,菌液通过0.22 μm有机过滤膜过滤,取上清液续滤液移入上机小瓶待用,用于高效液相色谱分析。
高效液相色谱条件:色谱柱:C18反相色谱柱(4.6 mm×150 mm,5 μm);流动相:100%甲醇(V/V,分析纯);测定波长:205 nm;流速:1.0 mL/min;柱温:38 ℃;进样量100 μL。
得到峰面积结果并记录,选取胆固醇降解率较好的菌种,重复上述进行复筛。胆固醇降解率公式如下。
胆固醇降解率=(Ac-As)/Ac×100%
式中,Ac为高胆固醇MRS-CHOL培养液初始胆固醇的峰面积;As为培养后培养液中剩余胆固醇的峰面积。
1.8 菌种鉴定
1.81 6S rDNA和26S rDNA序列测定
根据Li[14]的文献研究,进行细菌和酵母DNA的提取。内生细菌采用通用引物:27F(5′-AGAGTTTCATCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)对菌株16S rDNA片段进行PCR扩增;内生酵母采用通用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)扩展26S rDNA D1/D2区基因。
1.8.2 系统发育分析
登录NCBI微生物鉴定系统,将基因测序仪得到的菌株序列提交至GenBank获取序列号(OM658523-OM658539),与GenBank数据库中的已知菌株序列进行同源性比对分析。采用MEGA 7软件应用N-J法构建系统发育树,并确定分离菌株的分类地位。
2 结果和分析
2.1 内生菌分离纯化结果
采用无菌水稀释法和酸碱稀释法处理柠檬汁,由此得到浓度为1×10-2、1×10-3、1×10-4g/mL和酸碱度为6、7、8时的柠檬汁溶液,经内生菌的培养及分离纯化之后,根据菌株在MRS培养基生长的情况,选择浓度为1×10-2g/mL、pH为6和7的柠檬汁,培养菌株数量可达在300株以上,根据菌株的生长情况及多样性,从中筛选出122株柠檬内生菌进行后续研究。
2.2 胆固醇标准曲线
通过高效液相法得到胆固醇标准曲线,回归方程为y=4 488 129.619x+2 111.418,R2=0.999 9。
2.3 胆固醇降解率
2.3.1 降解率初筛结果
分离得到的柠檬内生菌菌株在高胆固醇MRS-CHOL培养液中培养48 h后,利用高效液相色谱法测定胆固醇含量,与空白对照组对比计算得到胆固醇降解率,将初筛结果汇总,得到图1、2,胆固醇降解率初筛结果在25%以上的菌株共23株。

图1 1~60号菌种胆固醇降解率初筛结果
2.3.2 降解率复筛结果
对胆固醇降解率初筛结果在25%以上的菌株,重复“2.3.1”实验操作进行高效液相色谱法复筛,重复测定三次胆固醇的峰面积取平均值(见表1)。共筛选获得胆固醇降解率高于25%菌株共17株。

图2 61~122号菌种胆固醇降解率初筛结果

表1 菌种胆固醇降解率复筛结果
2.4 菌种鉴定结果
据BLAST比对结果,取相似度较高的序列构建系统进化树(图3和图4),分析可知28号、38号、39号、76号、79号、92号和94号菌株均与MeyerozymacarpophilaCBS 5256在进化树上处于同一分支,同源性高达99.65%,亲缘关系最近,可鉴定为卡氏假丝酵母(Meyerozymacarpophila);62号、97号、98号、101号和118号菌株与MeyerozymaguilliermondiiCBS 2030在进化树上处于同一分支,同源性高达99.66%,亲缘关系最近,可鉴定为季也蒙毕赤酵母(Meyerozymaguilliermondii);85号和88号菌株与WickerhamomycesanomalusCBS 5759在进化树上处于同一分支,同源性高达99.83%和99.48%;可鉴定为异常威克汉姆酵母(Wickerhamomycesanomalus);89号和90号菌株与PichiamembranifaciensCBS 107在进化树上处于同一分支,同源性高达99.72%可鉴定为膜醭毕赤酵母(Pichiamembranifaciens)。结果表明,菌株119号与AcetobacterghanensisLMG 23848处在同一分支,同源性100%,鉴定为加纳醋杆菌(Acetobacterghanensis)。

图3 柠檬内生菌酵母属系统发育树
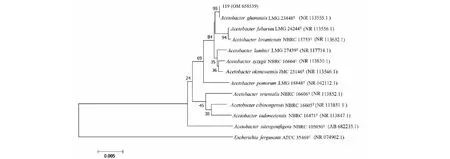
图4 119号菌株系统发育树
3 讨论与结论
本试验以胆固醇为底物,采用高效液相色谱法筛选柠檬内生菌的胆固醇降解率,再结合16S或26S rDNA基因序列鉴定。筛选获得25%以上胆固醇降解率的菌株17株,鉴定结果为酵母属16株和醋酸杆菌1株,分别为卡氏假丝酵母,季也蒙毕赤酵母,异常威克汉姆酵母,膜醭毕赤酵母和加纳醋杆菌。
最早Shaper实验室1963年发现非洲某些部落大量饮用乳杆菌发酵的乳制品后,体内血清胆固醇含量普遍较低[15]。研究发现普通动物粪便中排泄的胆固醇比无菌动物排泄的多,而且当给这两种动物同时喂食高胆固醇食物时,无菌动物血液中的胆固醇含量是普通动物的两倍,这暗示肠道中定居的微生物可能会对肠道中胆固醇的吸收有一定的影响[16-19]。迄今,有大量实验证实不同种类的乳酸菌具有降低胆固醇的效果,其中以嗜酸乳杆菌的材料最为丰富[20]。
本实验筛选出多株酵母菌和醋酸杆菌具有降低胆固醇的效果,为后期降脂发酵食品或药品的开发提供了更多的菌种选择。

