高速逆流色谱分离制备青桑葚中原花青素及其抗氧化活性研究
汪玉玲,蔡为荣,卓允允,王晴晴
安徽工程大学生物与食品工程学院,芜湖 241000
桑葚(mulberry),作为桑科植物桑树的果实[1],营养成分丰富,具有抗癌、抗氧化、镇痛消炎、乌发美容等多种功效[2]。青桑葚,又被称为黄桑葚,是指未成熟的桑葚,作为一种中药材,相对于成熟桑葚青桑葚更易于采摘、运输和贮存,且其成分中原花青素、儿茶素、表儿茶素类物质含量远高于成熟桑葚[3]。国内外已有从葡萄籽、玫瑰花、玉米须、蔓越莓、可可豆等各种植物中提取分离原花青素的研究[4-8],Liu等[9]使用LSA-10树脂对山楂中的原花青素进行富集纯化;Chen等[10]采用膜分离过滤法从葡萄籽中分离低聚原花青素,使低聚原花青素含量达65%,但未得到单体分离组分;Glavnik等[11]使用高效薄层色谱法分析了日本虎杖中的原花青素,从其粗提取物中鉴定出了原花青素的单体到十聚体以及B型原花青素,但该方法很难用于制备;Sun等[12]采用半制备高效液相色谱法从葡萄籽中分离原花青素,但预处理复杂,且分离量低;本文选择高速逆流色谱法(high-speed countercurrent chromatography,HSCCC),其分离量大,可进行批量制备分离,操作简便,分离效率高。
原花青素(procyanidins,PC),作为一种多酚类化合物广泛存在于植物体中,它主要由儿茶素、表儿茶素(epicatechin,EC)、表没食子儿茶素(epigallocatechin,EGC)以及表儿茶素没食子酸酯(epicatechin gallate,ECG)等聚合而成,有较强的抗氧化活性[13,14]。本工作拟利用高速逆流色谱法从青桑葚中分离纯化原花青素类物质,应用高效液相色谱(high performance liquid chromatography,HPLC)鉴定各组分化学成分和分析其纯度;通过考察各组分的DPPH自由基、ABTS+自由基以及羟自由基的清除能力,反映其抗氧化能力强弱。这一工作拓展了桑葚深加工利用的范围,为青桑葚原花青素工业化生产提供方向,对桑葚作为药用资源的开发利用具有一定的参考价值。
1 材料与方法
1.1 主要材料与试剂
青桑葚购自陕西天玺尚品商贸有限公司,40 ℃烘干1 h,至青桑葚含水量低于10%后粉碎,粉碎后过60目筛,低温避光储存备用。
ABTS(批号:20200629,国药集团化学试剂有限公司);DPPH(批号:RY393024,安徽博美生物科技有限公司);表没食子儿茶素(批号:EGC060919,安徽博美生物科技有限公司);表儿茶素(批号:EC060919,安徽博美生物科技有限公司);表儿茶素没食子酸酯(批号:EB20191225,安徽博美生物科技有限公司);儿茶素(批号:21042621,上海同田生物技术有限公司);原花青素A1(批号:21052539,上海同田生物技术有限公司);原花青素B2(批号:21062924,上海同田生物技术有限公司);色谱纯乙腈、甲醇(国药集团化学试剂有限公司);其他试剂均为分析纯。
1.2 主要仪器与设备
HH-4数显恒温水浴锅(金坛大地自动化仪器厂);真空冷冻干燥机(松源华兴科技发展有限公司);Multiskan FC型酶标仪(赛默飞世尔仪器有限公司);TBE-300B高速逆流色谱(上海同田生物技术有限公司);Waters 2998液相色谱仪(美国Waters公司)。
1.3 试验方法
1.3.1 青桑原花青素粗提物制备
称取一定量青桑葚样品粉末置于烧杯中,使用60%乙醇作为提取液,料液比1∶20,在40 ℃水浴条件提取90 min,重复提取三次,抽滤得浸提液,再在45 ℃下减压旋转蒸发至浸膏状态。浸膏用水复溶后依次用石油醚、氯仿萃取,去除其脂类、生物碱等杂质。再用乙酸乙酯萃取,萃取过后将所得乙酸乙酯级分在45 ℃条件下旋蒸除去乙酸乙酯[15],得到浸膏用水复溶,真空冷冻干燥备用。
1.3.2 高速逆流色谱(HSCCC)溶剂系统筛选
适宜溶剂体系的筛选是HSCCC分离中最为复杂和关键工作,依据Ito归纳认为[16],在不知目标组分极性的情况下,根据本文分离物质为乙酸乙酯萃取物,溶剂体系的筛选可以从正己烷-乙酸乙酯-甲醇-水体系开始,调整各组成溶剂的体积比。结合溶剂体系的极性和参考相关文献[17-21]选取了表(1)中各溶剂体系进行HSCCC分离体系筛选。同时利用高效液相法测定各个体系对目标组分的分配系数K,方法如下:根据溶剂体系比例配制溶液,剧烈震荡后静置分层,分别取上下相各2 mL,准确称取5 mg青桑葚粗提物,溶于上下相,摇匀,待两相分配达到平衡后,将两相进行分离,然后过0.45 μm滤膜,用HPLC检测分析,按式(1)和(2)计算目标组分的分配系数K和分离因子(α),通常在HSCCC溶剂系统中,K值范围在0.5~2之间最合适。
(1)
(2)
式中:S上表示目标组分在上相中测得的峰面积;S下表示目标组分在下相中测得的峰面积;Ki和Kj(Ki≥Kj)分别代表不同组分在溶剂体系中的分配系数。
1.3.3 HSCCC分离制备
按照“1.3.2”节筛选的最佳溶剂比例组合作为HSCCC溶剂体系。将配好的溶剂体系静置后分层,上相作为固定性、下相作为流动相,超声脱气30 min。进样前,低温恒温槽设定温度30 °C,先泵入固定相,流速为30 mL/min,待固定相充满管道后,转速为正转850 r/min,当转速恒定后,以2 mL/min流速泵入流动相,待检测器出口端流出一定体积流动相且紫外信号稳定,即体系系统达到平衡,开始进样。准确称取青桑原花青素粗提物200 mg,用15 mL流动相充分溶解,过0.45 μm有机滤膜,进样后打开色谱工作站,检测波长为280 nm,根据高速逆流实验时,设备得到的色谱流出图对出峰组分分步收集,粗提物经高速逆流色谱在500 min内分离得到F1、F2、F3、F4,最后用气泵吹出固定相命名为F5,对收集所得各个组分进行真空冷冻干燥,避光冷藏贮存备用。
1.3.4 HPLC分析检测
分别准确称取一定量经“1.3.3”节HSCCC分离所得组分,用甲醇(色谱纯)配制成质量浓度为1 mg/mL的样品溶液,并配置一定浓度的标准品溶液,过0.45 μm有机滤膜,用于HPLC法对样品定性分析与纯度分析。采用标准品对照法和内标法对样品进行成分鉴定;依据峰面积归一法计算所得组分的纯度,按式(3)计算样品纯度[22]。
(3)
上式中:Wi为待测组分i的峰面积比例/%;fi为校正因子;Ai为待测组分i的峰面积。
色谱条件:Sun Fire®C18柱(150 mm×4.6 mm,5 μm);流动相A:0.1%甲酸-乙腈,流动相B:0.1%甲酸-水;梯度洗脱:0~6 min,15%A;6~10 min,15%→35%A;10~15 min,35%→45%A;15~20 min,15%A;流速1 mL/min;检测波长280 nm,柱温30 ℃;进样量10 μL。
1.3.5 抗氧化能力测定
1.3.5.1 DPPH自由基清除能力测定
参考Li[23]的方法并略作修改。分别准确称取1.0 mg样品(青桑葚高速逆流组分F1、F2、F3、F4、F5)用甲醇将其配制成不同质量浓度(0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80、0.90、1.00 mg/mL)的样品溶液,在96孔酶标板中每孔中先后加入各组分不同浓度样品溶液100 μL和0.5 mg/mL DPPH甲醇溶液100 μL,室温下,暗处反应30 min,517 nm处测定紫外吸光度,记作实验组Ai;加入样品溶液和甲醇溶液各100 μL,记作对照组Aj;加入甲醇100 μL和DPPH甲醇溶液100 μL,记作空白组Ao,每组样品设3组平行组;以同浓度抗坏血酸(Vc)作对比实验。按式(4)算出DPPH自由基的清除率。
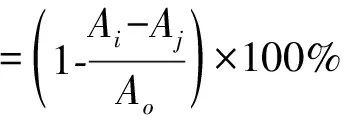
(4)
1.3.5.2 ABTS+自由基清除能力测定
参考Li[24]的方法并略做改动。配置7 mmol/L的ABTS溶液及2.45 mmol/L的过硫化钾溶液,按1∶1的体积比摇匀混合后常温避光放置16~24 h,得到ABTS自由基阳离子储备液。然后,用甲醇稀释约6倍。取ABTS稀释液200 μL与100 μL的不同浓度的样品液混合,室温、避光条件下反应6 min,立即测定其在734 nm处的吸光度,记作实验组Ai;加入样品100 μL和超纯水200 μL,记作对照组Aj;加入超纯水100 μL和ABTS工作液200 μL,记作空白组Ao,每组样品设3组平行组;以同浓度抗坏血酸(Vc)作对比实验;按照公式(5)计算ABTS自由基的清除率。

(5)
1.3.5.3 羟基自由基清除能力测定
采用Fonton反应-水杨酸法测定羟基自由基清除能力。在96孔酶标板中每孔中先后加入试样和9 mmol/L水杨酸-乙醇溶液、9 mmol/L硫酸亚铁溶液及9.79 mmol/L过氧化氢溶液各50 μL[25]。37°C恒温条件下反应30 min,510 nm处测定吸光度值记为实验组Ai。加入样品50 μL和超纯水150 μL,记作对照组Aj;加入超纯水50 μL和上述三种溶剂各50 μL,记作空白组Ao;以同浓度抗坏血酸(Vc)作对比实验;每组样品设3组平行组;按照公式(6)计算羟基自由基的清除率。

(6)
2 结果与分析
2.1 HSCCC溶剂系统的确定
根据青桑葚粗提物的HPLC色谱图(如图2),结合标准品出峰时间(如图1)并选取粗提物中占比较大物质组分作为目标组分,则选择了图2中峰1、2、3和4四个目标化合物色谱峰。

图1 标准品HPLC图
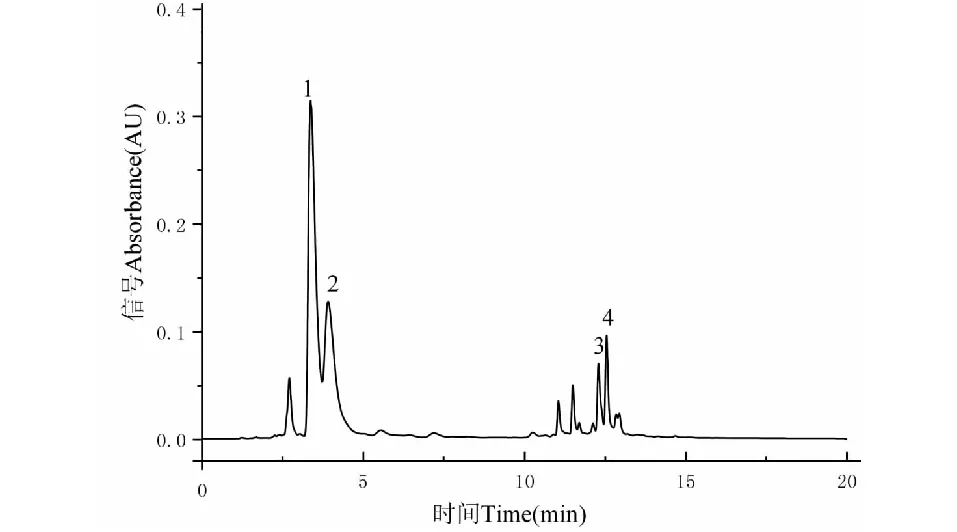
图2 青桑葚粗提物HPLC色谱图
按照“1.3.2”方法测定不同溶剂体系中目标组分1、2、3、4的分配系数K并计算组分1与组分2和组分3与组分4相对的分离因子α,如表1所示。根据所得目标组分在不同溶剂中的分配系数和分离因子α,并比较具体分离效果,可知当溶剂体系对不同组分的分配系数K接近于1,分离因子α接近1.5时,即选取正己烷-乙酸乙酯-水(1∶20∶20,V/V/V)作为分离青桑葚中原花青素的HSCCC溶剂体系有较优分离效果。

表1 不同溶剂体系中四个目标组分的分配系数和分离因子
2.2 HSCCC分离制备结果
经“2.1”溶剂体系筛选优化,优化前后青桑原花青素粗提物HSCCC分离效果如图3,优化前溶剂体系为正己烷∶乙酸乙酯∶甲醇∶水(0.17∶12.5∶1∶12.5,V/V/V/V),固定相保留率为64.28%,100 min左右开始出峰,色谱分离出2个峰,分离效果较差;而经溶剂体系筛选后以正己烷-乙酸乙酯-水(1∶20∶20,V/V/V)作为分离青桑葚原花青素粗提物的HSCCC溶剂体系,体系固定相保留率为64.21%,与优化前相差不大,出峰时间提前约20 min,分离出4个峰,如图3中优化后谱图所示。
如图3中青桑中青桑葚粗提物HSCCC分离效果图所示,根据分离效果计算出从200 mg青桑原花青素粗提物经HSCCC分离所得各组分的质量和得率分别为F1(28.5 mg,14.25%)、F2(10.43 mg,5.22%)、F3(6.85 mg,3.43%)、F4(10.65 mg,5.33%)、F5(13.65 mg,6.83%)。

图3 HSCCC分离青桑中原花青素粗提物溶剂优化前后色谱图
2.3 HPLC检测分析结果
采用HPLC对青桑葚粗提物经HSCCC分离所得的五个组分(F1、F2、F3、F4、F5)进行液相色谱检测分析,其结果如图4分别为HSCCC分离组分F1~F5的液相色谱图。
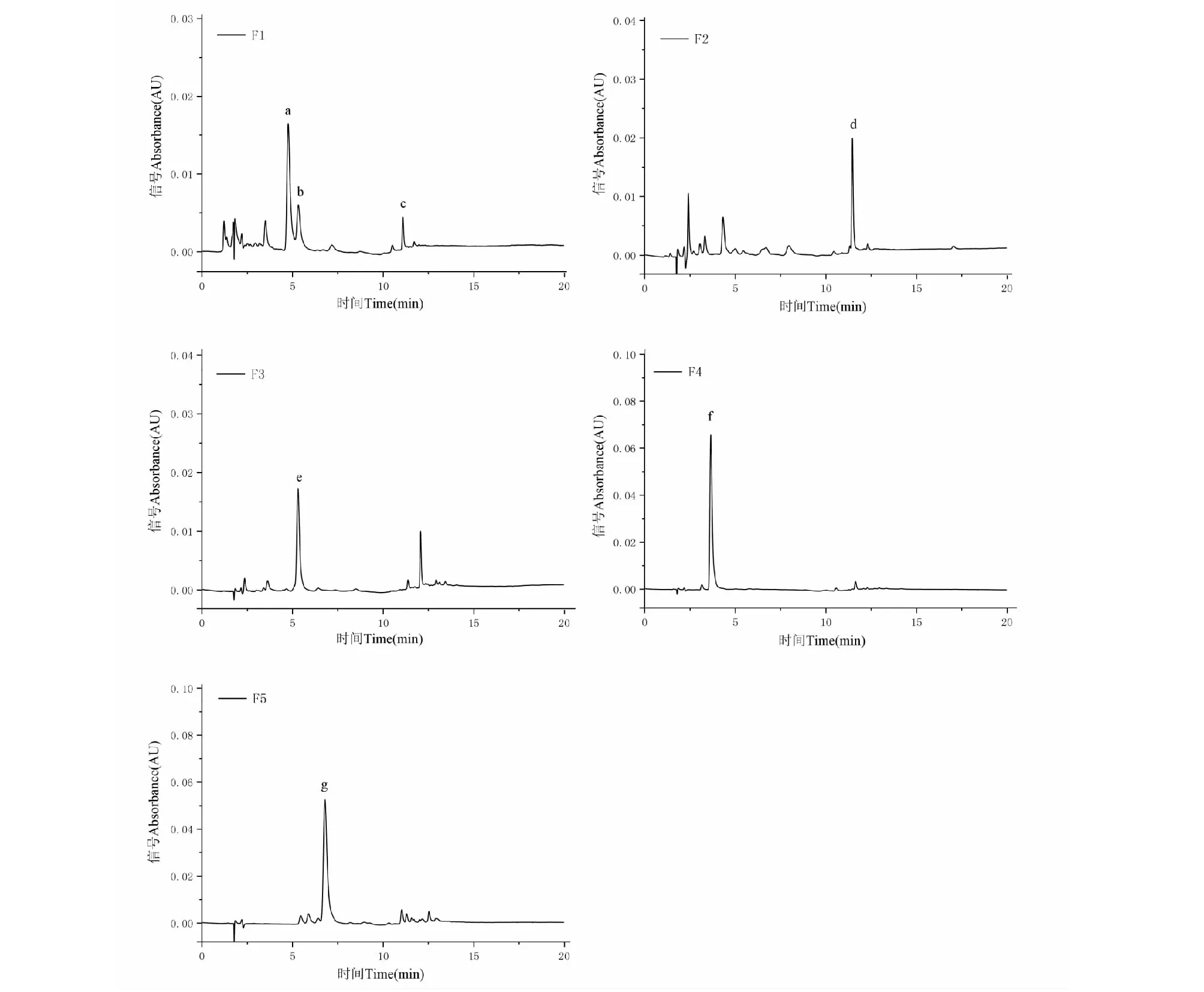
图4 青桑葚粗提物各组分的HPLC色谱图
由图可知,HSCCC分离对青桑原花青素粗提物中相近组分有较好分离效果,如图2中的组分1与组分2,其中组分1在F4中被富集,而组分2主要位于F2。对照表儿茶素、儿茶素、表没食子儿茶素、表儿茶素没食子酸酯、原花青素A1、原花青素B2等标品的HPLC图(见图1),根据保留时间对照标品初步推测定性,采用内标法将标品与样品混合,根据出峰时间和出峰情况推测判断样品中未知峰物质是否为推测的标品物质,再按式(3)计算样品的纯度。
得出F1中峰a、b和c分别为儿茶素(38.54%)、原花青素B2(12.96%)和原花青素A1(9.58%);F2中峰d为ECG(18.54%);F3中峰e为原花青素B2(51.10%);F4中峰f为EGC,纯度达到95.05%;F5中峰g为EC,纯度达到73.75%。相似结构与性质物质的分离是天然产物分离制备的重难点,通过此高速逆流色谱分离,可将原花青素粗提物液相谱图中相近出峰物质分离在不同组分中,为后期的单体分离奠定了基础。
2.4 抗氧化结果分析
2.4.1 DPPH自由基清除能力分析
DPPH是一种较为稳定的含氮自由基,分子结构简单,广泛用于各类天然产物的体外抗氧化活性研究。文中测定的青桑葚粗提物经HSCCC所得五个组分不同质量浓度(0.1~1 mg/mL)对DPPH自由基的清除活性如图5所示,随着不同组分样品浓度的增加,其DPPH自由基的清除能力也逐渐增强,DPPH自由基清除能力各个组分比较:F5>F4>F2>F3>F1>青桑葚粗提物,但差于同浓度Vc,其中F4与F5的DPPH自由基清除率明显优于其他三个组分,且当两者浓度大于0.3 mg/mL时,其DPPH自由基清除率大于80%,可能是由于F4、F5纯度较高的原因。另外F2较F1好,这与Liu等[26]文中儿茶素类物质清除DPPH自由基的能力:ECG>EC>儿茶素相符。

图5 不同浓度样品对DPPH自由基的清除率
2.4.2 ABTS+自由基清除能力分析
ABTS+自由基溶液表现为深蓝色,在734 nm处有最大紫外吸收峰。随着被测物质加入ABTS+自由基溶液后,被测物质中的部分抗氧化成分能与ABTS+自由基发生反应而使蓝色褪去,可根据其在734 nm处吸光度变化测定其清除效果。由图6可以看出经青桑葚粗提物以及经HSCCC分离出的5个组分在0.1~1 mg/mL的浓度范围内,ABTS+自由基清除能力排序为:Vc>F5>F4>F2>F3>F1>青桑粗提物。其中F5和F4对ABTS+自由基的清除率比其他组分要好,在0.3 mg/mL时清除率已大于90%,但是各组分的清除效果都较同浓度Vc差。

图6 不同浓度样品对ABTS+自由基的清除率
2.4.3 羟基自由基清除能力分析
由图7知羟基自由基清除能力排序大致为:F1>F5>Vc>F4>F2>青桑粗提物>F3,F1、F5和Vc在0.1~1 mg/mL不同浓度范围内,随着浓度增大,羟自由基清除率增大,且清除能力F1>F5>Vc>F4;其中F1组分羟自由基清除率远大于Vc,可能是F1组分体系共同作用的结果;F2、F3和青桑葚粗提物在较高浓度时,其清除率呈现负值情况,代表不但不能有效清除羟基自由基,反而能促进它的生成,这可能是由于被测物质混合物体系中含有某种物质可以产生羟基自由基,但其具体机理与原因需要进一步研究。

图7 不同浓度样品对羟基自由基的清除率
3 结论
以青桑葚为原材料,经本实验条件下提取、脱脂除杂、萃取富集获得粗提物,HSCCC分离纯化最佳溶剂体系为正己烷-乙酸乙酯-水(1∶20∶20,V/V/V),200 mg青桑原花青素粗提物经HSCCC分离5个组分得率分别F1(28.5 mg)、F2(10.43 mg)、F3(6.85 mg)、F4(10.65 mg)、F5(13.65 mg),各组分中含有儿茶素、原花青素B2、原花青素A1等物质,其中F4中含表没食子儿茶素,纯度达到95.05%;F5中表儿茶素,纯度达到73.75%。分离所得各个组分都具有一定的抗氧化活性,以Vc作为对照,DPPH自由基清除能力:Vc>F5>F4>F2>F3>F1>青桑葚粗提物;ABTS+自由基清除能力:Vc>F5>F4>F2>F3>F1>青桑葚粗提物;羟基自由基清除能力:F1>F5>Vc>F4>F2>青桑葚粗提物>F3。HSCCC制备量大、色谱柱无填料,本实验中粗提物经1次分离可获得5个组分,且部分组分具有较高纯度的单体物质和较强的抗氧化活性。文章研究内容为原花青素的生产开辟了新思路,也为青桑葚中原花青素类物质的药用功效研究提供一定的理论支持。

