普洱大叶茶中对褪黑素受体具有激动作用的活性化合物
王 豪,王 委,刘艳芳,郭志谋,王超然*
1泰州新药创制服务中心,泰州 225300;2中国科学院大连化学物理研究所,大连 116023
抑郁症、焦虑症和睡眠障碍为常见的中枢神经系统疾病,现代药理学研究认为其发病与褪黑素(melatonin,MT)和5-羟色胺等神经递质的含量降低及受体功能下降有关[1-3]。因而,这些神经递质的受体模型常被应用于抗精神疾病药物的研发,其中,MT1受体激动剂circadin、ramelteon、agomelatine等已在临床上用于抑郁症等中枢神经系统疾病的治疗[1,3]。
茶叶由山茶科山茶属(Camellia)植物的幼嫩叶或芽加工而成,药食同源,使用历史悠久。现代药理学研究表明茶叶具有兴奋中枢神经系统、利尿、抗氧化、抗病毒、降血压等诸多药理活性[4-6],茶多酚类化合物一般被认为是茶叶活性的物质基础[6-8],然而,茶叶抗精神疾病活性的物质基础并不十分明确,茶叶对褪黑素受体功能的影响也鲜有报道。
为了进一步阐明茶叶抗精神疾病活性的物质基础,本研究在前期发现普洱大叶茶(Camelliasinensis)新鲜叶片提取物的乙酸乙酯部分对褪黑素受体具有明显激动作用的基础上,基于褪黑素受体激动活性测试模型,在活性跟踪指导下,综合运用硅胶柱层析和高效液相色谱等分离技术,对上述茶叶活性部位进行跟踪分离,并在HEK293细胞模型上通过钙流检测法测试分离化合物对褪黑素受体的激动作用,以期为茶叶的进一步开发利用和新的抗精神疾病药物的研发提供更多理论依据。
1 材料与方法
1.1 仪器和试剂
SGW®X-4B熔点测定仪(上海精密仪器科技有限公司);1290-6530 LC-QTOF液质联用仪(Agilent公司,美国);Nicolet iS5红外光谱仪(ThermoFisher公司,美国);Avance III-600超导核磁共振仪(Bruker公司,德国);NewstyleTM制备/半制备高效液相色谱仪(汉邦科技有限公司);柱层析用硅胶及GF254薄层层析板(青岛海洋化工厂);显色剂为10%的硫酸乙醇溶液;FlexStation 3台式多功能酶标仪(Molecular Devices,美国);分析纯级阳性对照药褪黑素(CAS:73-31-4,上海晶纯生化科技股份有限公司);实验中所用其它试剂均为分析纯(国药集团化学试剂有限公司)。
1.2 材料
实验用新鲜样品5 kg采自云南省普洱市,由河南农业大学李家美研究员鉴定为普洱大叶茶Camelliasinensis,标本(20190509)存放于江苏省手性医药化学品生物制造重点实验室。
1.3 提取与分离
新鲜普洱大叶茶叶片先用50%乙醇回流提取2次后再用热水回流提取1次,每次4 h,总提取液浓缩后用乙酸乙酯萃取,得到茶叶乙酸乙酯部分浸膏和水部分浸膏。
对MT1和MT2受体均具有激动作用的茶叶乙酸乙酯部分浸膏(80 g)经硅胶柱层析分离,经氯仿-甲醇-水梯度洗脱(100∶0∶0、90∶10∶1、80∶20∶2、70∶30∶3、0∶100∶0)粗分得到组分Fr.1~Fr.5,活性组分Fr.3(20 g)经硅胶柱层析(氯仿∶甲醇=90∶10)分离得到亚组份Fr.3-1~Fr.3-6,活性亚组分Fr.3-1(0.45 g)再经半制备液相色谱(RP C-18,甲醇∶水=10∶90→100∶0)分离得到Fr.3-1-1~Fr.3-1-4,Fr.3-1-1再经反复纯化得到化合物7(150 mg),Fr.3-1-3(60 mg)经凝胶柱层析(LH-20,氯仿∶甲醇=50∶50)纯化得化合物8(14 mg);活性亚组分Fr.3-4(4.6 g)经硅胶柱层析(氯仿∶乙酸乙酯=70∶30)洗脱得到4个次组分Fr.3-4-1~Fr.3-4-4,Fr.3-4-1(450 mg)经硅胶柱层析(氯仿∶丙酮=15∶85)分离得到Fr.3-4-1-1~Fr.3-4-1-3,Fr.3-4-1-1和Fr.3-4-1-2再分别经凝胶柱层析纯化得化合物4(15 mg)和化合物9(6 mg),Fr.3-4-2(1.7 g)经半制备液相色谱(MCI,CHP20P,甲醇∶水=10∶90→100∶0)洗脱得Fr.3-4-2-1~Fr.3-4-2-5,Fr.3-4-2-3(0.95 g)再经硅胶柱层析(氯仿∶乙酸乙酯=80∶20)划分为Fr.3-4-2-3-1~Fr.3-4-2-3-3,Fr.3-4-2-3-2(0.7 g)再经硅胶柱层析纯化得化合物3(520 mg);活性组分Fr.3-5(9.3 g)经半制备液相色谱(MCI,CHP20P,甲醇∶水=10∶90→100∶0)洗脱得Fr.3-5-1~Fr.3-5-6,Fr.3-5-1(1.2 g)经硅胶柱层析(氯仿∶甲醇=90∶10)洗脱得到Fr.3-5-1-1和Fr.3-5-1-2,Fr.3-5-1-1(0.5 g)先后经半制备液相色谱(RP C-18,甲醇∶水=40∶60)和凝胶柱层析(氯仿∶甲醇=50∶50)纯化,得化合物6(280 mg),Fr.3-5-1-2(0.4 g)先后经硅胶柱层析(氯仿∶乙酸乙酯=40∶60)、半制备液相色谱(RP C-18,甲醇∶水=40∶60)和凝胶柱层析(氯仿∶甲醇=50∶50)纯化,得化合物5(50 mg)。
活性组分Fr.4(29 g)经硅胶柱层析(氯仿-甲醇-水(90∶10∶1、80∶20∶2))洗脱得到Fr.4-1~Fr.4-7,Fr.4-5(1.2 g)经半制备液相色谱(MCI,CHP20P,甲醇∶水=10∶90→100∶0)洗脱得到Fr.4-5-1~Fr.4-5-5,其中,活性次组分Fr.4-5-3(0.4 g)再经半制备液相色谱(RP C-18,甲醇∶水=15∶85→75∶25)分离得到Fr.4-5-3-1~Fr.4-5-3-6,Fr.4-5-3-1(0.12 g)再反复经硅胶柱层析和凝胶柱层析纯化,得化合物1(12 mg);Fr.4-5-3-2(0.20 g)经凝胶柱层析纯化得到化合物2(13 mg)。
1.4 对褪黑素受体的激动活性测试
被测样品对褪黑素受体的激动作用在HEK293细胞模型上通过钙流检测法测试[6,9]。取培养在添加10%胎牛血清的杜氏改良培养基中的稳转HEK293细胞,接种于Matrigel®Matrix 预先包被的96孔黑色板(细胞密度为4 × 104/孔),在含5% CO2的温箱中培养24 h后,用HDB免洗Fluo-8钙试剂盒在37 ℃下黑暗中染色1 h,然后分别用被测样品和阳性药物处理,室温下用Flex-Station 3台式多模式微孔板阅读器读取吸收值。以褪黑素作为阳性对照,将阳性对照的激动率设定为100%,供试样品对褪黑素受体的激动率以阳性对照的百分比计算[6]。
2 实验结果
2.1 结构鉴定
化合物1白色粉末,(+)HR-ESI-MS:m/z331.117 3[M+H]+(calcd for C18H19O6,331.117 6);(-)HR-ESI-MS:m/z329.098 7[M-H]-(calcd for C18H17O6,329.099 0);1H NMR(600 MHz,CD3OD)δ:7.01(1H,s,H-6′),6.56(1H,s,H-3′),5.95(1H,d,J=2.0 Hz,H-6),5.93(1H,d,J=2.0 Hz,H-8),4.43(1H,d,J=9.2 Hz,H-2),3.83(1H,ddd,J=10.6,9.2,6.0 Hz,H-3),2.94(1H,dd,J=15.3,6.0 Hz,H-4a),2.43(1H,dd,J=15.3,10.6 Hz,H-4b),1.52(3H,s,H-8′),1.47(3H,s,H-9′);13C NMR(150 MHz,CD3OD)δ:74.5(d,C-2),68.0(d,C-3),28.0(t,C-4),157.8(s,C-5),96.6(d,C-6),156.9(s,C-7),95.9(d,C-8),157.9(s,C-9),101.3(s,C-10),125.4(s,C-1′),135.4(s,C-2′),112.8(d,C-3′),145.1(s,C-4′),146.1(s,C-5′),112.7(d,C-6′),76.9(s,C-7′),32.1(q,C-8′),28.5(q,C-9′)。以上数据与文献[10]报道一致,故被鉴定为(+)-7′,7′-dimethyl-5-hydroxy-2R,3S-trans-pubeschin。
化合物2白色粉末,(+)HR-ESI-MS:m/z347.111 3[M+H]+(calcd for C18H19O7,347.112 5);(-)HR-ESI-MS:m/z345.097 1[M-H]﹣(calcd for C18H17O7,345.098 0);1H NMR(600 MHz,CD3OD)δ:6.39(1H,s,H-6′),5.91(1H,d,J=2.3 Hz,H-6),5.76(1H,d,J=2.3 Hz,H-8),4.39(1H,s,H-2),4.24(1H,d,J=5.0 Hz,H-3),2.86(1H,dd,J=17.4,5.0 Hz,H-4a),2.74(1H,d,J=17.4 Hz,H-4b),1.62(3H,s,H-8′),1.60(3H,s,H-9′);13C NMR(150 MHz,CD3OD)δ:72.6(d,C-2),64.6(d,C-3),26.5(t,C-4),157.5(s,C-5),96.2(d,C-6),156.6(s,C-7),95.7(d,C-8),157.8(s,C-9),99.8(s,C-10),124.8(s,C-1′),122.2(s,C-2′),143.7(s,C-3′),135.1(s,C-4′),145.3(s,C-5′),109.4(d,C-6′),75.5(s,C-7′),28.6(q,C-8′),24.5(q,C-9′)。以上数据与文献[11]报道一致,因而被鉴定为plumbocatechin A。
化合物3白色粉末,(+)HR-ESI-MS:m/z291.086 6[M+H]+(calcd for C15H15O6,291.086 3);(-)HR-ESI-MS:m/z289.068 1[M-H]﹣(calcd for C15H13O6,289.065 9);1H NMR(600 MHz,CD3OD)δ:6.83(1H,d,J=1.8 Hz,H-2′),6.75(1H,d,J=8.4 Hz,H-5′),6.71(1H,dd,J=8.4,1.8 Hz,H-6′),5.92(1H,d,J=2.2 Hz,H-6),5.85(1H,d,J=2.2 Hz,H-8),4.56(1H,d,J=7.5 Hz,H-2),3.97(1H,ddd,J=8.2,7.5,5.6 Hz,H-3),2.84(1H,dd,J=16.4,5.6 Hz,H-4a),2.50(1H,dd,J=16.4,8.2 Hz,H-4b);13C NMR(150 MHz,CD3OD)δ:82.8(d,C-2),68.8(d,C-3),28.5(t,C-4),157.6(s,C-5),96.3(d,C-6),156.9(s,C-7),95.5(d,C-8),157.8(s,C-9),100.8(s,C-10),132.2(s,C-1′),115.2(d,C-2′),146.2(s,C-3′),146.2(s,C-4′),116.1(d,C-5′),120.0(d,C-6′)。以上数据与文献[12]报道一致,故被鉴定为(-)-儿茶素。
化合物4白色粉末,(+)HR-ESI-MS:m/z443.097 0[M+H]+(calcd for C22H19O10,443.097 3);(-)HR-ESI-MS:m/z441.078 9[M-H]﹣(calcd for C22H17O10,441.082 7);1H NMR(600 MHz,CD3OD)δ:6.96(2H,s,H-2′,H-6′),6.83(1H,s,H-5′),6.72(2H,s,H-3″,H-7″),5.96(1H,d,J=2.1 Hz,H-6),5.94(1H,d,J=2.1 Hz,H-8),5.37(1H,ddd,J=6.1,5.9,5.1 Hz,H-3),5.06(1H,d,J=5.9 Hz,H-2),2.81(1H,dd,J=16.5,5.1 Hz,H-4a),2.71(1H,dd,J=16.5,6.1 Hz,H-4b);13C NMR(150 MHz,CD3OD)δ:71.1(d,C-2),79.3(d,C-3),24.3(t,C-4),157.5(s,C-5),96.4(d,C-6),156.4(s,C-7),95.6(d,C-8),158.0(s,C-9),99.6(s,C-10),131.4(s,C-1′),114.4(d,C-2′),146.2(s,C-3′),146.2(s,C-4′),116.2(d,C-5′),119.2(d,C-6′),167.6(s,C-1″),121.3(s,C-2″),110.1(d,C-3″,C-7″),146.3(s,C-4″,C-6″),139.8(s,C-5″)。以上数据与文献[13]报道一致,因而被鉴定为儿茶素-3-氧-没食子酸酯。
化合物5白色粉末,(+)HR-ESI-MS:m/z459.075 6[M+H]+(calcd for C22H19O11,459.072 2);(-)HR-ESI-MS:m/z457.041 6[M-H]﹣(calcd for C22H17O11,457.041 2);1H NMR(600 MHz,CD3OD)δ:6.97(2H,s,H-3″,H-7″),6.40(2H,s,H-2′,H-6′),5.95(2H,s,H-6,H-8),5.37(1H,ddd,J=5.3,5.1,4.7 Hz,H-3),5.05(1H,d,J=5.1 Hz,H-2),2.76(1H,dd,J=16.3,4.7 Hz,H-4a),2.71(1H,dd,J=16.3,5.3 Hz,H-4b);13C NMR(150 MHz,CD3OD)δ:71.0(d,C-2),79.1(d,C-3),23.7(t,C-4),157.6(s,C-5),96.3(d,C-6),156.3(s,C-7),95.5(d,C-8),158.1(s,C-9),99.5(s,C-10),130.9(s,C-1′),106.2(d,C-2′,C-6′),146.9(s,C-3′,C-5′),133.9(s,C-4′),167.7(s,C-1″),121.4(s,C-2″),110.3(d,C-3″,C-7″),146.3(s,C-4″,C-6″),139.8(s,C-5″)。以上数据与文献[4]报道一致,故被鉴定为没食子儿茶素没食子酸酯。
化合物6白色粉末,(+)HR-ESI-MS:m/z481.054 6[M+Na]+(calcd for C22H18O11Na,481.054 1);(-)HR-ESI-MS:m/z457.039 9[M-H]﹣(calcd for C22H17O11,457.041 2);1H NMR(600 MHz,CD3OD)δ:6.94(2H,s,H-3″,H-7″),6.49(2H,s,H-2′,H-6′),5.95(2H,s,H-6,H-8),5.52(1H,brs,H-3),4.96(1H,s,H-2),2.97(1H,dd,J=17.3,4.5 Hz,H-4a),2.83(1H,dd,J=17.3,1.9 Hz,H-4b);13C NMR(150 MHz,CD3OD)δ:69.9(d,C-2),78.6(d,C-3),26.8(t,C-4),157.8(s,C-5),96.5(d,C-6),157.2(s,C-7),95.8(d,C-8),157.8(s,C-9),99.4(s,C-10),130.8(s,C-1′),106.8(d,C-2′,C-6′),146.7(s,C-3′,C-5′),133.8(s,C-4′),167.6(s,C-1″),121.5(s,C-2″),110.2(d,C-3″,C-7″),146.3(s,C-4″,C-6″),139.8(s,C-5″)。以上数据与文献[14]报道一致,因而被鉴定为表没食子酸儿茶素没食子酸酯。
化合物7白色粉末,(+)HR-ESI-MS:m/z291.083 8[M+H]+(calcd for C15H15O6,291.086 3);(-)HR-ESI-MS:m/z289.066 0[M-H]﹣(calcd for C15H13O6,289.065 9);1H NMR(600 MHz,CD3OD)δ:6.97(1H,d,J=1.7 Hz,H-2′),6.79(1H,dd,J=8.2,1.7 Hz,H-6′),6.75(1H,d,J=8.2 Hz,H-5′),5.93(1H,d,J=2.3 Hz,H-6),5.91(1H,d,J=2.3 Hz,H-8),4.80(1H,s,H-2),4.16(1H,s,H-3),2.85(1H,dd,J=16.7,4.6 Hz,H-4a),2.73(1H,dd,J=16.7,2.8 Hz,H-4b);13C NMR(150 MHz,CD3OD)δ:79.8(d,C-2),67.5(d,C-3),29.2(t,C-4),157.6(s,C-5),96.4(d,C-6),157.4(s,C-7),95.9(d,C-8),158.0(s,C-9),100.1(s,C-10),132.3(s,C-1′),115.3(d,C-2′),145.7(s,C-3′),145.9(s,C-4′),115.9(d,C-5′),119.4(d,C-6′)。以上数据与文献[15]报道一致,故被鉴定为(-)-表儿茶素。
化合物8乳白色粉末,(+)HR-ESI-MS:m/z307.079 1[M+H]+(calcd for C15H15O7,307.081 2);(-)HR-ESI-MS:m/z305.059 8[M-H]﹣(calcd for C15H13O7,305.060 8);1H NMR(600 MHz,CD3OD)δ:6.39(2H,d,J=1.8 Hz,H-2′,H-6′),5.91(1H,d,J=2.3 Hz,H-6),5.85(1H,d,J=2.3 Hz,H-8),4.51(1H,d,J=7.2 Hz,H-2),3.95(1H,ddd,J=7.8,7.2,5.3 Hz,H-3),2.80(1H,dd,J=16.2,5.3 Hz,H-4a),2.49(1H,dd,J=16.2,7.8 Hz,H-4b);13C NMR(150 MHz,CD3OD)δ:82.9(d,C-2),68.8(d,C-3),28.1(t,C-4),157.6(s,C-5),96.2(d,C-6),156.9(s,C-7),95.5(d,C-8),157.9(s,C-9),100.7(s,C-10),131.6(s,C-1′),107.2(d,C-2′,6′),146.9(s,C-3′,5′),134.0(s,C-4′)。以上数据与文献[16]报道一致,因而被鉴定为没食子酸儿茶素。
化合物9淡黄色粉末,(+)HR-ESI-MSm/z307.079 1[M+H]+(calcd for C15H15O7,307.081 2);(-)HR-ESI-MSm/z305.059 8[M-H]﹣(calcd for C15H13O7,305.060 8);1H NMR(600 MHz,CD3OD)δ:6.51(2H,d,J=1.8 Hz,H-2′,H-6′),5.93(1H,d,J=2.3 Hz,H-6),5.90(1H,d,J=2.3 Hz,H-8),4.74(1H,s,H-2),4.12(1H,s,H-3),2.84(1H,dd,J=16.6,4.6 Hz,H-4a),2.72(1H,dd,J=16.6,2.9 Hz,H-4b);13C NMR(150 MHz,CD3OD)δ:79.9(d,C-2),67.5(d,C-3),29.2(t,C-4),157.7(s,C-5),96.3(d,C-6),157.3(s,C-7),95.9(d,C-8),158.0(s,C-9),100.1(s,C-10),131.5(s,C-1′),107.0(d,C-2′,6′),146.7(s,C-3′,5′),133.6(s,C-4′)。以上数据与文献[16]报道一致,故被鉴定为表没食子酸儿茶素。
化合物1~9结构见图1。
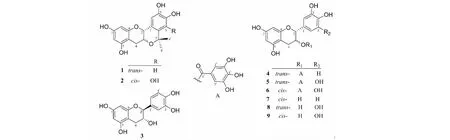
图1 化合物1~9的化学结构
2.2 对褪黑素受体的激动作用
活性跟踪指导下得到的化合物对褪黑素受体的激动作用在HEK293细胞模型上通过钙流检测法进行测试[1,9],测试结果如表1所示,上述9个化合物对褪黑素MT1受体均具有激动作用,同时,化合物1、3、5、7和8对褪黑素MT2受体也具有一定的激动作用。其中,化合物3在0.96 mmol/L浓度时对MT1受体的激动率为362.93%(EC50为46.29 μmol/L),对MT2受体的激动率为136.13%(EC50为102.41 μmol/L);化合物1在0.98 mmol/L浓度时对MT1和MT2受体的激动率分别为301.51%和79.37%;化合物4在0.98 mmol/L浓度时对MT1受体的激动率为174.26%,对MT2受体没有明显激动作用。

表1 茶叶活性组分及化合物1~9对褪黑素受体MT1和 MT2的激动作用
3 讨论与结论
现代药理学研究表明,褪黑素的受体功能和抑郁症、焦虑症等精神疾病的发病与治疗密切相关[1-3];茶叶具有兴奋中枢神经系统的药理活性[4-6],但其活性物质基础并不十分明确。因而,为进一步阐明茶叶抗精神疾病活性的物质基础,本研究采用褪黑素受体MTT法测试模型,在活性跟踪指导下,从普洱大叶茶的活性部位分离得到9个多酚类化合物,通过HR-ESI-MS及NMR分析并与文献数据比对,鉴定了它们的化学结构。化合物1和2为首次从山茶属中发现的黄烷醇类吡喃衍生物,丰富了茶叶的化学信息。
活性测试结果表明,本研究得到的9个化合物对褪黑素MT1受体均具有一定的激动作用,并且对褪黑素MT1受体的激动作用普遍高于相应的对褪黑素MT2受体的激动作用。尤为值得注意的是,化合物(-)-儿茶素(3)含量较高,作为茶叶的大量成分之一,对褪黑素MT1和MT2受体同时具有较高的激动活性,很有可能是茶叶调节MT受体而发挥抗精神疾病活性的主要活性物质,其作用机制值得进一步研究。

