基于网络药理学研究6-姜辣素改善L6成肌细胞糖脂代谢紊乱的作用机制
曾 颜,田珈瑜,詹权操,刘宇哲,李 冬,王 尚*,王建伟*
1重庆医科大学基础医学院;2重庆医科大学中医药学院 中医药防治代谢性疾病重庆市重点实验室,重庆 400016
糖脂代谢紊乱作为代谢性疾病的重要特征,严重危害人类健康。随着高脂肪或高糖饮食的迅速增加,肥胖、糖尿病、高血压、血脂异常、非酒精性脂肪肝[1]、动脉粥样硬化等与糖脂代谢相关的疾病引起了越来越多的关注。胰岛素抵抗(insulin resistance,IR)是糖脂代谢的主要核心病理之一,普遍存在于糖脂代谢异常患者中。骨骼肌是机体能量代谢的重要场所,是机体消耗葡萄糖的主要器官,胰岛素刺激所致的葡萄糖摄取与脂肪酸的消耗约80%是由骨骼肌完成的,因此骨骼肌组织在胰岛素抵抗中占有重要地位,是调节糖脂代谢的关键外周组织[2]。研究显示[3],肌肉线粒体供能障碍、脂肪酸摄入增加及氧化减少,与脂质沉积、IR、2型糖尿病(T2DM)等糖脂代谢紊乱相关疾病关系密切。以游离脂肪酸刺激L6大鼠成肌细胞建立糖脂代谢紊乱模型已经应用于多种降糖降脂潜在药物的评价工作中[4,5]。然而,由于糖脂代谢调控机制复杂,药物治疗作用靶点单一且存在不良反应风险,因此,寻找安全、有效且全面改善糖脂代谢紊乱的药物是临床医师一直致力解决的难题。传统中医药在防治糖脂代谢紊乱方面具有明显的特色和优势,具有多靶点、多通路、联合增效、协同交互等的特点。
中医学认为,糖脂代谢紊乱相关疾病属于消渴、脾痒、痰浊、疲血、症痕、积聚范畴,是一组以脏腑功能失调,津液失于输化导致的综合症。血脂血糖犹如营血津液,为水谷化生的精微物质,生理情况下,脏腑功能健全,水谷精微贯注血脉,温煦肌肤,濡养脏腑百骸。过食肥甘醇酒厚味、久坐久卧损伤脾气,脾不散精,精气不能上归于肺而朝百脉,水谷精华留滞不化,土塞木郁,郁而化热,耗气伤津,清气不升,浊阴不降,聚湿生痰,留而成疲,痰浊、癖因阻遏经络脏腑导致血糖血脂升高,这是糖脂代谢紊乱相关疾病的基本病因病机。生姜为姜科植物姜(ZingiberofficinaleRosc)的根茎。姜为世界上最常用的调味料之一,也是世界传统医学中最常用的草药之一。中医认为,生姜味辛能散,归脾、胃、肺经,能温中散寒,燥湿消痰,在调理脾胃,治疗痰湿的方药中被广泛应用。生姜能够改善脂质代谢,具有较好的降血脂作用,生姜中的6-姜辣素在降血脂方面有较高的生物活性。本课题组前期研究表明,6-姜辣素能明显改善高果糖所致以及衰老相关大鼠脂肪肝、脂质异位沉积、线粒体功能、高甘油三酯血症及胰岛素敏感性[6]。Pournaderi等[7]发现6-姜辣素作为生姜主要的活性成分,在抗炎抗氧化方面有着显著的效果。Algandaby等[8]指出6-姜辣素的抗炎作用可以防治大鼠的肝纤维化。Saravanan等[9]研究指出6-姜辣素通过调控脂质分布,调节胰岛素、瘦素、淀粉酶和脂肪酶的含量从而减轻高脂饮食诱导的肥胖。
虽然已有大量文献报道指出6-姜辣素可改善糖脂代谢紊乱,但其具体作用的靶点和机制尚不明确。随着生物信息学的发展,基于网络药理学探究药物作用靶点已成为新兴的研究热点,本研究通过网络药理学与体外实验相结合的方法,以高果糖高油酸诱导的L6大鼠成肌细胞为研究对象,探讨6-姜辣素治疗糖脂代谢紊乱的作用靶点和机制。
1 材料与方法
1.1 6-姜辣素相关靶点筛选
运用TCMSP[10]数据库和SwissTargetPrediction[11]数据库筛选6-姜辣素作用靶点,6-姜辣素的SMILES格式在PubChem[12]数据库获取,并查找已发表文献对未筛选出的靶点进行补充。合并2个数据库靶点后,删除重复数据,利用Uniprot[13]蛋白标准化数据库对6-姜辣素相关靶点进行统一转化。
1.2 糖脂代谢紊乱相关靶点筛选
以“glycolipid metabolism disorder”为关键词,通过GeneCards[14]数据库筛选目标靶点,以GeneCards数据库relevance score > 0.1选取目标靶点,查找已发表文献对未筛选出的靶点进行补充。
1.3 6-姜辣素-糖脂代谢紊乱靶点的蛋白质-蛋白质相互作用(PPI)网络构建
为明确6-姜辣素药物靶点与糖脂代谢紊乱靶点的相互关系,通过Cytoscape 3.7.1软件分析得到关键蛋白基因,以度(degree)>平均值(约5.84)将所得交集靶点导入STRING数据库,构建蛋白PPI网络图。
1.4 6-姜辣素-糖脂代谢紊乱靶点富集分析
利用R包对靶点分子进行基因本体(GO)、京都基因与基因组百科全书(KEGG)富集,得到核心靶点的分子功能(molecular functions,MF)、生物过程(biological processes,BP)、细胞组分(cellular components,CC)及KEGG信号通路,整理后导入Cytoscape 3.7.1软件进一步可视化分析。
1.5 KEGG Mapper映射
使用KEGG Mapper对富集基因进行基因映射。
1.6 L6细胞体外实验验证
1.6.1 细胞株、试剂及仪器
L6细胞株(中国上海吉凯基因);6-姜辣素(上海源叶生物科技有限公司,货号B21838);油酸、油红、果糖(美国Sigma公司,货号分别为O1008、O0625、F3510);TG检测试剂盒(北京普利莱基因技术有限公司,货号E1013);胎牛血清(美国Gemini公司,批号A58G00J);DMME培养基(美国Gibco公司,批号8121437);胰蛋白酶、青/链霉素、RIPA裂解液、BCA蛋白浓度测定试剂盒(碧云天生物技术公司,货号:C0201、ST488、P0013B、P0010);RNAiso Plus、转录试剂盒、SYBR Premix(中国大连TAKARA公司,货号:9109、RR047A、RR820A);羊抗兔、羊抗鼠、IL-1β抗体(武汉博士德生物工程有限公司,批号:BA1054、BA1050,A00101-1);TNF-α抗体(沈阳万类生物科技有限公司,货号WL01581)、GAPDH抗体(美国Bioworld 公司,货号AP0063)、AKT抗体、p-AKT抗体、p-mTOR抗体、ERK抗体、p-ERK抗体、p-NF-κB-p65抗体、β-actin抗体(美国CST公司,货号:3063S、4060S、5536t、4695S、4370S、3033S、4970S);mTOR、NF-κB-p65、PI3K(美国Abcam公司,货号:ab2732、ab194921、ab191606)。
垂直电泳装置(型号PowerpacTMBasic,美国BIO-RAD公司);Touch RT-PCR仪(型号CFX96,美国BIO-RAD公司);全自动酶标仪(型号Syneyy HTX,基因有限公司);高速冷冻离心机(型号icEN-24R、杭州奥盛仪器有限公司);Odyssey Fc双色红外荧光成像系统(型号Odyssey FC,美国LI-COR公司);正置荧光显微镜(型号U-HGLGPS,日本Olympus公司)。
1.6.2 实验细胞株的培养
L6大鼠成肌细胞加入10%胎牛血清、100 U/mL青霉素及0.1 mg/mL链霉素的DMEM培养基置于37 ℃恒温5% CO2细胞培养箱培养,待生长至70%~80%时,换为含2%马血清的DMEM培养基进行诱导分化。每隔一天换液培养,待其生长至80%长出肌管,说明得到分化成熟的骨骼肌细胞。
1.6.3 油红染色
在24孔板中铺入生长状态良好的大鼠成肌细胞,待密度为70%~80%,换为2%的马血清培养,待其80%长出肌管,对细胞进行饥饿处理12 h后,加入含10%胎牛血清的培养基进行培养作为对照组(control,Con),加入果糖(25 mmol/L)油酸(100 μmol/L)作为模型组(model,M),在其基础上加入6-姜辣素(10 μmol/L)作为给药组(6-gingerol,G),于细胞培养箱孵育;24 h后取出细胞,PBS洗5次,每次5 min;多聚甲醛固定30 min,PBS再洗5次,每次5 min;异丙醇孵育2 min,油红染色17 min,流水冲洗;加入异丙醇分色20 s,流水冲洗;苏木素染色30 s,流水冲洗,甘油封片,镜下观察。
1.6.4 TG测定
将生长状态良好的L6大鼠成肌细胞种植于6孔板,分组情况参照“1.6.3”,按照普利莱TG测定试剂盒操作,做3次实验重复。
1.6.5 IL-1β、TNF-α蛋白水平检测
细胞分组及药物干预按照“1.6.3”,6孔板培养细胞,药物干预24 h,弃去培养基,用PBS清洗两次,加入胰蛋白酶置于细胞培养箱消化30 s,培养基终止消化,800 r/min离心5 min,加入PBS清洗细胞沉淀,重复两次,每孔细胞加入300 μL RIPA裂解液,采用BCA试剂盒检测蛋白浓度。取蛋白样品上样进行SDS-PAGE电泳,转膜后,用含5%脱脂奶粉的TBST封闭2 h,封闭结束后,与对应的一抗稀释液4 ℃孵育过夜。第二天用TBST洗膜4次,每次10 min。加入辣根过氧化物酶标记的二抗(1∶5 000),室温孵育2 h。孵育结束后,用TBST洗膜4次,每次10 min。洗膜完成后,采用ECL化学发光显色法显影,实验结果采用ImageJ软件进行分析。
1.6.6 RT-PCR检测PI3K-AKT通路相关基因表达
收集细胞,按照试剂盒提取总RNA,用NanoDrope 2000检测RNA含量和纯度,逆转录为cDNA,然后按照10 μL反应体系,循环条件:95 ℃,30 s预变性;95 ℃变性5 s,60 ℃退火延伸30 s,共40个循环检测。以β-actin作为内参,数据采用2-ΔΔCt法对目的基因进行相对定量分析。引物序列详见表1。
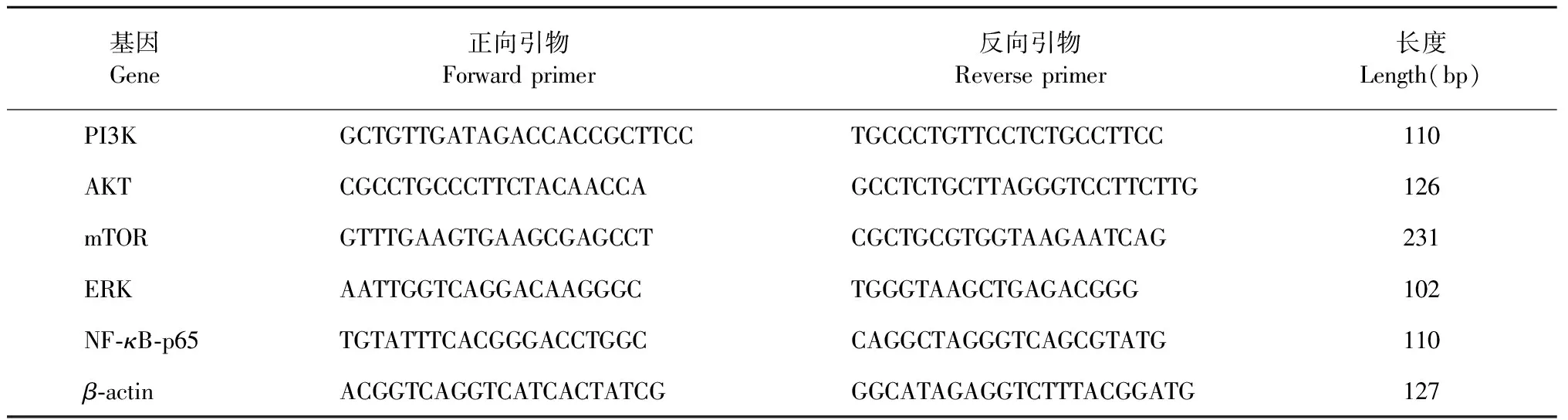
表1 实时荧光定量 PCR 相关基因引物序列
1.6.7 Western blot检测PI3K-AKT通路相关蛋白表达
参照方法“1.6.5”。
1.6.8 统计学分析

2 结果
2.1 6-姜辣素和糖脂代谢紊乱相关靶点的获取
运用TCMSP数据库、SwissTargetPrediction数据库检索6-姜辣素目标靶点,得到117个靶点。通过GeneCards数据库获取糖脂代谢紊乱相关的14 971个作用靶点。
2.2 6-姜辣素-糖脂代谢紊乱靶点PPI网络构建
将6-姜辣素的117个靶点与糖脂代谢紊乱相关的14 971个靶点取交集,绘制Venn图得到113个共同靶点(见图1);将交集靶点提交至STRING数据库,得到6-姜辣素靶点PPI网络(见图2)。并按照其“度”值从高到低排序,取其排名前30名,关键的靶基因有TP53、MAPK3、CASP3、mTOR、PI3K(见图3)。

图1 6-姜辣素靶点与疾病靶点韦恩图

图2 6-姜辣素靶点与糖脂代谢紊乱靶点的PPI网络

图3 6-姜辣素与糖脂代谢紊乱靶点交集
2.3 GO与KEGG富集分析
对PPI网络涉及蛋白质进行GO和KEGG富集分析,结果显示主要参与的生物学过程包括蛋白丝氨酸/苏氨酸激酶活性、蛋白质酪氨酸激酶活性、非跨膜蛋白酪氨酸激酶活性、PI3K活性G蛋白偶联胺受体活性等;参与的主要分子功能包括胰岛素受体底物结合、磷酸酶结合、激素结合、蛋白磷酸酶结合等;参与的通路主要包括PI3K-AKT信号通路、自噬、乙、丙型肝炎、人类巨细胞病毒感染等(见图4)。

图4 6-姜辣素治疗糖脂代谢紊乱靶点的KEGG富集分析
2.4 6-姜辣素治疗糖脂代谢紊乱的靶点在PI3K-AKT信号通路中的映射
为进一步了解药物靶点的相关性,使用KEGG Mapper将有效靶点映射在PI3K-AKT信号通路上,结果表明6-姜辣素靶向PI3K-AKT通路上的15个蛋白,包括PI3K、AKT、mTOR、ERK、NF-κB-p65等(见图5)。

图5 6-姜辣素治疗糖脂代谢紊乱靶点在PI3K-AKT通路中的映射
2.5 TG测定和油红染色结果
与对照组相比,模型组甘油三酯含量显著增加(P<0.01);与模型组相比,给药组甘油三酯含量明显降低(P<0.01),油红染色和甘油三酯变化趋势一致。表明6-姜辣素可以改善高果糖高油酸造成L6细胞的脂质沉积,结果见图6。
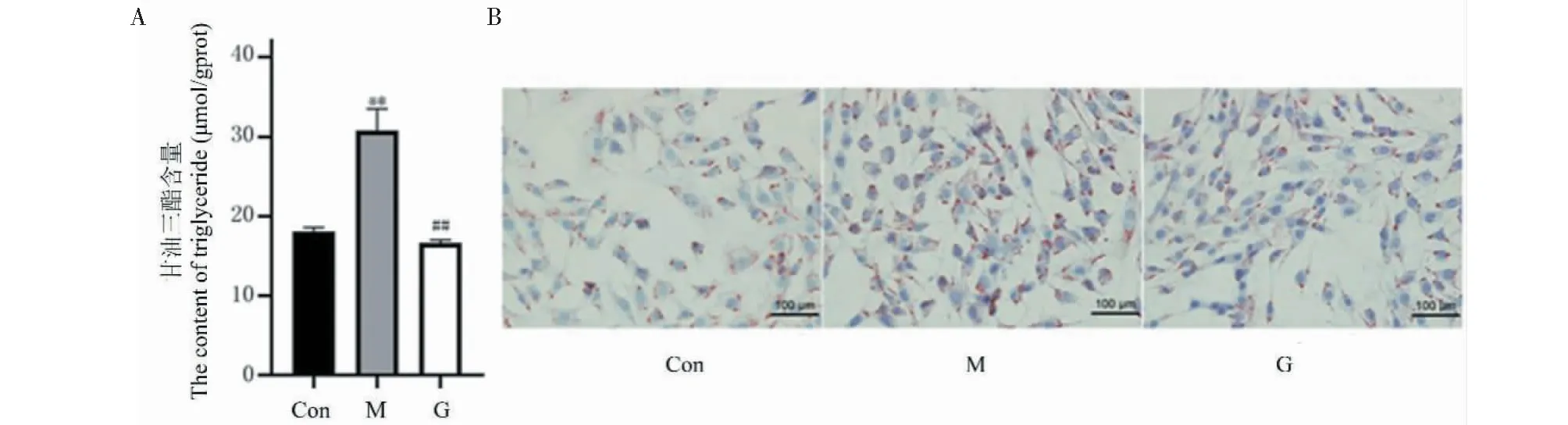
图6 L6细胞的TG含量和油红染色
2.6 大鼠成肌细胞的IL-1β、TNF-α蛋白表达水平
与对照组相比,模型组IL-1β、TNF-α表达显著上调(P<0.05,P<0.01);与模型组相比,给药组IL-1β、TNF-α表达上调(P<0.05,P<0.01)。提示6-姜辣素降低了高果糖高油酸引起的L6细胞的炎症反应(见图7)。

图7 6-姜辣素对IL-1β、TNF-α蛋白的影响
2.7 6-姜辣素对大鼠成肌细胞PI3K-AKT通路相关基因的影响
与对照组相比,AKT的mRNA含量在模型组显著下调(P<0.01);与模型组相比,给药组AKT的mRNA含量上调(P<0.05),其他基因在模型组和给药组间无差异(见图8)。

图8 6-姜辣素对PI3K-AKT通路基因水平的影响
2.8 6-姜辣素对大鼠成肌细胞PI3K-AKT通路相关蛋白表达的影响
与对照组相比,模型组p-AKT表达显著下调(P<0.01);与模型组相比,给药组p-AKT、PI3K表达上调(P<0.05)。与对照组相比,p-mTOR、p-ERK、p-NF-κB-p65表达上调;与模型组相比,给药组p-mTOR、p-ERK、p-NF-κB-p65表达下调(见图9)。

图9 6-姜辣素对PI3K-AKT信号通路相关蛋白表达的影响
3 讨论与结论
糖脂代谢紊乱是由遗传、环境、精神、饮食等多种因素参与的疾病,其机制主要涉及神经-内分泌-免疫紊乱、胰岛素抵抗、氧化应激、炎性反应、肠道菌群失调等,并以高血糖、血脂失调、脂肪肝、超重、高血压、动脉粥样硬化等单一或合并出现为主要临床表现[15]。本研究通过构建6-姜辣素-糖脂代谢紊乱基因调控网络,发现PI3K-AKT信号通路与6-姜辣素靶点密切相关,进一步通过基因映射发现PI3K-AKT通路、mTOR、ERK、NF-κB-p65可能是6-姜辣素发挥作用的重要靶点。
PI3K-AKT信号通路是胰岛素作用下激活的主要信号转导通路,胰岛素激活该通路后,诱导其下游蛋白级联反应,参与糖脂代谢[16]。PI3K激活AKT,AKT磷酸化下游底物,这些底物参与调节多种细胞功能,包括凋亡、代谢和细胞周期进程[17]。当机体处于IR状态时,该信号通路的转导也受到影响,相关功能转导途径减弱或受阻,通路中胰岛素受体底物(IRS)、PI3K、AKT蛋白质磷酸化水平表达下调。PI3K-AKT通路受损与肥胖的发展和糖脂代谢紊乱有关。本研究结果显示,与对照组相比,模型组AKT基因水平和蛋白磷酸化下调;与模型组相比,给药组AKT基因水平、蛋白磷酸化水平上调;PI3K基因在各个组间没明显差异,与模型组相比,给药组PI3K蛋白水平显著上调。这提示6-姜辣素可能通过调节PI3K-AKT通路克服胰岛素信号通路的损伤改善糖脂代谢紊乱。mTOR是一种289 kD丝氨酸/苏氨酸激酶,是PI3K-AKT的下游通路[18],是细胞生长所必需的营养物质和代谢过程之间的重要分子连接。研究表明[19],在高脂环境中,mTOR的磷酸化水平升高,抑制mTOR的磷酸化能够促进自噬信号通路的激活改善胰岛素抵抗,从而改善糖脂代谢紊乱。Yu等[20]证明6-姜辣素抑制p-mTOR的表达。本研究结果显示,与对照组相比,模型组p-mTOR上调;与模型组相比,给药p-mTOR下调,提示6-姜辣素可能抑制mTOR的磷酸化来改善糖脂代谢紊乱。
Nishi等[21]发现长期的脂质代谢失衡会导致外周器官异位脂肪分布(脂毒性),包括肾脏、心脏和骨骼肌,从而加速外周炎症和疾病。研究表明,脂质在骨骼肌的异位沉积能促进炎症的发生[22]。近年来,越来越多的证据表明,慢性低度炎症与糖脂代谢紊乱(如胰岛素抵抗、明显肥胖和2型糖尿病)之间存在潜在联系,这些疾病与炎症因子产生异常有关。炎性细胞因子水平升高可影响胰岛素和脂质信号分子,从而引起糖脂代谢紊乱。Longo等[23]亦发现可通过改善组织中的炎症和胰岛素敏感性改善糖脂代谢紊乱。研究表明[24],炎症细胞因子的基因转录及表达需要活化核转录因子κB(NF-κB),其中NF-κB的活化与丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)有关。NF-κB是与氧化应激相关的真核细胞转录因子,p65是涉及NF-κB激活的一个重要亚基[25]。激活的NF-κB进入细胞核并诱导许多基因的表达,这些基因涉及先天性和适应性免疫调节、细胞粘附、炎症反应和抗细胞凋亡机制[26]。MAPK通路在炎症反应中扮演着重要角色,其中包括p38 MAPK、ERK介导的级联反应,该信号通路的激活与NF-κB通路激活引起的TNF-α等炎性因子的释放增多有关,从而加剧炎症反应[27]。目前多个体内体外试验均表明生姜的有效成分通过抑制NF-κB、MAPK磷酸化发挥强大的抗炎作用[28],NF-κB能够介导调节多种炎症介质,包括TNF-α、IL-1β、IL-6、IL-8等。研究亦证明从食用生姜中提取的6-姜辣素具有抗炎作用[29]。本研究发现,与对照组相比,模型组中IL-1β、TNF-α、p-ERK、p-NF-κB-p65蛋白水平上调;给药后逆转了这一情况,表明6-姜辣素可能通过调控ERK、NF-κB-p65的翻译后水平,阻断促炎因子IL-1β、TNF-α,降低炎症反应改善糖脂代谢紊乱。
综上所述,6-姜辣素能够抑制ERK、NF-κB-p65蛋白的磷酸化从而降低炎症反应并通过调控PI3K/AKT/mTOR轴改善胰岛素抵抗。本研究阐明了6-姜辣素治疗糖脂代谢紊乱的潜在作用靶点,为6-姜辣素的临床应用提供了理论基础。

