基于指纹图谱及体外抗氧化活性试验的灯盏花标准汤剂的质量评价
李艳荣,杜义龙,赵胜男,王子怡,周维维,3,潘海峰*
1承德医学院中药研究所;2河北省中药研究与开发重点实验室;3承德市食品药品检验检测中心,承德 067000
灯盏花又名灯盏细辛,为菊科植物短葶飞蓬Erigeronbreviscapus(Vant.)Hand.-Mazz.的干燥全草,春秋两季采收,收载于2020年版《中国药典》一部,具有活血通络止痛,祛风散寒之功效[1]。现代药理研究表明,灯盏花具有神经保护、心脑血管保护、抗氧化、抗癌、等药理作用[2]。癌症、心脑血管等疾病与机体内过多的活性氧如超氧阴离子自由基、羟基自由基和脂质自由基等导致的氧化损伤密切相关[3]。适当服用抗氧化剂可以清除体内过多的自由基,有利于人类的身体健康和疾病的预防控制[4,5]。文献[6,7]表明灯盏花有很好的抗氧化活性。灯盏花化学成分复杂,化学成分与活性量效关系尚不十分清楚。中药化学指纹图谱因其能够表征中药所含的物质成分,符合中医药理论的整体性和模糊性,已广泛用于中药质量评价[8]。但因其仅反映中药的化学信息,未能与中药疗效间建立关系而使应用越来越受到限制。2020年国家药监局药审中心发布了《中药生物效应检测研究技术指导(试行)》,倡导建立与活性相关的质量控制方法以保证中药在临床应用中的安全性和有效性。中药“谱效关系”研究能使中药活性成分整体特征表达与多指标、多靶点的作用紧密联系,可合理确定药效物质基础[9],也符合中药的作用特点。
中药标准汤剂是经标准化工艺制备而成的单味中药饮片水煎剂,用于标化临床用药,保障用药的准确性和计量的一致性[10],作为衡量中药配方颗粒是否与临床汤剂基本一致的标准参照物。标准汤剂的提出,为实现基于中药水煎液的剂型的质量一致性、建立有效的质量评价方法提供了物质基准。本文以灯盏花标准汤剂为研究对象,以体外清除DPPH和ABTS自由基活性实验验证其抗氧化作用,同时建立其HPLC指纹图谱并测定总黄酮含量;采用双变量相关性分析筛选出显著相关的抗氧化成分,对筛选的成分进行聚类分析(CA)和主成分分析(PCA),进一步利用正交偏最小二乘-判别分析(OPLS-DA)找出差异成分;对其抗氧化作用进行质量评价,以其为灯盏花及其制剂的质量控制提供依据。
1 仪器与材料
1.1 仪器
Agilent 1200型高效液相色谱仪(在线脱气机、四元泵、自动进样器和DAD检测器,美国安捷伦公司);AG245电子分析天平(十万分之一,梅特勒-托利多);电子分析天平(千分之一,JA5003,天津天马衡基仪器有限公司)HC-2062高速离心机(科大创新股份有限公司);紫外-可见分光光度计(岛津UV-2600 probe);上海亚荣旋转蒸发仪(RE-52AA);Thermo Fisher Scientific酶标仪(美国)。
1.2 试药
DPPH(批号:464RB-GE,上海化成工业发展有限公司);ABTS(批号:M0403A,泽浩公司);阳性对照维生素C(Vc,批号:J1024A,泽浩公司);过硫酸钾(K2S2O8,天津欧博凯化工有限公司);对照品咖啡酸(批号:110885-200102)购自中国食品药品检定院,绿原酸(批号161217)、洋蓟素(批号17041106)、异绿原酸A(批号17061201)、灯盏花乙素(批号18032206)、异绿原酸B(批号17121201)、灯盏花甲素(批号18032802)、异绿原酸C(批号170824)均购自成都普菲德生物技术有限公司,以上对照品均供含量测定用。乙腈、甲酸为色谱纯,其他试剂为分析纯,水为娃哈哈纯净水。
收集灯盏花药材共16批,详见表1。由河北民族师范学院董建新教授鉴定均为菊科植物短亭飞蓬Erigeronbreviscapus(Vant.)Hand.-Mazz.的干燥全草。
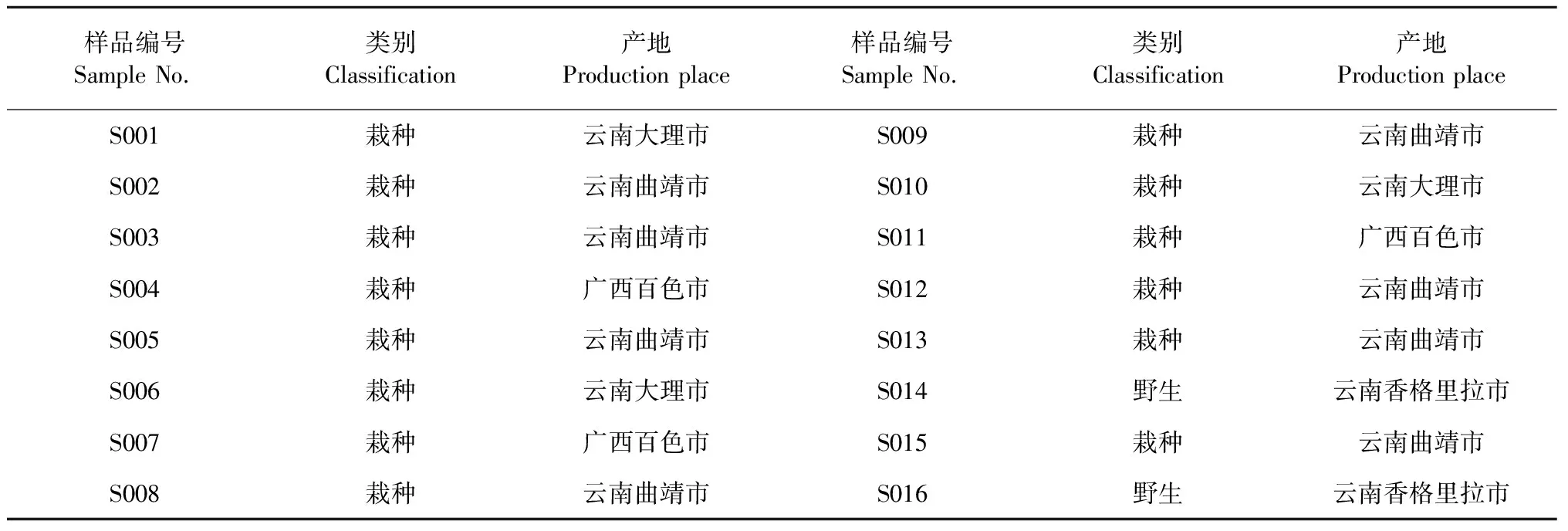
表1 16批灯盏花药材产地信息
2 方法与结果
2.1 灯盏花标准汤剂的制备[10]
取灯盏花药材100 g,加12倍蒸馏水浸泡30 min,一煎煮武火沸后文火煎煮30 min,趁热过滤,二煎加10倍蒸馏水武火煮沸后文火煎煮20 min,趁热过滤,合并两次滤液,60 ℃水浴浓缩至500 mL,制得生药浓度为0.2 g/mL的灯盏花标准汤剂。
2.2 灯盏花标准汤剂体外抗氧化活性的测定
2.2.1 阳性对照维生素C溶液的制备
取维生素C约50 mg,精密称定,置10 mL量瓶,用蒸馏水溶解并定容,作为储备液。取上述储备液适量用蒸馏水稀释成系列浓度的待测液,备用。
2.2.2 DPPH溶液的制备
精密称定DPPH约12 mg置100 mL量瓶,用70%乙醇溶解并定容,备用。
2.2.3 ABTS溶液的制备
精密称定ABTS 40 mg和K2S2O818 mg分别置10 mL量瓶,用蒸馏水制得ABTS和K2S2O8初始溶液。分别精密吸取2.5 mL的ABTS和K2S2O8初始溶液置100 mL容量,蒸馏水定容得ABTS溶液,避光12~16 h备用。
2.2.4 供试品溶液的制备
按“2.1”项下方法制备16批灯盏花标准汤剂,过滤取续滤液作为供试品溶液。
2.2.5 清除DPPH自由基能力的测定

取“2.2.4”项下供试品溶液,用蒸馏水制成系列浓度的溶液作为待测液。以维生素C为阳性对照,分别精密吸取50 μL的阳性对照和各批标准汤剂的待测液于96孔板,取系列各孔ABTS溶液加入量为100 μL,避光反应6 min,734 nm处吸光度,其他及计算方法同“2.2.5”项下。计算对照维生素C和各待测液的ABTS清除率。
2.2.7 数据处理
计算半清除率IC50时,各提取液对自由基的清除率与浓度不呈线性关系,故本实验利用SPSS 19.0软件中Probit方法进行回归分析,拟合得相应的方程Probit(p)= Intercept + Bx,再通过卡方检验后得到IC50值(Probit=0.50时提取液的浓度)。
2.3 灯盏花标准汤剂中总黄酮的含量测定
2.3.1 芦丁对照品溶液的制备
取芦丁对照品约10 mg,精密称定用适量乙醇溶解,加蒸馏水稀释并定容,得浓度为0.2 mg/mL的对照品溶液。
2.3.2 供试品溶液的制备
分别取“2.2.4”项16批灯盏花标准汤剂200 μL,加入蒸馏水1 800 μL,摇匀即得供试品溶液。
我们使用了定焦镜头配合大光圈(f/1.8和f/2.8),确保前景或背景是模糊的。要想让二者在构图中同时发挥作用,可以采用一反常规的做法,不把焦点对准人物让背景模糊,而是对准背景让人物模糊。
2.3.3 检测波长的选择
取显色后的芦丁对照品溶液和供试品溶液(S001)使用紫外-可见分光光度计于400~650 nm波长进行扫描,光谱图见图1,结果显示对照品溶液和供试品溶液显色后在505 nm均有最大吸收,故选择检测波长为505 nm。

图1 对照品芦丁和灯盏花标准汤剂显色后的光谱图
2.3.4 线性关系考察
参照2020年版《中国药典》一部中总黄酮的含量测定方法(亚硝酸钠-硝酸铝-氢氧化钠比色法)显色[11]。精密量取芦丁对照品溶液0、1、2、3、4、5、6 mL分别置25 mL量瓶(记作1~7号瓶),各加水至6 mL,加5%NaNO2溶液1 mL摇匀,放置6 min;加10% Al(NO3)3溶液1 mL摇匀,放置6 min;加NaOH试液10 mL,加水至刻度摇匀,放置15 min。以1号瓶为空白,测定505 nm下各吸光度A为纵坐标(Y),浓度(C,mg/mL)为横坐标绘制标准曲线,回归方程为:Y=12.8X-0.002 9,r=0.999 4,线性范围为0.007 85~0.047 09 mg/mL。
2.3.5 精密度试验
精密量取芦丁对照品溶液3 mL置25 mL量瓶,按“2.3.4”项下的方法,自“加水至6 mL”起依法显色并测定吸光度,连续测定6次,记录吸光度A,计算吸光度的RSD为0.59%,表明仪器精密度良好。
2.3.6 重复性试验
精密吸取“2.2.4”项下灯盏花标准汤剂(S001),按“2.3.2”项下方法制备供试品溶液,平行制备6份,精密量取1 mL供试品溶液置25 mL量瓶,按“2.3.4”项下的方法,显色并测定吸光度,按标准曲线法计算样品中总黄酮的含量,总黄酮含量的RSD为1.14%,表明方法重复性良好。
2.3.7 稳定性试验
精密吸取“2.3.4”项下灯盏花标准汤剂(S001),按“2.3.2”项下方法制备供试品溶液,精密量取1 mL供试品溶液置25 mL量瓶,按“2.3.2”项下的方法显色,分别于显色后0、5、10、15、25、30 min测定吸光度,计算吸光度的RSD为1.97%,表明供试品溶液显色30 min内稳定性良好。
2.3.8 加样回收率试验
取已知总黄酮含量的灯盏花标准汤剂(S001)100 μL,加入芦丁对照品适量,按“2.3.2”项下方法制备供试品溶液,平行制备6份,分别精密量取1 mL供试品溶液置25 mL量瓶,按“2.3.2”项下的方法显色并测定吸光度并计算加样回收率。结果见表2。

表2 芦丁的加样回收率结果
2.3.9 灯盏花标准汤剂总黄酮的测定
取“2.3.2”项下各批供试品溶液1 mL按“2.3.4”项下方法显色,测定其吸光度,带入“2.3.4”项下回归方程,计算各批标准汤剂总黄酮的含量。结果16批样品总黄酮的含量分别为:8.30、7.77、6.79、5.35、8.53、8.59、5.35、5.70、7.52、11.3、2.85、7.36、7.93、8.02、7.48、9.62 mg/mL。
2.4 总黄酮含量与抗氧化之间的双变量相关性分析
采用SPSS 19.0中的Person双变量相关性分析计算16批样品抗氧化活性(IC50,mg/mL)与总黄酮含量(mg/mL)的相关系数,结果DPPH IC50和ABTS IC50与总黄酮的相关系数分别为-0.718和-0.841,表明灯盏花标准汤剂总黄酮的含量和抗氧化活性(IC50)之间在0.01水平(双侧)显著相关(P<0.01),且为负相关。结果表明灯盏花标准汤剂对DPPH和ABTS自由基有一定的清除能力,且清除ABTS自由基的能力更强;总黄酮含量高的样品抗氧化能力强。
2.5 灯盏花标准汤剂指纹图谱的建立
2.5.1 供试品溶液的制备
精密吸取“2.2.4”项下各灯盏花标准汤剂1 mL置10 mL量瓶用蒸馏水定容;精密吸取上述溶液1 mL置离心管,精密加入1 mL 20%的乙腈混匀,12 000 r/min离心10 min,上清液过0.45 μm微孔滤膜作为供试品溶液。
2.5.2 对照品溶液的制备
分别取各对照品适量,精密称定,用甲醇溶解分别制成含绿原酸、咖啡酸、洋蓟素、灯盏花乙素、异绿原酸B、灯盏花甲素、异绿原酸A和异绿原酸C分别为877、204、713、1053、683、645、627、913 μg/mL的贮备液。分别精密吸取各储备液分别制成含绿原酸、咖啡酸、洋蓟素、灯盏花乙素、异绿原酸B、灯盏花甲素、异绿原酸A和异绿原酸C分别为21.93、3.40、3.56、78.98、6.83、6.45、15.68、22.83 μg/mL的混合对照品溶液。
2.5.3 色谱条件
Agilent ZORBAX Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm);以乙腈为流动相A,以0.1%甲酸水为流动相B,按表3中的规定进行梯度洗脱;检测波长为:(0~9 min,252 nm;9~60 min,330 nm);流速为0.8 mL/min;柱温为30 ℃;进样量为10 μL。

表3 流动相的梯度洗脱程序
2.5.4 方法学考察
精密度试验:取S001号标准汤剂按“2.5.1”项下方法制备供试品溶液,采用“2.2”项下色谱方法连续进样6针。以绿原酸为参比峰,各共有峰相对保留时间和相对峰面积的RSD均小于1.6%,方法精密度良好。
重复性试验:取S001号标准汤剂按“2.5.1”项下方法平行制备6份,按“2.4”项下色谱方法进样。以绿原酸为参比峰,各共有峰相对保留时间和相对峰面积的RSD均小于1.8%,方法重复性良好。
稳定性试验:取S001号标准汤剂按照“2.5.1”项下方法制备供试品溶液,分别于0、2、4、8、12、24 h进样。以绿原酸为参比峰,各共有峰相对保留时间和相对峰面积的RSD均小于2.0%,供试品溶液在24h内稳定。
2.5.5 HPLC指纹图谱的建立与共有峰的确认
将16批灯盏花汤剂按“2.5.1”项下方法制备供试品溶液进行HPLC测定,分别记录各批的色谱图,将各批AIA格式的色谱图导入《中药色谱指纹图谱相似度评价系统 2012版》评价软件,以S001为参照图谱,采用“中位数法”生成对照图谱,共生成21个共有峰,经对照品比对6、9、10、13、14、15、18、19分别是绿原酸、咖啡酸、洋蓟素、灯盏花乙素、异绿原酸B、灯盏花甲素、异绿原酸A和异绿原酸C。16批样品的叠加图、对照指纹图谱和混合对照品溶液的色谱图见图2、图3和图4。
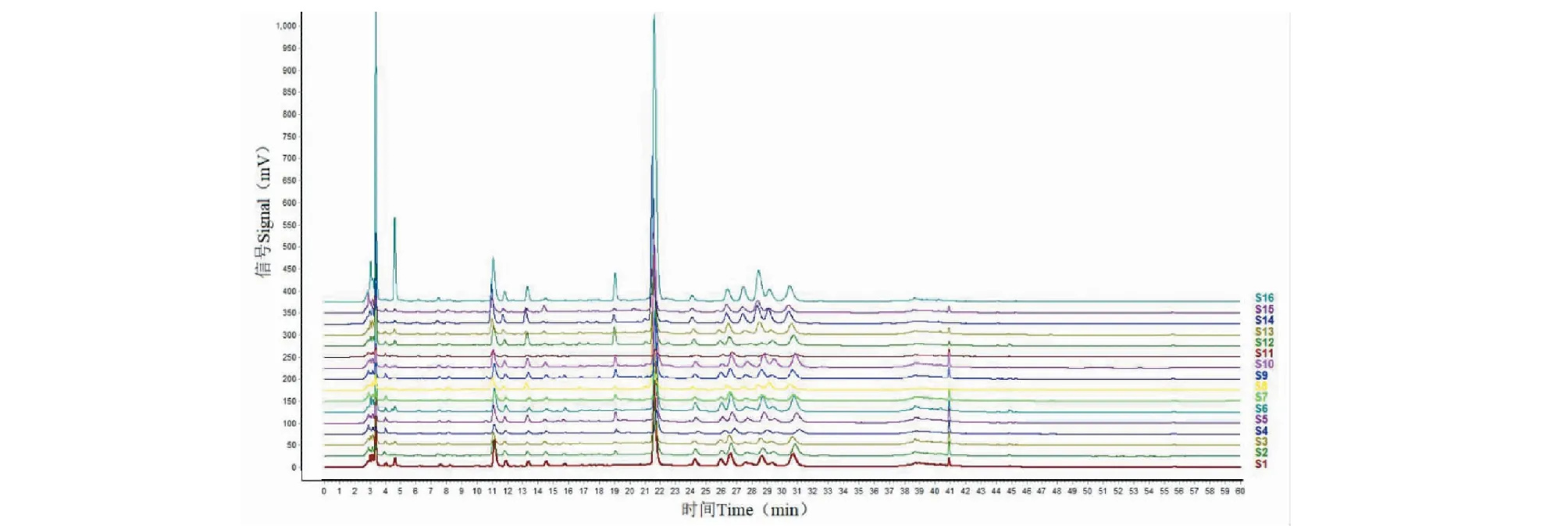
图2 16批灯盏花标准汤剂的叠加色谱图

图3 灯盏花标准汤剂对照指纹图谱

图4 混合对照品溶液色图谱
2.5.6 相似度评价
采用《中药色谱指纹图谱相似度评价系统 2012A版》评价软件进行评价。结果16批灯盏花标准汤剂的相似度分别为:0.993、0.962、0.955、0.965、0.966、0.992、0.961、0.968、0.993、0.993、0.964、0.975、0.982、0.855、0.991、0.770,相似度有一定差异。
2.6 统计分析
2.6.1 双变量相关性分析法筛选灯盏花标准汤剂体外抗氧化活性物质
16批灯盏花标准汤剂DPPH和ABTS的IC50值结果见表4。以共有峰峰面积为自变量,以DPPH和ABTS的IC50值为抗氧化活性指标作为因变量,采用SPSS19.0进行皮尔森(Pearson)双变量相关性分析,筛选出与清除DPPH自由基显著相关(P<0.05)的共有峰10个(记作“DPPH组”):峰3、4、6(绿原酸)、7、11、13(灯盏花乙素)、14(异绿原酸B)、15(灯盏花甲素)、17和19(异绿原酸C);与清除ABTS自由基显著相关的色谱峰13个(记作“ABTS组”):与清除ABTS自由基显著相关的色谱峰13个:峰3、4、6、7、8、11、13、14、15、16、17、18(异绿原酸A)和19。结果见表5。

表4 不同批次的灯盏花标准汤剂的抗氧化活性
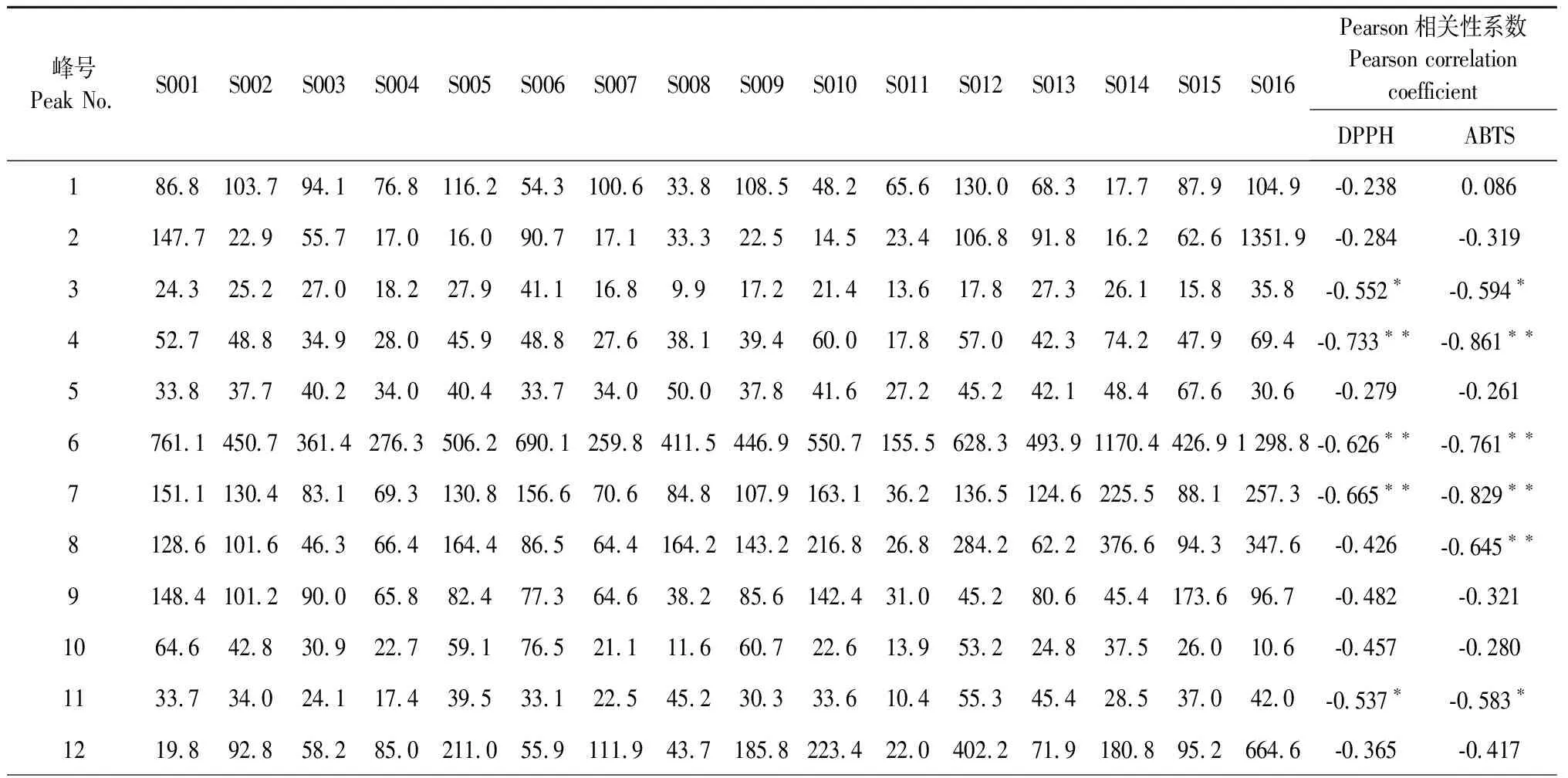
表5 灯盏花标准汤剂共有峰与抗氧化作用指标的相关性分析结果
2.6.2 聚类分析(CA)
利用SPSS 19.0统计学软件分别将筛选出的“DPPH组”色谱峰和总黄酮含量数据、“ABTS组”色谱峰和总黄酮含量数据为变量,采用聚类方法为最远邻元素,度量标准为区间平方Euclidean距离,对灯盏花标准汤剂样品进行聚类分析。聚类结果基本一致,树状图分别见图5和图6。当类间距大于10时分为两类,即野生的S014和S016分为一类,其余14批种植的分为一类。推测可能与灯盏花的生长环境(光照、海拔、经纬度)、采收期等因素有关。

图5 DPPH组聚类树状图

图6 ABTS组聚类树状图
2.6.3 主成分分析(PCA)及样品综合得分的计算
利用SPSS 19.0统计学软件分别将筛选出的“DPPH组”色谱峰面积和总黄酮含量、“ABTS组”色谱峰面积和总黄酮含量为变量进行主成分分析,并进行KMO检验及Bartlett球形检验。其中“DPPH组”“ABTS组”的KMO度量值分别为0.625、0.583,Bartlett球形检验结果P值均小于0.001,提示各变量之间存在显著的相关性,可进行主成分分析。按照特征值>1的原则分别提取主成分,“DPPH组”提取3个主成分,初始特征值累积贡献率为92.457%,第一个主成分特征值为7.920,贡献率为71.99%;第二主成分特征值为1.235,贡献率为11.23%;第三主成分特征值为1.015,贡献率为9.227%。“ABTS组”提取3个主成分,初始特征值累积贡献率为91.896%,第一个主成分特征值为9.807,贡献率为70.05%;第二主成分特征值为1.847,贡献率为13.19%;第三主成分特征值为1.212,贡献率为8.657%。根据公式Fi=Zx×A计算各主成分得分,其中A为特征向量矩阵,Zx为标准化数据矩阵。结合各成分的贡献率,建立评分模型:FDPPH=0.7199F1+0.1123F2+0.09927F3,FABTS=0.7005F1+0.1319F2+0.08657F3。各主成分得分、综合得分及排序见表6。由表6,两组的评分结果相似,野生的2批药材排分比较靠前且清除DPPH自由基和ABTS自由基的能力较强。将上述分析变量分别导入SPSS 19.0软件,进行主成分分析。主成分二维得分图分别见图7和图8。样品均被分成两组,野生的S014和S016分成一组,其余14批分成一组,主成分分析与聚类分析结果基本一致。

图7 DPPH组主成分得分图

图8 ABTS组主成分得分图

表6 灯盏花标准汤剂主成分得分及排序
2.6.4 正交偏最小二乘判别分析(OPLS-DA)
为了更好地观察样品间的组间差异,在主成分分析的基础上进一步进行有监督的OPLS-DA分析,将“DPPH组”色谱峰面积和总黄酮含量数据、“ABTS组”色谱峰面积和总黄酮含量数据为变量导入SIMCA14.1软件,获得相应的模型。由模型验证参数可知,“DPPH组”和“ABTS组”模型的稳定性好、交叉验证预测力较高(DPPH组:R2X=0.921,R2Y=0.666,Q2=0.457;ABTS组:R2X=0.914,R2Y=0.660,Q2=0.459)。“DPPH组”和“ABTS组”的OPLS-DA得分图见图9和图10。采用OPLS-DA变量重要性投影值(VIP)筛选出差异性质量标志物。95%置信区间内,VIP>1的成分在分类中起重要作用[12,13],“DPPH组”和“ABTS组”变量重要性投影值(VIP)结果见图11和图12。“DPPH组”中峰11、15、14和峰13是VIP>1说明这几个色谱峰是灯盏花标准汤剂清除DPPH自由基的差异性标志物;“ABTS组”中峰11、15、14和峰19 VIP>1说明这几个色谱峰是灯盏花标准汤剂除ABTS自由基的差异性标志物。

图9 DPPH组OPLS-DA得分图

图10 ABTS组OPLS-DA得分图
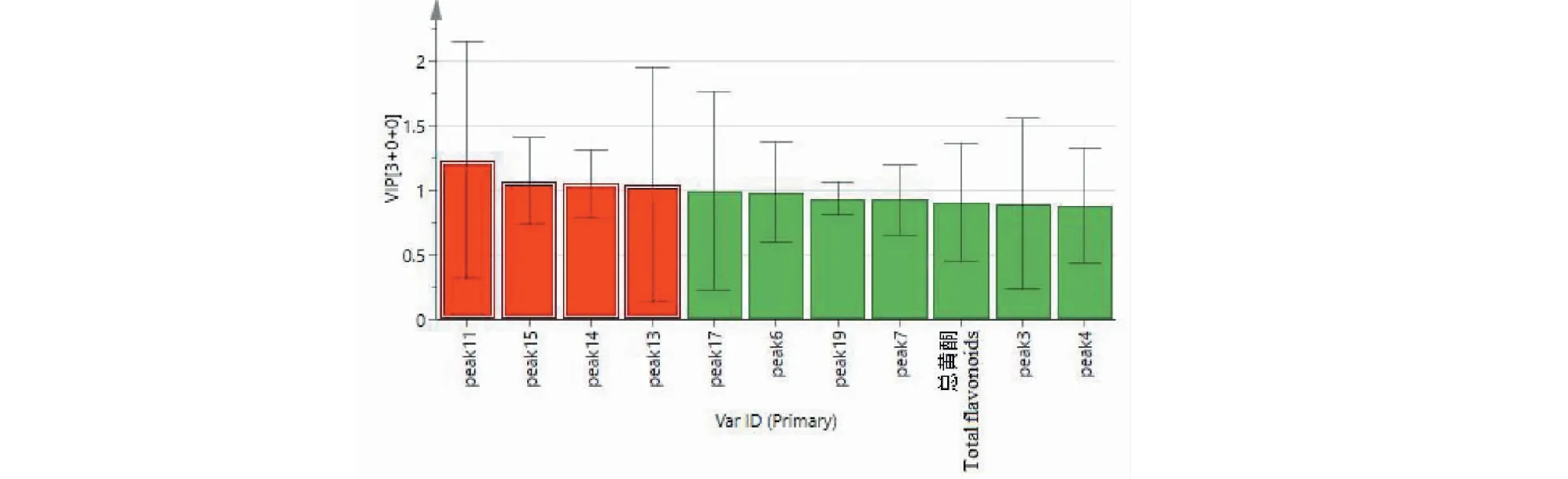
图1 DPPH组变量重要性投影值(VIP)

图12 ABTS组变量重要性投影值(VIP)
3 讨论
DPPH和ABTS自由基经常作为衡量活性成分体外抗氧化活性的指标,DPPH法通过与具有孤对电子的物质结合来测定药材的抗氧化能力,ABTS法通过与亲水性和亲脂性物质结合来测定抗氧化能力[14]。灯盏花的主要活性成分包括黄酮类化合物[15],本文测定了16批灯盏花标准汤剂的总黄酮含量为2.85~11.28 mg/mL,以清除DPPH和ABTS自由基为抗氧化指标评价了其体外抗氧化活性,DPPH的IC50值为1.00~3.39 mg/mL,对ABTS的IC50值为0.254~2.16 mg/mL,表明灯盏花标准汤剂清除ABTS自由基的能力强于清除DPPH自由基。采用Pearson双变量相关性分析,表明2种体外抗氧化活性(IC50值)与总黄酮的含量显著负相关(P<0.01),相关系数分别为-0.714和-0.841,即IC50值越小、总黄酮含量越高提取液的抗氧化能力越强。故总黄酮的含量是影响灯盏花抗氧化强弱的指标之一,可作为评价灯盏花抗氧化强弱的指标。
在指纹图谱建立过程中,实验考察了Agilent ZORBAX-SB C18、Agilent ZORBAX Eclipse XDB-C18、Agilent Extend C18色谱柱,根据色谱峰个数、分离程度等比较得出Agilent ZORBAX Eclipse XDB-C18效果较好;考察了不同流速(0.8、1、1.2 mL/min),结果0.8 mL/min分离效果比较好;考察了不同梯度的0.1%甲酸水-甲醇、0.1%甲酸水-乙腈两元系统、0.1%甲酸水-乙腈-四氢呋喃三元系统,得出0.1%甲酸水-乙腈-四氢呋喃的分离效果更好,且基线较为平稳;筛选200~400 nm检测波长,结果不同时间段变化波长得到的色谱峰多且基线平稳,最终确定0~9 min是252 nm,9~60 min是330 nm。
近几年文献对灯盏花药材指纹图谱的研究多采用HPLC法,对指纹图谱进行了相似度评价和共有峰的确定[16-20];文献[16-18]对指纹图谱采用CA和PCA进行了化学模式识别,对药材进行了分类,但未对差异性原因进行深入分析。本文前期灯盏花药材指纹图谱[18]的基础上建立了灯盏花标准汤剂的指纹图谱,相似度为0.770~0.993,得到21个共有峰,用对照品指认出8个已知成分。本文采用双变量相关性分析筛选出峰3、4、6(绿原酸),峰7、11、13(灯盏花乙素),峰14(异绿原酸B),峰15(灯盏花甲素),峰17、19(异绿原酸C)10个色谱峰与清除DPPH自由基能力显著负相关(即共有峰峰面积越大IC50值越小),Person相关系数分别为:-0.552、-0.733、-0.626、-0.665、-0.537、-0.518、-0.767、-0.754、-0.541和-0.748,表明所对应化学物质是清除DPPH自由基的主要活性成分。峰3、4、6、7、8、11、13、14、15、16、17、18(异绿原酸A)和19共13个色谱峰与清除ABTS自由基显著负相关,Person相关系数为:-0.594、-0.861、-0.761、-0.829、-0.645、-0.583、-0.676、-0.721、-0.740、0.574、-0.652、-0.720和-0.518,对应物质是清除ABTS自由基的主要活性成分。两种抗氧化方法测定的抗氧化活性(IC50值)均与已知成分绿原酸、灯盏花乙素、异绿原酸B、灯盏花甲素和绿原酸C显著相关,提示这5种成分是灯盏花抗氧化的主要活性物质。
试验以筛选出的DPPH显著相关的10个共有峰和总黄酮含量为变量,ABTS显著相关的13个共有峰和总黄酮含量为变量分别进行CA和PCA分析,均将样品分成两类,即野生的S014和S016为一类,其余14批种植的为一类。推测可能与灯盏花的生长环境(光照、海拔、经纬度等)、采收期等因素有关。同时,以这些成分为变量建立了灯盏花标准汤剂的评分模型,16批标准汤剂的得分排序与体外抗氧化活性强弱排序基本一致。笔者在CA和PCA的基础上进一步进行OPLS-DA分析,找出了与清除DPPH自由基相关的4个主要差异成分:峰11、15(灯盏花甲素)、14(异绿原酸B)和峰13(灯盏花乙素);与清除ABTS自由基相关的4个主要差异成分:峰11、15、14和峰8(灯盏花乙素)。研究结果提示在控制灯盏花质量时,应在控制含量较高的灯盏花乙素(即野黄芩苷)[1]的基础上,应适当增加其他药效活性较强的质控指标。
综上,本研究将化学指纹图谱与生物活性评价相结合,通过谱效相关性研究,初步探讨了灯盏花标准汤剂的抗氧化活性成分,所建立的方法操作简便,结果可靠,可为进一步研究灯盏花的药理作用及质量评价提供依据。后续可以加大样本量,采用液质联用技术对标准汤剂未知成分的共有峰进行指认、药理活性及综合多种药理活性的谱效关系研究,为灯盏花的质量研究提供依据。

