红树林内生真菌Aspergillus fumigatus SAS10二聚萘并吡喃酮类代谢产物研究
陈赞鸿,朱静琳,林灵茵,郭思雨,黄美荧,徐文艳,黄洪波,陶移文*
1广州医科大学药学院;2广东省分子靶标与临床药理学重点实验室,广州 511436
红树林生活在恶劣的环境中,例如高温高盐低氧、浸水的土壤、潮汐运动、强风和海浪等,这为真菌、细菌和其他微生物提供了独特的栖息地[1]。红树林来源真菌因其独特的生存环境而产生出结构新颖、活性显著的次级代谢物,并对多种抗炎药、新颖抗生素、抗真菌药和抗癌药等先导化合物的发现做出了重要贡献[2,3]。烟曲霉(Aspergillusfumigatus)是一种腐生性营养真菌,主要栖息于土壤中,是侵袭性曲霉病最常见致病菌[4],其孢子和一些代谢成分容易通过空气传播引起人类肺部疾病感染,如真菌过敏性哮喘、变态反应性支气管肺曲菌病和侵袭性肺曲霉菌病等[5]。烟曲霉菌属分布在世界各地,生存适应度高、繁殖能力强、代谢产物多样[6]。据文献报道,2006年至2016年从烟曲霉中分离到220多种具有良好活性的次生代谢产物[7],主要的代谢产物有聚酮类化合物[8]、二酮哌嗪类衍生物、生物碱类、烟曲霉素类和喹啉类衍生物等[9]。其中,二聚萘并吡喃酮类化合物对多种致病菌具有中等抑菌活性[10],对多种癌细胞均表现出一定的抑制活性[11],同时还具有致突变[12]、抗氧化与相关酶的抑制等活性[13]。本课题组前期研究表明,来自海南省东寨港自然保护区红树林植物无瓣海桑内生真菌AspergillusfumigatusSAS10大米发酵培养代谢产物丰富。前期研究从该菌株获得了5个吡喃酮类化合物和2个酯类化合物[14]。本文在前期工作基础上,继续深入研究其大米发酵代谢产物的化学成分和抗菌活性,以期发现结构独特、抗菌活性显著的先导化合物。
1 材料与方法
1.1 仪器与材料
超净工作台(SJ-CJ-2FDQ型,苏州苏洁净化有限公司);摇床(上海紫裕生物),烘干箱;恒温培养摇床(THZ-1038,太仓市实验设备厂);数显电热培养箱(HPX-9162 MBE,上海博讯实业有限公司医疗设备厂);旋转蒸发仪(XHRE-2000C,上海霄汉实业发展有限公司);蒸汽灭菌锅(日本松下健康医疗器械株式会社 MLS-3781L-PC);色谱纯乙腈(瑞典Oceanpak公司);超声波清洗机(宁波新芝生物科技股份有限公司);JEOL 400NB 核磁共振波谱仪(日本电子株式会社);安捷伦7890B型气相色谱仪(美国Agilent 公司);安捷1260 Infinity 高效液相色谱仪(美国Agilent公司);安捷伦7200型质谱仪(美国Agilent公司);Triple TOFTM 5600高分辨质谱仪(美国ABSCIEX公司);高效液相系统(LC-20A和LC-20AD,岛津);Sharpsil-AQ C18半制备柱(10 mm × 250 mm,5 μm,上海煊美实业);硅胶薄层板(HS-GF254,青岛海洋化工厂分厂);硅胶(200~300、300~400目,青岛海洋化工厂分厂);真空干燥箱(DZF系列,上海一恒科学仪器有限公司);超净水机(MILLI-Q);低温冷冻离心机(CT18RT,Techcomp);全波长酶标仪(Epoch,美国BioTek公司);大米培养基(85 g大米加160 mL的2 g/L的粗海盐水,高压灭菌);MH肉汤(青岛海博生物技术有限公司);二甲基亚砜(上海麦克林生化科技有限公司);PBS缓冲液(赛默飞世尔生物化学制品有限公司);色谱纯乙腈(瑞典Oceanpak);色谱纯甲醇(美国Merck 公司);其余石油醚、乙酸乙酯等分析纯试剂均为国产(上海泰坦科技股份有限公司)。
选用分离自海南省东寨港红树植物无瓣海桑(Sonneratiaapetala)茎部组织的菌株AspergillusfumigatusSAS10为研究材料,植物组织经广州医科大学药学院郑国栋教授鉴定,现保存于广州医科大学药学院。
1.2 发酵、提取与分离
将菌种接种于PDA培养皿培养3天,单菌落接种于装有150 mL葡萄糖蛋白胨酵母膏(GYP)液体培养基中,在摇床上120 r/min,25 ℃培养3天,制成种子液后接种5 mL于大米培养基中,静置40天。
发酵产物用等体积的甲醇浸泡48 h,搅拌均匀,纱布过滤得粗提液,重复5次。收集粗提液后减压旋蒸至无甲醇,以等体积乙酸乙酯萃取5次,合并,旋干得浸膏602 g。
粗提物经硅胶(200~300目)柱层析分离,采用石油醚-乙酸乙酯(体积比为100∶0、80∶20、67∶33、50∶50、33∶67、20∶80、0∶100)系统梯度洗脱,不同梯度使用洗脱有机溶剂5 L,获得7个(Fr.A~Fr.G)不同极性段的组分。各组分经检测分析后,将Fr.F(97.90 g)进行正相硅胶(300~400目)柱层析,用石油醚-乙酸乙酯(50∶50→0∶100)梯度洗脱,相应获得组分Fr.F1~F6,对Fr.F3(23.4 g)进行正相硅胶(300~400目)柱层析,用石油醚-乙酸乙酯(体积比为50∶50→0∶100)梯度洗脱,相应获得组分Fr.F3A~F3R,合并Fr.F3D~F3E(2.78 g),用半制备HPLC进行分离,流动相分别为乙腈-水(65∶35,V/V),流速为2 mL/min,检测波长为220 nm和280 nm,得到化合物1(12.1 mg,tR=21.472 min)、2(3.2 mg,tR=27.491 min)、4(5.4 mg,tR=24.582 min);对Fr.G(3.3g)通过半制备HPLC进行分离流动相分别为乙腈-水(65∶35,V/V),流速2 mL/min,检测波长为220 nm和280 nm,得到化合物5(14.6 mg,tR=23.106 min);再将Fr.F2(2.3 g)进行分离,流动相分别为乙腈-水(75∶25,V/V),流速为2 mL/min,检测波长为220 nm 和266 nm,得到化合物8(7.8 mg,tR=20.207 min);同理,Fr.E段(147.22 g)进行正相硅胶(300~400目)柱层析,用石油醚-乙酸乙酯(50∶50→0∶100)梯度洗脱,获得 7个组分(Fr.E1~E7),将Fr.E5组分(3.69 g)进行正相硅胶(300-400目)柱层析,用石油醚-乙酸乙酯(50∶50→0∶100)梯度洗脱,获得16组分(Fr.E5A~E5P),Fr.E5H段(1.3 g)用半制备HPLC进行分离,流动相分别为乙腈-水(75∶25,V/V),流速为2 mL/min,检测波长为 220 nm和280 nm,得到化合物3(4.1 mg,tR=29.045 min)和化合物6(35.4 mg,tR=27.923 min);Fr.E5L(2.2 g)段用半制备HPLC进行分离流动相分别为乙腈-水(45∶55,V/V),流速为2 mL/min,检测波长为220 nm和280 nm,得到化合物7(11.2 mg,tR=21.113 min)。
1.3 抗菌活性测定
采用倍半稀释法[15]测定化合物1~8对大肠杆菌(EscherichiacoliATCC 25922)、金黄色葡萄球菌(StaphylococcusaureusATCC 29213)和两种耐甲氧西林葡萄球菌(MRSA N315和MRSA NCTC 10442)致病菌的抑制活性。将上述4株致病菌接入MH液体培养基中,于37 ℃ 200 r/mim恒温振荡培养箱中培养24 h备用。取待用菌液,用PBS缓冲液稀释至酶标仪600 nm下OD值为0.1,再用MH肉汤稀释100倍,即为实验用菌液(1×106CFU/mL)。采用96孔板,每孔预先加入100 μL MH肉汤和100 μL样品(200 μg/mL),混合均匀,然后依次倍半稀释,最后每孔添加100 μL实验用菌液,即样品最终浓度分别为50、25、12.5、6.25、3.125、1.562、0.781和0.390 μg/mL(每个浓度重复3个复孔)。将孔板放入37 ℃恒温培养箱中培养24 h,记录0 h和24 h酶标仪测量结果,计算抑制率。阳性对照为万古霉素和链霉素,阴性对照为实验用菌液和MH肉汤。
1.4 菌株分离与鉴定
将采自海南省东寨港红树林植物无瓣海桑Sonneratiaapetala茎部组织充分洗净后剪成小块,在浓度为75%的酒精中浸泡1 min,再用浓度为2%的次氯酸钠溶液浸泡3 min,最后转入浓度为75%酒精中浸泡30 s后,再用无菌水漂洗3次后平放于孟加拉红培养基平板上,放入28 ℃恒温培养箱中培养至组织切面长出菌丝。用平板划线法将菌丝接种至新的孟加拉红培养基平板上,直到平板上的菌落形态基本一致后接入马铃薯葡萄糖琼脂培养基平板上,待真菌菌落基本覆盖,记录菌落生理生化特征,保存待用。
菌株SAS10经DNA提取,PCR反应,ITS序列测定,测定结果与NCBI数据库进行比对,选择具有较高序列相似度的已有序列进行BLAST,并使用MEGA 7.0构建进化树,结果鉴定SAS10为Aspergillusfumigatus[10]。
2 结果与分析
2.1 结构鉴定

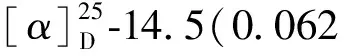
化合物3黄色粉末;分子式为C32H26O10,HR-ESI-MS:m/z571.160 4[M+H]+;1H NMR(400 MHz,DMSO-d6):7.39(1H,s,H-9),7.31(1H,s,H-10),6.61(1H,d,J=2.2 Hz,H-9′),6.55(1H,s,H-3′),6.26(1H,s,H-3),6.09(1H,d,J= 2.2 Hz,H-7′),4.01(3H,s,10′-OMe),3.74(3H,s,8-OMe),3.58(3H,s,8′-OMe),3.44(3H,s,6-OMe),2.55(3H,s,2′-Me),2.44(3H,s,2-Me);13C NMR(100 MHz,DMSO-d6):169.1(s,C-2),106.8(d,C-3),184.1(s,C-4),101.4(s,C-5),102.0(s,C-6),157.4(s,C-7),117.8(s,C-8),159.7(d,C-9),161.1(d,C-10),167.9(s,C-2′),109.9(d,C-3′),182.4(s,C-4′),152.5(s,C-5′),110.5(s,C-6′),96.8(d,C-7′),160.9(s,C-8′),96.4(d,C-9′),159.3(s,C-10′),103.9(s,C-4a),140.0(s,C-5a),109.3(s,C-9a),153.6(s,C-10a),107.6(s,C-4a′),140.3(s,C-6a′),104.1(s,C-10a′),155.0(s,C-10b′),20.1(q,2-Me),61.4(q,6-OMe),56.0(q,8-OMe),20.3(q,2′-Me),55.1(q,8′-OMe),56.4(q,10′-OMe)。以上数据与文献[16]报道基本一致,故化合物3鉴定为asperpyrone C。




化合物8黄色粉末;分子式为C16H14O5;ESI-MS:m/z287.09[M+H]+;1H NMR(400 MHz,DMSO-d6):7.18(1H,s,H-10),6.86(1H,s,H-9),6.47(1H,s,H-7),6.19(1H,s,H-3),3.87(6H,s,6,8-OMe),2.39(3H,s,2-Me);13C NMR(100 MHz,DMSO-d6):168.7(s,C-2),106.8(d,C-3),183.7(s,C-4),162.1(s,C-5),160.2(s,C-6),100.9(d,C-7),161.4(s,C-8),97.3(d,C-9),98.2(d,C-10),152.6(s,C-11),103.5(s,C-12),107.5(s,C-13),140.8(s,C-14),20.2(q,2-Me),55.9(q,6-OMe),55.5(q,8-OMe)。以上数据与文献[20]报道基本一致,故化合物8鉴定为rubrofusarin B。
化合物1~8结构见图1。

图1 化合物1~8的结构
2.2 抗菌活性结果
化合物1~8在50 μg/mL浓度下的抑菌活性结果见表1。结果表明8种化合物对金黄色葡萄球菌、大肠杆菌和两种耐甲氧西林金黄色葡萄球菌有不同程度的抑制作用,其中化合物6对耐甲氧西林金黄色葡萄球菌(MRSA N315)的IC50为32.42 μg/mL,阳性对照药万古霉素对金黄色葡萄球菌的MIC为1.25 μg/mL,对两种耐甲氧西林金黄色葡萄球菌的MIC为0.675 μg/mL,链霉素对大肠杆菌的MIC为1.25 μg/mL。
3 讨论与结论
本课题组研究了红树林内生真菌AspergillusfumigatusSAS10次生代谢物的化学成分,利用各种分离纯化和鉴定技术,从发酵液中提取分离得到7个二聚萘并吡喃酮类化合物和1个萘并吡喃酮角形单体,所有化合物均为首次报道的南海红树林内生真菌烟曲霉次生代谢产物,为二聚萘并吡喃酮类化合物的获取提供了新来源。根据化合物的结构及相关研究[21],我们推测它们的生源合成途径是醋酸-丙二酸途径(见图2)。7分子的乙酰辅酶A经过一系列反应可以得到线型萘并吡喃酮母核(如化合物8和11)和角型萘并吡喃酮母核(如化合物9和10),然后在Gip1相关酶作用下[22],将萘并吡喃酮单体羟基上的一个电子移除,形成结合氧自由基,再经过共轭系统中电子重排导致单体上的碳活化,两个碳活化单体通过自身或者互相偶联,从而生成二聚体1~7。

图2 化合物1~8可能的生源合成途径
据文献报道,该类化合物在抗菌和抗肿瘤等方面都表现出较好的活性。化合物1和4对人胰腺癌细胞PANC-1、乳腺癌细胞MDA-MB-231、人结肠癌细胞Caco-2和卵巢癌细胞SK-OV-3均表现出一定的抑制活性,其中1对 PANC-1 细胞表现出强细胞毒性,其IC50值为8.25 ± 2.20 μM[10];2、6和8的抗细菌(枯草芽孢杆菌,大肠埃希氏菌和荧光杆菌)以及抗真菌(红锥菌和白色念珠菌)活性较好,其中2对枯草芽孢杆菌、荧光杆菌的MIC均为1.9 μg/mL(阳性对照均为青霉素:0.78 μg/mL),6对荧光杆菌和红色毛癣菌的MIC均为7.8 μg/mL(阳性对照分别为青霉素:0.78 μg/mL和酮康唑:3.9 μg/mL)[23];1、4、6和7对白色念珠菌、大肠杆菌和金黄色葡萄球菌均表现出弱的抑菌作用(前者阳性对照为两性霉素B,后两者阳性对照为氨苄青霉素钠)[24,25]。我们的抗菌活性表明,化合物1~8对金黄色葡萄球菌、大肠杆菌和两种耐甲氧西林金黄色葡萄球菌具有不同程度的抑制活性,其中化合物6对耐甲氧西林金黄色葡萄球菌(MRSA N315)的IC50为32.42 μg/mL。另外,二聚萘并吡喃酮体对金黄色葡萄球菌(S.aureusATCC 29213)和两种耐甲氧西林葡萄球菌(MRSA N315和MRSA NCTC 10442)的抑制活性普遍比线型萘并吡喃酮单体的抑菌活性强,不同构型(线型和角型)的二聚萘并吡喃酮类化合物的抑菌活性也存在一定的差异,后续我们将深入研究二聚萘并吡喃酮类化合物的抗菌构效关系,为该类新型抗菌剂的开发奠定基础。

