鞍上区实质性肿瘤的影像诊断思维
朱羽苑 梁宗辉
病例资料患者,男,36 岁。体检发现鞍区占位,考虑垂体瘤可能。半年后开始自觉双眼视物较前模糊。实验室检查:皮质醇(7:00~10:00):77 nmol/L(参考值172.0000~497.0000 nmol/L)。甲状腺功能:三碘甲状腺原氨酸(TT3):1.00 nmol/L(参考值1.18~3.40 nmol/L);甲状腺素(TT4):42.44 nmol/L(参考值57.6~161.3 nmol/L);游离三碘甲状腺原氨酸(FT3):2.51 pmol/L(参考值3.39~6.47 pmol/L);游离甲状腺素(FT4):6.92 pmol/L(参考值10.29~21.88 pmol/L);促甲状腺激素(TSH):1.383 mIU/L(参考值0.3~3.6 mIU/L)。性激素指标:促卵泡成熟素:0.83 IU/L(参考值1.50~12.40 IU/L);黄体生成激素:1.13 IU/L(参考值1.70~8.60 IU/L);催乳素:165.77 mIU/L(参考值131.0~647.0 mIU/L);睾酮:1.42 nmol/L(参考值9.9~27.8 nmol/L);雌二醇:<73.00 pmol/L(参考值94.8~223 pmol/L);孕酮:0.45 nmol/L(参考值0.70~4.30 nmol/L);人绒毛膜促性腺素:<0.6 IU/L(参考值<5.0 IU/L)。患者否认近期感染史、其他慢性病史及肿瘤病史。
影像学检查:头颅MRI 平扫加增强(图1)见鞍上区肿块 影,T1WI 呈稍低信号,T2FLAIR 呈稍高信号,DWI 呈等信号,增强后呈明显均匀强化,大小约32.27 mm×27.56 mm;两侧中脑大脑脚轻度受压;鞍上池及视交叉受压;双侧海绵窦结构信号未见明显异常。第三脑室受压扩张。
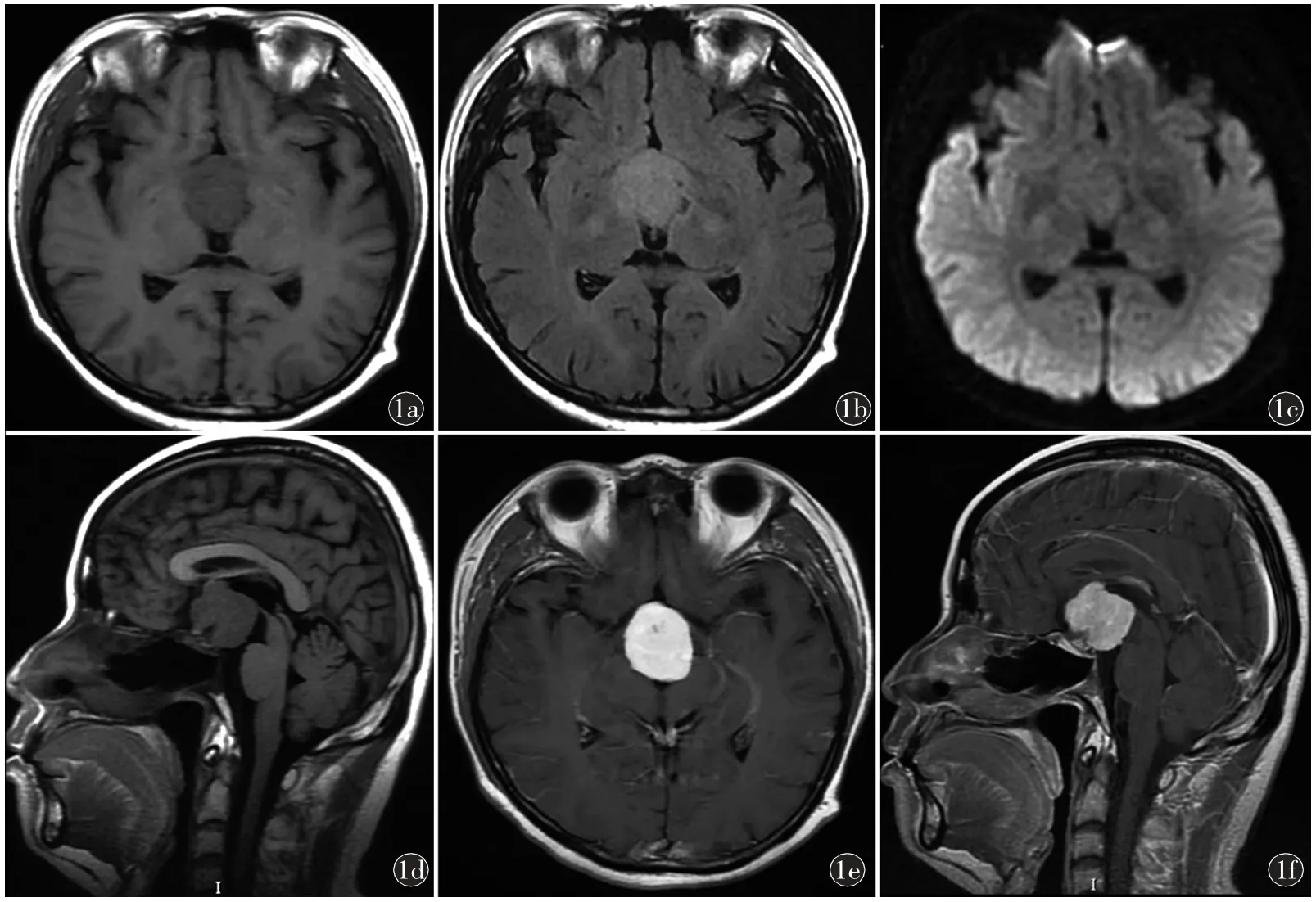
图1 MRI 平扫加增强,鞍上区实质性病变,包绕垂体柄上部及漏斗结构,直径约为3 cm,病灶呈浅分叶状,界清。a)横断面T1WI 呈稍低信 号;b)T2 FLAIR 呈 稍高信号;c)DWI 呈等信号;d)矢状位T1WI 所示垂体及垂体柄下部可见,垂体后叶T1WI 高亮信号未显示;e)、f)增强后病灶明显均匀强化,未见明显坏死、出血、囊变或者血管流空信号;视交叉、双侧下丘脑内侧核、部分中脑结构(乳头体、灰结节)受推移,肿瘤部分延伸至第三脑室内;未累及周围脑膜或颅底骨质
手术记录:在全麻下行经鼻鞍区占位切除术,术中见肿瘤与周边组织粘连,仅行部分切除。病理结果:(鞍上)垂体细胞瘤(WHO I 级)。免疫组化:EMA(+),VIM(+),TTF1(+),S100(+),PR(-),CK(-),GFAP(+),Ki67(灶4%),Olig2(-),Syn(-),SMA(血管+),CD34(血管+),SSTR2a(-/+),STAT6(+/-)。
随访:患者术后开始内分泌替代治疗(优甲乐、可的松、安特尔口服),可耐受。术后6 个月行鞍上区肿瘤立体定向放疗2 次。1~2 年随访头颅MRI 鞍上区肿瘤无明显变化,视物模糊症状基本消失。
讨论垂体细胞瘤(pituicytoma)是一类少见的鞍区及鞍上区肿瘤,起源于神经垂体和漏斗部的特殊胶质细胞即垂体细胞,仅占鞍区肿瘤的0.07%,生长缓慢,WHO 分级为Ⅰ级。2017 年WHO 垂体肿瘤分类中,垂体细胞瘤与垂体颗粒细胞瘤(granular cell tumor,GCT)、梭形细胞嗜酸细胞瘤(spindle cell oncocytoma,SCO)以及鞍区室管膜瘤(sellar ependymoma)统称为垂体后叶肿瘤(posterior pituitary tumours,PPT)[1]。2022 年最新版WHO 垂体肿瘤分类中,垂体后叶肿瘤属于垂体细胞肿瘤家族,包括传统的垂体细胞瘤、嗜酸细胞型(梭形细胞嗜酸细胞瘤)、颗粒细胞型(颗粒细胞瘤)和室管膜型(鞍区室管膜瘤)垂体细胞瘤[2]。
垂体细胞瘤多见于中年人,中位发病年龄47 岁,儿童少见,男女发病率无明显差别[2]。垂体细胞瘤常累及鞍区垂体后叶、垂体柄或者下丘脑漏斗,可表现为单独的鞍区及鞍上肿瘤,或两者同时受累。肿瘤较小时多无明显症状,逐渐长大后主要表现为肿瘤压迫症状,以视觉障碍、视野缺损最常见,其次是头痛、垂体功能减退,可伴随疲乏、头晕、恶心、呕吐等症状,部分患者出现闭经、泌乳、性欲减低症状,尿崩症罕见[3-5]。
垂体细胞瘤多见于鞍上区以及垂体后叶,少数完全位于鞍区[6]。病变大体表现呈粉红色,表面光整,血供非常丰富,轻微触碰即可大量出血。镜下由梭形或者星形的细胞呈暴风雪状结构排列,细胞内含有圆形、卵圆形、长条形的不规则细胞核,以及合胞状纤维状胞浆,细胞间有丰富的毛细血管网。免疫组化TIFF-1、Vimentin、S-100(+),GFAP(+/-),EMA(+/-)、SYN(-)、CD34(+),突触小泡蛋白(-)、嗜铬颗粒(-)、神经纤维(-),Ki-67 多低水平表达[3,7]。
影像上,垂体细胞瘤表现为鞍区和/或鞍上区实性结节,界清,可呈浅分叶状,CT 为稍高密度,MRI 为T1WI 等或稍低信号,T2WI 稍高信号,增强后大多数呈明显均匀强化,且呈持续性强化,与垂体腺瘤的早期强化有所不同;病灶呈均匀实性,较少发生囊变、钙化、出血或者坏死。肿瘤较小时,往往表现为鞍上区垂体柄后方的结节,与垂体后叶关系密切,此为典型部位,结合影像学表现,更容易做出诊断;肿瘤较大时,可压迫垂体前叶、垂体柄、视交叉、鞍膈、下丘脑等结构[6,7],并可向第三脑室内生长,此时很难判断肿瘤的起源。由于垂体细胞瘤可起源于垂体柄,形成位于鞍上区、以垂体柄为中心的肿瘤,正如本例所示。垂体细胞瘤血供丰富,触碰易出血,且术后并发症较多,出血为首要危及生命的原因,还有永久激素替代、永久尿崩症;一半病例无法完整切除,术后易复发。部分患者可能行立体定向放疗获益更大。所以考虑到该诊断对于治疗前评估尤其重要[8]。
本例患者为36 岁男性,以视物模糊缓慢起病,实验室检查提示垂体功能减退(包括甲状腺激素、性激素以及皮质醇)。MRI 提示肿瘤为鞍上区实质性病变,包绕垂体柄上部及漏斗结构,直径约为3 cm,病灶呈浅分叶状,界清,T1WI 呈稍低信号,FLAIR 呈稍高信号,增强后明显均匀强化;矢状位图像所示垂体及垂体柄下部可见,垂体后叶T1WI 高亮信号未显示。视交叉、双侧下丘脑内侧核、部分中脑结构(乳头体、灰结节)受推移,肿瘤部分延伸至三脑室内。其MRI 信号具有实质性肿瘤的特征,大致以垂体柄和漏斗为中心,且垂体后叶T1WI 高亮信号未显示,结合临床表现及实验室检查,在诊断时除了考虑常见的鞍上区肿瘤以外,尚需考虑到垂体后叶肿瘤如颗粒细胞瘤、垂体细胞瘤的可能。
影像诊断思维鞍区肿瘤的诊断思维与其他部位大原则相同,先定位后定性,并需要结合临床表现、实验室检查做出最后诊断。鞍区肿瘤的定位主要是确定肿瘤的起源,首先是确定肿瘤与垂体组织包括垂体柄的关系,其次是确定肿瘤与鞍旁结构的关系,此外还需要确定肿瘤与鞍上结构(视交叉、下丘脑)的关系。不同组织、结构起源的肿瘤具有不同的生长方式。因此,鞍区肿瘤定位要考虑到肿瘤的部位、生长方式,同时需要考虑肿瘤与周围结构的关系。鞍区肿瘤的定性则需结合影像学表现、临床表现和实验室检查,譬如与垂体组织关系密切的肿瘤往往有内分泌改变,有些生长于鞍区的肿瘤如生殖细胞瘤本身具有内分泌功能,进而引起相应的临床表现和实验室检查的异常;影像学上,有些肿瘤具有特征性的表现,如颅咽管瘤通常有典型的“蛋壳状”钙化、囊变多见等。
鞍上区肿瘤通常因压迫视交叉引起视力障碍或视野缺损,因此临床表现对此类肿瘤的鉴别诊断意义不大;实验室检查中,腺垂体所分泌的激素包括生长素、催乳素、促黑素、促甲状腺激素、促肾上腺皮质激素、促性腺激素等,起源于腺垂体的肿瘤通常伴有内分泌的改变,本例中甲状腺激素、性激素以及皮质醇有异常,考虑与肿瘤累及垂体柄有关,而非腺垂体本身病变所引起;垂体后叶不分泌激素,可以储存和释放下丘脑分泌的激素,主要是抗利尿激素和缩宫素,本例中没有相关的异常表现。因此,实验室检查对本例肿瘤的定性诊断也没有太大帮助。
既然临床表现和实验室检查对本例鞍上区肿瘤的定性诊断不能提供有价值的线索,就只能从影像学表现上寻找定性诊断的依据。本例患者为36 岁男性,鞍上区实性占位与腺垂体完全分开,且腺垂体结构完整,信号正常,首先可以排除起源于腺垂体的垂体腺瘤的诊断;病变以垂体柄上部和漏斗为中心,垂体后叶也没有明显形态异常,但神经垂体T1WI 的高亮信号未见显示,由于20%的正常神经垂体T1WI 高信号可不显示,因此,肿瘤起源于神经垂体的证据并不充分,但尚不能完全排除,就需要寻找其他的证据;从肿瘤本身的信号特征分析,本例T1WI 略低信号、T2FLAIR 略高信号、DWI 等信号,符合实质性肿瘤的信号特点,增强后呈现明显均匀强化,符合肿瘤血供丰富的特点,而这些特征与垂体后叶起源肿瘤相符合;同时需要与常见的鞍上区实质性肿瘤如成人常见的鞍上脑膜瘤、乳头状颅咽管瘤等等进行鉴别诊断。
鞍上脑膜瘤多见于女性,来源于鞍结节、鞍膈、鞍背、床突等结构,T1WI、T2WI 接近等信号,CT 钙化较其他部位脑膜瘤少见,偶可见囊变、坏死,增强后中度至明显强化,近鞍结节等结构附着处可见脑膜尾征,颅底骨质可见硬化[9],但本例矢状位图像显示肿瘤与鞍结节、鞍膈完全分离,且无脑膜尾征,也不累及颅底骨质,因此脑膜瘤的诊断依据不足。也有文献提到,当垂体细胞瘤和鞍膈、后床突的脑膜瘤较难鉴别时,可通过DSA 鉴别,前者供血主要来源于颈内动脉,后者主要来源于颈外动脉[3,7]。
乳头状颅咽管瘤在40~60 岁成人中多见,发病率明显低于儿童的成釉颅咽管瘤,以鞍上实质性病变为主,视力减退、垂体功能低下为主要表现。影像学上,肿瘤呈圆形、类圆形为主,不规则分叶少见,部分病变伴有少量囊变,而大量囊变及钙化少见。CT 表现为实性密度为主结节,少许低密度囊变区,T1WI 呈等或稍低信号,T2WI 实性部分多呈高信号,增强后明显强化,局部可强化不均匀[10]。本例为完全实质性肿瘤,且强化均匀,因此也不完全符合。
对于年轻患者而言,鞍上区实质性肿瘤还需排除青少年多发的生殖细胞瘤、毛细胞星形细胞瘤及视交叉胶质瘤的可能。鞍上生殖细胞瘤女性多见,最常见症状是尿崩症,还有早熟、体格矮小、视交叉受累等症状,影像学上病灶质地均匀,一般无钙化,T1WI 呈等低信号,T2WI 呈高信号,呈均质性强化,可累及垂体柄、漏斗,或者同时累及蝶鞍,病变多向后上生长,可伴有其他部位多发病变,可随脑脊液播散[11]。鞍上毛细胞星形细胞瘤以实质性多见,可伴小囊变,青少年以视力障碍为主要表现,病灶较大,多呈T1WI 等信号、低信号或等低混杂信号,T2WI 呈高信号或等高混杂信号,实性部分强化明显,多不均匀强化,少数也可随脑脊液播散[12]。视交叉胶质瘤青少年和儿童常见,以视神经萎缩、视力障碍为主要表现,可合并神经纤维瘤病,影像学上表现为鞍上区视交叉处球形或横置的椭圆形或不规则肿块,边缘锐利光整,CT 呈稍高密度,T1WI 呈均质等或稍高信号,T2W 呈均质稍高信号,边缘的薄层低信号代表脑膜,增强后均匀显著强化[13]。
此外,定位于垂体柄和漏斗的病变均发病率较低,通常表现为鞍上区占位,需要考虑垂体后叶肿瘤。垂体后叶肿瘤最常见的是颗粒细胞瘤,多见于60 岁男性、50 岁女性,发病率女性:男性为2∶1,约一半患者有肿瘤压迫相关症状,且鞍上病变最常见,或者鞍上、鞍内同时累及,很少单独出现于鞍区[5];影像学上,肿瘤界清、呈分叶状,钙化少见,T1WI 等信号,T2WI 可见低信号,强化可均匀或者不均匀,强化程度多变[5,14,15]。T2WI 低信号以及多变的强化方式是颗粒细胞瘤区别于垂体细胞瘤(T2WI 等或稍高信号)的特征性表现。且垂体后叶肿瘤很少出现尿崩症,可与淋巴细胞性垂体炎等鞍区/鞍上肿瘤相区别。
最后,累及漏斗和垂体柄的病变亦可表现为鞍上区占位,还需考虑到系统性病变的累及,比如结节病、朗格汉斯细胞增生症及转移瘤等,此类患者多有相关病史,且病变早期较小,占位性效应不明显,治疗后可缩小或消失。
综上所述,本例患者为少见的鞍上区垂体细胞瘤,需要结合定位、病灶形态、病灶密度/信号、强化方式以及临床症状、实验室检查等进行综合判断。对于鞍上区以垂体柄和漏斗为中心的富血供实质性肿瘤,需要考虑垂体后叶肿瘤的可能性,尤其表现为均质明显强化时,需要考虑垂体细胞瘤,为治疗方案的合理制定提供有用的参考信息。

