不同月经周期正常子宫的扩散加权成像研究
郭艳会 张毅 李天然 强金伟
女性生殖系统功能特殊,结构复杂,其中子宫是产生月经和孕育胎儿的激素依赖器官,子宫体由内向外分别为内膜、结合带和外肌层,各个分区结构受激素影响,受体表达状况不同,形态、结构和功能随着激素的变化而发生周期性的改变,这一特征在子宫内膜厚度变化方面体现的尤为显著[1,2]。同时,随着女性年龄的增长,子宫和卵巢的功能逐渐下降,激素分泌紊乱,也将对子宫的形态、结构和功能产生影响。超声检查简单、便捷,但是容易受医生检查水平和操作手法的限制,以及肠道气体和肥胖的影响,使有些疾病的检出及诊断受到限制。MRI 不会受到这些因素的影响,而且不同的扫描序列成像结果大为不同,MRI 因其优异的软组织分辨率、多序列、多方位及无电离辐射等特点,已广泛用于显示子宫解剖、发现病变、良恶性疾病的鉴别、恶性肿瘤的术前分期及术后疗效监测等方面[3]。本研究通过测量正常子宫内膜、结合带、外肌层在不同年龄段、不同生理周期的ADC值,以期为DWI 在子宫病变中的应用提供参照。
资料与方法
1.一般资料
前瞻性招募56 位不同年龄段女性志愿者进行盆腔MRI 检查,育龄期组:40 岁以下(包括40岁);围绝经期组:40 岁以上仍有月经且月经周期仍规律的女性;绝经组:已绝经女性。其中育龄期组23 例,年龄24~39 岁,平均27.968 岁,中位年龄27 岁;围绝经期组15 例,年龄41~55 岁,平均48.76 岁,中位年龄49 岁;绝经组18 例,年龄48~75 岁,平均年龄56.54 岁,中位年龄54 岁。所有患者均为健康女性且无节育环,育龄期组及围绝经期女性月经周期规律,周期为28~32 d,且无子宫肌瘤、腺肌症、盆腔炎及其他肿瘤性疾病。所有参加者体型匀称,身体质量指数(body mass index,BMI)在标准范围内,近期无激素等药物使用史。育龄期组及围绝经期组于排卵期(月经周期第14天)、分泌中期(第21 天)进行盆腔MRI 检查,绝经组只行一次MRI 检查,时间随机。
2.影像检查方法
使用3.0 T MRI 扫描仪(MAGNETOM Verio,Siemens,Erlangen)八通道体部相控阵线圈,所有志愿者扫描前排空膀胱,自由呼吸,仰卧位脚先进,扫描范围从髂前上棘至股骨上段水平,行常规MRI 序列及DWI 扫描。采用SE 序列行横断面T1WI 扫描:TE 10 ms,TR 455 ms,层厚5 mm,层间距1 mm,视野32 cm,矩阵320×240;横断面T2WI序列:TR 3160 ms,TE 90 ms,视野32 cm,层厚5 mm,层间距1 mm,矩阵320×288;横断面FSE 序列FS T2WI:TR 5500 ms,TE 96 ms,视野32 cm,层厚5 mm,层间距1 mm,矩阵320×288。DWI 扫描采用横断面单次激发自旋回波序列加权EPI 序列:TR 3500,TE 61 ms,b 值为0 和1000 s/mm2。
3.图像分析
观察常规DWI 检查(b=0、1000 s/mm2)图像信号,并应用Siemens 自带的后处理软件进行分析,由两位拥有三年以上影像诊断经验的放射科医生分别测量并记录。ROI 选择参照横断位T2WI 图像,在ADC 图上分别于子宫内膜、结合带、外肌层各随机选取三个类椭圆形ROI,大小20~50 mm2,取其平均值,得出参数ADC 值。
4.统计学方法
采用SPSS 22.0(IBM,Chicago,IL)完成数据统计学处理,分别比较不同年龄组、不同周期和不同子宫结构之间ADC 值的差异,采用区组间方差分析对各组数据进行多重比较前,首先完成方差齐性检验,当方差齐时,使用最小显著差异法(least significant difference,LSD)对各组ADC 值进行对比分析;当方差不齐时,通过使用Tamhane 对各组数据进行对比分析。P<0.05 表示差异有统计学意义。
结果
不同个体的子宫位置有不同程度差异,包括子宫前位、中位、后位,而且角度也各有不同,所以常规MRI 扫描不能获得标准的横断面图,后经过讨论改进了扫描方法,如果子宫前倾或后倾角度不超过45°,横断位选择垂直于子宫长轴扫描,如果角度超过45°,横断位选择平行于子宫长轴扫描,以得到最理想的DWI 及ADC 图像。
育龄期组和围绝经期组健康志愿者要在一个月经周期内全部完成两次磁共振扫描,绝经组随机进行MRI 扫描,所得MRI 图像成像良好。正常女性不同年龄段不同周期子宫三层结构的ADC值见表1。各年龄组子宫三层结构间DWI 信号强度为结合带低于外肌层低于内膜,ADC 值大小关系为结合带低于内膜低于外肌层(图1~6)。
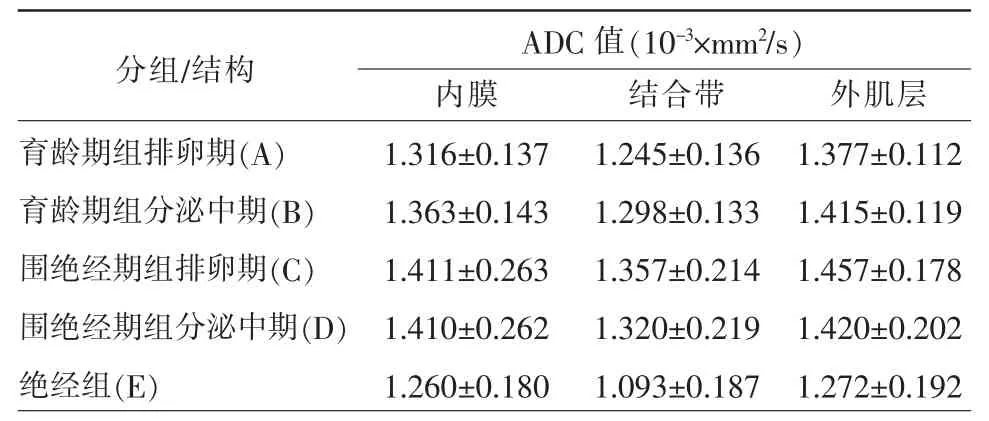
表1 不同年龄段不同周期子宫三层结构ADC 值
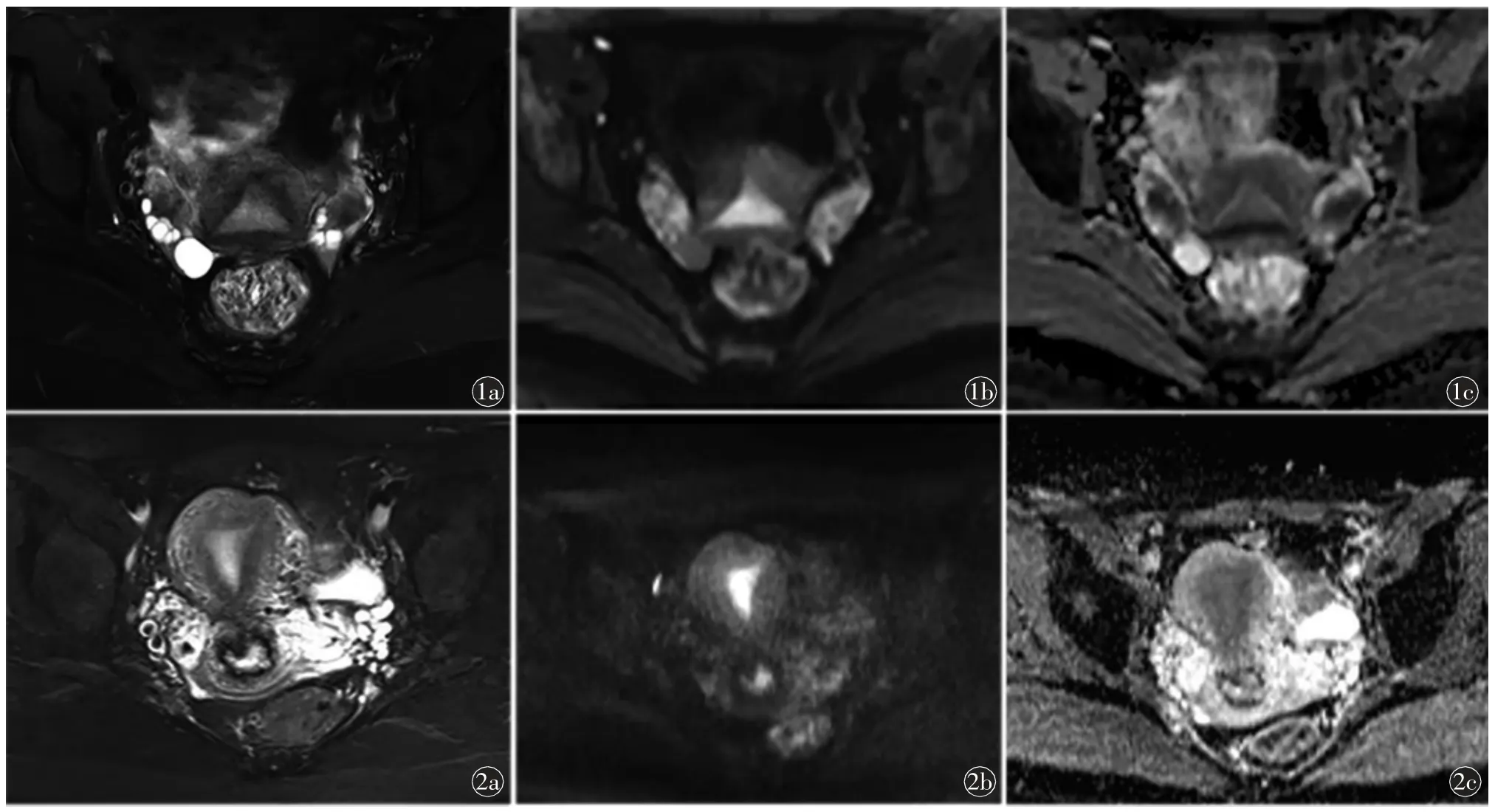
图1 女,26 岁,育龄期志愿者,排卵期MR 图像。a)T2WI 横断位,T2WI 信号强度为结合带低于外肌层低于内膜;b)DWI 横断位(b=1000 s/mm2),DWI 信号强度大小关系为结合带低于外肌层低于内膜;c)ADC 横断位,ADC 值大小关系为结合带低于内膜低于外肌层图2 女,39岁,育龄期志愿者,分泌中期MR 图像。a)T2WI 横断位,T2WI 信号强度为结合带低于外肌层低于内膜;b)DWI 横断位(b=1000 s/mm2),DWI信号强度大小关系为结合带低于外肌层低于内膜;c)ADC 横断位,ADC 值大小关系为结合带低于内膜低于外肌层
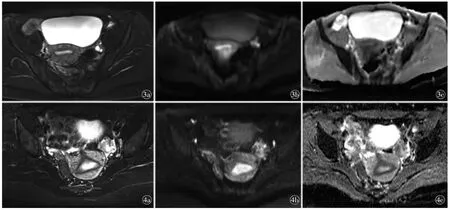
图3 女,44 岁,围绝经期志愿者,排卵期MR 图像。a)T2WI 横断位,T2WI 信号强度为结合带低于外肌层低于内膜;b)DWI 横断位(b=1000 s/mm2),DWI 信号强度大小关系为结合带低于外肌层低于内膜;c)ADC 横断位,ADC 值大小关系为结合带低于内膜低于外肌层图4 女,41岁,围绝经期志愿者,分泌中期MR 图像。a)T2WI 横断位,T2WI 信号强度为结合带低于外肌层低于内膜;b)DWI 横断位(b=1000 s/mm2),DWI 信号强度大小关系为结合带低于外肌层低于内膜;c)ADC 横断位,ADC 值大小关系为结合带低于内膜低于外肌层
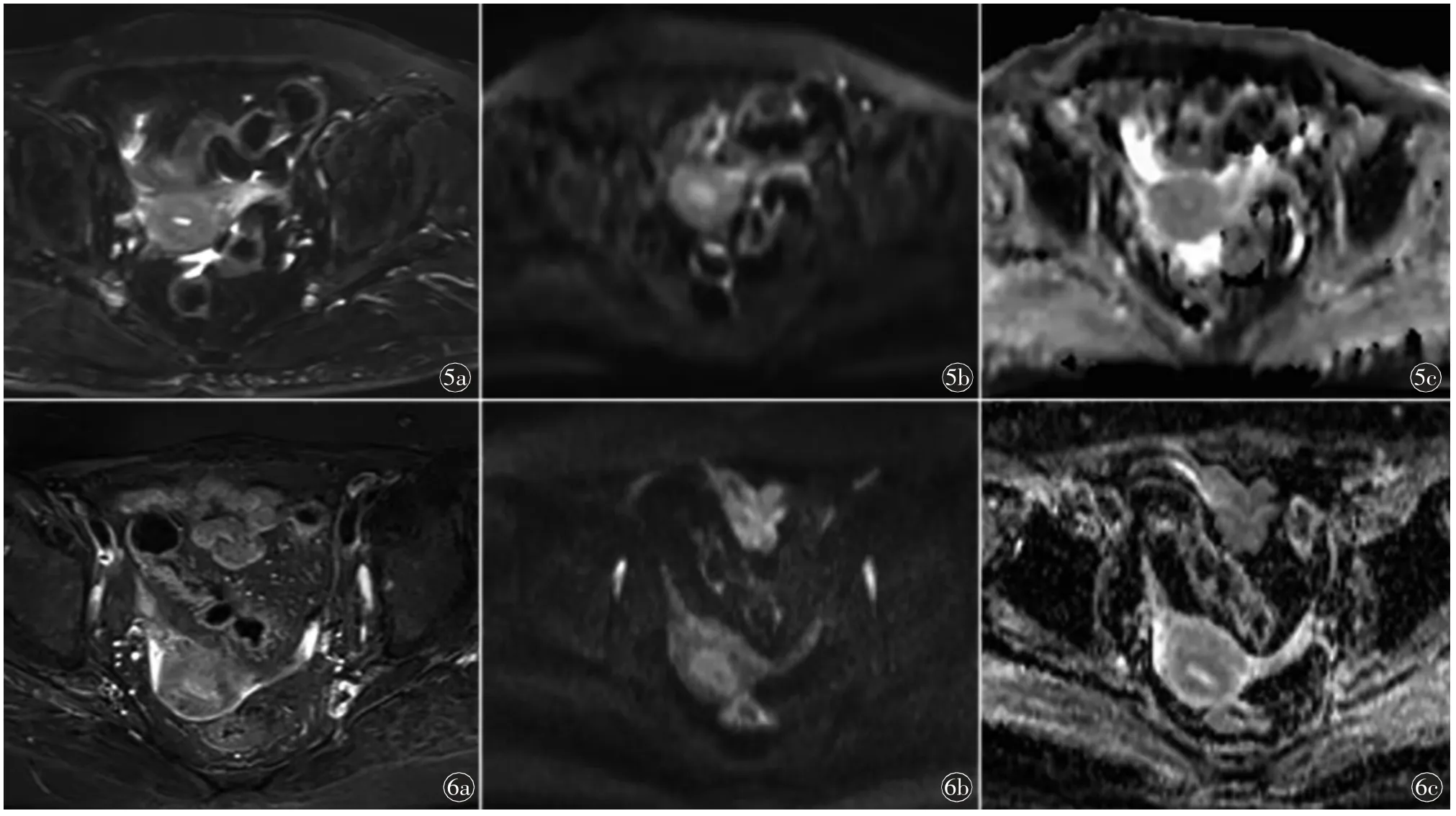
图5 女,63 岁,绝经期志愿者的MR 图像。a)T2WI 横断位,T2WI 信号强度为结合带低于外肌层低于内膜;b)DWI 横断位(b=1000 s/mm2),DWI 信号强度大小关系为结合带低于外肌层低于内膜;c)ADC 横断位,ADC 值大小关系为结合带低于内膜低于外肌层图6 女,75岁,绝经期志愿者的MR 图像。a)T2WI 横断位,T2WI 信号强度为结合带低于外肌层低于内膜;b)DWI 横断位(b=1000 s/mm2),DWI 信号强度大小关系为结合带低于外肌层低于内膜;c)ADC 横断位,ADC 值大小关系为结合带低于内膜低于外肌层。
1.子宫不同结构在同一年龄组同一周期的ADC 值差异
观察图像各年龄组子宫三层结构DWI 信号强度为结合带低于外肌层低于内膜。育龄期组在排卵期和分泌中期子宫各层结构两两比较ADC值差别均有统计学意义(P<0.05);围绝经期组在排卵期和分泌中期子宫各层结构两两比较ADC值差别均无统计学意义(P>0.05);绝经期组内膜与结合带、结合带与外肌层间ADC 值差别有统计学意义(P<0.05)(表2)。
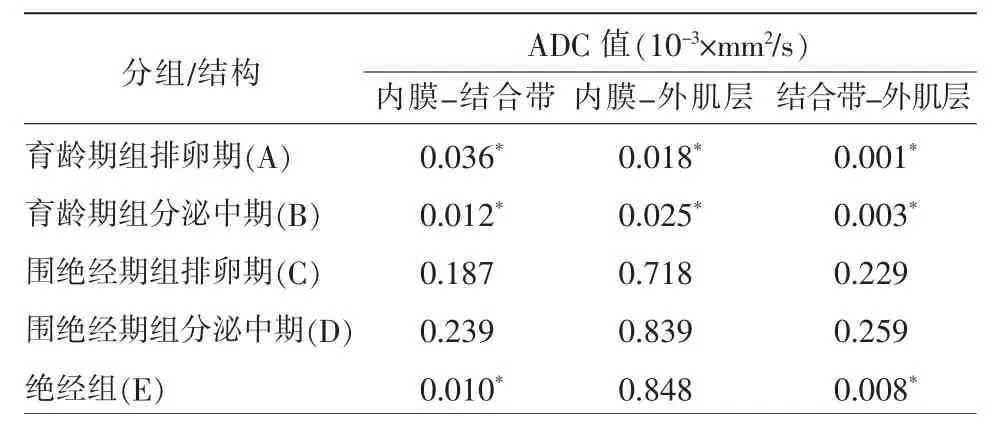
表2 子宫不同结构在同一年龄组同一周期的ADC 值比较
2.不同年龄组在同一周期同一子宫结构的ADC 值比较
育龄期组子宫内膜的DWI 信号强度高于围绝经期组,绝经期组的子宫内膜DWI 信号强度最低,而结合带与外肌层DWI 信号强度变化不明显。不同年龄组同一周期同一子宫结构的ADC 值比较见表3。育龄期组与围绝经期组比较,仅在排卵期两组内膜间ADC 值差异有统计学意义(P<0.05),围绝经期组排卵期的子宫内膜ADC 值高于育龄期组排卵期。
在育龄期组和围绝经期组,排卵期时内膜的DWI 信号强度稍高于分泌中期,而结合带与肌层的DWI 信号强度变化不明显。育龄期组排卵期内膜ADC 值低于分泌中期,差异有统计学意义(P<0.05),其余各组ADC 值无统计学差异(P>0.05)(表3)。
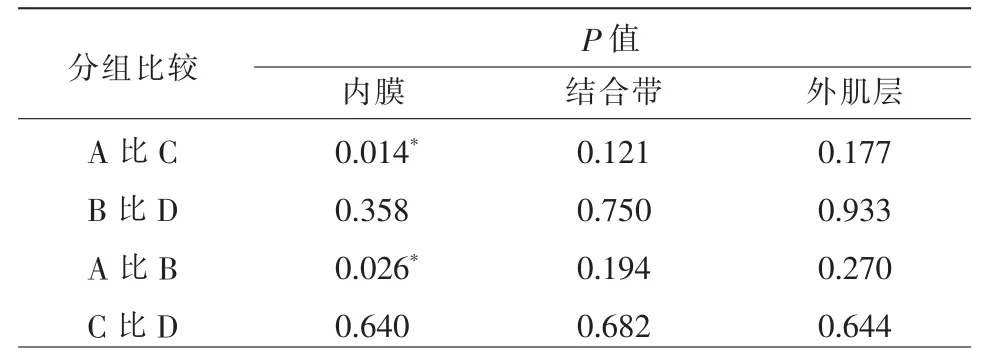
表3 不同年龄组同一周期同一子宫结构的ADC 值比较和不同月经周期同一年龄组同一子宫结构的ADC 值比较
讨论
本研究对志愿者进行了常规MRI 成像扫描,包括T1WI 横断位、T2WI 横断位、T2WI 压脂序列横断位及DWI 序列扫描,多方位成像,提供的信息量远大于超声检查。DWI 技术最早主要用于超急性脑梗死等中枢神经系统疾病的诊断,随着磁共振软件技术的提高,其在体部及盆腔的临床应用也越来越广泛[4,5],有助于疾病的发现、良恶性肿瘤的鉴别及预测和监控放化疗疗效[6-9]。但由于子宫有明显的分层结构,并且随着月经状态和年龄发生明显改变,故正常子宫的DWI 表现多样。
本研究显示:育龄期组在排卵期和分泌中期子宫不同结构间ADC 值两两比较差异明显,这与大多数研究相符[4,10,11]。而围绝经期组在排卵期和分泌中期子宫各层结构ADC 值两两比较均无统计学差异,与以往研究不符[3],这可能是由该研究者把年龄限制在40~49 岁,而本研究围绝经组女性年龄范围是40 岁以上仍有月经且月经仍规律的女性,样本差异造成了结果的不同,同时由于随着年龄的增长,人体内性激素分泌紊乱,子宫的各项功能开始减退,月经周期开始紊乱,月经量逐渐减少,提示年龄因素带来的激素水平的变化会对子宫结构的ADC 值产生影响[12]。本研究显示:绝经期组内膜与结合带、结合带与外肌层间ADC 值的差异有统计学意义,而内膜与外肌层间ADC 值差异无统计学意义。ADC 值的大小受到细胞密度、组织来源及微环境的影响[13],绝经期女性子宫失去了周期性改变,两侧卵巢卵泡耗竭,分泌雌激素功能停止,子宫体积明显缩小,内膜变薄甚至基本消失、腺体萎缩,细胞密度明显减低,所以内膜的水分子的扩散相对自由;但与此同时,子宫肌层平滑肌细胞萎缩,血管明显变细、变少,血供减少,使外肌层ADC 值降低,两方面因素使内膜与外肌层间ADC 值相差不大。结合带除了与肌层改变相同外,其肌细胞内还富细胞器成分,如线粒体、高尔基体、内质网等[14],导致结合带ADC 值降低更明显,所以其ADC 值明显低于内膜和外肌层。
本研究显示子宫三层结构中外肌层ADC 值最高,内膜其次,结合带最低。研究显示[15-17]:内膜固有层基质细胞、腺体、血管丰富,同时内膜的微环境比较复杂,首先子宫内膜间质细胞能产生使内膜基质粘稠的酸性黏多糖,其次内膜的上皮细胞内分泌很多粘附分子、酶类,这些因素使细胞、间质紧密,限制水分子的扩散,而外肌层富含血管,平滑肌肌束排列不紧密,细胞间隙所占百分比高,细胞间隙宽,水分子扩散不受限,所以子宫内膜的ADC 值低于外肌层。结合带有着紧凑的平滑肌束,含水量极低,肌细胞密度高,细胞核所占百分比增高,同时结合带的肌纤维排列方向相同,所以结合带内的水分子扩散受到明显限制,所以结合带的ADC 值最低。
本研究中育龄期组与围绝经期组仅在排卵期内膜间ADC 值差异有统计学意义,前者ADC 值低于后者。针对此项结果,可能是由女性的子宫组织学结构、激素状态及生理特点决定。Kido 等[18]的研究结果表明,育龄期女性的子宫内膜和结合带的ADC 值与月经周期的变化密切相关,这是因为子宫内膜和结合带共同由副中肾管分化而成,雌孕激素受体在结合带中的变化同内膜相同,均与月经周期密切相关。而围绝经期女性卵巢功能开始下降,激素的分泌开始紊乱,激素的分泌对内膜影响较结合带明显,使内膜的ADC 值增高,结合带和外肌层ADC 值改变并不明显。
本研究中育龄期组排卵期及分泌中期内膜间ADC 值差异有统计学意义。在排卵期,雌激素水平达到高峰,腺上皮间质细胞及血管上皮细胞明显增殖,胞质减少,胞核变大形似纺锤,使大量水分子的扩散受到细胞内外空间同时限制;至分泌中期,孕酮水平迅速升高,内膜腺体受间质蜕膜化影响停止生长,随后迅速萎缩并发局灶性坏死和水肿,从而扩大了细胞外空间,减少水分子扩散限制,使分泌中期水分子扩散度高于排卵期内膜,ADC 值高于排卵期,结合带与外肌层受影响不大,这与杨晶等[19]的研究结果不同。而本研究中围绝经期组排卵期及分泌中期内膜间ADC 值无明显差异,可能原因为年龄增大带来的雌孕激素水平的下降对内膜的影响较小,致使ADC 值变化不大。
综上所述,子宫的ADC 值在不同结构、不同年龄、不同月经周期有所不同。育龄期不同周期及绝经期妇女的子宫ADC 值大小为结合带小于内膜小于外肌层。围绝经期组排卵期内膜ADC 值高于育龄期排卵期,育龄期组排卵期内膜ADC 值低于分泌中期,围绝经期组子宫三层结构ADC 值差异不明显,当利用ADC 值分析子宫病变时应考虑这些因素的影响。
本研究尚有不足之处:首先,样本量较少,且b 值单一;其次,ADC 值的测量尽管重复了三次测量取平均值,但ROI 的选取人为因素影响较大,对结果可能造成一定的影响;再者,受个体差异的影响,本研究所得的DWI 及ADC 图像并非完全是标准的横断位图像,对ADC 值的测量也会有一定的影响。

