增强CT 纹理分析预测肝细胞癌病理分级的价值
张月 黄顺根 蒋震 盛茂 郭万亮
肝细胞癌(hepatocellular carcinoma,HCC)是常见恶性肿瘤之一,其发病率居全球第6 位,病死率居全球第3 位[1]。研究表明HCC 的组织学分化程度是术后复发的主要因素[2,3],HCC 低分化患者较中高分化患者术后复发率更高[4],不同分化程度的HCC 治疗方案不同。因此术前预测HCC 的病理分级对治疗方案的制定有重要意义。纹理分析可以定量分析医学图像中像素的局部特征、变化规律及分布情况,已被用于评估多种肿瘤(乳腺癌、肾癌、间质瘤等)的异质性、病理分级及肿瘤复发[5-7]。本研究对基于常规增强CT 的MaZda 纹理分析技术预测HCC 分化程度的可行性,以及最佳时期和纹理特征筛选方法进行了探讨。
资料与方法
1.研究对象
回顾性分析2017 年6 月~2021 年6 月间在苏州大学附属第二医院行增强CT 检查,并经外科根治性切除手术病理证实为HCC 的128 例患者的影像学资料。手术切除标本均经充分固定、石蜡包埋,切成5 μm 切片后行HE 染色。由两位拥有5年以上肝脏疾病诊断工作经验的病理医师,参照Edmondson-Steiner 分级准则[8],将HCC 病理结果分为Ⅰ~Ⅳ级,并达成一致。共纳入:Ⅰ级10 例、Ⅱ级58 例、Ⅲ级54 例、Ⅳ级6 例,分为低级别组(Ⅰ级和Ⅱ级)和高级别组(Ⅲ级和Ⅳ级)。纳入标准:(1)经手术病理确诊且病理分级明确;(2)CT 检查前未接受过任何相关临床治疗(如介入、穿刺活检和放化疗);(3)病灶为单发且直径大于1 cm;(4)手术与CT 增强检查间隔不超过1 个月。排除标准:(1)病灶为复发或肝内转移;(2)门静脉及下腔静脉癌栓形成;(3)CT 图像不完整,质量不佳。
2.仪器与方法
所有患者均采用GE 64 排螺旋CT(Discovery CT 750 HD)行腹部增强扫描。扫描参数:准直器宽64×0.625 mm,管电压120 kV,自动毫安技术,层厚5.0 mm,层间距5.0 mm。先行平扫,增强扫描使用双筒高压注射器(Urich)自肘静脉注射对比剂碘佛醇(320 mg I/ml),剂量为1.5 ml/kg,注射流率3 ml/s,对比剂注射完毕后使用相同流率注射20 ml生理盐水进行冲管。使用自动触发技术(阈值为120 HU,监测点置于腹腔干开口层面)获得动脉期,随后65 s 和180 s 获得门脉期和延迟期图像。
3.纹理分析
将所有患者0.625 mm 薄层图像从PACS 系统以DICOM 格式导出,导出前统一窗宽350 HU,窗位50 HU。由一名低年资腹部放射科医师将3 期增强图像导入MaZda 软件(Version 4.8)进行纹理分析。选择病灶显示最清晰的时期,在肿瘤最大层面手动勾画ROI,沿病灶边缘内移1~2 mm 以避免部分容积效应,然后复制ROI 至其他时期,不吻合的部分进行调整(图1),为真实反映肿瘤异质性,绘制ROI 时,包含肿瘤内部的坏死囊变、破裂出血、血管及钙化部分。由一名高年资腹部放射科医师进行复审。每个ROI 可提取出6 组共279 个纹理特征(表1)。

表1 MaZda 软件提取的纹理特征
使用MaZda 软件对HCC 的纹理特征进行筛选:分别使用Fisher 相关系数(fisher coefficient,Fisher)、分类错误率联合平均相关系数(classification error probability and average correlation coefficients,POE+ACC)、互信系数(mutual information coefficient,MI)及上述3 种方法联合(Fisher+POE+ACC+MI,FPM)4 种统计学筛选方法。前3 种方法分别筛选出10 个,FPM 筛选出30 个纹理特征。
分类准确性判定:使用MaZda 软件自带的B11 统计软件(Version 4.8)对筛选出的纹理特征进行病变分类:分类方法包括原始数据分析(raw data analysis,RDA)、主成分分析(principal component analysis,PCA)、线性鉴别分析(linear discriminant analysis,LDA)和非线性鉴别分析(nonlinear discriminant analysis,NDA)。分类结果以误判率R 表示,分为5 个等级:≤10%为优秀,10%<R≤20%为良好,20%<R≤30%为中等,30%<R≤40%为一般,>40%为较差。

4.统计学方法
HCC 纹理特征的筛选及分类使用MaZda 软件及自带B11 软件完成;使用SPSS 软件(Version 25.0)比较两组间获得最小误判率纹理特征的统计学差异,符合正态性及方差齐性的纹理特征使用独立样本t 检验,反之使用曼尼U 检验。使用二元Logistic 回归模型进一步降维筛选出最佳纹理特征;采用受试者工作特征(receiver operator characteristic,ROC)曲线评估最佳纹理特征及回归模型预测HCC 病理分级的效能。P<0.05 为差异有统计学意义。
结果
增强扫描不同时期、不同纹理特征筛选方法及不同分类方法相结合鉴别HCC 高、低级别组的误判率总结见表2。增强扫描3 个时期,使用FPM筛选法联合NDA 分类法获得的误判率均较其他联合方法低,动脉期最小误判率为10.94%(14/128),门脉期最小误判率为3.13%(4/128),延迟期最小误判率为7.81%(10/128),均处于良好等级以上。
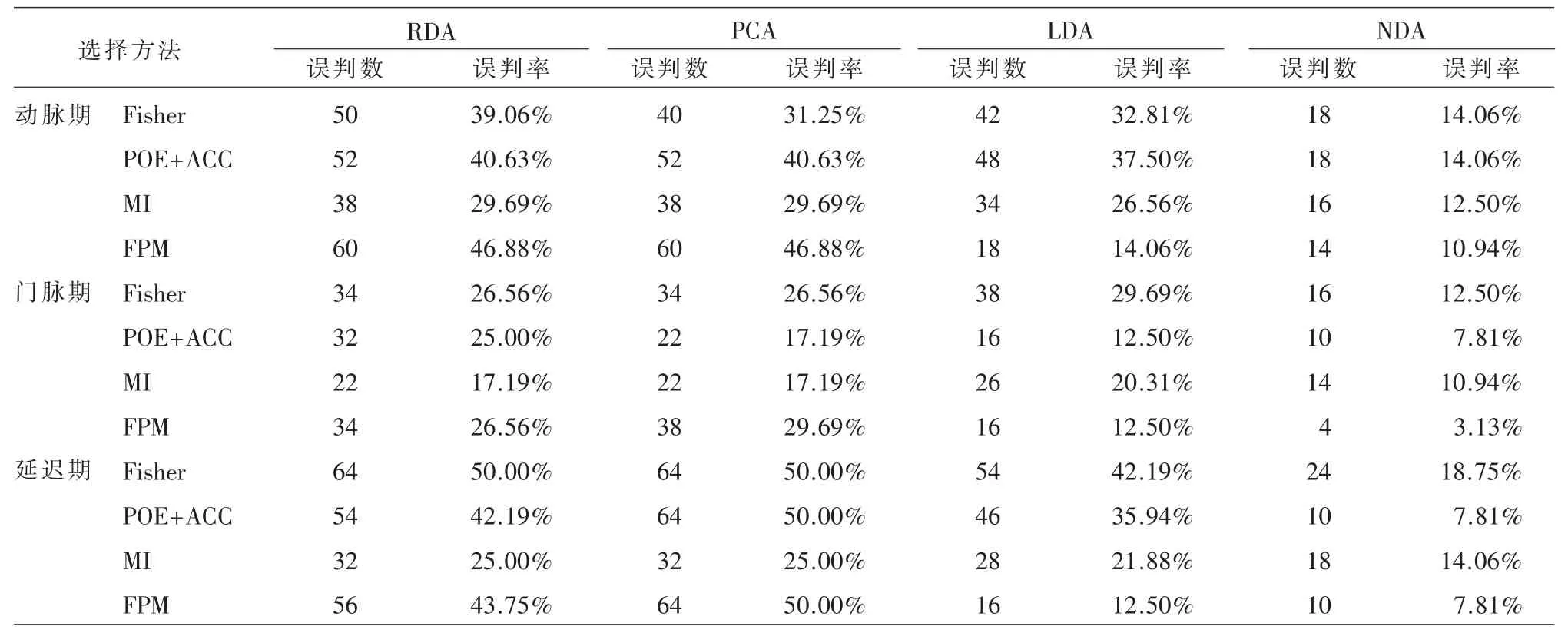
表2 不同增强时期及不同筛选、分类方法相组合产生的误判率结果
比较门脉期经FPM 筛选出的30 个纹理特征,其中23 个纹理特征有统计学差异,纳入二元Logistic回归模型进一步降维筛选出3 个最佳的纹理特征,分别为Perc.99、S(3,-3)Contrast 及WavEnLL_s-3。Perc.99、S(3,-3)Contrast 及WavEnLL_s-3 在HCC高级别组均低于低级别组(高级别组比低级别组分别为185.83±14.38 比204.63±16.74,10.73±4.80比24.62±18.08,23778.71±4236.25 比28605.72±4212.81)。表3 总结了最佳纹理特征及Logistic 模型鉴别HCC 高、低级别组的诊断效能,其中以Logistic 模型诊断效能最高。图2 显示出3 个最佳纹理特征及Logistic 模型的ROC 曲线的比较。
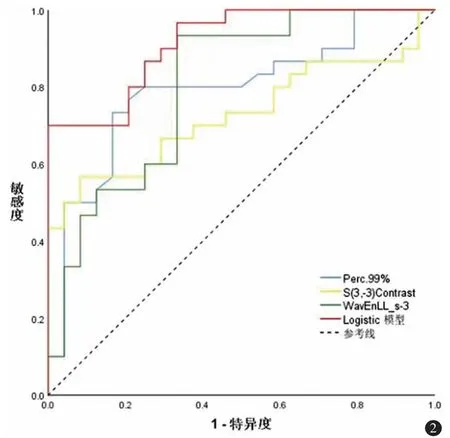
图2 最佳纹理特征及Logistic 模型的ROC 曲线下面积比较
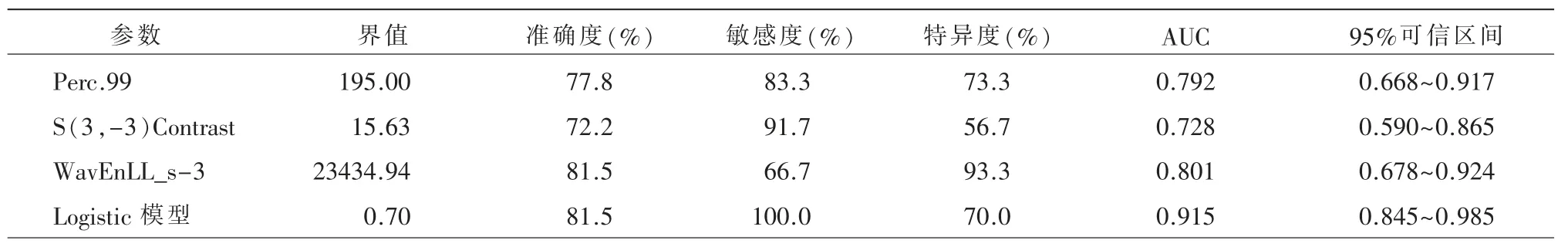
表3 最佳纹理特征及Logistic 模型鉴别HCC 高、低级别组的诊断效能
讨论
手术切除是目前治疗HCC 最有效的措施之一,近年来外科技术飞速发展,但术后复发率仍然较高,术后5 年复发率高达70%[9]。由于HCC 的组织学分化程度影响治疗方案的制定,因此术前预测HCC 分级有重要价值。穿刺活检是术前诊断HCC 病理分级的金标准,然而穿刺活检具有一定的创伤性,操作不慎时易出现一些并发症;另外穿刺活检只是对所提取的小部分标本进行分析,无法避免取样误差,易忽略肿瘤组织间异质性,存在一定的局限性[10]。腹部增强CT 可提供肿瘤大小、数目、形态、部位、边界、血供情况、有无癌栓及转移等手术所需信息,已经成为HCC患者术前常规检查。纹理分析通过分析已有的腹部增强CT 图像,不需要对患者进行额外的处理,亦不会额外增加患者的经济及身体负担,已被应用于肝脏纤维化[11,12]、肝脏肿瘤的诊断及鉴别诊断[13]、HCC 术后疗效评估[14]等方面。本研究结果显示基于常规增强CT 的MaZda 纹理分析技术可预测HCC 的组织分化程度。
1.不同增强时相与纹理特征筛选方法组合的比较
应用MaZda 软件进行纹理特征提取、筛选和降维,不同增强时期使用相同的筛选、分类方法产生的误判率结果不同。本研究中门脉期误判率最低,其次为延迟期,再次为动脉期。原因可能为:HCC 的形成过程伴随着血流动力学改变,研究发现Edmondson-Steiner 病理分级Ⅰ、Ⅱ级主要由肝动脉及门静脉供血,而Ⅲ、Ⅳ级则仅由肝动脉供血[15]。因此HCC 低级别组门脉期及延迟期肿瘤的相对强化程度要高于高级别组;此外,由于HCC高级别组囊变、坏死更常见,门脉期及延迟期HCC实性成分与囊变坏死成分对比更强,因此纹理特征参数值之间的差异相应增大,使其诊断效能相对较高。
相同的增强时期与不同筛选、分类方法相组合产生的误判率结果亦不同,使用FPM 筛选出的30 个纹理特征经NDA 进行分类,可以获得最低的误判率,与以往乳腺良恶性病变的鉴别、脑胶质母细胞瘤和单发转移瘤的鉴别研究中所得结论一致[16,17]。Fisher、POE 联合ACC、MI 筛选方法分别获得10 个最佳纹理特征,而FPM 是这三者的联合,能够提供更多纹理特征,可以反映更多的肿瘤信息。与RDA、PCA、LDA 三种分类方法比较,NDA分类法通过选择使用合适的支持向量机,把非线性、不可分离数据转化成三维空间分布的、可分离的线性数据。使用不同的内积核函数可以产生不同的支持向量机。常见的4 类核函数包括:线性核函数、多项式核函数、径向基核函数和Sigmoid 核函数。MaZda 软件中的Sigmoid 核函数,可以更好地将非线性的、不可分离的数据转换成线性的、可分离的数据,而其他特征分类法是线性变换,在将非线性数据转换为线性数据方面具有局限性[18]。因此,FPM 结合NDA 可以获得最低误判率。
2.二元Logistic 回归模型分析
门脉期筛选出的30 个纹理特征中23 个有统计学差异,纳入二元Logistic 回归模型进一步降维筛选出3 个最佳纹理特征,分别为Perc.99、S(3,-3)Contrast 及WavEnLL_s-3。Perc.99 指的是从直方图左边开始,在小于第99%体素区间内的平均灰度值,与病变的异质性相关,可以反映病变的细微变化。研究表明病变异质性越大,高百分位数差异越大[19];Contrast 是指图像中亮像素与暗像素之间差异的大小,差异越大,肿瘤异质性越高。门脉期肿瘤实性成分强化最明显,与不强化的囊变坏死成分对比度差异较大;WavEnLL_S_3 是指LL 子采样因素中小波系数的能量,也可反映肿瘤的异质性。本研究显示Perc.99、S(3,-3)Contrast 及WavEnLL_s-3 在HCC 高级别组均较低级别组小,原因可能是HCC 的组织学分化与血供程度相关,门脉期HCC 高级别组实性成分强化低于低级别组,且高级别组坏死、囊变更多见,肿瘤内部异质性更大[20]。表2 显示与单个最佳纹理特征的诊断效能相比,Logistic 回归模型的诊断效能更高,这表明应该整合多维影像组学特征来选择有价值的特征进行建模。
3.局限性
首先,本研究仅使用产生最小误判率的门脉期图像纹理特征进行了研究,将平扫及增强扫描三期图像纹理特征进行筛选建模可能会获得更高的诊断效能。此外,研究表明一些形态学特征可在一定程度上预测组织学分化程度。例如,Chang等[21]研究表明HCC 的分化程度随肿瘤大小的增加而降低;刘志强等[22]研究表明肿瘤范围越大、边缘清楚、有肿瘤内出血坏死、有侵袭转移者,肿瘤分级越高。其次,本研究为单中心,入组样本量较少,未对构建模型进行验证,也未比较不同机器及扫描方案可能产生的影响。最后,本研究基于肿瘤最大层面提取纹理特征,相较于肿瘤全体积分析,不能完全反映整个病灶的全部信息。
综上所述,基于增强CT 的MaZda 纹理分析技术能够预测肝细胞癌的分化程度;不同的增强时期及不同的筛选分类方法相组合会产生不同的预测效能,其中以门脉期联合FPM 及NDA 为佳。门脉期联合FPM 获得的纹理特征经过Logistic 回归建模,模型诊断效能较高。

