树突状细胞与嗜酸性粒细胞在难治性鼻窦炎中的相关性研究
曾银萍,牟忠林,丁 顺,罗志飞
(海南医学院第一附属医院1.耳鼻咽喉头颈外科,2.病理科,海南 海口 570102)
难治性鼻窦炎(refractory rhinosinusitis,RRS)临床治疗效果难以令人满意,根本原因还在于发病机制不明确,不能对因治疗。大多数学者认为免疫功能缺陷是难治性鼻窦炎患者手术疗效不佳及导致难治的潜在原因之一[1],树突状细胞(dendritic cell,DC)是目前已知功能最强的抗原呈递细胞,是机体免疫应答的始动者,尤其在鼻息肉发生、发展机制中的作用成为近年来的研究热点。树突状细胞可通过一系列的细胞及体液免疫机制导致嗜酸性粒细胞(eosinophil,EOS)的浸润增多[2],而EOS也 可 以 诱 导 树 突 状 细 胞 的 成 熟[3],目 前,CD83、CD11c、S100 与CD1a 一起被认为是成熟DC 的膜标记分子[4-6],也是鉴定DC 的主要的标记物。难治性鼻窦炎的特征之一是EOS 浸润增多[7]。笔者应用免疫组化和免疫荧光双标记法,通过检测难治性鼻窦炎患者鼻窦黏膜中成熟树突状细胞CD83 和CD11c 表达情况,分析其与EOS 浸润增多的相关性,对难治性鼻窦炎发病机制进行探讨。
1 资料与方法
1.1 研究对象
选取2018 年1 月~ 2019 年12 月在我院耳鼻咽喉-头颈外科住院行鼻内窥镜手术治疗的慢性鼻窦炎患者,共90 例,入组患者术前均完善鼻内窥镜和鼻窦三维CT 检查,排除哮喘、结核、肝炎、高血压及糖尿病等内外科严重疾病或恶性肿瘤疾病,术前1个月内未使用过抗组胺药、糖皮质激素及免疫抑制剂药物治疗,手术统一由我科具有丰富鼻内镜技术经验的高级职称医师完成。按如下标准筛选符合本实验标准的患者,并分组登记。难治组:RRS 患者要求:(1)合理的药物治疗未获得理想疗效,同时接受过1 次或1 次以上的鼻内镜手术;(2)在手术前后接受了规范的围手术期治疗与鼻腔护理;(3)接受了3 个月及以上的术后规范性药物治疗;(4)半年及以上的随访结果显示上述体征与症状仍迁延不愈者,共30 例,男性12 例,女性18 例,年龄34~57岁,平均年龄(42.17±5.75)岁。初治组:慢性鼻窦炎(chronic rhinosinusitis,CRS)患者要求:(1)通过药物及手术综合治疗后患者临床症状明显改善或痊愈;(2)术后的患者复查VAS 评分不得大于3 分;(3)术后单侧鼻腔鼻内镜Lund-Kennedey 评分不得大于3 分;(4)手术复查者鼻腔通畅,鼻窦开放良好,鼻腔黏膜无水肿,鼻腔无或仅有少量异常分泌物,共30 例,男性17 例,女性13 例,年龄18~63 岁,平均年龄(40.03±9.81)岁。对照组:无明显鼻部炎症症状,鼻内镜及CT 检查均未发现鼻息肉或炎症病变的单纯性鼻中隔偏曲病人,共30 例,男性21 例,女性9 例,年龄16~54 岁,平均年龄(39.50±7.18)岁。经检验各组间男女比例及年龄差异均无统计学意义(P>0.05)。
1.2 方法
1.2.1 标本采集 难治组和初治组取患者的病变鼻窦黏膜组织,对照组则取患者的鼻中隔黏膜组织。每份组织标本均放入10%多聚甲醛溶液中固定,然后再石蜡包埋保存,用于进一步的苏木精-伊红(Hematoxylin-eosin,H-E)染色、免疫组化(Immu‐nohistochemistry,IHC)、免疫荧光双标记实验。
1.2.2 免疫组化检测各组CD83 和CD11c 表达步骤 以同一标本两张连续切片,分别监测;各组切片常规脱蜡,热修复抗原,滴加5%BSA 封闭液,分别加入适当稀释的一抗,分别为CD83(1∶200)和CD11c(1∶250),于4 ℃孵育过夜,加生物素化山羊抗兔IgG(稀释浓度:1∶100)及SABC 试剂(稀释浓度:1∶100),行DAB 显色,接着苏木素轻度复染,然后酒精逐级梯度脱水,使用二甲苯进行透明,迅速滴加中性树胶封片,在显微镜下观察。采用LEICA成像系统对CD83 和CD11c 的免疫组化结果进行定位、定量观察,对比各组患者鼻窦或鼻黏膜组织中成熟DC 细胞标志物CD83 和CD11c 的表达情况。
1.2.3 H-E 染色检测各组EOS 浸润步骤 固定后的各组切片组织行常规H-E 染色,先行二甲苯脱蜡,使用梯度乙醇固定,苏木素着色大约5~10 min,稀氨水(1%)返蓝,伊红着色1~5min,各梯度乙醇脱水,予以二甲苯透明,迅速滴加中性树胶,加盖玻片封片,在显微镜下观察并拍照。采用LEICA 成像系统对EOS 的H-E 染色结果进行定位、定量观察,对比各组患者鼻窦或鼻黏膜组织中EOS 的浸润情况。
1.2.4 免疫荧光双标记检测步骤 石蜡切片脱蜡至水,使用梯度乙醇固定,再将切片放入盛满EDTA 抗原修复缓冲液(pH 8.0)的修复盒中,在微波炉内进行抗原修复,画圈自发荧光淬灭,在圈内滴加BSA 孵育30 min,然后血清封闭,加一抗,切片平放于湿盒内4 °C 孵育过夜后,再将玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3 次,每次5 min,在圈内滴加与一抗相应种属的二抗覆盖组织,避光室温孵育50 min。玻片再次PBS 洗涤3 次后,在圈内滴加DAPI 染液复染细胞核,避光室温孵育10 min,再次脱色洗涤,用抗荧光淬灭封片剂封片,切片在荧光显微镜下反复观察,最后采集图像。
1.3 结果判定
1.3.1 CD83 和CD11c 的免疫组化表达判定 组织切片先于低倍镜视野(×100)下确定5 个阳性细胞表达多的区域,阳性细胞的统一标准是棕黄色或黄色细胞,蓝色细胞核为总细胞,然后在高倍镜视野(×400)下拍照,应用Image-proplus 6.0 软件对每张照片进行分析得出阳性细胞百分比即为阳性率(%)。
1.3.2 EOS 细胞计数 先于低倍镜视野(×100)下确定5 个阳性细胞表达多的区域,再在高倍镜视野(×400)下计数。
1.3.3 免疫荧光共表达测定判定 在低倍镜视野(×100)确定出5 个CD11c 及CD83 共标记高表达部位,接着借助高倍镜视野(×400)采集图像,再借助图像分析软件Image-proplus 6.0,对每张照片进行分析得出阳性细胞百分比即为阳性率(%),多个视野均值作为该切片的终值。
1.4 统计学处理
使用SPSS 19.0 统计软件,数值变量均采用均数±标准差(xˉ±s)表示,计量资料均进行正态性检验,以单因素方差分析进行多组间差异统计,采用Pearson 相关性检验测各组CD83 和CD11c 共表达与EOS 细胞浸润的相关性,均以P<0.05 为差异具有统计学意义。
2 结果
2.1 CD83 及CD11c 表达情况及各组间差异统计学分析
经过免疫组化处理,CD83 及CD11c 标记阳性的细胞多为黄色、棕色或棕黄色,呈圆形或者椭圆形,对照组鼻中隔黏膜组织中仅可见少量的CD83和CD11c 阳性细胞,难治组中CD83 及CD11c 阳性细胞主要位于上皮层和固有层,并呈散在分布,数目明显多于初治组和对照组,见图1、图2、表1。将表1 中难治组、初治组和对照组免疫组化标记CD83及CD11c 阳性的表达情况进行单因素方差分析比较,据统计学结果显示难治组、初治组较对照组差异均有统计学意义(P<0.05);难治组和初治组两组间CD83 及CD11c 的表达阳性率占比差异也有统计学意义(P<0.05),这说明难治性鼻窦炎患者较非难治性鼻窦炎患者中鼻黏膜的树突状细胞数目是存在差异的。
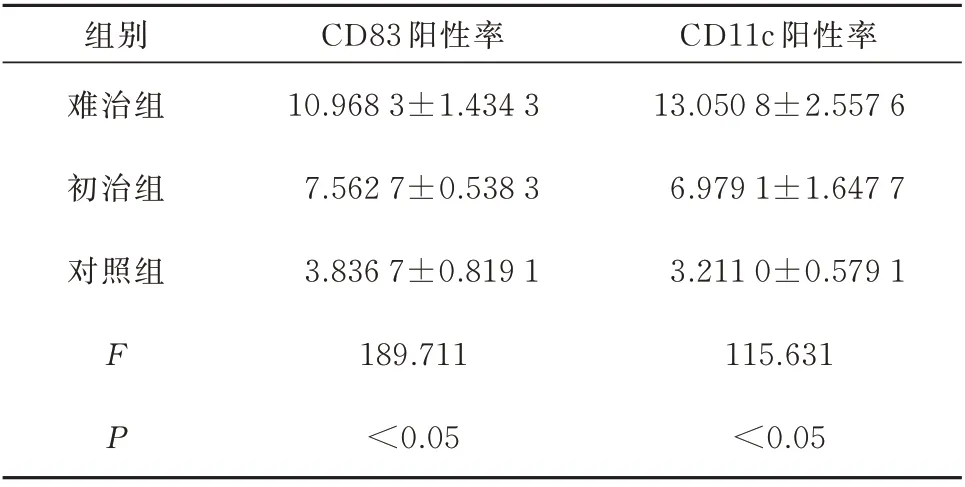
表1 各组CD83 和CD11c 的表达情况(n=30,%,xˉ±s)Tab 1 Expression of CD83 and CD11c in each group(n=30,%,xˉ±s)
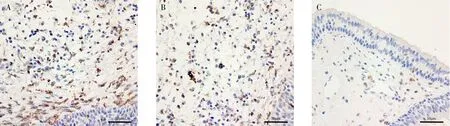
图1 各组CD83 免疫组化图像(标尺为50 μm)Fig 1 Immunohistochemical images of CD83 in each group(The scale is 50 μm)
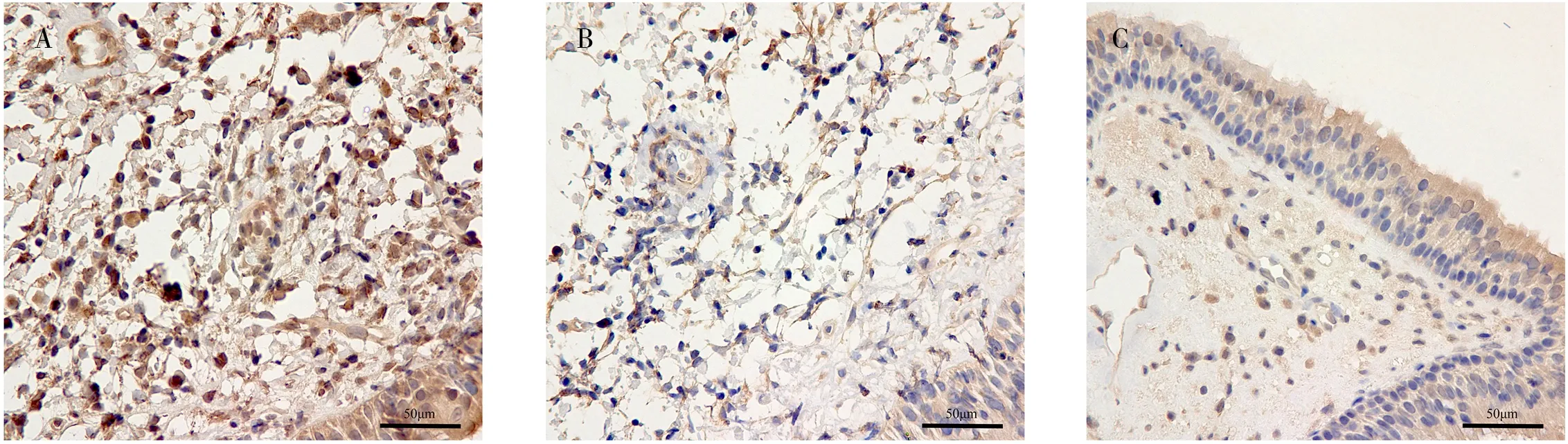
图2 各组CD11c 免疫组化图像(标尺为50 μm)Fig 2 Immunohistochemical images of CD11c in each group(The scale is 50 μm)
2.2 免疫荧光下各组CD83 和CD11c 在成熟DC 上共表达及各组间差异分析
CD83 和CD11c 均可作为成熟DC 表面标记分子,两者共定位更能说明成熟DC 在RRS 中高表达。因此,本研究将CD83 和CD11c 共同标记,探究CD83 和CD11c 共 定 位 的DC 在RRS 中 的 表 达 情况。红色代表CD83,绿色代表CD11c,核染呈蓝色,共同标记DC 时叠加为橘红色。发现初治组、对照组、难治组中CD83 及CD11c 共定位的DC 差异有统计学意义(P<0.05),见表2。各组的免疫荧光图像,见图3。
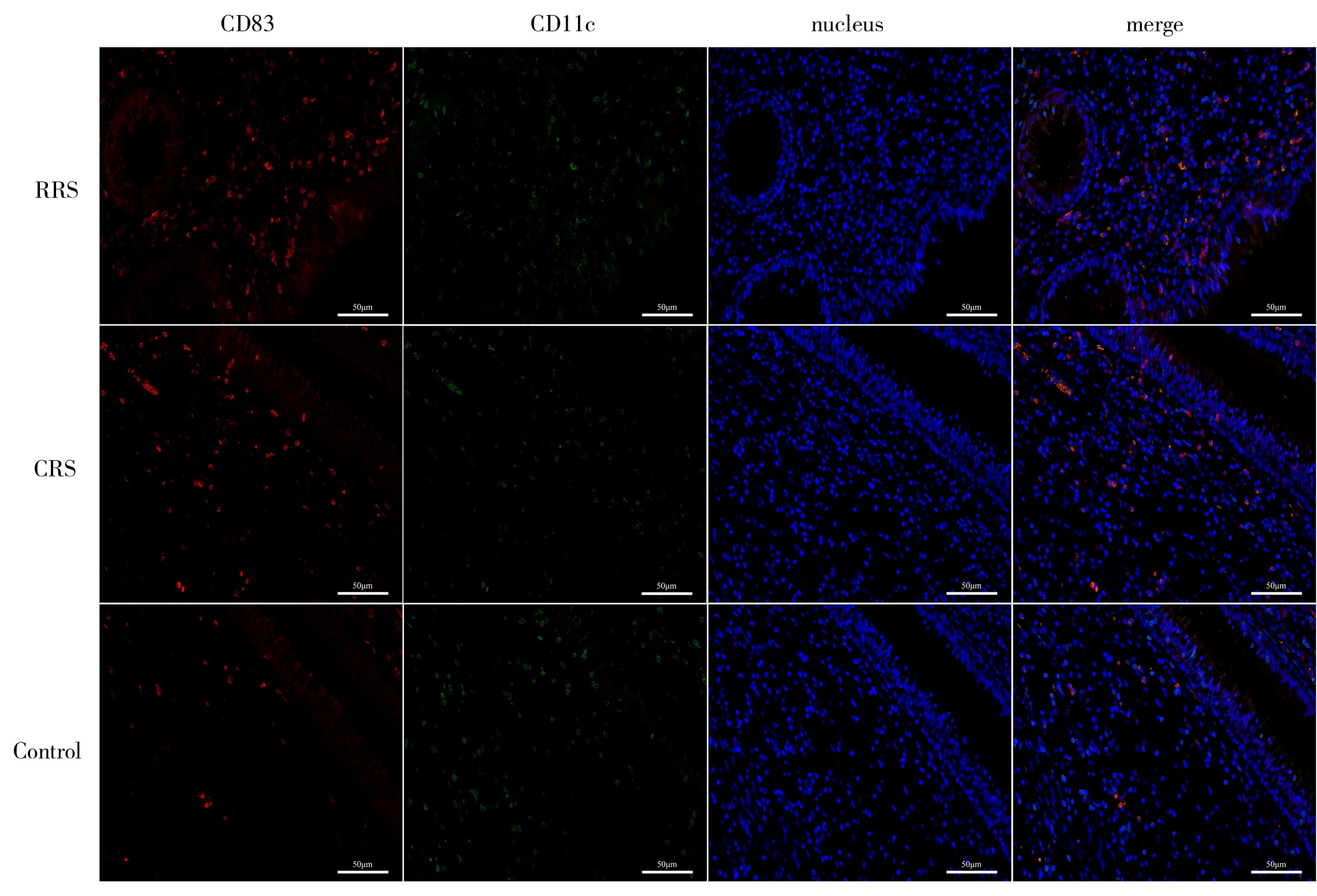
图3 各组免疫荧光图像(标尺为50 μm)Fig 3 Immunofluorescence images in each group(The scale is 50 μm)

表2 各组CD83 和CD11c 的共表达情况(n=30,%,xˉ±s)Tab 2 Co-expression of CD83 and CD11c in each group(n=30,%,xˉ±s)
2.3 EOS 浸润情况及各组间差异统计学分析
显微镜下可见EOS 主要以细胞核2~3 分叶,其特征可见胞浆为鲜红色颗粒。主要存在于上皮层及间质层中,难治组和初治组的组织切片内EOS 浸润数较对照组均明显增多。对照组正常的鼻中隔黏膜上皮细胞整齐,基膜无明显增厚,间质无水肿,EOS 浸润较少;初治组上皮下为水肿的疏松结缔组织,腺体增生,间质内有浸润的炎症细胞,可见些许EOS;而难治组上皮细胞排列紊乱、脱落、断裂,腺体较多增生,基膜明显增厚,EOS 浸润明显增多,见图4。将表3 中各组结果进行单因素方差分析,难治组、初治组两组患者的鼻黏膜组织EOS 浸润数高于对照组,3 组间差异具有统计学意义(P<0.05);难治组中的鼻黏膜组织EOS 计数高于初治组。
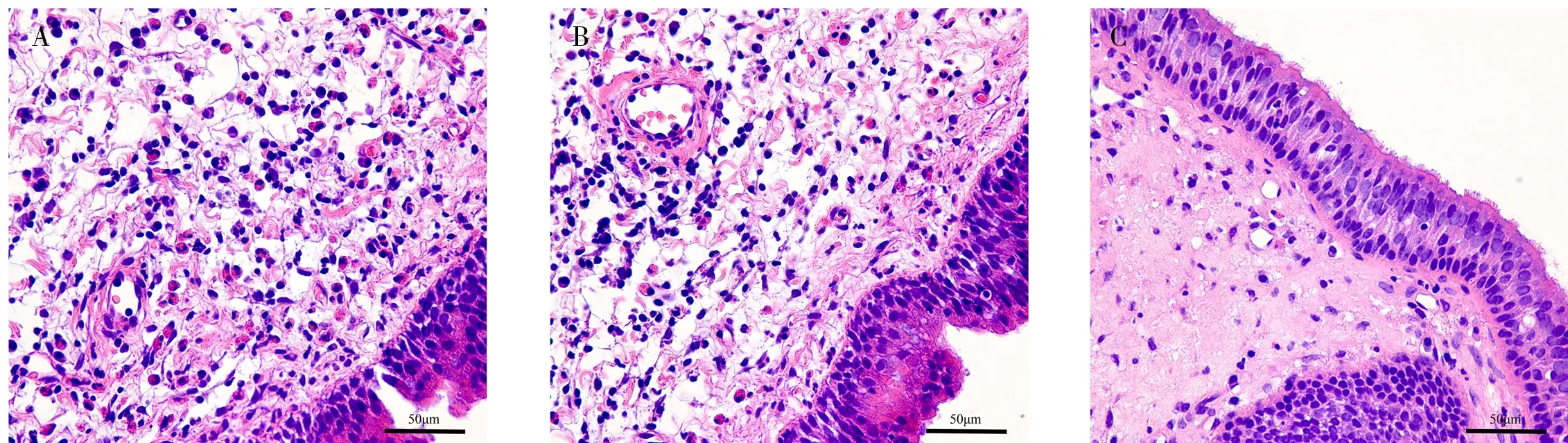
图4 各组EOS 浸润图像(标尺为50 μm)Fig 4 EOS infiltrating images in each group(The scale is 50 μm)
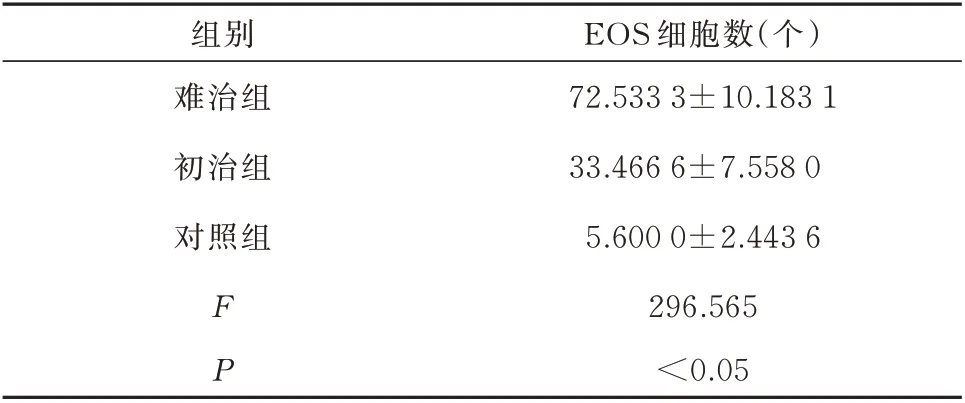
表3 各组EOS 的浸润情况(n=30,xˉ±s)Tab 3 EOS infiltration in each group(n=30,xˉ±s)
2.4 各组CD83 及CD11c 共表达与EOS 浸润的相关性分析
经免疫荧光检测CD83 及CD11c 在各组鼻黏膜组织共表达水平,与各组中EOS 浸润情况,对各组样本检测指标进行散点图预测分析呈线性趋势,通过Pearson 相关性分析,结果见表4,各组CD83 及CD11c 共表达与EOS 浸润间均呈正相关关系。
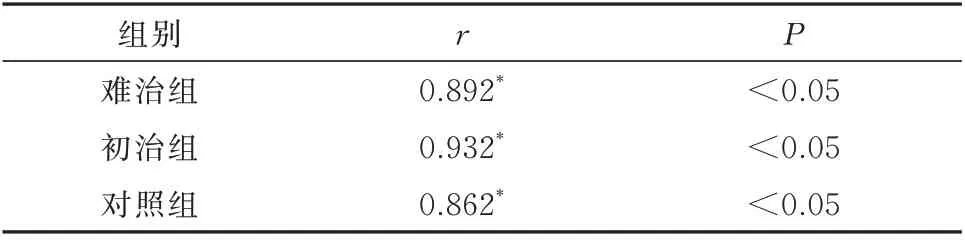
表4 CD83 及CD11c 共表达与EOS 表达的相关性(n=30)Tab 4 Correlation between CD83 and CD11c co-expres⁃sion and EOS expression(n=30)
3 讨论
随着医学的进步和发展,绝大多数CRS 患者经过系统的药物和手术治疗后,均能得到较好的预后,然而有资料表明超过15%的CRS 患者经综合治疗后仍会有持续不愈的临床症状以及术后复发等问题,称为难治性鼻窦炎[8]。早在2001 年Wrees‐mann 等[9]首次提出RRS 是继发于药物和手术治疗之后,炎症仍然长期迁延存在持续不愈的鼻窦炎,并 阐 述 了 可 能 的 发 病 机 制,并 由Desrosiers[10]在2004 年从病理生理学的角度进行了阐述,2012 年欧洲鼻-鼻窦炎鼻息肉诊疗指南又将RRS 正式定义为Difficult-to-treat rhinosinusitis,简 称 为DTRS[11]。2013 年韩德民[12]结合前人的治疗经验,首次在我国阐述RRS 的相关内容,对其定义、可能的发病机制、诊断和治疗理念做了系统的研究论述。2018 年中国慢性鼻窦炎诊断和治疗指南肯定了RRS 与DTRS 两种描述,但也指出其临床定义及诊断标准尚未达成共识。然而由于RRS 的病因和发病机制至今仍未完全阐明,临床治疗一直缺乏针对性,治疗效果仍难令人满意。
RRS 是一种复杂的、多因素作用引起的炎性疾病,目前研究表明EOS 的浸润参与了难治性鼻窦炎的发病机制中,是多因素共同作用的其中重要一环[13]。EOS 具有致炎和细胞毒作用,是变应性鼻炎的一个重要临床指标,多见于变态反应性疾病[14],且在鼻息肉形成和生长过程中起重要作用[15,16]。在鼻窦炎患者中,EOS 的局部活化和脱颗粒,一方面释放二磷酸亚甲基和嗜酸细胞阳离子蛋白等碱性蛋白,导致局部上皮的损伤;另一方面产生如血小板活化因子等炎症介质,作用于血管的介质,导致黏膜水肿;此外它还可以使细胞因子活化,刺激上皮增生和化生,新生血管形成从而导致息肉的发生和发展。难治性鼻窦炎患者,术后鼻窦内可见黏膜水肿、黏液脓性分泌物、囊泡、息肉及迁延不愈的慢性炎性持续存在,与EOS 浸润的增多密切相关[17-19]。本研究结果难治组中病变黏膜内EOS 数目较初治组和对照组明显浸润增多,与前述研究结果相同,再次验证了EOS 浸润参与了难治性鼻窦炎发生、发展过程。
日本学者Yoshimi 发现鼻腔正常黏膜中存在少量朗格罕细胞,绝大部分为树突状细胞(dendritic cell,DC),其在鼻炎患者的鼻黏膜中发现朗格罕细胞的数量明显增多[20]。这一发现足以证明DC 为主的朗格罕细胞参与了鼻腔炎症性疾病的发生和发展。DC 的特点是能够刺激初始型T 细胞(naive T cell)增殖,是机体免疫应答的始动者,在调节T 细胞分化方向中起主要作用,为目前发现功能最强的抗原呈递细胞。DC 诱导的免疫耐受与其未成熟或半成熟状态密切相关,成熟的DC 主要诱导免疫激活,正常情况下体内大多数DC 处于非成熟状态,当成熟DC 缺乏时,非成熟DC 可导致T 细胞阴性选择,从而诱导抗原特异性耐受[21]。所以,DC 成熟状态不同与免疫反应类型和程度有密切关系,既能诱导免疫激活反应,又能诱导免疫耐受,在炎症性疾病的免疫调节过程中发挥重要的作用。成熟DC 表面可高表达CD83、CD11c、S100 与CD1a 等识别标志分子[4-6],成熟DC 在体外培养时会高表达CD83,通过CD83 分子的表达量来研究DC 的成熟程度[22,23]。DC 另外一种特征标记物是CD11c,在细胞内吞中起重要作用,通过CD11c 捕捉抗原,将其递呈给CD4+和CD8+T 细胞,产生免疫应答[24]。亦可同时携带抗原定向迁移到淋巴结边缘CD11c 细胞区,靶 向 呈 递 给CD4+和CD8+T 细 胞[25]。因 此,CD11c 亦是细胞免疫的正向调控因子[26]。因此,本研究首先运用免疫组化分别标记DC 表明的CD83、CD11c 分子,检测其表达量来确定DC 的成熟程度。通过免疫荧光共定位,确定CD83 及CD11c 共表达的DC 在各组间的阳性表达率,研究发现,RRS 中CD83 及CD11c 共表达阳性率明显高于另外两组(P<0.05),存在高表达。表明了成熟DC 参与了RRS的发病过程,为深入探究成熟DC 在RRS 中的作用机制提供了新的思路。
本研究难治组DC 和EOS 浸润存在正相关关系,提示EOS 与树突状细胞在难治性鼻窦炎的发生、发展过程中可能存在相互促进作用,具体如何相关在以往研究中可初步了解。Lotfi 等[3]通过实验研究发现病原体相关分子模式的非甲基化寡核苷酸DNA 可 刺 激EOS 诱 导DC 成 熟,DC 细 胞 的 比 率证明了DC 的成熟与EOS 直接相关;杨继红等[2]对正常鼻黏膜和鼻息肉组织均分别行免疫组化染色和迈格吉(may-grunwald giemsa,MGG)染色实验,得出了鼻息肉组织中巨噬细胞即抗原呈递细胞和EOS 表达明显增高。由于Th1/Th2 比例平衡在免疫应答调节中起到关键作用,有学者认为DC 通过一系列细胞及体液免疫导致其平衡失调,抑制T 细胞分化为Th1,促进Th2 极化,使Th2 分泌的细胞因子占优势,主要是IL-4、IL-5、IL-6、IL-10[27]。IL-5已被证实在鼻息肉组织中表达明显升高,参与了鼻息肉发生、发展,并且其抑制EOS 的凋亡,延长EOS 存活时间,同时在炎症反应中也促发EOS浸润[28]。
本 研 究 结 果,DC 的 标 志 物CD83 和CD11c 在 难治性鼻窦炎患者鼻窦黏膜中的高表达趋势,而且其与EOS 浸润程度呈正相关,表明了DC 和EOS 在RRS 发生及发展中起着相互促进作用,证实DC 参与了难治性鼻窦炎发生、发展过程,为研究难治性鼻窦炎发病机制提供新思路,为其治疗提供新的靶点,本研究尚存在一定的局限性,首先样本量较小,缺少多中心、大样本、随机对照实验,而DC 是否通过调控EOS 导致RRS,具体如何相互作用,是否可作为评估RRS 严重程度及预后的一个重要参考指标,还有待进一步研究。
作者贡献度说明
曾银萍:实验设计及病例资料收集、实验操作、数据分析、撰写论文。牟忠林:指导实验设计及帮助修改论文。丁顺:参与实验病例收集、数据整理等。罗志飞:参与病理资料收集、指导实验操作等。

