四神丸对急性溃疡性结肠炎小鼠模型中Ⅰ型、Ⅲ型干扰素表达的影响
董佳敏,卢 涛,李 珂,李梦佳,王旭丹,葛东宇,吴 莹,2
(1.北京中医药大学,北京 102488;2.广西医科大学附属柳州市人民医院,广西 柳州 545008)
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病(inflammatoryboweldisease,IBD)最常见的一种类型,主要症状为腹痛、腹泻、便血、体重下降,易发展为难治的结直肠癌,其发病率近年来呈上升趋势[1,2]。UC 的 发 病 原 因 及 机 制 普 遍 认 为 与 易 感 基因、环境因素、饮食习惯、精神疾患、肠道菌群种类以及数量改变、异常的免疫反应作用于肠道共生微生物以及肠黏膜有关[3,4]。干扰素(interferon,IFN)主要包括Ⅰ型、Ⅱ型和Ⅲ型,其中Ⅰ型和Ⅲ型干扰素可通过相同的JAK/STAT 信号通路,激活干扰素刺激基因(ISGs)的转录,诱导下游信号的表达,从而在疾病中发挥作用[5]。Ⅰ型和Ⅲ型IFN 在UC的发病过程中起到重要作用,Ⅰ型IFN 能通过调节抗炎和促炎过程维持肠道的免疫平衡,临床可使用Ⅰ型IFN 治疗UC;缺失Ⅲ型干扰素受体的小鼠体重显著下降,并且加重了肠道的炎性损伤;也有观点认为Ⅰ型和Ⅲ型IFN 的表达会加重炎症反应[6-9]。因此探究Ⅰ型和Ⅲ型IFN 在UC 结肠中的表达情况可能有助于治疗UC。
在中医学中,UC 多归属于“痢疾”、“泄泻”、“肠澼”、“肠风”和“滞下”等范畴。临床常见证型以脾肾阳虚证多见[10,11]。四神丸具有温肾健脾,涩肠止泻的作用,可治疗脾肾阳虚之五更泻,临床常用来治 疗UC 等 肠 道 疾 病[12,13]。但 四 神 丸 治 疗UC 的 作用机制是否与Ⅰ型、Ⅲ型IFN 及其受体有关鲜有报道。本研究采用DSS 制备急性UC 模型,观察四神丸对UC 小鼠症状、体征的改善及小鼠结肠组织中Ⅰ型、Ⅲ型IFN 及其受体表达的变化,为Ⅰ型、Ⅲ型IFN 对UC 发挥作用的进一步研究以及在临床更合理的使用提供依据。
1 材料与方法
1.1 动物
SPF 级 雄 性C57BL/6Cnc 小 鼠40 只,6~7 周龄,18~22 g,购自北京维通利华实验动物技术有限公司,动物合格证号SCXK(京)2016-0006,饲养于北京中医药大学良乡校区动物房,温度18~22 ℃,相对湿度50%~60%,动物实验经北京中医药大学实验动物伦理委员会审查通过(BUCM-4-2020091401-3049)。
1.2 主要试剂与仪器
四神丸(批号20080016)购自北京同仁堂(集团)有限公司;柳氮磺胺吡啶肠溶片(批号09190911)购自上海信谊天平药业有限公司;低分子葡聚糖硫酸钠(批号CAM6550)购自日本和光纯药工业株式会社(Wako);邻联甲苯胺法粪便隐血定性检测试剂盒(批号L18S11G125170)购于上海源叶生物科技有限公司;苏木素-伊红(HE)染色试剂盒、高效RIPA 组织细胞裂解液、BCA 蛋白浓度测定试剂盒、SDS-PAGE 凝胶配制试剂盒购自北京索莱宝科技有限公司;miRNeasy Mini Kit 试剂盒购自德国Qiagen 公司;Reveraid First Strand cDNA Syn‐thesis Kit 试剂盒购自美国赛默飞世尔科技公司(ThermoFisher);Power STBR®Green PCR Master‐Mix 购自美国应用生物系统公司(Appliedbiosys‐tems);PCR 引物由生工生物工程(上海)股份有限公 司 合 成;Mouse IL-28B(IFN lambda3)Uncoate‐dELISA 试剂盒、Recombinant Mouse IL-28 Ralpha/IFN-lambda R1 Fc Chimera,CF 购自美国英杰生命技术有限公司(Invitrogen);VeriKineTMMouse IFN Alpha ELISA Kit、VeriKineTMMouse IFN Beta ELI‐SA Kit 试剂盒购自美国维百奥生物科技(PBL As‐say Science)有限公司;Mouse IL-28A Simple Step ELISA®Kit 试 剂 盒 购 自 美 国Abcam 公 司;Mouse IFN-α/β R2 Antibody 试 剂 购 自 美 国R&D 公 司;HRP-conjugated Affinipure Rabbit Anti-Goat IgG(H+L)试剂、普通ECL 发光化学检测试剂盒购自美 国Proteintech 公 司;Rabbit Anti-Mouse IFN-α/β R1 Antibody 试剂购自中国北京义翘神州生物技术有限公司(Sino Biological Inc.)。
石蜡包埋机HistoCore Aracadia H、研究级高分辨显微分析系统、摊片机HI1210、烤片台HI1220、自动组织脱水机HistoCore Pearl、冷却态HistoCore Arcadia C、全自动轮转式切片机、多功能染色机ST5020、RM2255 购自德国徕卡(Leica)显微系统有限公司;低温离心机Centrifuge5417R 购自德国艾本德(Eppendorf);多功能荧光分子成像系统、电泳仪、电转仪购自美国伯乐公司(Bio-Rad);多功能酶标仪SpectraMax®i3x 购自美国美谷分子仪器有限公司(MD);荧光定量PCR 仪QuantStudio™Real-Time PCR 购自美国赛默飞世尔科技公司(Thermo Fish‐er)。
1.3 实验方法
1.3.1 四神丸对急性UC 小鼠疾病活动指数(DAI)的影响 雄性C57BL/6Cnc 小鼠随机分为对照组(Control)、葡聚糖硫酸钠模型组(DSS)、四神丸组(SSW)与柳氮磺胺吡啶组(SASP)。除对照组外,其余小鼠4% DSS 灌胃给药进行造模,0.2 mL/d,连续5 d,造模第2 天后灌胃给药,SSW 组小鼠给予1.5 g/kg 四神丸0.2 mL,SASP 组小鼠给予0.25 g/kg SASP 0.2 mL,Control 组 和DSS 组 给 予 等 体 积生理盐水,2 次/d,连续7 d。造模后每天记录小鼠体重并计算体重分数;观察粪便黏稠度;邻联甲苯胺法检测粪便隐血情况。根据体重分数、粪便黏稠度和粪便隐血分数计算小鼠的疾病活动指数评分(DAI)。
1.3.2 四神丸对急性UC 小鼠结肠组织病理变化的影响 小鼠末次给药后禁食不禁水1 d,脱颈处死小鼠,剪取结肠,清洗后取约3 cm 结肠用10%中性福尔马林溶液固定24 h,自来水充分冲浸。脱水、石蜡包埋、切片、HE 染色法进行染色,在显微镜下观察并计算组织学评分。
1.3.3 qPCR 检 测 小 鼠 结 肠 组 织 中IFN-α、IFN-β、IFN-λ2、IFN-λ3 mRNAs 水 平 取100 mg 结 肠 组织,加入液氮进行研磨,用匀浆机进行组织匀浆,按照miRNeasy Mini Kit 试剂盒的说明书提取RNA,测定RNA 浓度,并进行反转录合成cDNA。建立20 μL qPCR 反 应 体 系:Power SYBR GreenPCR Master Mix 10 μL,上游引物(10 mol/L)0.4 μL,下游引物(10 mol/L)0.4 μL,无核酸酶的高纯水7.2 μL,cDNA(原 液5 倍 稀 释)2 μL。95 ℃10 min;95 ℃5 s,60 ℃30 s,40 个循 环;95 ℃15 s,60 ℃1 min,95 ℃15 s。

表1 引物序列Tab 1 Sequence primers
1.3.4 ELISA 检测小鼠结肠组织中IFN-α、IFN-β、IFN-λ2、IFN-λ3 水平 取100 mg 结 肠组织加1 mL生理盐水研磨,将研磨液转移至1.5 mL EP 管,置于冰上20 min,每隔5 min 震荡一下,12 000 r/min 离心5 min,吸取上清液,BCA 法测定蛋白浓度,将样品稀释50 倍,用ELISA 试剂盒测定IFN-α、IFN-β、IFN-λ2、IFN-λ3 的表达水平。
1.3.5 Western blot 检测小鼠结肠组织中干扰素受体IFNAR1、IFNAR2、IFNLR1 表达 取一小段结肠组织剪碎,加入高效RIPA 组织、细胞裂解液,充分裂解组织,再将组织裂解液吸取到1.5 mL EP 管中,12 000 r/min 离心5 min。吸取上清液,BCA 法测定蛋白浓度并进行变性。蛋白样品使用SDSPAGE 凝胶电泳,电转后封闭1 h,加入一抗(IFN-α/βR2、IFNLR1、IFN-α/βR1),4 ℃孵育过夜,用PBST洗三次,5~10 min/次,加入二抗,孵育1 h,用PBST洗三次,5~10 min/次。加入ECL 发光液,使用多功能荧光分子成像系统进行曝光。
1.4 统计学处理
数据使用Graphpad Prism 8.0.2 处理,采用单因素方差分析(One-Way ANOVA)进行各组间差异比较,当方差不齐时,各组间比较采用Tamhance´s T2 检验;当方差齐时,各组间比较采用LSD 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 四神丸能够降低UC 小鼠DAI 水平
与DSS 组相比,四神丸和SASP 治疗后小鼠体重分数显著降低(P<0.001);腹泻分数显著降低(P<0.01~0.001);便血分数明显降低(P<0.01)。与对照组相比,DSS 组小鼠的DAI 明显上升(P<0.001),四神丸组与SASP 组小鼠的DAI 也显著上升(P<0.001)。但与DSS 组相比,四神丸和SASP治疗组小鼠的DAI 都明显下降(P<0.001)。见表2、图1。
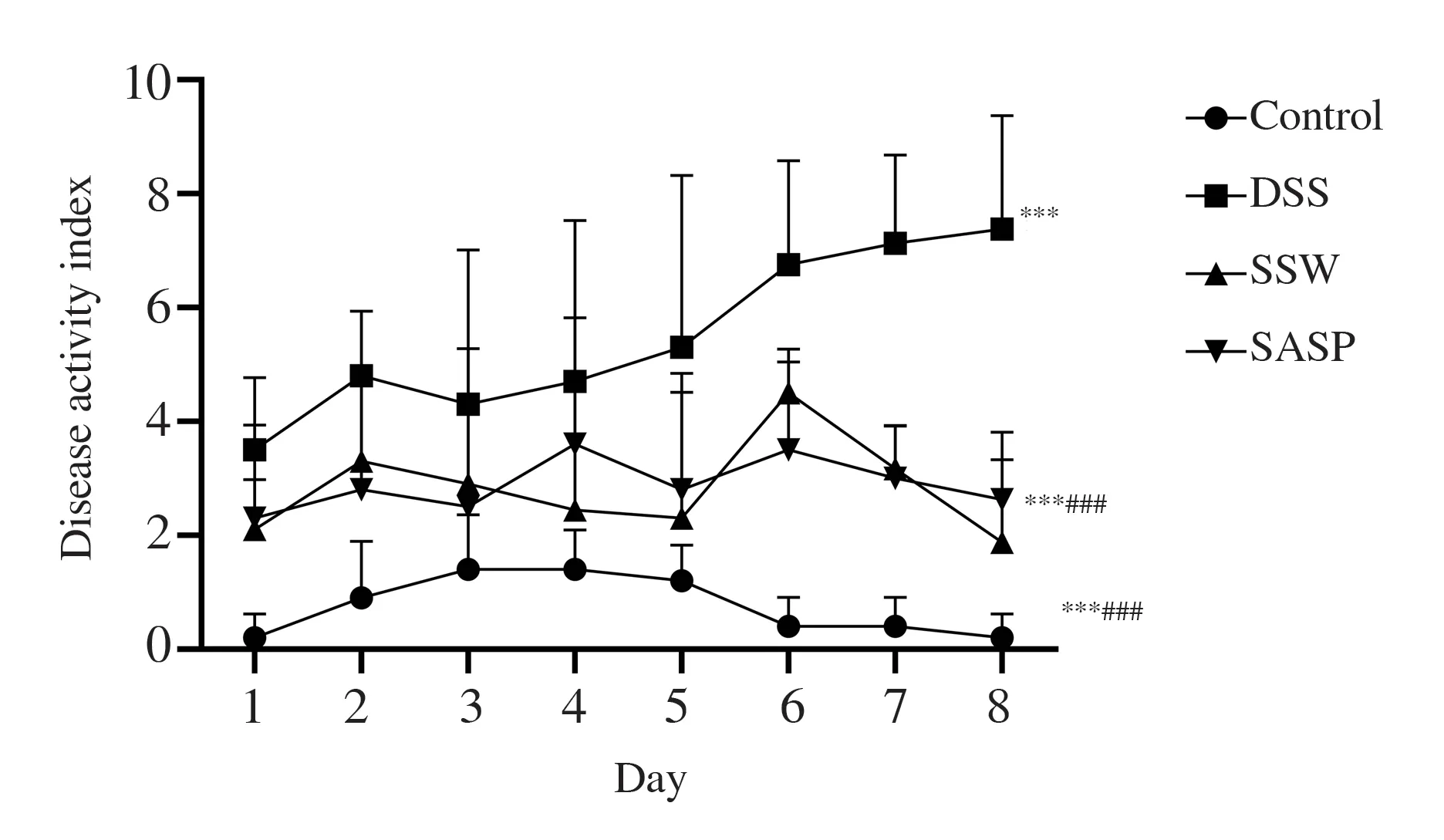
图1 各组小鼠DAI 的变化Fig 1 DAI changes of mice in each group
表2 各组小鼠疾病活动指数的变化(±s,n=10)Tab 2 Disease activity index changes of mice in each group(±s,n=10)
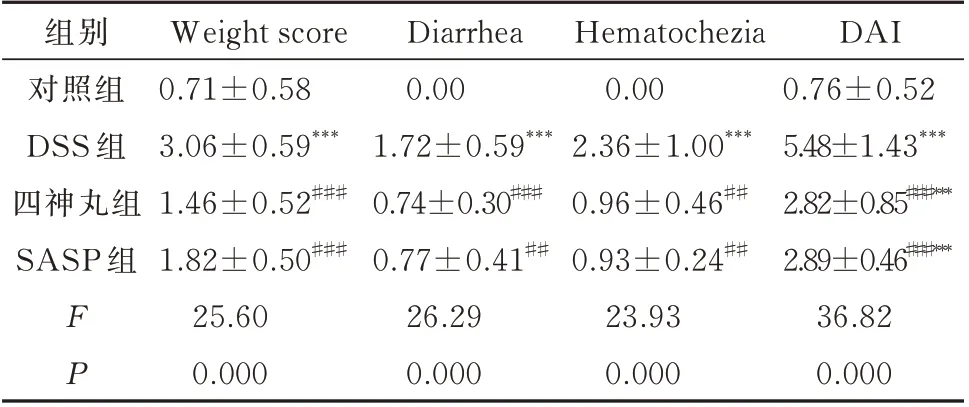
表2 各组小鼠疾病活动指数的变化(±s,n=10)Tab 2 Disease activity index changes of mice in each group(±s,n=10)
注:与对照组相比,*P<0.05,**P<0.01,***P<0.001;与DSS 组相比,#P<0.05,##P<0.01,###P<0.001。
DAI 0.76±0.52 5.48±1.43***2.82±0.85###***2.89±0.46###***36.82 0.000组别对照组DSS 组四神丸组SASP 组FP Weight score 0.71±0.58 3.06±0.59***1.46±0.52###1.82±0.50###25.60 0.000 Diarrhea 0.00 1.72±0.59***0.74±0.30###0.77±0.41##26.29 0.000 Hematochezia 0.00 2.36±1.00***0.96±0.46##0.93±0.24##23.93 0.000
2.2 四神丸能够恢复结肠组织病理变化
结肠组织HE 染色表明四神丸能减少炎性细胞浸润,恢复结肠黏膜、隐窝结构,缩小淋巴结,有效减轻组织病变。与对照组小鼠相比,DSS 组、四神丸组和SASP 组小鼠结肠组织的组织学评分明显升高(P<0.01~0.001)。四神丸或SASP 治疗后,小鼠结肠组织的组织学评分显著降低(P<0.001)。见表3、图2。

图2 各组小鼠结肠组织HE 染色(×200)Fig 2 HE staining of mice in each group(×200)
表3 各组小鼠组织学评分的变化(±s,n=10)Tab 3 Histological score changes of mice in each group(±s,n=10)

表3 各组小鼠组织学评分的变化(±s,n=10)Tab 3 Histological score changes of mice in each group(±s,n=10)
注:与对照组相比,*P<0.05,**P<0.01,***P<0.001;与DSS 组相比,#P<0.05,##P<0.01,###P<0.001。
HE stain 0.00 12.50±0.93***1.00±0.89###**1.29±0.76###***563.60 0.00组别对照组DSS 组四神丸组SASP 组FP
2.3 四神丸对急性UC 小鼠结肠组织中IFN-α、IFN-β、IFN-λ2、IFN-λ3 mRNAs 表达的影响
与对照组相比,DSS 组小鼠结肠组织中IFN-α、IFN-β、IFN-λ2、IFN-λ3 mRNA 水平明显降低(P<0.01~0.05);四神丸组IFN-β、IFN-λ2 mRNA 水平升高(P<0.05),IFN-α、IFN-λ3 mRNA 水平升高但无统计学意义(P>0.05)。经治疗后与DSS 组相比,四神丸组IFN-α、IFN-β、IFN-λ2、IFN-λ3 mRNA水平明显上升(P<0.01~0.001)。见表4。
表4 各组小鼠IFN-α、IFN-β、IFN-λ2、IFN-λ3 mRNAs 的变化(±s,n=3)Tab 4 Changes of IFN-α,IFN-β,IFN-λ2 and IFN-λ3 mRNAs of mice in each group(±s,n=3)
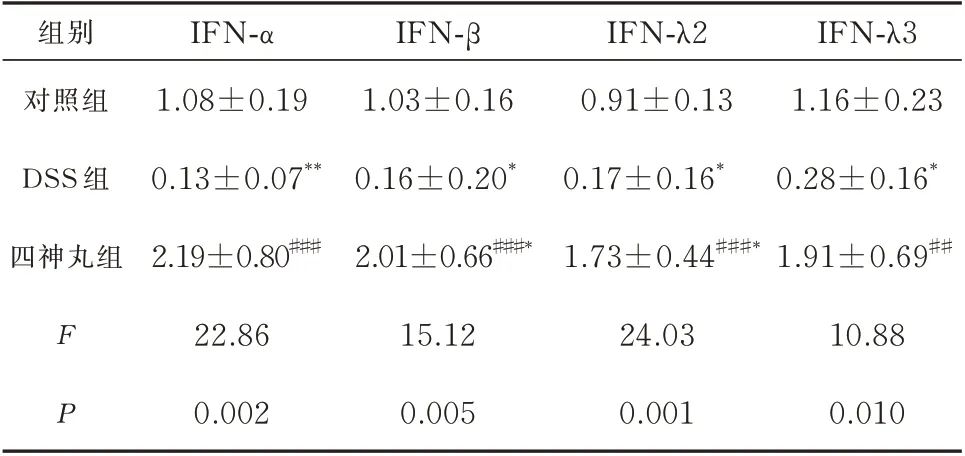
表4 各组小鼠IFN-α、IFN-β、IFN-λ2、IFN-λ3 mRNAs 的变化(±s,n=3)Tab 4 Changes of IFN-α,IFN-β,IFN-λ2 and IFN-λ3 mRNAs of mice in each group(±s,n=3)
注:与对照组相比,*P<0.05,**P<0.01,***P<0.001;与DSS 组相比,#P<0.05,##P<0.01,###P<0.001。
IFN-λ3 1.16±0.23 0.28±0.16*1.91±0.69##10.88 0.010组别对照组DSS 组四神丸组F P IFN-α 1.08±0.19 0.13±0.07**2.19±0.80###22.86 0.002 IFN-β 1.03±0.16 0.16±0.20*2.01±0.66###*15.12 0.005 IFN-λ2 0.91±0.13 0.17±0.16*1.73±0.44###*24.03 0.001
2.4 四神丸对急性UC 小鼠结肠组织中IFN-α、IFN-β、IFN-λ2、IFN-λ3 水平的影响
ELISA 法检测小鼠结肠组织匀浆上清中IFNα、IFN-β、IFN-λ2、IFN-λ3 的表达发现,与对照组相比,DSS 组IFN-α、IFN-β、IFN-λ2、IFN-λ3 水平明显降低(P<0.01~0.001);四神丸组IFN-β 水平升高(P<0.01),IFN-α、IFN-λ2、IFN-λ3 水平升高无统计学意义;SASP 组IFN-α、IFN-β、IFN-λ2、IFN-λ3 水平均有明显升高(P<0.01~0.001)。经治疗后与DSS 组相比,四神丸组IFN-α、IFN-β、IFN-λ2、IFNλ3 水 平 均 明 显 升 高(P<0.01~0.001),SASP 组IFN-α、IFN-β、IFN-λ2、IFN-λ3 水平均明显升高(P<0.01~0.001)。见表5。
表5 各组小鼠IFN-α、IFN-β、IFN-λ2、IFN-λ3 的变化(±s,n=3)Tab 5 IFN-α,IFN-β,IFN-λ2 and IFN-λ3 change of mice in each group(±s,n=3)

表5 各组小鼠IFN-α、IFN-β、IFN-λ2、IFN-λ3 的变化(±s,n=3)Tab 5 IFN-α,IFN-β,IFN-λ2 and IFN-λ3 change of mice in each group(±s,n=3)
注:与Control 小鼠相比*P<0.05,**P<0.01,***P<0.001;与DSS 小鼠相比#P<0.05,##P<0.01,###P<0.001。
IFN-λ3 233.70±20.08 56.86±14.37***242.80±32.76###390.80±31.86###***110.70 0.00组别对照组DSS 组四神丸组SASP 组F P IFN-α 67.96±2.94 58.74±1.25**74.49±5.32##78.39±1.17###***29.60 0.00 IFN-β 78.85±2.67 41.00±19.11**135.90±23.76###**212.60±61.87##**18.72 0.00 IFN-λ2 76.38±3.00 15.02±5.79***64.59±19.62##102.00±5.27###***46.86 0.00
2.5 四神丸对急性UC 小鼠结肠组织中IFNAR1、IFNAR2、IFNLR1 表达的影响
与对照组相比,DSS 组IFNAR1、IFNAR2、IF‐NLR1 水平明显降低(P<0.05~0.01);四神丸组IF‐NAR2 水平升高(P<0.001),IFNAR1、IFNLR1 水平升高但差异无统计学意义;SASP 组IFNAR2、IF‐NLR1 水平升高(P<0.05~0.001),IFNAR1 水平升高无统计学意义(P>0.05)。经治疗后与DSS 组相比,四神丸组和SASP 组IFNAR1、IFNAR2、IFN‐LR1 水 平 均 明 显 升 高(P<0.05~0.001)。 见 表6、图3。
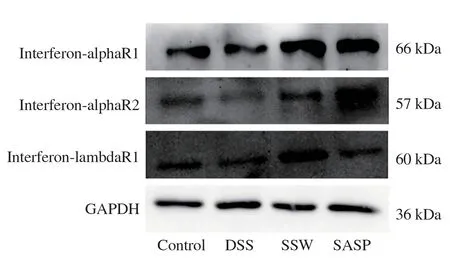
图3 各组小鼠结肠组织中IFNAR1、IFNAR2、IFNLR1 的表达水平Fig 3 Expression levels of IFNAR1,IFNAR2 and IFN⁃LR1 in colon tissues of mice in each group
表6 各组小鼠IFNAR1、IFNAR2、IFNLR1 的变化(±s,n=3)Tab 6 IFNAR1,IFNAR2 andI FNLR1 changes of mice in each group(±s,n=3)

表6 各组小鼠IFNAR1、IFNAR2、IFNLR1 的变化(±s,n=3)Tab 6 IFNAR1,IFNAR2 andI FNLR1 changes of mice in each group(±s,n=3)
注:与对照组相比,*P<0.05,**P<0.01,***P<0.001;与DSS 组相比,#P<0.05,##P<0.01,###P<0.001。
IFNLR1 1.04±0.06 0.57±0.14**1.41±0.36#0.90±0.05#*9.275 0.005组别对照组DSS 组四神丸组SASP 组F P IFNAR1 0.95±0.06 0.60±0.11**1.14±0.20#0.93±0.08#10.46 0.003 IFNAR2 0.52±0.05 0.37±0.03*0.84±0.03###***1.18±0.01###***338.50 0.000
3 讨论
UC 是一种自发性的慢性疾病,而这种慢性疾病被描述为开始于直肠并以一种连续的损伤扩展到邻近的结肠。随着人们生活水平的不断提升,生活环境、生活习惯和饮食结构的改变,我国UC 的发病率正逐年增高。UC 病程较长,常规药物(如氨基水杨酸类药物、免疫抑制剂、类固醇类药物)往往只能缓解症状,难以完全治愈,并且一些患者对于常规药物治疗有不良反应,很容易发展成为难治性的UC[14]。因此寻求更加有效的方法治疗UC 成为重中之重。
肠道微生物、肠黏液层、肠道上皮、免疫细胞相互 作 用 保 持 胃 肠 道 的 稳 态[15,16]。而 在UC 中,这 一动态平衡被完全打破。UC 患者的肠上皮层完整性降低;黏膜组织的通透性增加[17];固有免疫系统紊乱,诸多炎性细胞因子过度表达加重炎性损害,如IL-1β、IL-8、TNF-α、IL-6、IL-23、IL-12、IL-17 等[18];同时T 细胞的平衡也被打破,辅助性T 细胞(Th1、Th2)的过度增多,导致Th1 和Th2 细胞和调节性T细胞(Treg)的数量不平衡[19],活化的T 细胞产生并释放炎性因子,进一步加重持续性的炎症[20]。最近研究发现干扰素系统在UC 的进程中也发挥了重要的作用。干扰素是被发现的具有干扰病毒复制作用的细胞因子[21],分为I 型、Ⅱ型和Ⅲ型IFN。Ⅰ型IFN 包 括IFNα、IFNβ,通 过 异 质 二 聚 体 受 体(IFNαβR)发挥作用,激活JAK/STAT 信号通路,形成干扰素刺激基因因子(ISGF)3 从而发挥作用[22]。在平常状态下,Ⅰ型IFN 在肠道或者其它组织中含量很低[23]。研究表明I 型IFN 信号对UC 的作用有两面性。Ⅰ型IFN 信号缺失的小鼠结肠炎的症状加重,Ⅰ型IFN 的表达能够维持肠道的免疫平衡[7]。也有研究发现Ⅰ型IFN 增多,反而加重了肠道炎症[6,24]。Ⅱ型干扰素IFN-γ 主要起到促炎作用,破坏结肠黏膜的完整性,导致UC 的发生[25]。Ⅲ型IFN(包含IFNλ1,2,3,4)利用与Ⅰ型IFN 相同的JAK/STAT 信号通路发挥作用[8],但其受体主要由IFNλR1 和IL-10R2 亚 基 组 成[26]。与Ⅰ型IFN 相 比,Ⅲ型IFN 可能在免疫信号的传递上和肠道上皮细胞作用更加密切。IFN-λ 可以减少过度的炎性反应,却不会引起机体防御功能减弱。Durbin 等[27]报道在用DSS 诱导结肠炎后,缺失Ⅲ型干扰素受体的小鼠CXCL10 的表达比正常小鼠显著上调,这引起了小鼠体重的显著下降,并且加重了肠道的炎性损伤。
在中医理论中,UC 大多是由外感时邪、饮食不洁、饮食不节、情志内伤以及素体脾肾不足所致,引起机体的气滞、血瘀、湿热、痰浊等。UC 属于本虚标实,寒热错杂,以脾肾阳虚为本,湿热血瘀为标[10]。其中脾肾阳虚证以温补脾肾、收涩固脱为治疗原则,多用四神丸治疗[28,29]。诸多研究表明四神丸能够缓解UC 患者的症状体征,并具有一定控制炎症的作用[30-32]。四神丸能够有效降低脾肾阳虚型UC 大鼠结肠组织中蛋白激酶B(Akt)、磷脂酰肌醇-3 激 酶(PI3K)以 及 雷 帕 霉 素 靶 蛋 白(mTOR)mRNAs 水平,能够增高IL-10 的表达水平,使p-PI3K、p-mTOR 以及p-Akt 蛋白的表达水平下降[29]。四神丸能够有效降低IL-1β 的表达水平,升高IL-4的表达水平,升高IL-13 的表达水平,说明四神丸治疗UC 大鼠的免疫机制可能与调节Th1/Th2 的免疫平衡有一定关联,可以抑制过度的免疫反应[33]。本研究用四神丸治疗DSS 诱导的小鼠急性UC 模型取得了良好的效果,印证了四神丸的治疗作用。但目前四神丸治疗UC 过程中干扰素系统所发挥的免疫学作用并不明确,笔者的研究发现模型组的结肠组织中Ⅰ型干扰素和Ⅲ型干扰素通路中IFN-α、IFN-β、IFN-λ2 和IFN-λ3 及 其 受 体IFNAR1、IF‐NAR2 和IFNLR1 的表达水平显著降低,说明DSS诱导的急性小鼠UC 模型可能通过抑制Ⅰ型、Ⅲ型IFN 信号通路,使得免疫调节作用发生异常,从而导致结肠黏膜炎性损伤的加重。在经过四神丸治疗后,上述因子的表达水平均显著升高,说明四神丸可能通过促进Ⅰ型、Ⅲ型IFN 及其受体的表达,对小鼠结肠黏膜的免疫反应进行调节,从而抑制过度的免疫反应造成的炎性损伤,使小鼠结肠黏膜结构恢复正常。四神丸治疗小鼠急性UC 时,Ⅰ型和Ⅲ型IFN 的表达变化,缓解了UC 小鼠的症状体征,减少了炎性损害,使UC 小鼠趋于康复。这一发现为进一步探讨四神丸治疗UC 时干扰素信号通路发挥的作用奠定了基础。
作者贡献度说明:
董佳敏、李珂、李梦佳进行实验操作,数据收集整理及撰写文章;卢涛、王旭丹、葛东宇、吴莹对实验设计,数据分析统计及作图,文章撰写等进行指导。

