黄芩茎叶-虎杖配伍对急性肺损伤大鼠TRPV1 表达及炎性细胞因子的影响
屈新亮,段广靖,赵 博,谢 锋,王 斌,高 峰,卫培峰,李 敏
(陕西中医药大学药学院,陕西咸阳 712046)
急性肺损伤(acute lung injury,ALI)病理过程较为复杂,通常由多种因素引起,例如感染、创伤、脓毒血症等。患者主要有胸闷、气短、呼吸困难等临床表现,进一步演变可导致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),病死率达30%~45%[1]。急性肺损伤主要发病机制与炎症反应相关,表现为各种病因诱导肺内促炎因子生成增加,炎症因子的大量释放与激活使肺内炎症反应失控,肺泡毛细血管内皮细胞和肺泡上皮细胞受损、广泛肺水肿,进一步导致肺部炎性细胞浸润、水肿、气体交换障碍[2]。
黄芩、虎杖为两种传统的中草药,均具有抗炎、抗肿瘤、抗病毒、抗氧化的药理作用[3-6]。二者发挥清热解毒功效时常配伍联用[7]。黄芩茎叶与黄芩根的药理作用相似,也具有抗炎作用[8]。黄芩茎叶-虎杖相互作用关系尚未明确,对抗炎药效的影响及机制尚未见深入研究,在一定程度上限制其现代化研究与临床应用,因此阐明其配伍作用机制具有重要意义。
瞬时受体电位香草酸亚型1(TRPV1)是瞬时受体电位(TRP)家族的成员,有研究表明,TRPV1在感染部位被激活后,在减少炎症介质的分泌和抑制炎症反应过程中具有重要的调控作用,从而改善了肺损伤。故本研究将探讨黄芩茎叶-虎杖配伍后对LPS 诱导大鼠ALI 中炎性因子和TRPV1 表达方面的影响及其机制,为临床应用提供理论基础。
1 材料与方法
1.1 试验药物
黄芩茎叶(黑龙江省大兴安岭);虎杖饮片(豪州市永刚饮片厂有限公司)。取黄芩茎叶和虎杖药材各100 g,加15 倍量水,浸泡30 min,武火煮沸后文火煎煮50 min,双层纱布过滤;二煎加10 倍量水,武火煮沸后文火煎煮40 min,过滤,合并两次滤液,浓缩至1 mL 药液含生药1 g,4 ℃以下储存。
1.2 动物
SPF 级健康雄性SD 大鼠48 只(四川实验动物质量检测中心),体质量(150±10)g,6 周龄,生产许可证号:SCXK(川)2020-030,饲养环境为:温度(25±1)℃,相对湿度(50%~60%),自由进食与饮水,动物实验及方法经陕西中医药大学伦理委员会批准。
1.3 试剂
LPS(脂多糖,sigma,货号:L8880);TNF-α、1L-1β ELISA 试剂盒(上海酶联,货号分别为:ml002859,ml003057);SOD 活性检测试剂盒(南京建成,货号:A001-3-1);TRPV1 抗体(武汉博士德,货号:CX0125);SYBR Green PCR 试剂盒(德国QIAGEN 公 司,货 号:208052);RNA 提 取 试 剂 盒TRI reagent(美国英杰,货号:15596018)。
1.4 仪器
ELx808 全自动酶标仪(Bio-Tek)、ICX40 倒置显微镜(舜宇光学科技有限公司)、高速冷冻离心机(Thermo)、伯乐电泳仪(BIO RAD)、荧光定量PCR仪(上海罗氏制药)。
1.5 动物造模与分组处理
将48 只SD 雄性大鼠随机分为6 组:对照组、模型组、地塞米松阳性组、黄芩茎叶-虎杖配伍低、中、高剂量组。每组8 只。黄芩茎叶-虎杖配伍低、中、高剂量组分别灌胃3.5、7.0、14.0 g/kg,对照组和模型组给予等量0.9%氯化钠。地塞米松组大鼠腹腔注射5 mg/kg 地塞米松。连续给药7 d,每天给药1次。第8 天除对照组外,其余各组用1 mL 注射器吸取LPS 溶液(配制成1 mg/mL)经大鼠尾静脉注射8 mg/kg 的LPS 诱导ALI 模型。造模6 h 后,将动物麻醉,取腹主动脉血5 mL,分离血清备用,−80 ℃保存。
1.6 标本采集与检测
1.6.1 大鼠肺组织湿/干质量比值的测定 取新鲜右肺组织,置于超纯水中清洗,吸干水分,称取湿质量。将肺组织置于60 ℃恒温箱干燥,72 h 后,称重得肺干重,根据公式W/D=肺组织湿重/肺组织干重×100%计算湿/干质量(W/D)比值。
1.6.2 大鼠肺组织病理变化 肺组织用4%多聚甲醛固定,石蜡包埋,切成薄片(约4 μm),二甲苯脱蜡,梯度乙醇脱水,脱蜡,进行苏木精-伊红染色液(HE)染色,于光学显微镜100 倍视野下观察肺组织病理变化。
1.6.3 大鼠相关炎性因子的检测 测定大鼠肺组织中BALF 上清液中的TNF-α、1L-1β 含量。麻醉并结扎右肺,暴露气管行气管插管,分离并结扎右侧主支气管,经气管缓慢注入冷生理盐水,收集BALF,离心,−80 ℃保存。严格按照ELISA 试剂盒说明书进行操作,采用酶标仪(450 nm)读取吸光度OD 值,最终计算出样品的浓度。
1.6.4 大鼠肺组织SOD 的检测 取大鼠血清,按试剂盒说明书测定各组大鼠肺组织中SOD 的水平。
1.6.5 qRT‐PCR 法检测肺组织TRPV1mRNA 表达 采用Trizol 法抽提总RNA,根据试剂盒说明书将RNA 逆转录为cDNA,以cDNA 为模板,β-actin为内参照,使用qRT-PCR 试剂盒和罗氏480Ⅱ型qRT-PCR 仪 检 测TRPV1 的mRNA 水 平。采 用2-ΔΔCT法计算TRPV1 相对表达水平。引物序列见表1。反应条件为95 ℃持续30 s 激活热启动酶,95 ℃变性5 s 和60 ℃延伸30 s,共45 个循环。

表1 引物序列表Tab 1 Primer sequence of TRPV1
1.6.6 Western blot 法检测肺组织中蛋白表达 在肺组织中加入RIPA 裂解液,于匀浆机中研磨,待充分裂解后,离心取上清,取部分上清蛋白用BCA 试剂盒测定蛋白浓度。将调整的蛋白浓度与等体积5×上样缓冲液混合,于沸水中煮沸5 min 上样,进行SDS‐PAGE 凝胶电泳,200 mA 恒流转膜70/90 min;封闭后加入TRPV1(1∶1 000)和β-actin(1∶2 000),4 ℃孵育过夜。次日洗膜,加入Ⅱ抗(1∶2 000)室温孵育2 h。使用ECL 化学发光法显影,ImageJ 统计学处理图像分析方法进行分析,以目的蛋白与内参蛋白β-actin 的灰度比值表示相应蛋白表达水平的高低。
1.7 统计学处理
采用SPSS 21.0 软件进行统计学分析,数据结果均以xˉ±s 表示,采用单因素方差分析(ANOVA)进行组间比较,以P<0.05 为差异具有统计学意义。
2 结果
2.1 各组大鼠肺组织W/D 值的比较
与对照组相比,模型组大鼠肺组织的W/D 显著升高(P<0.01),说明肺部水肿较严重;与模型组相比,黄芩茎叶-虎杖配伍组中的低、中、高剂量明显降低了大鼠肺组织W/D 值(P<0.05),提示药物可预防肺水肿。其中黄芩茎叶-虎杖配伍组中的中剂量效果较显著(P<0.05)。见表2。
表2 各组大鼠肺组织W/D 比较(n=8,±s)Tab 2 Comparison of W/D of lung tissue of rats in each group(n=8,±s)

表2 各组大鼠肺组织W/D 比较(n=8,±s)Tab 2 Comparison of W/D of lung tissue of rats in each group(n=8,±s)
注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
W/D 2.06±0.21 6.92±0.35**5.74±0.70**#4.99±0.53**#3.84±0.20*##4.51±0.76**##31.62<0.0001组别对照组模型组阳性组低剂量黄芩茎叶-虎杖组中剂量黄芩茎叶-虎杖组高剂量黄芩茎叶-虎杖组剂量(g/kg)--5.0 3.5 7.0 14.0 FP--
2.2 各组大鼠肺组织病理变化的比较
结果显示,对照组大鼠肺泡结构完整,无炎性细胞浸润,未见病理变化;与对照组相比,模型组大鼠肺泡结构被破坏,可见片状血灶,有大量炎性细胞浸润;与模型组相比,黄芩茎叶-虎杖的中、高剂量组肺泡结构破坏明显改善,炎性浸润有所减轻。见图1。

图1 各组大鼠肺组织HE 染色(100×)Fig 1 HE staining of lung tissue of rats in each group(100×)
2.3 各组大鼠BALF 中炎性因子的比较
与对照组相比,模型组大鼠肺组织TNF-α、1L-1β 炎性细胞因子水平显著升高(P<0.01),提示炎性浸润偏多;与模型组相比,给药组大鼠BALF 中的TNF-α、1L-1β 水平明显降低(P<0.05),其中、高剂量尤为明显,差异均有统计学意义(P<0.05)。阳性药地塞米松组大鼠BALF 中的TNF-α、1L-1β 水平明显降低(P<0.05~0.01),见表3。
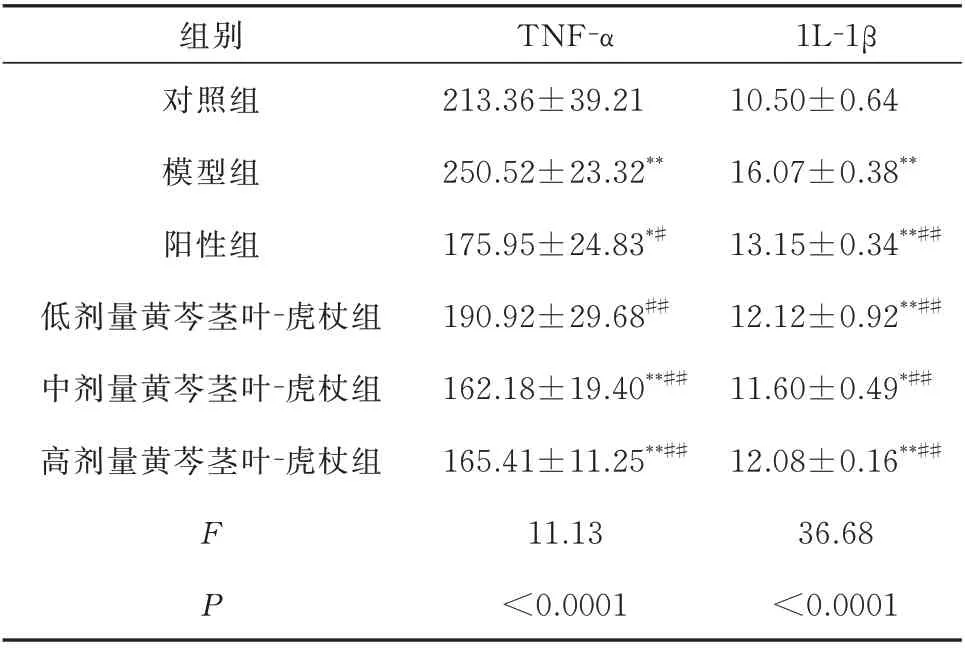
表3 各组大鼠BALF 中TNF⁃α、1L⁃1β 浓度的比较(pg/mL,n=8,xˉ±s)Tab 3 Comparison of the concentrations of TNF⁃α and 1L⁃1β in the BALF of rats in each group(pg/mL,n=8,xˉ±s)
2.4 各组大鼠血清中SOD 活性的比较
与对照组比较,模型组大鼠肺组织氧化应激水平SOD 活力降低(P<0.01);与模型组相比,阳性组和低、中、高剂量黄芩茎叶-虎杖配伍组大鼠肺组织血清中SOD 水平明显增加(P<0.05)。见表4。

表4 各组大鼠血清中SOD 活性的影响(U/mL,n=8,xˉ±s)Tab 4 Effects of SOD activity in serum of rats in each group(U/mL,n=8,xˉ±s)
2.5 各组大鼠肺组织TRPV1 mRNA 表达的比较
与对照组相比,模型组大鼠肺组织TRPV1 mRNA 相对表达显著上调(P<0.01);与模型组相比,阳性药地塞米松组和黄芩茎叶-虎杖的各剂量组大鼠肺组织TRPV1 mRNA 相对表达显著下调,差异均有统计学意义(P<0.05),且高剂量黄芩茎叶-虎杖组TRPV1mRNA 相对表达水平低于黄芩茎叶-虎杖低剂量组(P<0.05)。见表5。

表5 各组大鼠肺组织TRPV1 mRNA 表达的比较(n=8,xˉ±s)Tab 5 Comparison of TRPV1 mRNA expression in lung tis⁃sues of rats in each group(n=8,xˉ±s)
2.6 各组大鼠肺组织中TRPV1 蛋白表达的影响
与对照组相比,模型组大鼠肺组织TRPV1 蛋白表达水平显著上调(P<0.01);经黄芩茎叶-虎杖处理后,其与模型组相比,明显下调了TRPV1 的蛋白表达(P<0.01)。见图2、表6。

表6 各组大鼠肺组织中TRPV1 蛋白表达水平的比较(n=8,xˉ±s)Tab 6 Comparison of TRPV1 protein expression in lung tis⁃sues of rats in each group(n=8,xˉ±s)

图2 各组大鼠肺组织中TRPV1 蛋白表达情况Fig 2 The expression bands of TRPV1 protein in the lung tissues of rats in each group
3 讨论
ALI 是一种常见的临床疾病,会导致肺泡毛细血管膜损伤,广泛的中性粒细胞浸润和炎症介质的释放[9]。炎症反应在ALI 的发生和维持中起着重要作用[10,11]。因此,关注炎症过程的潜在目标将为预防和治疗ALI 提供新的治疗策略。
黄芩茎叶含有黄酮类、酚酸类等多种化学成分[12],具有抗炎、抗病毒、抗氧化及保护心肌缺血等显著药理活性[8]。在黄芩药材采收过程中,黄芩茎、叶和花等黄芩地上部分被废弃,故本研究旨在对黄芩茎叶进行充分利用,加大对黄芩药用资源的开发利用[13]。虎杖主要有抗炎、抗氧化、抗菌、抗病毒的作用[3]。现代研究发现虎杖中的主要成分白藜芦醇苷能降低血清TNF-α、IL-6 水平,增加SOD 水平,改善百草枯所致的急性肺损伤[14]。两药协同配伍发挥清热解毒功效,但具体作用及机制尚未阐明。本研究探讨了黄芩茎叶配伍虎杖对ALI 是否具有协同保护作用及具体作用机制。
在各种致病因素引起的肺损伤中,瞬时受体电位香草酸亚型1(TRPV1)已经被证明在炎症反应中充当重要角色[15,16]。大多数TRPV1 表达在肺内气道的上皮及上皮下、血管周围、气道平滑肌、肺泡等部位[17]。它可以被温度(>43 ℃)、辣椒素等激活,因此TRPV1 也被称为“热敏感性通道”。有文献报道,TRPV1 通道被激活后,能够显著降低气道炎症小鼠的炎症损伤,其过程可能与降低体内TNF-α、IL-6 等促炎细胞因子有关[18]。TNF-α、IL-6和IL-1β 是参与炎症反应的关键炎性介质,在ALI的发生发展过程中发挥着重要作用[19-22]。TNF-α和IL-1β 会增加肺上皮细胞的通透性,进而诱导肺组织损伤和中性粒细胞积聚,从而导致肺水肿[23]。
本研究结果显示,与模型组比较,大鼠肺组织肺泡结构被严重破坏,可见片状血灶,W/D 显著升高,肺水肿及大量炎性细胞浸润;而黄芩茎叶-虎杖组能明显改善破坏的肺泡结构,升高SOD 活力,降低大鼠肺组织,减少肺水肿和炎性浸润。
本研究,与模型组相比,黄芩茎叶-虎杖有效降低 了BALF 中TNF-α、1L-1β 的 水 平,表 明 药 物 对ALI 的改善与其对炎症反应的抑制有关。此外,Western blot 法与qRT-PCR 法结果显示,相比于模型组,黄芩茎叶-虎杖组显著下调TRPV1 蛋白和mRNA 相对表达水平,提示药物可能通过抑制TRPV1 对脂多糖诱导的急性肺损伤大鼠产生明显的保护作用。
综上所述,黄芩茎叶-虎杖对LPS 诱导的ALI大鼠具有保护作用,并其作用机制可能与促进SOD的 活 力,抑 制TNF-α 和IL-1β 的 水 平 以 及 下 调TRPV1 表达发挥抗炎作用。
作者贡献度说明:
屈新亮:实验撰写和动物模型构建;段广靖:测定肺组织W/D 值;赵博:ELISA 实验;谢锋:动物饲养及分组;王斌:观察肺组织病理变化;高峰:qRT-PCR 实验;卫培峰:West‐ern blot 实验;李敏:实验设计及校稿。
所有作者声明不存在利益冲突。

