“石见穿-猫爪草”药对治疗肺癌作用机制探讨
胡佳奇,许博文,程孟祺,赵雨薇,张 兴,郑红刚,花宝金
(1.北京中医药大学,北京 100029;2.中国中医科学院广安门医院肿瘤科,北京 100053)
肺癌(lung cancer)是一种严重威胁人类健康的恶性肿瘤,根据全球癌症统计报告推算,2020 年将有大约1 930 万癌症新发病例及1 000 万癌症死亡病例,其中肺癌发病率和死亡率分别为11.4% 和18%,分别占据所有恶性肿瘤第二位和首位[1]。肺癌的发病与吸烟、环境接触、遗传等多种因素密切相关,手术、放疗、化疗等是肺癌目前主要的治疗手段。据报道,约有80%的局限期小细胞肺癌患者和几乎所有的广泛期小细胞肺癌者在治疗后1 年内复发、进展或死亡[2]。1973~2010 年,肺腺癌和肺鳞状细胞癌的平均5 年生存率不超过20%,小细胞肺癌仅5.6%[3]。
肺癌于中医又称“肺积”,研究发现传统中医药不仅可以增强常规治疗的作用,还能逆转耐药性、降低不良反应和毒性、提高生活质量[4],具有很好的医学发展前景。现代中医认为,正虚、癌毒、痰凝、瘀滞是肺癌发生发展过程中的关键病理因素[5],因而“清热解毒”、“化痰散结”以及“活血化瘀”是中医辨治肺癌的主要治法之一[6]。石见穿为唇形科鼠尾草属植物紫参的全草,《中华本草》言其:“活血化淤、散结消肿”,基础研究表明石见穿提取物能明显抑制人肺癌细胞A549 增殖[7,8];猫爪草则为毛茛种植物小毛茛的块根或全草,《中华本草》言其:“解毒、化痰散结”,基础研究表明猫爪草总苷能抑制A549 裸鼠移植瘤生长[9]。临床上经常将二者合用治疗肺癌[10-12],但此药对作用于肺癌的具体机制尚无报道。
网络药理学可通过构建“成分-靶点-通路”网络顾及中药成分多样、作用靶点丰富的特点,系统阐述中药单品及复方的作用机制[13,14],通过预测靶点有利于指导科研方向及开发新药。本研究通过网络药理学探讨“石见穿-猫爪草”药对治疗肺癌的具体机制,为进一步的基础研究提供依据。
1 材料与方法
1.1 石见穿和猫爪草的活性成分及靶点筛选
根据ADME 筛选原则,以口服生物利用度(OB)≥30%和类药性(DL)≥0.18 在TCMSP 平台上对石见穿和猫爪草的全部成分进行筛选;通过查找文献,收集已经证实石见穿和猫爪草具有抗肺癌活性的有效化合物。在DrugBank 上将所有候选化合物寻找药物靶点,并经UniProt 校正为标准基因名称。最后根据Pubchem Cid 查找化合物的2D 结构,利用SwissTargetPrediction 进行靶点预测。将石见穿和猫爪草的预测靶点与药物靶点分别去重汇总得到“石见穿-猫爪草”药对靶点数据集。
1.2 肺癌相关靶点筛选
以“Lung Cancer”为 关 键 字,在GeneCards 和OMIM 检索治疗肺癌的潜在靶点。以“Lung Can‐cer”、“SCLC”、“NSCLC”为关键字,在DrugBank 查找治疗肺癌靶点予以补充。在疾病靶点过多的情况下,以Relevance score≥15 为条件对GeneCards中获得的疾病靶点进行筛选。将已获得的疾病靶点进行汇总去重,建立疾病靶点数据集。
1.3 药物和疾病共同靶点的获取
借助Venny(Version 2.1.0)获得药物和疾病的共同靶点,并绘制韦恩图,可认为是石见穿-猫爪草药对治疗肺癌的候选靶点。
1.4 “药物‐化合物‐靶点‐疾病”网络的构建
使用Cytoscape3.7.2 构建“中药-化合物-靶点-疾病”网络,网络中的节点(node)代表药物、成分、靶点和疾病,节点的大小以节点度值(Degree)表示,节点之间的关系以“边”(edge)表示。
1.5 靶蛋白相互作用网络的构建
在STRING(Version 11.0)平台上以物种为“Homo sapiens”、置信度为0.900 进行检索得到PPI网络。利用BioGrid、InWeb_IM、OmniPath 等数据库进行PPI 的挖掘分析,应用MCODE 进一步筛选核心的网络节点。
1.6 通路富集分析
GO 分析可以预测目标基因在生物过程(BP)、分子功能(MF)和细胞组成(CC)上的联系,而KEGG 则用于研究涉及的主要信号通路。GO 和KEGG 分析通过使用Metascape 完成。基于KEGG结果所映射的相关靶标,以此构建“通路-靶点”网络进一步筛选“猫爪草-石见穿”药对治疗肺癌的关键靶基因。
2 结果
2.1 石见穿、猫爪草活性成分及靶点的获取
共获得2 个石见穿有效成分,12 个猫爪草有效成分。虽然部分化合物OB 和DL 值不符合要求,通过查看化合物“Related Disease”,纳入包含“Lung Cancer”的石见穿有效成分10 个,猫爪草成分6 个。通过查阅文献,补充具有抗肺癌功效的石见穿有效成 分“maslinic acid”[15,16]、“emodin”[17,18]、“salvianolic acid A”[19,20]和“kaempferol”[15,21]。最 终 获 得 石 见 穿有效成分16 个、猫爪草有效成分18 个。
2.2 靶点的获取
在DrugBank 中筛选活性成分的靶点,获得石见穿活性成分对应靶点321 个,猫爪草117 个;以Probability>0.8 在SwissTargetPrediction 对 所 有 活性成分进行靶点预测,得到石见穿预测靶点103 个,猫爪草1 个。将所有靶点汇总后去重,得到药物靶点共276 个。在Genecards 和OMIM 分别得到1 675个、504 个肺癌靶点,在DrugBank 得到治疗肺癌的西药作用靶点293 个疾病靶点,共获2 121 个疾病靶点。通过使用Venny2.1.0,获得164 个药物和疾病的共同靶点,经靶点映射,获得30 个有效化合物,其中石见穿和猫爪草共有的化合物为beta-sitosterol,见图1、表1。

表1 潜在活性成分Tab 1 Potential active ingredients
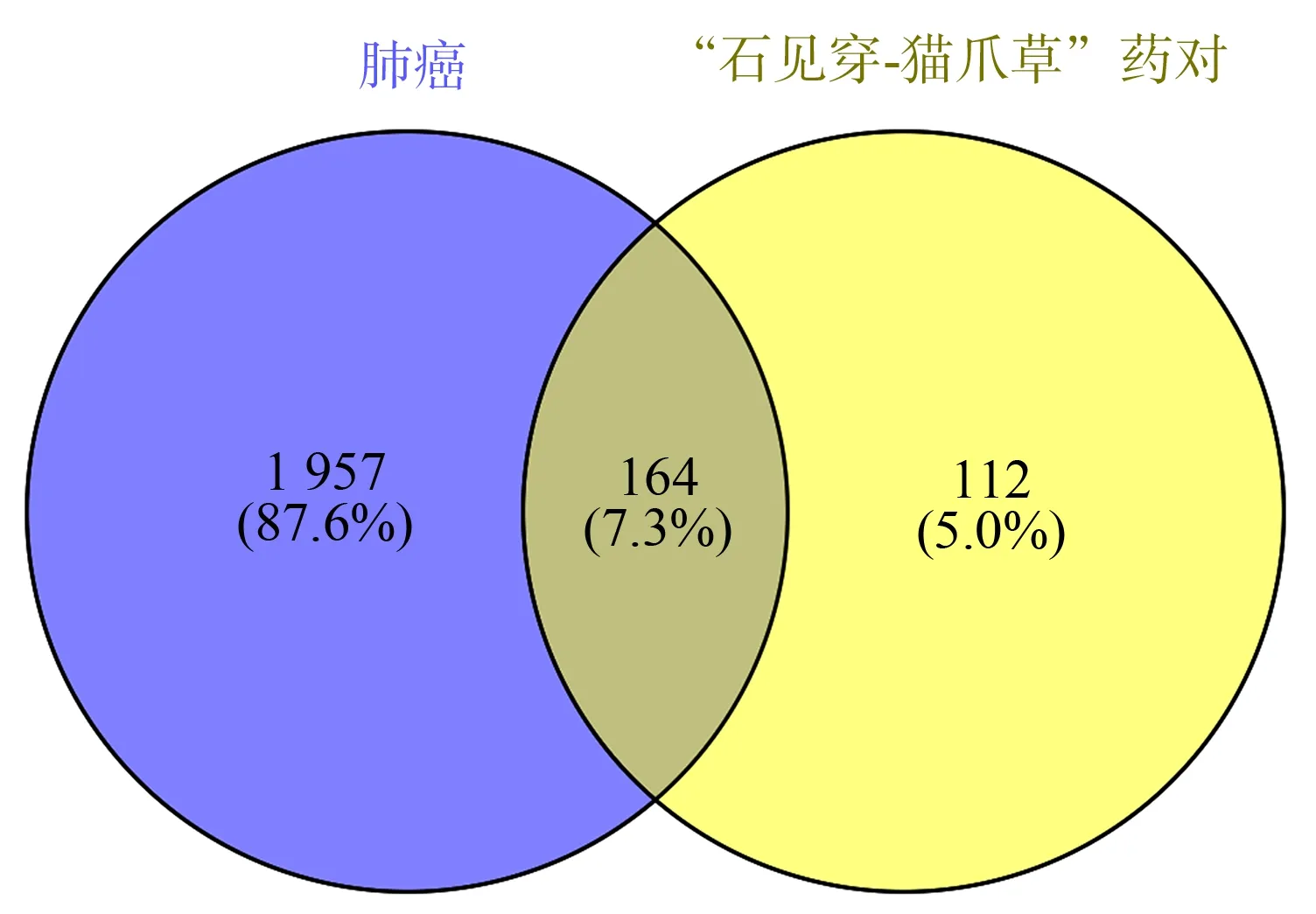
图1 靶点韦恩图Fig 1 Wayne diagram of target
2.3 “药物‐化合物‐靶点‐疾病”网络的构建
“中药-化合物-靶点-疾病”网络由197 个节点和521 条边组成,如图2。分析节点度值可知化合物排名前4 为quercetin、ursolic acid、beta-sitosterol、caffe‐ic acid,分别对应134、43、32、20,这可能是石见穿-猫爪草药对治疗肺癌较为重要的活性成分。
图2 “中药‐化合物‐靶点‐疾病”网络Fig 2 "Traditional Chinese medicine compound target disease" network
2.4 PPI 网络的构建
将164 个共同靶点上传至STRING,剔除13 个游离靶点,得到PPI 网络图,该网络包含151 个靶点和727 条边,见图3。

图3 靶点的PPI 网络Fig 3 PPI network of target
为了更精确地分析“石见穿-猫爪草”药对治疗肺癌的作用机制,通过MCODE 分析密集连接的网络关系,见图4。根据Log10(P)值,分别保留PPI 网络中3 个最佳评分的生物学过程并进行功能描述,见表2。

表2 PPI 内部核心网络模块的功能描述(前3 位)Tab 2 Function description of PPI internal core network module(top 3)

图4 PPI 内部核心网络模块Fig 4 PPI internal core network module
2.5 富集分析
共有2 443 个GO 术语显示富集,其中BP2 174个,CC84 个,MF185 个,KEGG 富 集 有170 条 信 号通路。据negLogP值排序,选择前20 个用R 语言绘制GO 气泡图,选择前20 个与肺癌相关的通路绘制KEGG 气泡图,见图5。
从图5 可知,涉及的主要GO 生物过程有cyto‐kines(细胞因子)、apoptosis(细胞凋亡)、oxidative stress(氧化应激)、hormone stimulus(激素刺激)、plasma membrane transmission(质膜传递)、protein kinase binding and activity(蛋白激酶的结合与活性)等。KEGG 结果包括pathways in cancer(癌症途径),non-small cell lung cancer(非小细胞肺癌),small cell lung cancer(小细胞肺癌),proteoglycans in cancer(癌症中的蛋白聚糖),EGFR tyrosine ki‐nase inhibitor resistance(EGFR 酪 氨 酸 激 酶 抑 制 剂耐药),IL-17 signaling pathway(IL-17 信号通路),TNF signaling pathway(TNF 信号通路),PI3K-Akt signaling pathway(PI3K-Akt 信号通路),Apoptosis(凋亡)等。

图5 富集分析气泡图Fig 5 Bubble diagram of enrichment analysis
为进一步揭示信号通路与候选靶标及化合物之间的关系,构建“通路-靶点”网络,见图6。由图可知,MAPK1、AKT1、PIK3R1、RAF1、EGFR 具有较大的Degree,为关键靶点。

图6 “通路‐靶点”网络Fig 6 "Pathway‐target" network
3 讨论
中药搭配使用具有协同促进作用,但组分更加复杂,对应的靶点也众多,难以阐明具体的作用机制。本研究通过使用网络药理学对现有数据库进行分析,预测“石见穿-猫爪草”药对治疗肺癌的有效成分、关键靶点及信号通路,探讨其分子作用机制。
3.1 潜在有效成分
本研究预测“石见穿-猫爪草”药对为作用于肺癌的主要成分包括quercetin(槲皮素)、ursolic acid(熊果酸)、beta-sitosterol(β-谷甾醇)和caffeic acid(咖啡酸)。
现有实验证实槲皮素能通过STAT3、AMPK/mTOR 通路促进肺癌细胞的凋亡、自噬进而抑制增殖和侵袭[22-25],王静等[26]进一步发现其与吉非替尼联用时可能通过促进细胞凋亡起到协同抑制肺癌细胞增殖的效果。王玉波等[27]则发现槲皮素逆转肺腺癌细胞耐药的机制可能与下调P-糖蛋白和sur‐vivin 蛋白有关。熊果酸主要通过调控miRNA 抑制人A549 细 胞 增 殖、迁 移、侵 袭[28,29]并 促 进 其 凋亡[30,31]以达到抑瘤的效果。G2/M 期是决定细胞有丝分裂的关键时期。周玲玉等[32]发现β-谷甾醇通过引起肺癌细胞在该时期出现阻滞诱导细胞凋亡。Wang 等[33]的 研 究 结 果 表 明β-谷 甾 醇 具 有 治 疗NSCLC 的潜力。目前并无研究表明咖啡酸具有抗癌效果,其主要用于预防肺癌患者放、化疗后出现的白细胞减少[34,35]。
3.2 关键基因靶点
本研究预测MAPK1、AKT1、PIK3R1、RAF1、EGFR 是“石见穿-猫爪草”药对干预肺癌的潜在基因靶标。
MAPK1/ERK2 是MAPK/ERK 信 号 通 路 重 要的蛋白激酶。多项研究表明肺癌细胞中MAPK/ERK 通路过度激活将促进肿瘤细胞的增殖、转移及增加耐药性[36-38]。陈婷等[39]研究发现南方红豆杉水提物含药血清即可通过下调MAPK1/ERK2 表达以增强吉非替尼对人肺癌A549 细胞增殖的抑制作用。许海平等[40]的临床研究同样表明尼妥珠单抗提高非小细胞肺癌患者近期疗效的机制与下调MAPK1/ERK2 表达有关。陈伟庄等[41]则发现肺癌患者血浆MAPK1/ERK2 含量明显高于对照组,对肺癌的诊断有一定参考意义。
AKT1 参与肿瘤细胞增殖、侵袭、转移[42],与肺癌 的 发 生 密 切 相 关[43]。Pan 等[44]的 研 究 表 明 上 调AKT1 表达可促进肺腺癌细胞增殖、转移和抑制凋亡。王 嘉 等[45]发 现65 例NSCLC 患 者 癌 组 织 中AKT1 的表达明显升高,杨艳荣等[46]进一步观察90例NSCLC 患者的远期生存,发现癌组织AKT1 蛋白表达阳性患者的3 年生存率显著低于表达阴性的患者,提示AKT1 蛋白过表达可能是肿瘤进展及不良 预 后 的 危 险 因 素。有 研 究[47,48]表 明AKT1 和AKT2 在肺癌的发生、发展中起反向调控,下调AKT1 抑制肺癌生长,而下调AKT2 则促进肺癌生长,因而在选择性靶向抑制AKT1 可能比同时抑制AKT 三种亚型的更有效,Chorner 等[49]的研究结果支持此观点。
PIK3R1 编码的蛋白p85 为PI3K 的调节亚单位。p85 促使PI3K 活化进而激活PI3K/AKT 通路促进肿瘤细胞增殖、抑制肿瘤细胞凋亡、促进肿瘤血管生成、调控肿瘤细胞周期和促进肿瘤细胞的侵袭与转移[50]。Tian 等[51]的研究表明miR-486-5p 可直接调控PIK3R1 抑制细胞增殖、侵袭和诱导凋亡。孙站兵等[52]通过分析数据库中肺纤维化miRNA 和肺癌mRNA 芯片资料,认为PIK3R1 是肺癌的潜在治疗靶点。
RAF1 是RAS-RAF-MAPK/ERK 信 号 通 路 重要的上游启动因素。Qiu 等[53]发现下调RAF1 可减少非小细胞肺癌细胞增殖,促进凋亡和停滞分裂周期。Tian 等[54]的研究进一步提示RAF1 的下调可能是 由miR-135 作 用 于RAB1B 实 现。Tian[55]和 蔡琴[56]的 研 究 团 队 发 现RAF1 高 表 达 或RAF 激 酶 抑制蛋白的下调是NSCLC 患者进展时间的独立危险因素,RAF1 可能是改善NSCLC 患者预后潜在治疗靶点[57]。
EGFR 突 变 可 引 起PI3K-AKT、RAS-RAFMAPK/ERK 等信号通路激活,促进肿瘤细胞增殖、侵袭、转移及抑制凋亡[58]。EGFR 主要有3 种突变类型,许广辉等[59]的研究发现相对于外显子20 T790M 突 变 和 外 显 子21 L858R 突 变,EGFR 外 显子19 突变的NSCLC 患者有更好的无瘤生存时间,且EGFR 突变类型的差异可能与术后复发及转移部位相关。
3.3 GO 和KEGG 分 析
GO 分析结果表明“石见穿-猫爪草”药对通过调控细胞因子、氧化应激、质膜传递、蛋白激酶的结合与活性、细胞凋亡等过程来发挥抗肺癌的作用。
细胞因子是由多种细胞合成的具有调节细胞生长、免疫应答、促进细胞凋亡和参与炎症反应等丰富生物学功能的小分子多肽或糖蛋白,是肿瘤微环境的重要组成部分[60],与肿瘤的发生、发展密切相关[61]。细胞内的氧化还原稳态对于维持胞内信号的正确传递至关重要[62],氧化应激会导致基因组不稳定,从而引起癌症的发生、转移和进展[63]。Nrf2是氧化应激过程的关键开关[64],在肿瘤组织中Nrf2表达水平明显升高的癌症患者,其生存率较低[65],是判断癌症预后的重要分子标记物。质膜传递、蛋白激酶的结合与活性为细胞内信号传导的关键生物过程,直接调控肿瘤细胞的增殖、分化、凋亡、侵袭和转移。
KEGG 结果显示“石见穿-猫爪草”药对可以直接调控癌症途径、非小细胞肺癌途径和小细胞肺癌途径;还包括EGFR 酪氨酸激酶抑制剂耐药、IL-17、TNF、PI3K-Akt 和凋亡,这与本研究预测靶点的功能基本一致,也证实了本研究的真实性与网络内部的高度关联性。
4 结语
本研究推测“石见穿-猫爪草”药对治疗肺癌的有效成分为槲皮素、熊果酸、β-谷甾醇、咖啡酸等,通过作用于MAPK1、AKT1、PIK3R1、RAF1、EGFR等靶点以调控细胞因子、氧化应激、质膜传递、蛋白激酶的结合与活性、细胞凋亡等过程,主要涉及癌症、非小细胞肺癌、小细胞肺癌途径以及IL-17、TNF、PI3K-AKT 和凋亡等信号通路。经过网络药理学的挖掘,本研究能为临床上“石见穿-猫爪草”药对用于肺癌的合理应用提供科学证据,也为进一步的基础研究提供依据。
作者贡献度说明:
胡佳奇、许博文:对药物和疾病靶点进行了筛选,并构建相互作用网络,最后撰写整篇文章;程孟祺:进行了富集分析;赵雨薇、张兴:对结果进行了讨论;郑红刚、花宝金:为本文的撰写思路提供指导,并给予资金支持。

