真伪熊胆粉物种基源分子生物学鉴定方法的建立及评价
赵 远,贾慧建,宋顺佳,李 琦,邵学超,艾金霞,孙丽媛
(北华大学医学技术学院分子生物学教研室,吉林 吉林 132013)
熊胆粉为脊索动物门哺乳纲熊科动物黑熊(Selenarctos thibetanus G.Cuvier)或棕熊(Ursus arctos Linnaeus)经胆囊术引流胆汁后干燥而得[1],其中含其他中药、动物胆汁和人工合成品不能替代的独有成分熊去氧胆酸[2]。研究[3-5]显示:熊胆粉对治疗中枢神经、肝胆、眼和肛肠等部位疾病有较好疗效。国家食品药品监督管理局审批的含熊胆粉成分的中药制剂有243种,中医的经典处方中有396方包含熊胆,以熊胆为原料的单味制剂熊胆胶囊收录于《中国药典》[6]。
熊胆入药历史长达百年,应用广泛需求量大,因来源稀缺和市场价格昂贵,故有不法商家借机将廉价易得的猪、牛胆汁加工成粉后,混入或冒充熊胆粉出售,以期谋取暴利。绍兴“4.18”非法生产销售“熊胆粉”假药案,总涉案金额高达1亿多元,不仅侵犯了消费者权益,也极大地影响了临床疗效。既往对于熊胆粉的鉴别,传统法主要采取口尝、手搓、火烧和水试等方法[7],受鉴别人员技术能力和经验影响较大,难以实现标准化;之后又以熊去氧胆酸作为检测指标,采用红外光谱测定法[8]、薄 层 色谱 鉴 别 法[9]和高 效 液 相色 谱 法[10-11]等技术鉴别,但此类方法检测指标单一且需大型精密仪器,检测成本高、耗时长。随着分子生物学方法的进步,位点特异性聚合酶链式反应(polymerase chain reaction,PCR)鉴别[12]、DNA条形码分子鉴定[13]、PCR-限制性内切酶酶切长度多态性[14]和荧光PCR[15-16]等分子生物学鉴别方法陆续应用于胆类药材鉴别,但均难以一次实验实现多种胆类同时检测。故亟需建立一种针对性鉴别熊胆粉掺伪的准确、快速且便捷的检测体系。
本研究根据猪、牛和熊线粒体细胞色素b基因设计物种特异性引物,根据不同长度的扩增片段进行鉴定;在物种属特异性PCR体系基础上建立并优化多重PCR体系,达到不同物种混合样品核酸片段同时扩增鉴定的目的。本课题组建立的多重PCR方法可同时检测多种DNA,具有高效、经济和简便等优点,便于基层实施快速检测,适用于常见的熊胆粉掺伪猪胆粉及牛胆粉的鉴别,为我国胆类药材市场监管提供了技术支持。
1 材料与方法
1.1 样品、主要试剂和仪器
熊胆粉购于国家标准物质资源平台,样品编号为D027550,猪胆粉和牛胆粉均由吉林省长春市食品药品检验研究所提供,均已采用液相色谱法鉴定为正品。9份混合胆类药材由标准品胆样按比例混合而成。2×Taq PCR Master Mix、100 bp DNA Ladder、普通琼脂糖凝胶DNA回收试剂盒、pGM-T连接试剂盒、DH 5α感受态细胞和质粒小提试剂盒均购自北京天根生物科技有限公司,三羟甲基氨基甲 烷[tris(hydroxymethyl)methyl aminomethane,Tris] 和乙二胺四乙酸 (ethylene diamine tetraacetic acid,EDTA)购自美国Genview公司,十二烷基磺酸钠(sodium dodecyl sulfate,SDS)购自美国Biosharp公司,无水乙醇(分析纯)、NaAc结晶和异丙醇购自天津市永大化学试剂有限公司,GelRed核酸染料购自美国Biotium公司,琼脂糖购自西班牙Biowest公司。HH-S精密恒温水浴锅购自江苏金坛市医疗仪器厂,NanoDrop One微量核酸蛋白测定仪购自美国Thermo公司,TC9600-G多功能梯度PCR仪购自美国Labnet公司,JY 300E通用型电泳仪购自北京君意东方电泳设备有限公司,UV WHITE-2020D紫外凝胶成像分析仪购自美国Biorad公司。
1.2 熊胆粉及其掺伪品猪胆粉和牛胆粉的DNA提取
取胆粉样品0.1 g,置于1.5 mL Ep管中,加入P1(NaCl、EDTA、Tris、10%SDS、PK酶和dd H2O)溶液500μL,P2(10%SDS)溶液30μL,P3(PK酶)溶液15μL,56℃水浴1 h。加入P4(饱和NaAc)溶液500μL,10 000 g离心10 min。取上清加入等体积P5(异丙醇)溶液,-20℃静置1 h。取出10 000 g离心5 min,弃去上清液。留沉淀加入P6溶液(70%冰冻乙醇溶液)500μL,11 000 g离心5 min,弃上清,并重复操作1次。沉淀室温晾干,双蒸水100μL溶解,作为供试品DNA溶液。采用微量核酸蛋白测定仪检测各方法所得微生物基因组DNA的浓度和纯度,浓度为机器直接读取数据;纯度计算方法:波长为260和280 nm处吸光度(A)值的比值,即A(260)/A(280),每份基因组DNA原液重复测量3次。
1.3 物种特异性引物的设计
在GenBank数据库中选取各动物线粒体细胞色素B基因:猪(AY830188.1)、牛(KU291093.1)和熊(EU573176.1),采用Primer Premier 5.0设计物种特异性引物,引物由生工生物工程(上海)股份有限公司合成。特异性引物序列见表1。

表1 特异性引物序列Tab.1 Sequences of specific primers
1.4 熊胆粉及其掺伪品猪胆粉和牛胆粉检测
物种特异性PCR体系:反应总体积为20μL,其中2×Taq PCR Master Mix 10μL,上游引物和下游引物(10 mg·L-1)各1.5μL,DNA模板(10 mg·L-1)1.5μL,无 菌ddH2O 5.5μL。PCR参数:94℃预变性5 min,94℃、30 s,60℃、30 s,72℃、30 s,循环35次,延伸72℃、10 min,4℃保存。
三重PCR体系:反应总体积为20μL,其中2×Taq PCR Master Mix 10μL;不同物种上下游引物(10 mg·L-1)各0.5μL,共计3μL;每一物种DNA模板(10 mg·L-1)0.5μL,共计1.5μL;无菌ddH2O 5.5μL。PCR参数:94℃预变性5 min,94℃、30 s,60℃、30 s,72℃、30 s,循环35次,延伸72℃、10 min,4℃保存。
PCR产物检测:5μL产物点样于1.5%琼脂糖凝胶,电压85 V、85 min。采用紫外凝胶成像仪观察检测结果。
1.5 物种特异性基因片段克隆和测序比对
紫外凝胶成像仪下取不同物种特异性DNA扩增片段进行凝胶回收,测定其DNA浓度。将目的基因与pGM-T载体连接为重组DNA,转化至DH 5α感受态细胞中,涂于LB培养基上,37℃过夜培养。次日挑取白色阳性重组菌落置于LB液体培养基,37℃培养过夜。提取质粒DNA,扩增后琼脂糖凝胶电泳检测。
质粒DNA浓度测定:选取浓度超过100 mg·L-1的样本,送至上海生物工程股份有限公司测序,并对测序结果与靶基因比对分析。序列结果经NCBI-Nucleotide BLAST分析。
1.6 方法学评价
1.6.1 引物的特异性评价 将猪、牛和熊胆粉提取的DNA分别以猪、牛及熊进行物种特异性引物扩增,参照“1.4”中物种特异性PCR体系及条件扩增,对引物的特异性进行检测。PCR过程中均以dd H2O作为空白对照。依据电泳结果评价引物的特异性。
1.6.2 多重PCR反应体系的特异性评价 以1为递减数量依次减少体系中模板DNA物种数,按“1.4”步骤中三重PCR体系及参数进行扩增,检测多重PCR体系的特异性。PCR过程中均以ddH2O作为空白对照。依据电泳结果评价多重PCR体系的特异性。
1.6.3 多重PCR体系的灵敏度评价 将提取的熊胆粉、猪胆粉和牛胆粉DNA模板检测浓度后稀释至102mg·L-1,采用ddH2O 10倍梯度稀释直至10-5mg·L-1,作 为PCR体 系DNA模 板。参照“1.4”步骤中三重PCR体系及参数,同时保持其中2种模板浓度始终不变,剩余物种模板浓度依次为102~10-5mg·L-1。依据电泳结果评价多重PCR体系的灵敏度。
1.6.4 混合胆样检测评价重复性 模拟掺假可能性,制备混合胆样,每种模拟混合方式制备3份,共计27份样品。参照“1.2”步骤中方法提取DNA,参照“1.4”步骤进行电泳,电泳后采用紫外凝胶成像分析仪观察结果。随机抽取其中5份混合胆样DNA,对检测体系进行重复性评价。见表2。

表2 样品模拟混合方式及其构成比Tab.2 Simulation mixing modes of samples and their component ratios
2 结 果
2.1 熊胆粉及其掺伪品猪和牛胆粉DNA的提取
将胆粉样DNA经微量核酸蛋白测定仪测定浓度和纯度,重复3次。A(260)/A(280)处于1.70~2.00,质量浓度均高于100 mg·L-1,该方法提取获得的DNA样品基本无蛋白质污染且纯度高,证明本研究建立的胆类药材DNA提取方法可有效提取胆类药材DNA。见表3。

表3 胆类药材基因组DNA检测结果Tab.3 Genomic DNA test results of biliary herbs
2.2 克隆鉴定及其序列比对
克隆鉴定结果与预期目的条带位置一致,琼脂糖凝胶电泳图谱分别于267、157和218 bp处出现单一特异性条带。见图1。

图1 猪、牛和熊胆粉克隆质粒的DNA PCR扩增产物电泳图Fig.1 Electropherogram of DNA PCR amplification products of suis fellis pulvis,pulvis billis bovis,and bear bile powder clone vectors
测序结果在NCBI-Nucleotide上采用相似性搜索算法(basic local alignment search tool,BLAST),与GenBank中已登记的猪(AY 830188.1)、牛(KU 291093.1)和熊(EU 573176.1)序列同源性达99%以上,证明多重PCR检测体系特异性试验结果的准确性及PCR扩增的特异性基因片段序列的正确性,同时也表明克隆的DNA片段分别为猪、牛和熊目的基因片段。见图2。

图2 猪(A)、牛(B)和熊(C)目的基因测序图谱及序列比对分析Fig.2 Sequencing maps and sequence alignment analysis on target genes of pig(A),bovine(B),and bear(C)
2.3 特异性检测
各物种引物特异性试验中分别仅于猪、牛和熊目的条带处见单一特异条带,其余泳道皆无条带,表明本研究所设计引物特异性良好。1~7号泳道依次见:猪、牛、熊、猪/牛、猪/熊、牛/熊和猪/牛/熊特异性条带。初步表明本研究所建立三重PCR引物之间互不干扰,体系特异性良好。见图3。
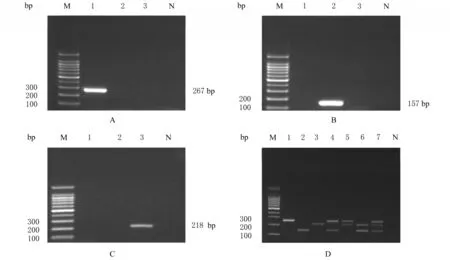
图3 引物特异性检测电泳图Fig.3 Electrophoregrams of specific test of primers
2.4 灵敏度检测
猪胆粉、牛胆粉和熊胆粉最低检测限均可达到1 mg·L-1,其他2种特异条带亮度不受影响。表明本研究所建立多重PCR检测体系结果稳定,当任意一种DNA减少至1 mg·L-1时,仍可准确检测,且无交叉干扰。见图4。

图4 多重PCR体系的灵敏度检测电泳图Fig.4 Electropherograms of sensitivity detection of multiplex PCR system
2.5 混合熊胆样品检测
模拟混合样品经DNA提取和多重PCR检测体系扩增后,未加入DNA模板的阴性对照泳道无条带,其余各泳道条带有无及明暗情况与各样品原模拟混合方式大致相符。表明该多重PCR检测体系特异性良好,3种特异性检测成分的构成比变化不影响检测的准确性,可基本满足熊胆粉中实际动物源性掺伪情况检测。见图5。

图5 混合熊胆样品琼脂糖凝胶电泳图Fig.5 Agargel electrophoregram of mixed bear bile samples
3 讨 论
熊胆粉是传统的名贵中药材,被誉为四大动物药材之首,已有上千年药用历史[17]。胆粉类药材形态相似,肉眼不易直观分辨[18],为确保熊胆粉产品的用药功效,避免对患者带来生命财产的严重损失,弘扬中医药文化,有必要建立鉴别熊胆粉掺伪检测的方法。
对于熊胆粉内化学成分鉴定,王一博等[19]建立了对5种胆汁酸应用高效液相色谱-电雾式检测器实现同时测定的检测方法;石岩等[20]建立了测定熊胆粉主要胆汁酸类成分的HPLC-ELSD方法;李晓琼等[21]采用一测多评法同步测定了熊胆粉中3种胆酸类成分含量,以熊去氧胆酸为内参物,实现定量分析。上述方法弥补了检测指标单一、紫外基线漂移和灵敏度差等问题,可较为全面反映熊胆粉中胆汁酸成分含量。但熊胆粉的药理作用机制尚未清楚,有关针对非胆汁酸类成分研究较少,其可能也在熊胆粉中发挥作用。已有研究[2]表明:可人工合成熊去氧胆酸,以其为指标鉴别熊胆粉真伪易产生假阳性结果。
许亚春等[22]基于DNA条形码技术对名贵中药材熊胆粉及混伪品构建邻接树,该方法虽具有很强物种特异性,但只能检测出是否存在特定物种,只能对纯正品或纯伪品提供鉴定。本研究采用改良SDS-蛋白酶K裂解法(SDS proteinase K cleavage,SDS-PK)法提取含有胆汁酸类样品DNA,其浓度高、纯度好,为多重PCR检测体系鉴别熊胆粉掺伪提供了良好的先决条件。基于多重PCR原理,根据猪、牛和熊线粒体细胞色素b基因设计出物种特异性引物,建立针对猪胆粉、牛胆粉和熊胆粉的多重PCR检测体系,依据不同长度的扩增片段进行鉴定。具有特异性强、灵敏度高和重复性好等优点,最低检测限可达到1 mg·L-1,且模拟实际掺假情况下,DNA含量低至检测样品总DNA含量10%时,仍可准确检测。与其他检测技术比较,其对混合品鉴别时具有高效性的特点,可实现熊胆粉伪品一次检测,即同时检出多种动物源性成分掺假,大大缩短了检测周期。
田娜等[23]基于STR分型原理建立用于胆粉类药材及其掺杂样品的通用DNA指纹图谱鉴别方法,但该法分型结果对仪器分辨率、片段大小准确性和操作人员等要求高,使其应用受到限制。本研究采用的检测方法无需昂贵的检测仪器,经济便捷,具有应用价值,适用于胆类药材市场质控监测。为方便后续商品化试剂盒组装应用,本课题组将猪、牛和熊物种特异性条带克隆作为阳性对照,解决实际应用中标准品难以获取的问题。后续可将本研究成果通过荧光定量PCR技术,建立多重荧光定量检测体系,进一步实现对待测样品中胆类药材DNA含量的精确检测。

