miR-152降低低密度脂蛋白受体表达对子宫内膜癌细胞增殖和侵袭的抑制作用
汪国武,姚 远,张 雨,徐 娜,刘 芳
(1.石河子大学医学院第一附属医院妇产科,新疆 石河子 832000;2.四川省遂宁市中心医院妇科,四川 遂宁 629000;3.新疆维吾尔自治区石河子市人民医院妇科,新疆 石河子 832000;4.南方医科大学第五附属医院妇科,广东 广州 510900)
子宫内膜癌(endometrial carcinoma,EC)是女性生殖系统最常见的恶性肿瘤之一,由于其发病机制复杂,在国内外均具有较高的死亡率,EC已成为医学和社会亟待解决的棘手问题之一[1-2]。研究[3-5]显示:非编码RNA在EC发生发展中发挥重要作用,尤其是微小RNA(microRNAs,miRNAs)对调控EC细胞增殖、侵袭和迁移起重要作用。miRNAs是一类小的非编码RNA,能抑制mRNA的 翻 译 或 促 进 其 降 解[6]。研 究[7-9]显 示:微 小RNA-152(microRNA-152,miR-152)在多种恶性肿瘤的增殖、侵袭和迁移过程中发挥作用。近些年来miR-152在EC中的作用也受到越来越多学者的关注。通过EC的miRNA表达谱发现了miR-152在EC组 织 中 低 表达[10],动 物实 验[11]结 果显 示miR-152参与了子宫内膜上皮细胞的增殖,但miR-152如何调控代谢在EC发生发展中发挥的作用尚不清楚。低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)是低密度脂蛋白(low-density lipoprotein,LDL)的受体,其可调控LDL的胞吞作用,对维持人体中胆固醇稳态和血浆中LDL处于相对恒定的水平具有重要作用[12]。研究[13]显示:异常的LDLR与多种癌症的发生密切相关。本研究探讨miR-152对EC细胞增殖和侵袭的影响及其与靶基因LDLR的关系,为研究EC的发病机制和靶向治疗方案提供依据。
1 资料与方法
1.1 组织来源选取2017年9月—2019年12月石河子大学医学院第一附属医院妇科收治且病理检查诊断为EC的患者21例作为肿瘤组,同期收治的39例非EC但行子宫切除术者作为对照组。肿瘤组和对照组患者内膜组织标本与年龄、身高、体质量(body mass,BM)、体质量指数(body mass index,BMI)、收缩压(systolic blood pressure,SBP)、舒张 压(diastolic blood pressure,DBP)、腰 围(waistline circumference,WC)和腹围(abdomina circumference,AC)等临床资料比较差异均无统计学意义(P>0.05),具有可比性。检测2组患者甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、LDL、高密度脂蛋白(highdensity lipoprotein,HDL)和Ki-67水平。所有患者在术前均未行放化疗治疗。
1.2 细胞、主要试剂和仪器EC RL 95-2细胞和293T细胞购自中国科学院上海细胞库。实时荧光定量聚合酶链式反应(real-time fluorescence quantitative PCR,RT-qPCR)实验所需试剂均购自北京天根生化有限公司,蛋白Marker购自美国Thermo公司,LDLR抗体(1∶500)和β-actin抗体(1∶10 000)均购自美国Abcam公司,二抗(羊抗鼠/兔)和ECL发光液购自广州碧云天公司,1640培养基、青/链霉素、澳洲胎牛血清和0.25%胰酶均购自美国Gibco公司,CCK-8试剂盒购自日本Dojindo公司,Lipofectamine 2000试剂盒和TRIzol购自美国Invitrogen公司,Matrigel基质胶和Transwell小室购自美国Corning公司,miR-152 mimics、pcDNA 3.1-LDLR和对照序列均购自上海吉玛公司,双荧光素酶报告基因检测试剂盒购自美国Promega公司。电泳仪购自美国Bio-Rad公司,酶标仪购自美国Thermo Fisher公司,CO₂细胞培养箱购自上海力康医疗设备有限公司,倒置显微镜购自德国蔡司公司。
1.3 生物信息学软件预测miR-152下游靶基因采用生物信息学数据库TargetScan 7.2(www.targetscan.org)和miRDB(www.mirdb.org)数据库预测miR-152的下游靶基因及其评分。
1.4 RT-qPCR法检测子宫内膜组织和细胞中miR-152及LDLR m RNA表达水平采用液氮将组织和细胞研磨至粉末状,向其加入TRIzol试剂提取总RNA,检测其浓度和完整性,对检测合格的样本分别按照PrimeScript RT Reagent Kit with gDNA Eraser试剂盒和RT-qPCR试剂盒说明书逆转录和加样,引物序列:miR-152 Forward 5′-GATAATTGGCCTTGCCAGTA-3′, miR-152 Reverse 5′-GTGTGTAGAGGTCAGGAAGT-3′;U6-Forward 5′-GGTAGCCGCGGTTGAAATGG-3′,U6-Reverse 5′-CAGTAAGCAGTAAAGTCGA-3′;LDLR-Forward 5′-CTGTAGGGGTCTTTACGTGTTC-3′,LDLR-Reverse 5′-GTTTTCCTCGTCAGATTTGTCC-3′;以β-actin作为内参。采用2-△△Ct法计算内膜组织和细胞中miR-152和LDLR mRNA的表达水平。
1.5 Western blotting法检测子宫内膜组织和细胞中LDLR蛋白表达水平组织和细胞总蛋白的提取按照试剂盒说明书进行,对其进行浓度测定,计算总蛋白浓度后依次进行点样电泳。将电泳后的产物切胶,采用电转系统(300 mA)将10%SDSPAGE凝胶电泳转移至PVDF膜上。采用5%脱脂牛奶摇床密封1 h,PBST清洗PVDF膜,采用LDLR抗体(1∶500)于4℃摇床上孵育过夜,PBST清洗PVDF膜,将其置入稀释好的辣根过氧化物酶标记的抗体(1∶500)中室温下孵育1 h,采用极敏感ECL化学发光试剂盒(P0018FT)进行曝光成像,以β-actin(1∶10 000)作为内参蛋白,采用Image J软件分析目的蛋白和内参蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参β-actin条带灰度值。
1.6 免疫组织化学染色检测子宫内膜组织中LDLR表达情况免疫组织化学检测的操作按照EnVision两步法操作说明进行。LDLR免疫组织化学检测抗体进行检测(1∶250),Ki-67抗体(克隆号MIB.I)由北京中杉金桥生物技术有限公司提供,结果判读由石河子大学医学院第一附属医院病理科2名副主任医师独立盲审,根据肿瘤细胞阳性比例和细胞膜着色深度进行综合评分。总分≥3分判读为阳性表达,总分<3分判读为阴性表达。评分标准:①按肿瘤细胞阳性比例进行评分,同一显微镜下计算肿瘤细胞阳性数,染色阳性细胞占肿瘤细胞的比例<10%计0分,10%≤比例<30%计1分,30%≤比例<70%计2分,比例≥70%计3分;②按细胞着色深度评分,无着色计0分,呈淡棕黄色计1分,棕黄色计2分,棕褐色计3分。
1.7 细胞培养、转染和分组RL 95-2细胞采用1640基础培养基+10%FBS+1%双抗青霉素链霉素培养液,培养条件为37℃、5%CO2饱和湿度,采用0.25%胰酶消化对数增长期的RL 95-2细胞,选取传代3代的RL95-2细胞进行转染。根据细胞转染物质的不同,分为空质粒组(转染miR-NC空质粒)、miR-152组(转染miR-152-mimics)、miR-152-mimics+pcDNA 3.1-vector组(同时转染miR-152 mimics和pcDNA 3.1-vector) 和miR-152-mimics+pcDNA 3.1-LDLR组(同时转染miR-152-mimics和pcDNA 3.1-LDLR)。转染步骤严格参照Lipofectamine 2000试剂盒说明书进行。转染后的细胞继续培养48 h,用于后续实验。
1.8 CCK-8法检测各组RL 95-2细胞增殖率将各组成对数生长的RL 95-2细胞消化后重悬,在96孔板中每孔加入3×103个细胞,置入培养箱中继续培养。24 h后,将旧培养基丢弃,每孔加入100μL含10%胎牛血清的DMEM培养基和10μL CCK-8溶液,置入培养箱中继续培养1 h,于450 nm处检测3组细胞的吸光度(A)值,以A值代表各组RL 95-2细胞增殖率,每组细胞设置3个复孔。在48、72和96 h时,再次进行上述操作,并采用GraphPad Prism 8软件进行绘图。
1.9 Transewell法检测各组侵袭细胞数冰上将Matrigel按照1∶10的比例与预冷的无血清DMEM培养基混匀,在Transewell小室中加入上述混合液100μL,在培养箱中孵育1 h使其凝结成胶。之后在每个Transewell小室上部加入200μL无血清DMEM与含4×104个RL 95-2细胞的混悬液,小室下部加入600μL含10%胎牛血清的DMEM培养基,置入培养箱中培养24 h,每组细胞均设置3个复孔。24 h后,采用棉棒擦拭Transewell小室上层细胞,4%多聚甲醛固定30 min后采用结晶紫染色20 min后拍照。
1.10 双荧光素酶报告基因实验检测各组293T细胞中荧光素酶活性将构建好的LDLR野生型或突变型序列插入至pmiR质粒载体中,随后重组的Mut-LDLR和WT-LDLR载体与miR-152-mimic共同转入293T细胞中,培养24 h后去除培养液,PBS洗涤3次,加入细胞裂解液,收集细胞用于双荧光素酶报告基因检测系统分析荧光素酶活性。荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.11 统计学分析采用SPSS18.0统计软件和Graphpad Prism 8.0软件进行统计学分析。肿瘤组和对照组患者子宫内膜组织中miR-152和LDLR mRNA表达水平、RL 95-2细胞增殖率、侵袭细胞数和细胞荧光素酶活性均符合正态分布,以±s表示,多组间比较采用单因素方差分析,组间样本均数两两比较采用两独立样本t检验,miR-152与LDLR mRNA在EC内膜组织中表达的相关性分析采用Pearson相关分析法。以P<0.05为差异有统计学意义。
2 结 果
2.1 2组患者一般资料和生化指标肿瘤组和对照组患者年龄、SBP、DBP及HDL比较差异均无统计学意义(P>0.05);此外,肿瘤组患者BMI、BM、WC、TC、TG和LDL均明显高于对照组(P<0.05)。见表1。
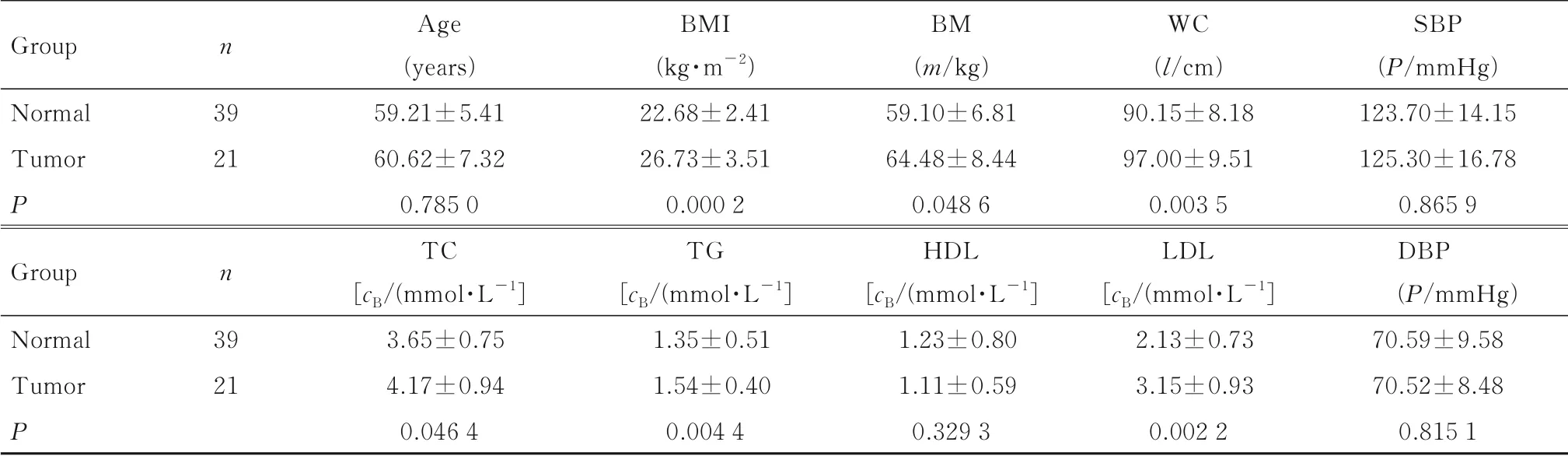
表1 2组患者一般资料和生化指标T ab.1 General data and biochemical indexes of patients in two groups
2.2 miR-152与LDLR的靶向关系采用生物信息学数据库TargetScan预测LDLR与miR-152存在一定的互补碱基对,构建了LDLR的野生型(WT)或突变型(Mut)3′UTR的质粒,见表2。并采用miRDB数据库预测靶基因LDLR的分值,LDLR的评分为99分。见表3。

表2 TargetScan预测miR-152与LDLR的靶向关系Tab.2 Targeting relationship between miR-152 and LDLR predicted by TargetScan

表3 miRDB数据库预测靶基因LDLR的分值Tab.3 Score of target gene LDLR predicted by miRDB database
2.3 2 组患者子宫内膜组织中miR-152和LDLR mRNA及蛋白表达水平肿瘤组患者子宫内膜组织中miR-152表达水平明显低于对照组(P<0.05),LDLR mRNA和蛋白表达水平均明显高于对照组(P<0.05或P<0.01)。免疫组织化学检测结果显示:肿瘤组患者子宫内膜组织中LDLR阳性表达率为66.67%(14/21),对照组患者子宫内膜组织中LDLR阳性表达率为30.77%(12/39),组间比较差异有统计学意义(P<0.05)。对LDLR mRNA的表达与miR-152表达水平相关性分析结果显示:LDLR mRNA表达水平与miR-152表达水平呈 负 相 关 关 系(r=-0.4387,P<0.05)。对LDLR mRNA表达与患者一般资料及生化指标的相关性分析结果显示:LDLR mRNA表达水平与患者Ki-67、BMI、TC、TG、BM和WC均呈正相关 关 系(r=0.4490,r=0.4377,r=0.4472,r=0.4706,r=0.5882,r=0.5130,P<0.05)。见图1~4。

图1 2组患者子宫内膜组织中miR-152和LDLR mRNA及蛋白表达水平Fig.1 Expression levels of miR-152 and LDLR mRNA and proteins in endometrial tissue of patients in two groups
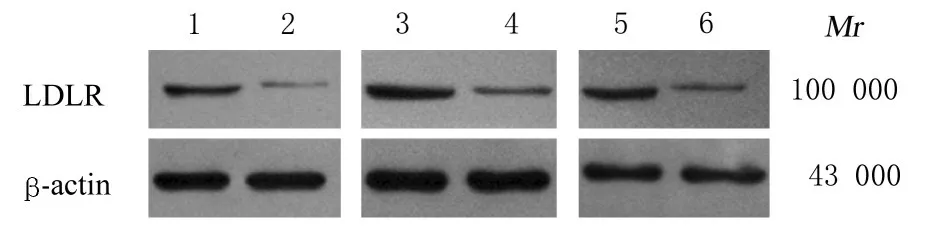
图2 2组患者子宫内膜组织中LDLR蛋白表达电泳图Fig.2 Electrophoregram of expressions of LDLR protein in endometrial tissue of patients in two groups

图3 免疫组织化学检测2组患者子宫内膜组织中LDLR蛋白表达情况(×100)Fig.3 Expressions of LDLR protein in endometrial tissue of patients in two groups detected by immunohistochemistry(×100)

图4 miR-152表达水平与LDLR mRNA表达水平的相关性Fig.4 Correlation between miR-152 expression level and LDLR mRNA expression level
2.4 miR-152过表达后各组RL 95-2细胞增殖率和侵袭细胞数CCK-8法检测结果显示:转染miR-152 mimics后,miRNA-152 mimics组细胞增殖率较对照组和miRNA-NC组明显降低(P=0.048,P=0.032)。Transwell实验在400倍显微镜下随机选取5个视野进行细胞计数:miR-152 mimics组和miRNA-NC组侵袭细胞数分别为(145.21±8.32)个和(49.21±6.46)个,miR-152 mimics组侵袭细胞数明显多于miR-NC组。见图5和6。

图5 CCK-8法检测miR-152过表达后各组RL 95-2细胞增殖率Fig.5 Proliferation rates of RL 95-2 cells in various groups after over-expression of miR-152 detected by CCK-8 method
2.5 LDLR作用后各组RL 95-2细胞增殖率和侵袭细胞数将miR-152 mimics和pcDNA 3.1-LDLR或pcDNA 3.1-vector空载体转染至RL 95-2细胞,于转染48 h后收集细胞。通过CCK-8法和Transwell试剂盒检测转染后EC细胞增殖和侵袭能力结果显示:转染72和96 h时,miR-152 mimics+pcDNA 3.1-LDLR组细胞增殖率明显高于miR-152 mimics组和miR-152 mimics+pcDNA 3.1-vector组(P<0.01),见图7。Transwell法检测中在400倍显微镜下随机选取3个视野进行细胞计数,miR-152 mimics+pcDNA 3.1-LDLR组、miR-152 mimics组和miR-152 mimics+pcDNA 3.1-vector侵袭细胞数分 别 为 (92.23±5.46)、(41.34±3.78) 和(37.92±4.13)个,即miR-152 mimics+pcDNA 3.1-LDLR组侵袭细胞数明显高于miR-152 mimics组和miR-152 mimics+pcDNA 3.1-vector 组 (P<0.01)。见图7和8。

图7 CCK-8法检测各组RL 95-2细胞增殖率Fig.7 Proliferaton rates of RL 95-2 cells in various groups detected by CCK-8 method

表4 LDLR mRNA表达水平与EC患者一般资料和生化指标相关性Tab.4 Correlations between expression level of LDLR and general data,biochemical indexes of patients with EC
2.6 各组293T细胞中荧光素酶活性与对照组比较,miR-152 mimics组转染野生型(WT)LDLR 3′UTR载体的293T细胞荧光素酶活性明显降低(P<0.01)。见图9。

图6 Transwell法检测miR-152过表达后2组RL 95-2细胞侵袭能力(结晶紫,×100)Fig.6 Invasion abilities of RL 95-2 cells in two groups after over-expression of miR-152 detected by Transwell assay(Crystal violet,×100)

图9 双荧光素酶报告基因实验检测2组293T细胞中荧光素酶活性Fig.9 Luciferase activities of 293T cells in two groups detected by dual luciferase reporter gene assay.
3 讨 论
miRNAs是只有20个核苷酸片段的内源性非编码RNA,虽然不直接参与蛋白质表达,却通过与靶基因结合,参与调控约1/3的蛋白质表达[14-15]。近年来研究[16-17]显示:多种miRNAs与恶性肿瘤的发生发展关系密切,在恶性肿瘤的发生发展中发挥抑癌或促癌作用,与下游靶基因相互作用在细胞增殖、分化、凋亡和侵袭迁移中发挥重要的调控作用。

图8 Transwell法检测各组RL 95-2细胞侵袭能力(结晶紫,×100)Fig.8 Invasion abilitiesof RL 95-2cellsin variousgroupsdetected by Transwell assay(Crystal violet,×100)
miR-152是miR-152/148a/148b家族成员之一,首先发现于小鼠的结肠组织中,位于11号染色体上,之后在人类组织中被发现,位于人17号染色体上,在多种恶性肿瘤组织中异常表达[18],与多种恶性肿瘤的预后关系密切,如miR-152通过抑制靶基因DNMT 1的表达,抑制卵巢癌细胞增殖,促进细胞凋亡[19]。此外miR-152可以靶向KLF5抑制宫颈癌细胞的增殖和细胞周期[20]。上述研究均提示miR-152在恶性肿瘤的发生发展过程中发挥抑癌作用,但在鼻咽癌中,miR-152抑制癌细胞的凋亡,通过靶向PTEN的表达促进细胞的增殖[21],证实了miR-152在不同的肿瘤中表达不同,并且生物功能也不同。本研究检测肿瘤组和对照组患者子宫内膜组织中miR-152表达结果显示:肿瘤组患者子宫内膜组织中miR-152表达水平较对照组明显降低,过表达RL 95-2细胞中miR-152表达可抑制EC细胞的增殖和侵袭能力,miR-152与EC的恶性进展有关。
LDLR是其家族的第一个成员,该家族由多个跨膜糖蛋白组成[22]。这些跨膜糖蛋白主要负责内化脂蛋白、外毒素和其他细胞外配体,最后被溶酶体降解[23]。研究[24-25]显示:LDLR与许多癌症相关,例如LDLR的表达与前列腺癌和宫颈癌的临床预后密切相关。最近文献[26]报道:在肝细胞癌中,LDLR是肝癌患者预后因素,并且下调LDLR可提高细胞内胆固醇合成,加速肝癌细胞的增殖,其机制部分归因于激活MEK/ERK信号通路。本研究结果显示:肿瘤组患者子宫内膜组织中LDLR高表达,提示LDLR与EC的发生发展密切相关,并且肿瘤组患者子宫内膜组织中LDLR的表达与Ki-67、BMI、TC、TG、BM和WC呈正相关关系,与miR-152表达呈负相关关系,即高血脂及肥胖的EC患者LDLR表达越高,EC细胞的增殖活力越强。因此,过表达miR-152可抑制EC细胞增殖和侵袭,再次加入LDLR后,EC细胞的增殖和侵袭得到恢复,提示miR-152通过抑制LDLR表达影响EC细胞增殖和侵袭。
综上所述,miR-152过表达对EC细胞的增殖和侵袭具有抑制作用,其机制可能与降低LDLR表达有关,本研究结果为EC的治疗提供了新靶点,但miR-152是否调控肿瘤其他恶性行为尚不清楚,有待进一步研究。

