骨髓间充质干细胞来源外泌体诱导自噬对MPP+抑制SH-SY5Y细胞存活的影响及其机制
汪文涛,米旭光,周 阳,蒲文星,高佳旭,景 猛,孟繁凯
(1.长春中医药大学临床医学院外科学,吉林 长春 130117;2.吉林省人民医院中心实验室,吉林长春 130021;3.吉林释然司法鉴定中心法医组,吉林长春 130022;4.吉林省人民医院神经外科,吉林 长春 130021)
在神经系统疾病中,无论是脑外伤(例如慢性硬膜下血肿、慢性硬膜外血肿和脑挫裂伤等)还是慢性神经系统疾病(例如帕金森病和阿尔茨海默病等)[1]均存在不同程度的神经细胞氧化损伤。神经细胞损伤会影响神经系统,患者会出现相应的肢体活动和感觉障碍,影响患者的日常活动。自噬是一种将细胞中损伤的细胞器和错误折叠的蛋白质呈递到溶酶体中进行消化降解和实现物质代谢需要的过程,目的是实现细胞自身的内稳态及细胞器的更新[2]。当细胞受到缺血、缺氧和能量供应障碍等应激刺激时,原本平衡的自噬功能被破坏[3],细胞就会发生氧化损伤,甚至死亡。自噬不足会导致细胞中有害物质得不到及时的清理,继而加重细胞损害,自噬过度又会导致自噬体可能过度吞噬包裹正常功能的细胞器,亦会加重细胞损伤[4]。有研究[5]显示:在神经细胞损伤模型中机体的细胞通过骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)外泌体(exosomes,Exo)激活自噬,增强细胞自噬可明显减轻神经细胞的氧化损伤,同时降低细胞死亡率。BMSCs及其外泌体在神经细胞修复中均发挥重要作用,BMSCs来源Exo(BMSCs-Exo)对SH-SY 5Y细胞的影响一方面是通过改变神经细胞所处的微环境,另一方面是将功能性的miRNA和蛋白质传递给神经元,促进神经元重塑,抑制细胞凋亡,进而促进功能恢复[6]。
本研究采用已1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridine ion,MPP+)诱导人神经母细胞瘤SH-SY 5Y细胞存活率降低的相关模型,探讨BMSCs-Exo抵抗细胞存活率下降的机制。
1 材料与方法
1.1 细胞、主要试剂和仪器BMSCs和人神经母细胞瘤SH-SY 5Y细胞为吉林省人民医院中心实验室传代保存。DMEM-HIGH GLUCOSE培养基(SH 30022.01)购自美国Hyclone公司,雷帕霉素(rapamycin,Rap)和胰蛋白酶(FG301-01)购自美国TRANS公司,3-甲基腺嘌呤(3-methyl adenine,3-MA)、胎牛血清(FB15015)购自美国CLARK公司,双抗(HY-K1006)购自美国MedChemExpress公司,无血清培养基(#05445)和无血清消化液(#05426)购美国自STEMCELL公司,无血清冻存液(05-713-1)购自美国BI公司,MPP+(N137206)和二甲基亚砜(D103280)购自美国Aladdin公司,噻唑兰[3-(4,5)-dimethylthiahiazo ( -2-y-l) -3, 5-di-phenytetra zoliumromide,MTT](M 8180)购自美国Solarbio公司,吖啶橙(A 60114)购自美国Sigma公司。超净台(1300 SERIES A 2)、细胞培养箱(Thermo3111)、高速离心机(Thermo-hera)和酶标仪(Multiskan Mk3)购自美国Thermo公司,低速离心机(SC-3616)购自安徽ZONKIA公司,-80℃冰箱(DW-861500)购自青岛澳柯玛股份有限公司。
1.2 细胞培养和分组将人神经母细胞瘤SHSY 5Y细胞常规培养于含10%胎牛血清和1%双抗的DMEM高糖培养基中,置于37℃、5%CO2培养箱中培养。每天倒置光学显微镜下观察细胞状态,待细胞长至80%~90%融合度时,采用胰酶进行消化传代。将细胞铺于96孔板或6孔板。
实验分为对照组[给予相应容积的磷酸盐缓冲液(phosphate buffered saline,PBS)]、MPP+组(给予0.50 mmol·L-1MPP+)、MPP++BMSCs培养上清液(BMSCs-Sup)组(给予0.50 mmol·L-1MPP+和BMSCs-Sup)、MPP++BMSCs-Exo组(给予0.50 mmol·L-1MPP+和100 mg·L-1BMSCs-Exo)、MPP++Rap组(给 予0.50 mmol·L-1MPP+和2μmol·L-1Rap)和MPP++BMSCs-Exo+3-MA组(给 予0.50 mmol·L-1MPP+、100 mg·L-1BMSCs-Exo和1 mmol·L-13-MA)。处理48 h后采用相应试剂盒行相关检测。BMSCs培养、传代采用无血清培养体系,步骤参照试剂说明书。
1.3 Exo的提取和检测无血清培养BMSCs:收集BMSCs指数增长期的培养液,在BMSCs指数增长期收集培养上清液,2 500 r·min-1离心5 min,收集上清。MPP++BMSCs-Sup组细胞加入BMSCs培养上清液。50%体积比的上清培养液含1体积SH-SY 5Y细胞正常培养液和1/2体积干细胞培养上清液。BMSCs-Exo提取:待BMSCs生长至80%时,于2℃-6℃以3 000 g离心10 min,收集上清。采用外泌体提取试剂盒说明书方法收集Exo。Exo的定量:采用BCA法,依据全式金蛋白质定量试剂盒说明书的步骤对收集的Exo进行蛋白定量。
1.4 MTT法检测各组SH-SY 5Y细胞存活率将SH-SY 5Y细胞铺于96孔板中,每孔5 000个细胞。采用不同浓度(0、0.25、0.50、1.00和2.00 mmol·L-1MPP+作用于SH-SY 5Y细胞24和48 h,检测细胞存活率。培养48 h后,采用MPP+、0.50 mmol·L-1MPP++BMSCs-Sup(体 积 比 为50%)或0.50 mmol·L-1MPP++100 mg·L-1BMSCs-Exo分别作用于SH-SY 5Y细胞。达到所需的加药时间后,每孔加入5 g·L-1MTT溶液20μL,37℃孵育4 h后,弃上清,每孔加入100μL DMSO,低速震荡10 min,采用酶标仪于492 mm处检测每孔的吸光度(A)值,计算细胞存活率。细胞存活率=(加药处理组A值-空白对照孔A值)/(对照组A值-空白对照孔A值)×100%。
1.5 吖啶橙染色观察各组SH-SY 5Y细胞中自噬酸性囊泡荧光强度SH-SY 5Y细胞以每孔1×106个的密度接种于6孔板中;24 h后去除培养基,加入含有0.50 mmol·L-1MMP+的培养基(含上清)。作用48 h后,分别加入Rap和3-MA作用6 h。吸去培养基,采用PBS洗涤细胞3次,然后采用1μg·L-1吖啶橙染色15 min,采用PBS洗涤3次,每次3~5 min,洗涤后采用4%多聚甲醛固定10 min,再次洗涤3次,在载玻片上滴加1滴VECTOR防荧光淬灭封片剂,盖上盖玻片,在共聚焦显微镜下观察。采用Image-Pro Plus 6.0软件分析各组SH-SY 5Y细胞中自噬酸性囊泡荧光强度。
1.6 Western blotting法检测BMSCs-Exo相关蛋白表达情况将20μg蛋白质样品置入12%SDS聚丙烯酰胺凝胶中电泳分离,PVDF膜转膜50 min,5%脱脂奶粉室温封闭2 h后,分别加入1∶1 000稀释的Calnexin抗体、TSG101抗体和CD63抗体,4℃环境轻摇过夜。次日经TBST洗脱抗体后,分别加入1∶2 000比例稀释的二抗室温下孵育2 h,采用TBST漂洗3次;将PVDF膜浸泡于显影液中显影曝光,UVP凝胶成像分析仪中采集图像。
1.7 统计学分析采用Graphpad Prism version 8.0统计软件进行统计学分析。各组SH-SY 5Y细胞存活率和SH-SY 5Y细胞中自噬酸性囊泡荧光强度均符合正态分布,以±s表示,多组间比较采用单因素方差分析。组间两两比较采用SNKq检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组SH-SY 5Y细胞存活率在SH-SY 5Y细胞中加入不同浓度(0、0.25、0.50、1.00和2.00 mmol·L-1)MPP+孵育24或48 h后检测结果显示:与0μmol·L-1MPP+组比较,在相同处理时间下,随着MPP+浓度的增加,SH-SY 5Y细胞存活率降低(P<0.05),呈剂量依赖性。在相同浓度MPP+作用下,随着作用时间的延长,SH-SY 5Y细胞存活率逐渐降低(P<0.05),呈时间依赖性。见图1和2。

图1 不同浓度MPP+作用24h各组SH-SY 5Y细胞存活率Fig.1 Survival rates of SH-SY 5Y cells in various groups after treated with different concentrations of MPP+for 24 h
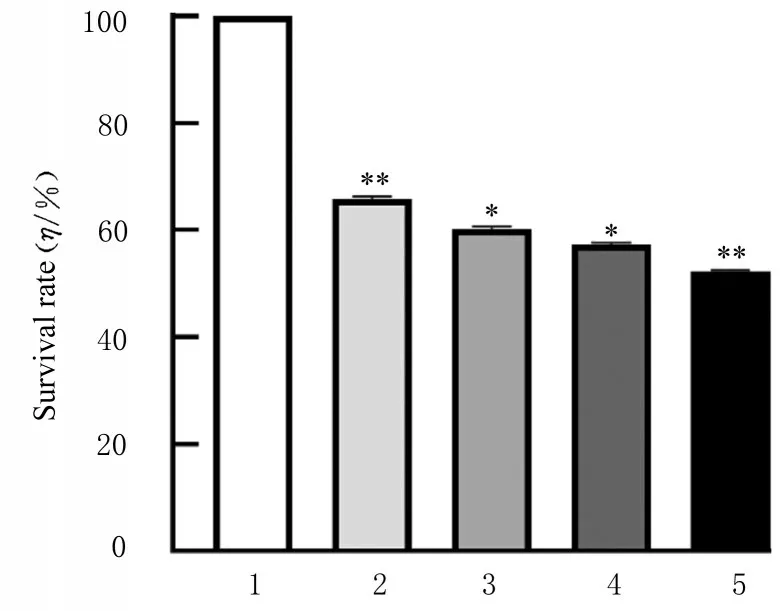
图2 不同浓度MPP+作用48 h各组SH-SY 5Y细胞存活率Fig.2 Survival rates of SH-SY5Y cells in various groups after treated with different concentrations of MPP+for 48 h
2.2 BMSCs-Sup作用后各组SH-SY 5Y细胞存活率和自细胞中噬酸性囊泡荧光强度与对照组(仅加入PBS)比较,MMP+组SH-SY 5Y细胞存活率降低(P<0.05);与MMP+组比较,MMP++BMSCs-Sup组SH-SY5Y细胞存活率降低(P<0.05),见图3。共聚焦显微镜下观察酸性泡状细胞器:正常细胞经吖啶橙染色后在荧光显微镜下可见绿色荧光和暗红色荧光,当细胞自噬水平增加时,红色荧光增强。与MMP+组比较,BMSCs-Sup组SH-SY 5Y细胞中自噬酸性囊泡荧光强度升高(P<0.05)。见图4和5。

图3 BMSCs-Sup作用后各组SH-SY 5Y细胞存活率Fig.3 Survival rates of SH-SY5Y cells in various groups after treated with BMSCs-Sup

图4 BMSCs-Sup作用后各组SH-SY 5Y细胞中自噬酸性囊泡的形态表现(吖啶橙,Bar=100μm)Fig.4 Morphology of autophagic acidic vesicles in SH-SY 5Y cells in various groups after treated with BMSCs-Sup(Acridine orange,Bar=100μm)

图5 BMSCs-Sup作用后各组SH-SY 5Y细胞中自噬酸性囊泡荧光强度Fig.5 Fluorescence intensities of autophagic acidic vesicles in SH-SY 5Y cells in various groups after treated with BMSCs-Sup
2.3 BMSCs-Exo作用后各组SH-SY 5Y细胞中目的蛋白的表达、细胞存活率和细胞中自噬酸性囊泡荧光强度Western blotting法检测结果显示:Exo标记蛋白CD63和TGS101蛋白高表达,但Calnexin蛋白不表达,符合BMSCs-Exo的特性,见图6。MTT检测结果显示:加入BMSCs-Exo后,与MPP+组比较,MPP++BMSCs-Exo组细胞存活率升高,见图7。共聚焦显微镜下观察自噬酸性泡状细胞器结果显示:与MPP+组比较,加入BMSCs-Exo的MPP++BMSCs-Exo组SH-SY 5Y细胞中自噬酸性囊泡荧光强度升高(P<0.05)。见图8和9。

图6 BMSCs-Exo作用后SH-SY 5Y细胞中CD63、TGS101和Calnexin蛋白表达电泳图Fig.6 Electrophoregram of expressions of CD63,TGS101,and Calnexin proteins in SH-SY 5Y cells after treated with BMSCs-Exo
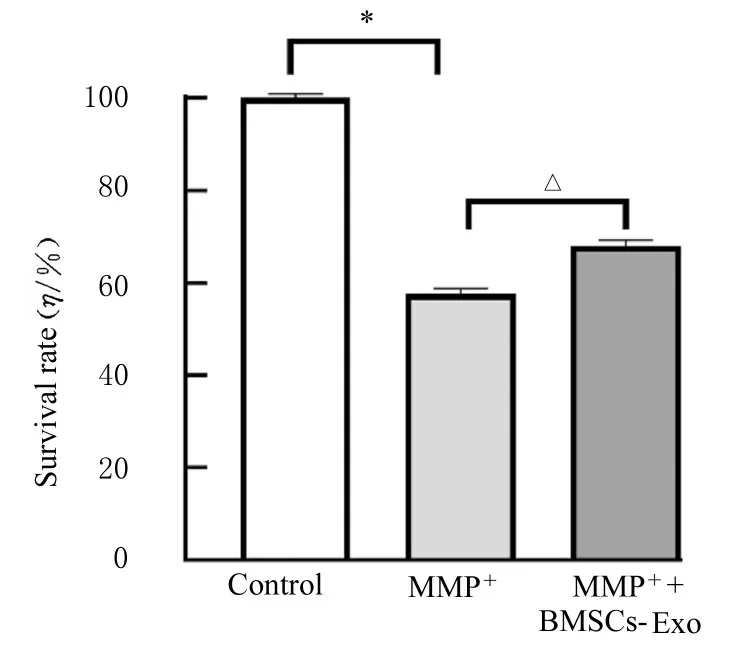
图7 BMSCs-Exo作用后各组SH-SY 5Y细胞存活率Fig.7 Survival rates of SH-SY5Y cells in various groups after treated with BMSCs-Exo

图8 BMSCs-Exo作用后各组SH-SY 5Y细胞中自噬酸性囊泡的形态表现(吖啶橙,Bar=100μm)Fig.8 Morphology of autophagic acidic vesicles in SH-SY 5Y cells in various groups after treated with BMSCs-Exo(Acridine orange,Bar=100μm)
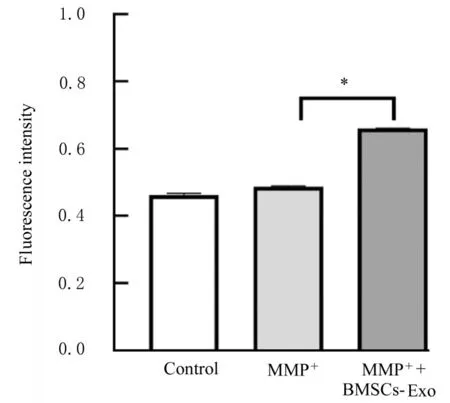
图9 BMSCs-Exo作用后各组SH-SY 5Y细胞中酸性囊泡荧光强度Fig.9 Fluorescence intensities of autophagic acidic vesicles in SH-SY 5Y cells in various groups after treated with BMSCs-E xo
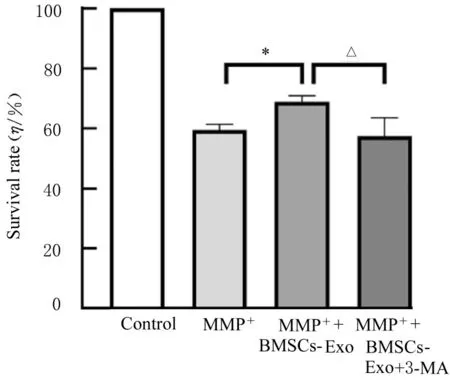
图11 3-MA作用后各组SH-SY 5Y细胞存活率Fig.11 Survival rates of SH-SY 5Y cells in various groups after treated with 3-MA
2.4 Rap或3-MA作用后各组SH-SY 5Y细胞存活率和细胞中自噬酸性囊泡荧光强度MTT法检测结果显示:与MPP+组比较,MPP++BMSCs-Exo组和MPP++Rap组细胞存活率明显升高(P<0.05)。与MPP++BMSCs-Exo组比较,MPP++BMSCs-Exo+3-MA组细胞存活率明显降低(P<0.05),见图10和11。共聚焦显微镜下观察酸性泡状细胞器结果显示:与MPP+组比较,MPP++BMSCs-Exo组、MPP++Rap组SH-SY 5Y细胞中自噬酸性囊泡数明显增加,细胞中酸性囊泡荧光强度升高(P<0.05),见图12和13。与MPP++BMSCs-Exo组比较,MPP++BMSCs-Exo+3-MA组SH-SY 5Y细胞中自噬酸性囊泡数明显减少,细胞中酸性囊泡荧光强度明显降低(P<0.05)。见图14和15。
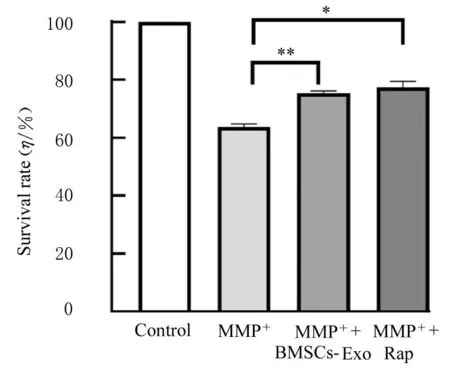
图10 Rap作用后各组SH-SY 5Y细胞存活率Fig.10 Survival rates of SH-SY 5Y cells in various groups after treated with Rap
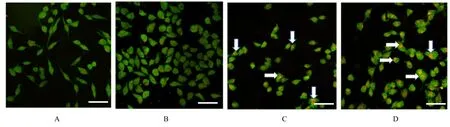
图12 Rap作用后各组SH-SY 5Y细胞中自噬酸性囊泡的形态表现(吖啶橙,Bar=100μm)Fig.12 Morphology of autophagic acidic vesicles in SH-SY 5Y cells in various groups after treated with Rap(Acridine orange,Bar=100μm)
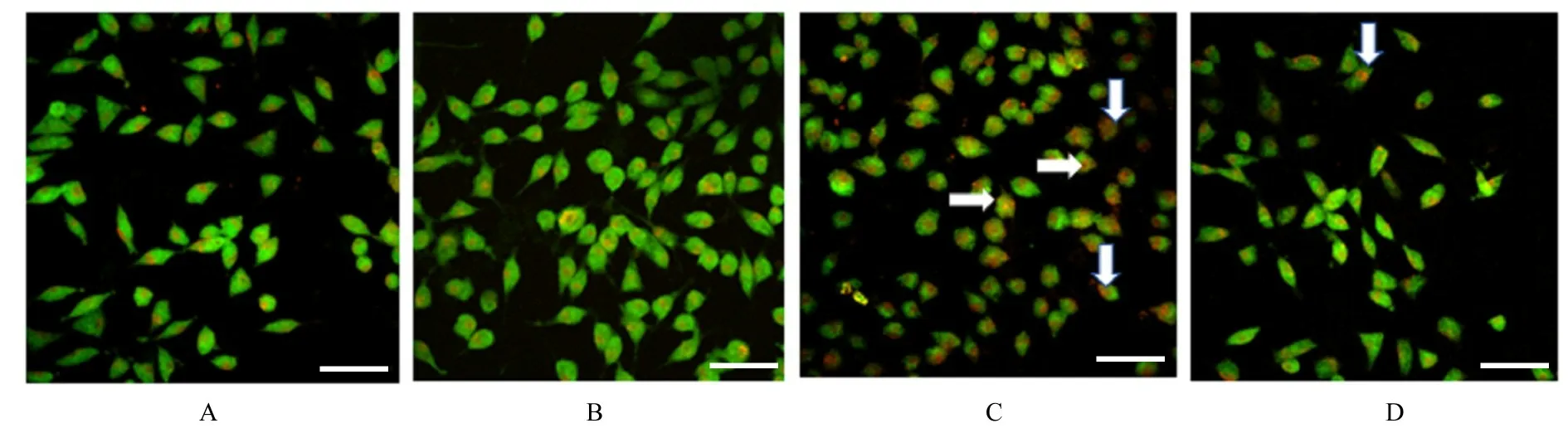
图14 3-MA作用后各组SH-SY 5Y细胞自噬酸性囊泡的形态表现(吖啶橙,Bar=100μm)Fig.14 Morphology of autophagic acidic vesicles in SH-SY 5Y cells in various groups after treated with 3-MA(Acridine orange,Bar=100μm)
3 讨 论

图13 Rap作用后各组SH-SY 5Y细胞中自噬酸性囊泡荧光强度Fig.13 Fluorescence intensities of autophagic acidic vesicles in SH-SY 5Y cells in various groups after treated with Rap
骨髓来源的Exo是BMSCs分泌的一组重要的信号纳米囊泡,是一种新的、多靶点的下一代生物制剂,可能是下调细胞因子风暴和逆转新型冠状病毒肺炎特征的宿主抗病毒防御抑制的关键[7-8];其包含大量的趋化因子生长因子mRNA和微小RNA(microRNA,miRNA),miRNA具有抗炎、再生和免疫调节作用功能,Exo是旁分泌和内分泌介质,赋予BMSCs其治疗特性,其具有优越的安全性、稳定性和可扩展性,这些使Exo成为可靠的和实用的治疗细胞损伤的物质[9]。BMSCs在神经细胞损伤中发挥重要作用,但存在着移植后不能准确到达作用部位,而且某些患者存在免疫排斥、细胞去分化和恶性肿瘤形成等风险[10]。Exo是由细胞分泌产生的脂质双分子层膜囊泡,在机体多种生理病理过程中发挥重要作用,是近些年来生物医学领域研究的热点问题[11]。Exo能够参与脑损伤等发生后的血管新生、神经再生和突触可塑性等诸多病理过程,其中miRNA介导的信号通路在神经退行性疾病的大脑修复过程中起关键性作用[12]。体内移植BMSCs-Exo还可以可减少细胞凋亡、减轻炎症和增强细胞活力,从而有助于损伤细胞的修复。
本研究探讨BMSCs-Exo抵抗MPP+诱导的SH-SY 5Y细胞存活率下降的机制,结果显示:BMSCs-Exo能够抵抗MPP+诱导的SH-SY 5Y细胞存活率下降。目前已有研究[13]显示:BMSCs对相关细胞及组织具有修复作用,BMSCs-Exo可有效促进骨关节炎(osteoarthritis,OA)大鼠的软骨修复和细胞外基质合成,以及减轻膝关节疼痛;BMSC-Exo也可减少小鼠的光老化和炎症,这可能有助于预防和治疗皮肤老化[14]。
BMSCs-Exo的提取通过聚合物的沉淀法从BMSCs-Sup中分离Exo。其鉴定可以通过蛋白质印迹等方法鉴定BMSCs-Exo,Exo裂解物的蛋白质印迹分析显示外泌体表面标志物[7]。有研究[8]显示:CD63和TSG101表达增强,Exo分泌增多,当CD63和TSG101表达减弱时,Exo分泌明显减少,CD63和TSG101可作为鉴定Exo标志蛋白。本研究结果显示:Exo表面标志物CD63和TSG101呈阳性表达,而未检测到Calnexin,表明BMSCs-Exo与BMSCs-Sup成功分离,BMSCs-Exo成功分离。
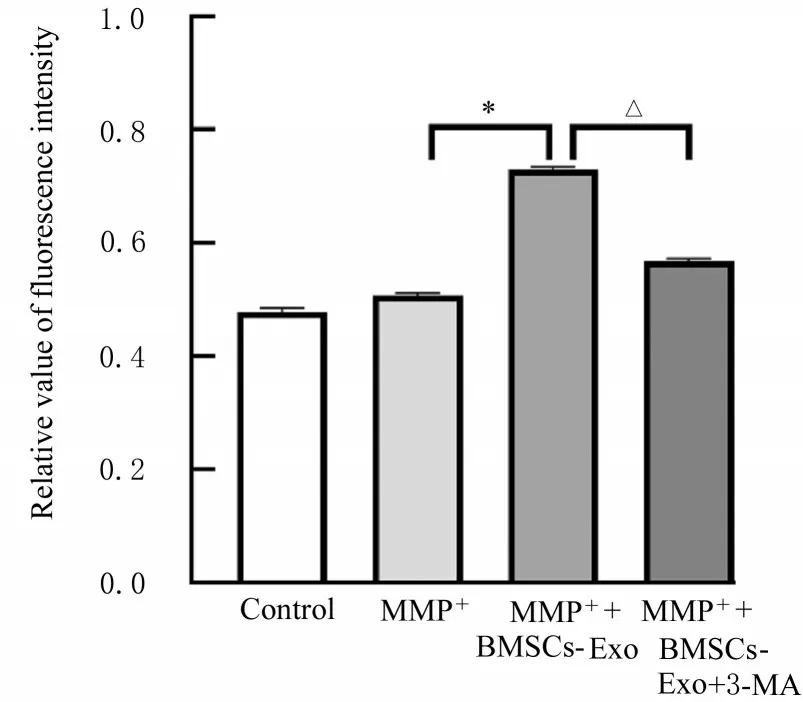
图15 3-MA作用后各组SH-SY 5Y细胞中自噬酸性囊泡的荧光强度Fig.15 Fluorescence intensities of autophagic acidic vesicles in SH-SY 5Y cells in various groups after treated with 3-MA
在真核细胞中,自噬是一种高度受控的溶酶体介导的功能消除损坏或老化的长寿蛋白质和细胞器。这是修复所需要的多重胁迫下细胞存活的细胞稳态[15]。细胞自噬情况的检测可以通过共聚焦显微镜下观察细胞中自噬酸性囊泡的荧光强度,自噬溶酶体由自噬体和溶酶体融合形成,是一种酸性囊泡细胞器,吖啶橙是一种荧光染料,在自噬溶酶体内酸性磷酸酶活性增强的情况下显著着色[16]。本研究通过吖啶橙对细胞进行染色,在共聚焦显微镜下观察自噬酸性囊泡的荧光强度,本研究结果显示:BMSCs-Exo在提高细胞存活率和调节自噬方面有独特的功能。
综上所述,在SH-SY 5Y细胞存活率降低时,BMSCs-Exo可以诱导SH-SY 5Y细胞自噬,从而抵抗MPP+诱导的细胞存活率下降,提高细胞存活率并促进损伤细胞的修复,对神经系统相关疾病的治疗有一定的指导意义。
——可作为磷酸盐库再利用!

