海藻酸钠-角豆胶互穿聚合物网络水凝胶药物缓释体系的制备及评价
栗 达,贾颜鸿,张泽兵,郝秀峰
(1.吉林大学口腔医院病理科 吉林省牙发育及颌骨重塑与再生重点实验室,吉林 长春 130021;2.吉林大学化学学院高分子科学系,吉林 长春 130021)
过去几十年中,不同种类的水凝胶产品不仅在组织工程、骨架材料和3D打印材料应用中取得了良好的市场反馈和巨大的商业价值[1-2],而且在药物载体领域也获得了极大关注。水凝胶的三维网络结构可以在介质中溶胀而不溶解[3],有助于实现在较长周期内稳定地释放药物。近年来,互穿聚合物网络(interpenetrating polymer network,IPN)水凝胶,即2种或2种以上聚合物网络形成相互贯穿或缠结结构的聚合物共混体系,因其特殊的生物物理性质被广泛应用于生物医学和医药领域[4],尤其是药物传输领域[5]。众多水凝胶产品中,天然高分子多糖水凝胶因其特有的生物可降解性、生物相容性、来源广泛、材料成本低和易于规模化生产等优势,在应用前景方面具有独特优势。海藻酸钠(sodium alginate,SA)是从海藻细胞壁和细胞间质中提取的一种阴离子聚电解质,是由M单元(β-D-2甘露糖醛酸)和G单元(α-L-2古洛糖醛酸)通过α(1-4)糖苷键聚合而成的线性嵌段聚合物,含有自由的羟基和羧基,具有生物相容性好、低毒性、低成本和易与二价金属离子凝胶化等优点,被广泛用于制备水凝胶并应用于药物缓释等领域[6-9]。有 研 究[10]显 示:SA与魔芋葡甘聚糖(konjac glucomannan,KGM)、乙基纤维素(ethyl cellulose,EC)和沸石P的复合水凝胶抗菌微球可以提高载药量和包封效率。角豆胶(locust bean gum,LBG)是由角豆种子的胚乳压制而成,LBG与其他天然胶复配可产生良好的凝胶协同作用,通过调节其配比来增加凝胶的黏度、凝胶能力、弹性及脆性等[11]。顺铂(cisplatin,DDP)是广泛使用的抗癌药物,但其较差的水溶性导致生物利用度低[12],为了克服这一缺点,本研究以廉价易得的SA和LBG为原料,将SA、LBG和戊二醛(glutaraldehyde,GA)及氯化钙(CaCl2)进行交联形成SA-LBG-IPN水凝胶包裹DDP,达到控制药物释放的目的。SA-LBG-IPN水凝胶能够克服单一SA水凝胶突释、漏释及交联网络易瓦解的缺陷,从而得到一种新型的缓释载药体系。
1 材料与方法
1.1 细胞、主要试剂和仪器口腔鳞状细胞癌CAL-27细胞株由上海交通大学附属口腔医学院陈万涛教授惠赠。DMEM培养基、胎牛血清和胰蛋白酶消化液(以色列BI公司)、牛血清白蛋白(bovine serum albumin,BSA)、SA和LBG(美国SIGMA公司),DDP(中国食品药品检定研究所),CaCl2和GA[水溶液25%(V/V)](天津天泰精细化学品有限公司),MTS检测试剂盒(美国Promega公司),AO/PI双染试剂盒(上海贝博生物试剂公司)。微量注射泵(保定申辰泵业有限公司),红外光谱仪(美国Niolect公司),紫外分光光度计[尤尼柯(上海)仪器有限公司],酶标仪(美国BioTek公司)。
1.2 IPN水凝胶的制备称取不同配比的SA和LBG(表1),溶于装有去离子水的烧杯中,磁力搅拌至完全溶解。将不同浓度GA加入SA-LBG混合液中,磁力搅拌至溶液混合均匀,超声去除溶液中的气泡。采用滴制法将混合溶液滴加至质量分数为3%的CaCl2溶液中,磁力搅拌30 min,得到球形凝胶珠。去离子水多次洗涤去除凝胶球表面残留的交联剂,室温干燥即得到空白IPN水凝胶。载DDP的水凝胶制备过程前期步骤同空白凝胶珠,将一定量DDP加入至SA-LBG-GA混合液中,搅拌均匀后后续步骤同空白IPN水凝胶。
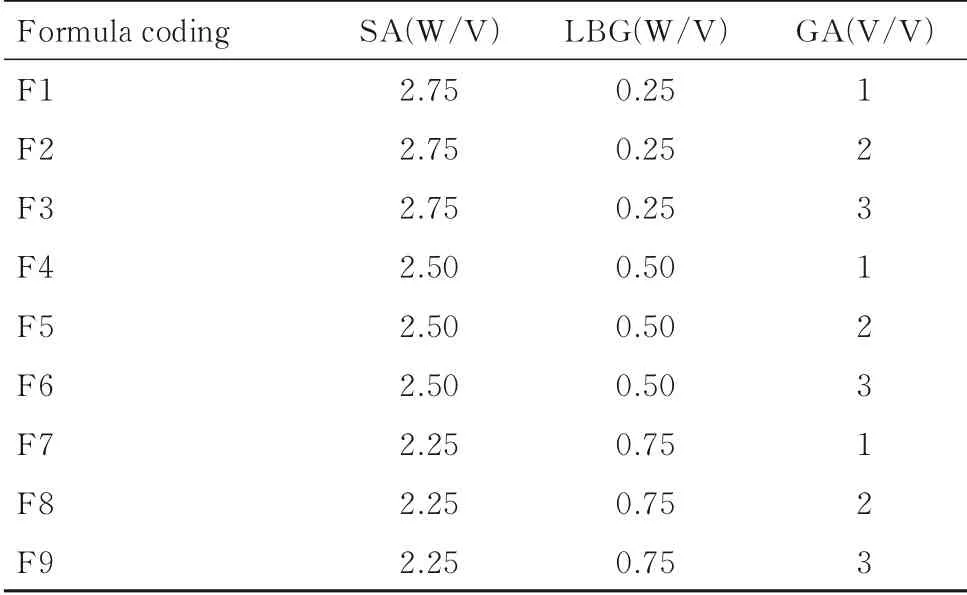
表1 不同配方凝胶珠的聚合物和交联剂的百分率Tab.1 Percentages of polymers and cross-linked for preparations of different hydrogel beads (η/%)
1.3 IPN水凝胶的表征采用扫描仪记录新鲜制备、室温干燥和溶胀后不同状态凝胶珠的形貌。数字显微镜下观察干燥后凝胶珠的尺寸,采用Image J软件测量微珠平均尺寸,测定20个凝胶珠取平均值。取干燥后凝胶珠样品进行真空喷金处理,然后采用HITACHI SU 8020型扫描电镜(scanning electron microscope,SEM)观察凝胶珠的外部形貌和内部结构。取SA粉末、LBG粉末、空白水凝胶、DDP粉末和载DDP水凝胶样品置于红外灯下干燥,按照1∶99的比例与溴化钾混合后在玛瑙砂浆中粉碎,制得透明试样薄片,将此片置于Thermo Fisher Nicolet is5型傅里叶变换红外光谱仪(fourier transform infrared spectrometer,FTIR)样品池中,在波长4 000 cm-1~500 cm-1范围内进行波数扫描,分辨率为4 cm-1,扫描次数为32次,得到样品的红外吸收光谱图。
1.4 载药和释药测试以BSA为模型药物,探讨水凝胶的载药与释药行为。载BSA水凝胶制备方法:称取0.06 g BSA溶于去离子水,待完全溶解后加入SA-LBG-GA混合液中,搅拌均匀后按照说明书制备载BSA水凝胶。收集载BSA水凝胶交联的CaCl2溶液和洗涤水凝胶的去离子水溶液并记录其体积。分别取出3 mL液体采用紫外分光光度计在波长280 nm处检测其吸光度(A)值,根据标准曲线计算BSA水平,采用如下公式计算药物包封率(encapsulation efficiency,EE)。EE=(m1-m2)/m1×100%。m1代表总投入的BSA质量(mg),m2代表游离的BSA质量(mg)。
称取室温干燥后的载BSA水凝胶置于锥形瓶中,加入50 m L PBS溶液,置于37℃、5%CO2孵箱中,在不同时间点取样3 mL,同时补充3 mL PBS溶液,将取出的样品采用紫外分光光度计于280 nm处检测其A值。根据标准曲线计算BSA水平,采用时间与累积释药率绘图,即得到BSA的释放曲线。累积释药率(Qn)按公式计算:Qn=[V0Cn+V∑C(n-1)]/M×100%。
V0为释药介质PBS体积,本研究中V0为50 mL,Cn为第n次取样时样液中BSA浓度(g·L-1),V为 每 次 取 样 体 积,本 研 究 中V为3 mL,M为载BSA量(mg)。
1.5 DDP-IPN凝胶珠作用后CAL-27细胞存活率实验分为对照组、DDP药液组和DDP凝胶珠组,每组设置9个复孔。将处于对数生长期的CAL-27细胞以6×103个/孔的密度接种于96孔细胞培养板中,每孔含0.1 mL高糖培养基,置于37℃、5%CO2孵箱中。待细胞贴壁后弃去孔内培养基,每组分别加入相应浓度的空白培养基、DDP药液和DDP-IPN凝胶珠。置于孵箱中培养6、12、24和48 h后,每孔加入20μL MTS液,继续孵育2 h后采用酶标仪于490 nm波长处检测A值,计算细胞存活率。细胞存活率=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。公式中实验组为DDP药液组或DDP凝胶珠组。
1.6 倒置荧光显微镜观察CAL-27细胞AO/PI荧光染色情况将处于对数生长期的CAL-27细胞以1×105个/孔的密度接种于6孔细胞培养板中,每孔含2 mL高糖培养基,置于37℃、5%CO2孵箱中。待细胞贴壁后弃去孔内培养基,每孔加入相应浓度的DDP-IPN凝胶珠(DDP凝胶珠组)、DDP药液(DDP药液组)和空白培养基(对照组)。置于孵箱中培养6、12、24和48 h后,取出DDP凝胶珠并弃去培养基,采用PBS洗涤细胞2次,离心收集漂浮细胞,每孔加入适量的AO/PI染色工作液覆盖细胞,继续孵育10 min,弃去染色工作液,采用新鲜培养基洗涤2次。在荧光显微镜下,选用488 nm激发光镜检。正常细胞呈均匀黄色或黄绿色,形态结构正常,凋亡细胞大小不一,细胞核破裂呈点状,被染成红色。
1.7 统计学分析采用Graphpad Prism 8.0统计软件进行统计学分析。各组细胞存活率符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNKq检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 结构表征新鲜制备的水凝胶为半透明球状(图1A),室温干燥后脱水颜色变黄,体积缩小(图1B),溶胀后的凝胶颜色变浅,结构保持完整(图1C)。不同配方的水凝胶粒径干燥后粒径为778.88~938.71μm。随着LBG比例的升高,凝胶珠粒径逐渐增加,这可能是因为SA-LBG混合液黏度提高,使得SA-LBG混合液在注射器针头处形成更大的液滴。而随着交联剂GA水平升高,凝胶珠内部交联更加紧密使得粒径变小,即LBG比例对凝胶珠的粒径有协同作用,GA则起拮抗作用。见图2。
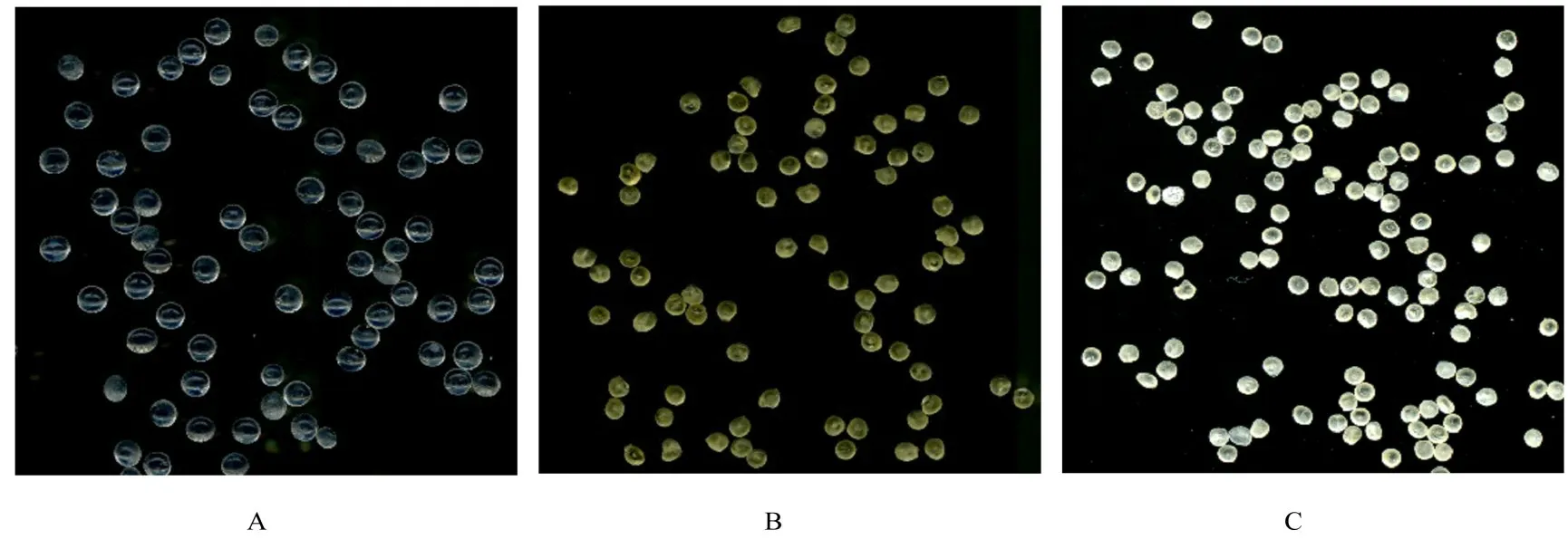
图1 不同状态下水凝胶形态表现Fig.1 Morphology of hydrogels in different states
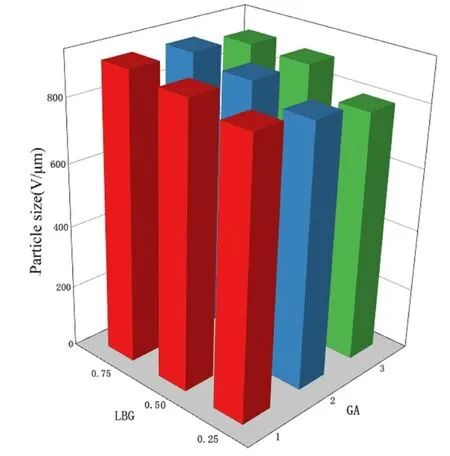
图2 不同配比LBG和GA组成的凝胶珠粒径的三维柱状图Fig.2 Three-dimensional histogram of particle sizes of hydrogel beads composed with different ratios of LBG and GA
干燥的凝胶珠表面粗糙甚至凹凸不平,出现褶皱现象,这是由于带负电的SA分子与带正电的Ca2+通过静电作用形成“蛋盒”结构而形成了外膜,在干燥过程中聚合物网络的部分塌陷所致。凝胶珠内部结构紧密,形成了多边形晶格状结构,利于有效包裹药物。说明所获得的凝胶珠结构完整,并可对药物进行有效包埋,可以用于后续的细胞学研究。见图3。

图3 扫描电镜下凝胶珠的形态表现(Bar=1μm)Fig.3 Morphology of hydrogel beads under scanning electron microscope(Bar=1μm)
SA在3 400 cm-1处的吸收峰属于O-H的伸缩振动峰,2 920 cm-1处为SA大分子六元环上C-H键的伸缩振动峰,1 613 cm-1和1 417 cm-1处的吸收峰由-COOH基团的振动引起[13-14],1 080 cm-1为C-O的伸展振动峰[15]。LBG也在3 400 cm-1,2 932 cm-1和1 100 cm-1出现特征峰,这些吸收峰也是多糖类物质的特征吸收峰。由于空白凝胶珠中形成氢键,-OH的伸缩振动峰向更高的波数3 451 cm-1移动。此外由于钙桥的形成,-COOH的对称和反对称伸缩振动峰均由1 613 cm-1和1 417 cm-1向长波方向1 637 cm-1和1 428 cm-1移动。DDP粉末的FTIR光谱中在3 280 cm-1、1 300 cm-1和800 cm-1的吸收峰是N-H的伸缩振动特征峰,表明药物纯度较高。DDP凝胶珠的FTIR光 谱 显 示3 280 cm-1和1 300 cm-1、800 cm-1的DDP特征峰,表明DDP凝胶珠中存在DDP的所有官能团,证实药物DDP被成功地包裹于DDP凝胶珠中,DDP的官能团与聚合物之间不存在化学和物理作用,因此药物分子在凝胶珠中是稳定的。见图4。
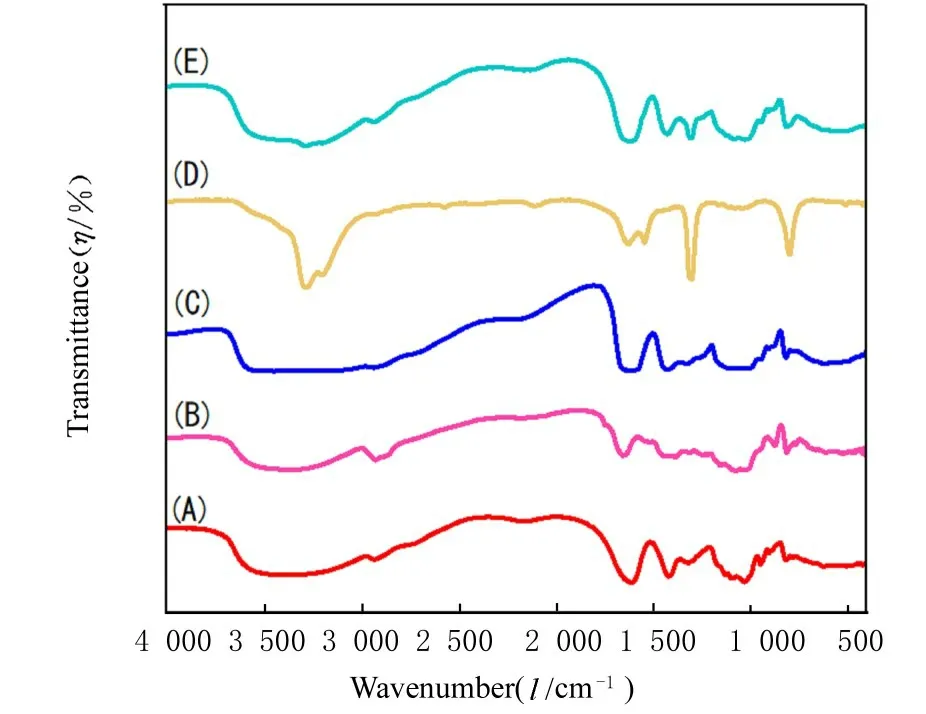
图4 凝胶珠的FTIR图Fig.4 FTIR gram of hydrogel beads
2.2 载药和释药效果载药IPN微珠的EE为51.67%~74.86%,LBG和GA的配比对凝胶珠的EE有协同作用。与F1、F2和F3配方比较,在F7、F8及F9配方中存在更多的LBG,水凝胶EE也更高。这是因为SA和LBG均为多糖,由疏水的甘露糖链和亲水的半乳糖单元组成。在LBG中,甘露糖与半乳糖的比率为4;在SA中,甘露糖与半乳糖的比率为0.53;与SA比较,LBG的疏水性更强。由于LBG的疏水性,LBG表现出有限的溶解性,随着LBG的增加,IPN的粒径增加,因此也包封了更多的药物。在F3、F6和F9配方中,随着交联剂GA水平的升高,交联的速率和效率均增加,聚合物之间的紧密结合有助于水凝胶包封药物,防止药物渗出[16]。因此选择F3、F6和F9配方,以BSA为模型药物,构建3种配方的释药曲线。见图5。
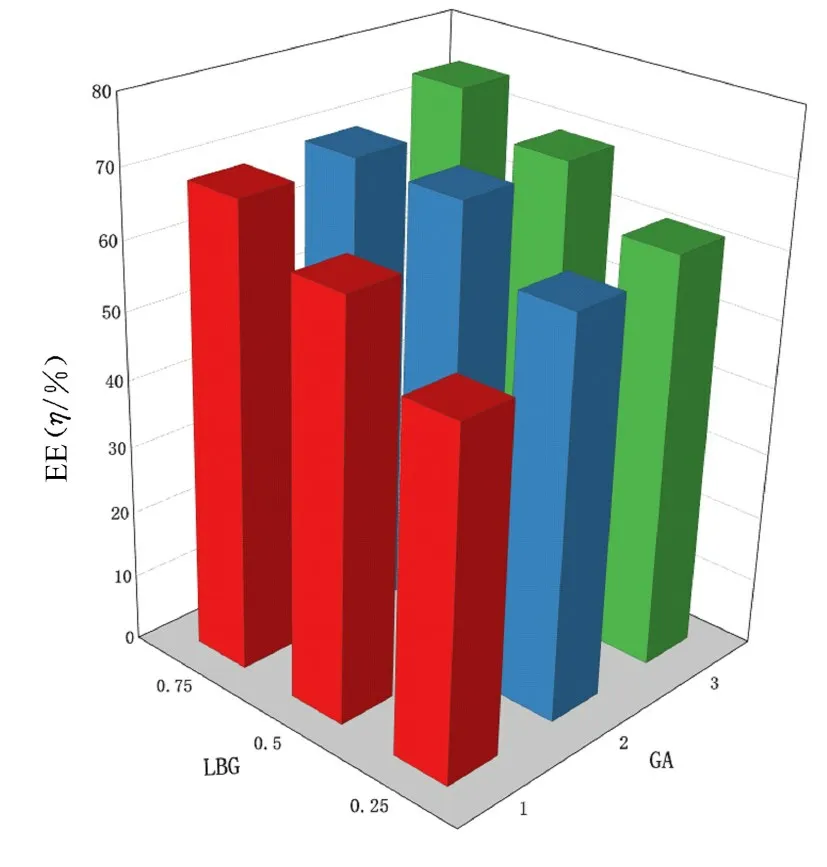
图5 不同配比LBG和GA组成的凝胶珠EE的三维柱状图Fig.5 Three-dimensional histogram of EE of hydrogel beads composed with different ratios of LBG and GA
根据F3、F6和F9配方,BSA为模型药物制备载BSA凝胶珠,检测其体外释放速率。载BSA凝胶珠的药物释放时间可达48 h。在3种配方中,随着LBG水平的升高,BSA由凝胶珠中的释放速率降低。这是因为凝胶层作为渗透介质的屏障,随着LBG水平的升高其厚度也增加,从而延缓了药物从溶胀的凝胶珠中扩散。并且由于LBG水平升高,亲水键减少,降低了药物的初始突释。见图6。

图6 不同配比凝胶珠的累积释放曲线图Fig.6 Cumulative release curves of hydrogel beads with different ratios
2.3 DDP凝胶珠和DDP药液作用不同时间后CAL-27细胞存活率综合载药与释药的结果,采用优化F9配方包封DDP。在6和12 h时,DDP药液组细胞存活率分别为(71.49±3.43)%和(66.05±4.42)%,而DDP凝胶珠组细胞存活率分别为(86.92±2.41)%和(75.16±0.89)%,DDP药液组细胞存活率较DDP凝胶珠组低(P<0.05),即DDP凝胶珠在12 h内释放的DDP浓度较低。但培养24和48 h后,DDP凝胶珠组CAL-27细胞存活率(42.34%±2.73%,34.95%±6.49%)低于DDP药液组(51.58%±2.76%,43.58%±1.14%)(P<0.05),表明DDP逐渐从水凝胶中释放。MTT法结果证实:IPN水凝胶具备良好的药物缓释性能,其提高了药物对CAL-27细胞的增殖抑制率和药物利用率。
2.4 倒置荧光显微镜下CAL-27细胞AO/PI荧光染色情况对照组正常细胞被AO染色为黄色或黄绿色,凋亡的细胞被PI染色为红色。6~48 h,对照组绝大多数CAL-27细胞被染色为绿色,48 h时可观察到少许细胞被染色为红色。与对照组比较,DDP药液组和DDP凝胶珠组CAL-27细胞在加药后6和12 h时存活细胞均较少,DDP凝胶珠组存活CAL-27细胞数略多于DDP药液组。但在24 h后,凝胶珠组凋亡细胞数增加,24和48 h时DDP凝胶珠组CAL-27存活细胞数少于DDP药液组,这与MTT法所检测的细胞存活结果相符,表明载DDP凝胶珠对CAL-27细胞具有持续且较强的杀伤作用。见图7。

图7 倒置荧光显微镜下各组CAL-27细胞AO/PI荧光染色情况(×400)Fig.7 AO/PI fluorescence staining of CAL-27 cells in various groups observed under inverted fluorescence microscope(×400)
3 讨 论
目前在口腔鳞状细胞癌的治疗中,早期鳞癌采用以手术治疗为主,辅助化疗和放疗为辅的综合治疗方法,晚期鳞癌以化疗为主。但化疗的耐药性和不良反应多等缺点明显。因此延长化疗药物体内存留而达有效浓度时间并减少给药次数从而提高患者依从性成为目前需要解决的问题。SA基水凝胶作为载药材料被广泛研究,在形成凝胶过程中,二价金属离子与SA分子上的羧基结合形成“蛋盒”结构 以 包 封 药 物[17-18]。但 既 往 研 究[19-21]显 示:由 于药物在交联过程中由凝胶珠中漏出,仅以SA与C a2+形成的凝胶珠存在药物EE低、药物突释及缓释效果差等诸多不足。为了克服这些缺点,可以将SA与其他聚合物联合形成IPN水凝胶,从而提高载药水凝胶的性能。KAYGUSUZ等[22]将蒙脱土掺入海藻酸盐水凝胶中发现:与SA水凝胶比较,复合水凝胶在胃介质和肠介质中均显示出更高的EE和更慢的蛋白质释放速率。许孟杰等[23]采用阳离子纤维素和SA制备出具有双膜结构的生物相容性水凝胶,发现其作为一种新型复合药物载体有明显的药物控释作用。AKBARI等[24]将不同量埃洛石纳米管加入至SA中制备水凝胶包裹抗肿瘤药物舒尼替尼,体外药物释放实验表明:随着埃洛石纳米管水平的升高,舒尼替尼从凝胶珠中的释放减少,释放速率也降低。在众多天然多糖聚合物中,LBG作为粘合剂、增稠剂、稳定剂和絮凝剂等广泛应用于医药配方中[25],在生物医学领域具有广阔的应用前景。LBG以β-D-糖苷键连接的D-甘露糖为主链,在某些D-甘露糖基的6位上连接1个ɑ-D-吡喃半乳糖,且疏水的甘露糖和亲水的半乳糖单元组的比例为4∶1[26]。疏水键含量较多的LBG聚合物可与其他的亲水胶体相互作用形成凝胶,且LBG的活性基团羟基暴露后更有利于包封药物。本课题组多年来致力于口腔癌的治疗和发病机制的研究,基于SA与CaCl2发生交联反应可以制备凝胶珠的原理,为了避免药物突释和延长释药时间,在SA中加入了同样为天然聚合物多糖的LBG,同时增加了GA作为交联剂,制备了SA-LBG-IPN水凝胶,旨在实现更高的药物EE和可持续的药物释放,以克服传统海藻酸钙凝胶中的药物突释。FTIR证实了聚合物与药物之间形成了IPN。随着LBG和GA水平的升高,凝胶珠药物EE由51.67%提高至74.86%。本文作者研究了载牛血清白蛋白凝胶珠在PBS中释放结果显示:24 h内药物释放缓慢,且药物可持续释放48 h。这有利于通过延长给药间隔从而提高患者的依从性。本研究结果显示:与DDP药液组比较,DDP凝胶珠组CAL-27细胞获得更好的持续性杀伤作用。
综上所述,本实验制备的IPN水凝胶微球可有效包封药物并实现药物控释,其配方可进一步调整及优化,以满足包封不同药物的需求,成为具有短半衰期和高水溶性药物的传递系统以达到持续释放的目的,从而获得药物良好的生物利用度及更好的临床效果。

