重组人生长激素对局灶性脑缺血再灌注小鼠运动功能的改善作用及其机制
林 韬,李莹华,连雅雯,陈晓伟,万 芪
(1.青岛大学附属医院神经外科 青岛大学神经再生与康复研究院,山东 青岛 266071;2.吉林大学第一医院康复医学科,吉林 长春 130021)
缺血性脑卒中(ischemic stroke,IS)是因脑部供血动脉发生堵塞导致脑组织坏死的一种常见脑血管疾病,具有发病率高、致残率高和病死率高等特点,严重影响了人们的生命健康和生活质量[1]。在超急性期及时再通血管和重建血流是缺血性脑卒中治疗的主要手段。然而脑缺血区域的血流复流后可能会导致短时间内神经元受损加剧和功能障碍,即脑缺血再灌注损伤。因此,如何有效减少脑缺血再灌注造成的神经元死亡,加速脑损伤后神经网络的修复是目前国内外研究的重点和难点。
生长激素是由脑垂体前叶嗜酸性颗粒细胞分泌的一种蛋白质激素,研究[2-4]显示:生长激素作为一种多向性激素,对中枢神经系统损伤后大脑的神经保护和修复有明显的治疗作用。基础研究[5-6]证实:重组人生长激素可改善局灶性脑缺血小鼠的认知功能,其机制与增加血清及脑组织中的神经营养因子表达,促进梗死灶周围区域和海马的神经修复有关,但运动功能改善方面的研究鲜有报道。一项临床研究[7]显示:重组人生长激素能够提高IS患者的日常生活活动能力,降低肌肉疲劳度,抑制肌纤维数量的减少,因此认为生长激素具有改善IS后运动功能障碍的潜力,但缺乏基础理论依据。本研究通过给予脑缺血再灌注损伤模型小鼠生长激素干预,观察其对小鼠运动功能的影响,并探讨其可能机制,从分子生物学水平为生长激素在治疗IS中的临床应用提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器8~10周龄SPF级雄性C57BL/6J小鼠,平均体质量(23±2)g,购自吉林乾和模式生物科技有限公司,动物生产许可证号:SCXK(吉)-2019-0001。小鼠饲养于恒温(22℃~24℃)房间,自由饮食,遵循昼夜节律。突触蛋白1(synapsin 1,SYN1)抗体和GADPH抗体购自美国Cell Signaling公司,HRP标记的山羊抗兔IgG抗体购自英国Abcam公司,TTC购自美国Sigma公司,BCA蛋白定量试剂盒、高效RIPA裂解液和ECL发光液均购自上海雅酶生物医药科技有限公司。大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)线栓购自瑞沃德生命科技有限公司,体视显微镜购自日本Olympus公司,电泳仪和电转仪购自美国Bio-Rad公司,恒温水浴锅购自江苏省荣化仪器制造公司。
1.2 实验动物分组、处理和给药方式小鼠在10%水合氯醛(350 mg·kg-1)腹腔麻醉下,采用改良Zea-Longa线栓法制作脑缺血再灌注损伤模型,随机分为生长激素治疗组(脑缺血再灌注+生长激素,SG组)和对照组(脑缺血再灌注+生理盐水,SS组),每组12只。SG组小鼠于造模后48 h开始颈部皮下注射重组人生长激素[5,8],剂量为1.4 mg·kg-1·d-1,持续14 d;SS组小鼠注射生理盐水,注射时间、剂量、部位及次数与SG组小鼠一致。
1.3 脑缺血再灌注损伤模型制备小鼠在术前12 h禁食,术前4 h禁水。麻醉后,颈部备皮消毒,切开颈部正中皮肤,钝性分离暴露左侧颈总动脉、颈外动脉和颈内动脉,将线栓沿颈总动脉插至颈内动脉,直至线栓顶端稍有阻力感(大脑中动脉开口处),固定线栓。1.5 h后,缓慢退出线栓,使颈内动脉重新得到血流灌注。
1.4 TTC染色法验证脑缺血再灌注损伤模型建立脑缺血再灌注24h后,通过TTC染色结果验证模型是否制作成功。小鼠断头取脑,将脑组织迅速置于-20℃冰箱,20 min后取出,行冠状切片,切为5片,厚度为2 mm。将切好的脑组织切片置入2%TTC染色液中,置于37℃水浴中避光孵育30 min,采用0.1 mol·L-1PBS溶液冲洗2~3次后拍照,保存图片。正常组织染色为红色,脑梗死组织为白色。
1.5 Longa法评价小鼠神经功能缺损情况脑缺血再灌注24h后,采用Longa法[9]进行神经功能缺损评分。Longa法评分标准:0分,正常,无神经功能缺损;1分,左侧前爪不能完全伸展,轻度神经功能缺损;2分,行走时,大鼠向瘫痪侧转圈,中度神经功能缺损;3分,行走时,大鼠身体向瘫痪侧倾倒,重度神经功能缺损;4分,不能自发行走,有意识丧失。评分1~3分者为造模成功,评分为0或4分或小鼠死亡视为造模失败。剔除造模失败小鼠,及时补充备用小鼠。
1.6 平衡木实验检测小鼠运动协调能力参考文献[10]的方法进行平衡木实验,用于评价脑缺血小鼠平衡功能及身体协调性。将100 cm×2 cm的横梁平放于距地面50 cm处(支撑柱:1.5 cm×1.5 cm×50.0 cm),让小鼠在其上行走。在起点处放置一盏灯(有60 W灯泡)进行强光刺激,末端放置1个黑匣子(20 cm×20 cm×20 cm,有1个4 cm×5 cm的入口孔)作为终点。摄像机记录小鼠在横梁中间80 cm的行走过程。根据Feeney评分标准进行评分:7分,能够顺利爬行横梁,瘫痪肢体完全起作用,无明显神经体征;6分,能够爬过横梁,瘫痪肢体起作用>50%;5分,能够爬过横梁,瘫痪肢体起作用<50%;4分,不能顺利爬过横梁,跌倒概率<50%;3分,不能顺利爬过横梁,跌倒概率>50%;2分,在横梁上不能行走,但可以坐在上面;1分,完全不能爬过横梁且无法将后肢放在水平位置,放在横梁上会掉下去。分别于损伤前、损伤后1 d和损伤后16 d进行平衡木实验,对小鼠行走过程中的表现进行评分,得分越高表明小鼠运动协调能力越好。
1.7 网屏实验检测小鼠肢体肌力参考文献[11]的方法进行网屏实验,用于评估脑缺血小鼠前后肢运动协调能力及肌力情况。网屏为50 cm×40 cm网带,网眼1 cm×1 cm,在网屏下方铺12 cm厚的海绵。先将网屏水平放置,而后将小鼠放置其上,启动秒表,在2 s内将此屏倒置,直至小鼠滑落,上限为60 s。分别于损伤前、损伤后1 d和损伤后16 d进行网屏实验,记录小鼠在网屏上停留的时间,时间越短表明肢体功能损伤越严重。
1.8 圆筒实验检测小鼠患肢使用率参考文献[12]的方法进行圆筒实验,检测小鼠在贴壁站立过程中患侧前肢的使用率。实验时将小鼠置于透明圆筒中(高17.50 cm,内径8.80 cm,外径9.50 cm,壁厚0.35 cm),观察5 min内小鼠前肢垂直探索筒壁过程,分别记录左侧(健侧)、右侧(偏瘫侧)和双侧触及筒壁的次数。根据公式计算小鼠肢体的使用情况。偏侧优势=(右侧+0.5×双侧)/(左侧+右侧+双侧)。局灶性脑缺血后,小鼠前肢的使用情况具有不对称性,损伤越重,越倾向于使用健侧前肢。分别于损伤前、损伤后1 d和损伤后16 d进行圆筒实验,记录小鼠患侧前肢使用率,数值越低表明患侧前肢损伤越严重。
1.9 免疫印迹法检测小鼠梗死灶周围区域中SYN1表达水平行为学实验结束后,将小鼠麻醉,采用0.9%生理盐水进行快速在体心脏灌注,随后断头取脑,分离梗死灶周围组织,-80℃保存。采用RIPA裂解液(同时加入蛋白酶抑制剂和磷酸酶抑制剂)裂解组织,超声震荡样品,4℃离心10 min,吸取上清备用。采用BCA蛋白定量试剂盒检测样品蛋白浓度,计算上样量。采用10%SDS-PAGE凝胶电泳分离,电转至PVDF膜上,室温下用3%BSA封闭1.5 h。加入一抗(SYN 1,1∶10 000;GAPDH,1∶5 000),4℃过夜。TBST洗膜5 min×3次,孵育HRP标记的二抗(HRP-IgG,1∶5 000)1.5 h,TBST洗膜10 min×3次。ECL化学发光法显色。采用Image J软件分析2组样品条带的灰度值,计算目的蛋白表达水平。目的蛋白的表达水平=目的蛋白条带灰度值/内参GAPDH条带灰度值。
1.10 统计学分析采用SPSS 26.0统计软件进行统计学分析,采用GraphPad Prism 8软件制图。2组小鼠运动协调能力评分、倒置抓握网屏时的停留时间、患侧肢体使用率和梗死灶周围区域中SYN1表达水平均符合正态分布,以±s表示,组内损伤前后比较采用配对t检验,两组间比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠脑缺血再灌注模型建立建立脑缺血再灌注模型24 h后,采用Longa法评估小鼠神经缺损程度,最终将评分为1~3分的小鼠纳入研究。随机选取6只Longa评分为1~3分的小鼠进行TTC染色,结果显示:缺血侧脑组织呈现出大范围梗死灶,表明小鼠脑缺血再灌注模型建立成功。见图1。其余24只小鼠随机分为SG组和SS组进行下一步实验,每组12只。
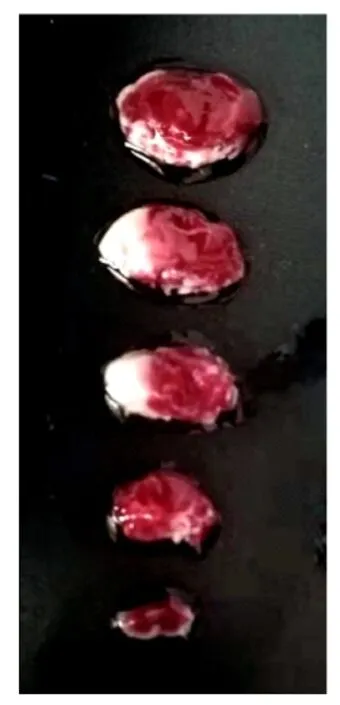
图1 脑缺血再灌注损伤小鼠脑组织形态表现(TTC)Fig.1 Morphology of brain tissue of mice with cerebral ischemia-reperfusion injury(TTC)
2.2 2组小鼠运动协调能力评分平衡木实验结果显示:与损伤前比较,损伤后1 d,2组小鼠运动协调能力评分明显降低(P<0.01),提示脑缺血再灌注损伤导致小鼠运动协调能力受损;损伤后16 d,2组小鼠运动协调能力评分均高于损伤后1 d(P<0.01),提示脑缺血再灌注损伤小鼠运动协调能力均有一定程度的恢复;SG组小鼠较SS组运动协调能力评分升高(P<0.05),提示生长激素可以促进脑缺血再灌注损伤小鼠运动协调能力的恢复。见图2。

图2 平衡木实验检测2组小鼠运动协调能力评分Fig.2 Scores of motor coordination abilities of mice in two groups detected by beam balance test
2.3 2组小鼠肌力网屏实验结果显示:与损伤前比较,2组小鼠在损伤1 d后倒置抓握网屏时的停留时间明显缩短(P<0.01),表明脑缺血再灌注损伤后,小鼠肌力出现明显降低;损伤后16 d,2组小鼠倒置抓握网屏时的停留时间均长于损伤后1 d(P<0.01),表明其肌力均有一定程度的改善;与SS组比较,SG组小鼠倒置抓握网屏时的停留时间明显延长(P<0.05),提示生长激素有利于促进脑缺血再灌注损伤小鼠肌力恢复。见图3。

图3 网屏实验检测2组小鼠倒置抓握网屏时停留时间Fig.3 Residence time of grasping screen upside down of mice in two groups detected by screen test
2.4 2组小鼠患侧肢体使用率圆筒实验结果显示:与损伤前比较,2组小鼠在损伤后1 d患侧肢体使用率明显降低(P<0.01),表明脑缺血再灌注损伤后,小鼠表现出明显的偏瘫现象,即其爬壁过程中更加依赖于健侧前肢;损伤后16 d,2组小鼠患侧肢体使用率均有所升高,其中SG组小鼠较SS组患侧肢体使用率更高(P<0.05),提示生长激素能够提高脑缺血再灌注损伤小鼠在爬壁过程中患侧肢体使用次数。见图4。

图4 圆筒实验检测2组小鼠患侧肢体使用率Fig.4 Utilization rates of affected limbs of mice in two groups detected by cylinder test
2.5 2组小鼠梗死灶周围区域中SYN 1表达水平损伤后16 d,与SS组(0.58±0.02)比较,SG组小鼠梗死灶周围区域中SYN1表达水平(0.73±0.05)明显升高(P<0.05),提示生长激素能够促进脑缺血再灌注损伤小鼠梗死灶周围区域中SYN1表达。见图5。

图5 2组小鼠梗死灶周围区域中SYN1表达电泳图Fig.5 Electrophoregram of expressions of SYN 1 in peri-infarct region of mice in two groups
3 讨 论
近年来生长激素在中枢神经系统疾病中的研究和应用日益受到人们的关注。生长激素广泛存在于中枢神经系统的皮质、海马、壳核、丘脑和脉络丛等部位[13],一方面,生长激素通过作用于脑组织中的相应受体,调节细胞凋亡信号通路,对受损的脑组织起到神经保护作用;另一方面,其通过提高内源性神经营养因子的表达,促进神经元和神经胶质细胞的分化和增殖,进而发挥神经营养与修复作用[14]。
刘海涛等[8]对脑缺血再灌注损伤大鼠模型进行生长激素干预发现:大鼠损伤区神经细胞凋亡明显减少,巢蛋白表达水平明显升高,表明生长激素可以抑制细胞凋亡,并促进神经干细胞增殖。ONG等[6]通过光化学血栓闭塞诱导小鼠局灶性脑缺血48h后外周给予生长激素的研究结果显示:生长激素可显著改善小鼠认知功能,其机制与促进梗死灶周围区域的神经修复有关。
本研究采用线栓法制备可逆性MCAO模型,诱导小鼠脑缺血再灌注损伤后对侧肢体运功功能障碍。该模型具有创伤小、缺血部位固定、可准确控制缺血和再灌注时间及能够高度模拟人类脑梗死的整个过程等优点,是探讨卒中后功能障碍改善机制的理想模型[15]。
研究[16]显示:脑卒中后因中枢神经系统受损,低级中枢失去高级中枢控制,常导致机体出现肌肉痉挛、运动协调能力下降和平衡功能丧失等,严重影响肢体的正常运动。本研究通过平衡木实验观察脑缺血再灌注损伤小鼠运动协调能力变化的结果显示:脑缺血再灌注损伤后1 d,小鼠运动协调能力评分明显降低,表明脑缺血再灌注损伤造成了小鼠运动协调能力降低。为观察生长激素是否可以改善小鼠的运动协调能力,对2组小鼠分别进行生长激素和生理盐水干预的结果显示:2组小鼠运动协调能力评分均有不同程度的提高,表明缺血再灌注损伤后大脑有一定程度的自然恢复,其可能机制与病灶周围水肿消退、侧支循环形成和脑源性神经营养因子释放等有关[17]。此外,与SS组比较,SG组小鼠运动协调能力评分升高更为明显,表明重组人生长激素可以促进脑缺血再灌注损伤小鼠运动协调能力的恢复。
本研究采用网屏实验评估脑缺血再灌注损伤小鼠前后肢肌力情况的结果显示:脑缺血再灌注损伤后1 d,小鼠倒置抓握网屏时的停留时间均明显缩短,提示脑卒中后小鼠肌力明显下降,运动功能严重损伤。经生长激素或生理盐水干预后,2组小鼠肌力均有一定程度的自然恢复。与SS组比较,SG组小鼠支撑于网屏的时间延长程度更高,表明重组人生长激素能够促进脑缺血再灌注损伤小鼠肌力恢复,进而改善运动功能。研究[18]显示:注射重组人生长激素4周后,大鼠骨骼肌肌纤维横截面积明显增加,肌肉总蛋白含量增加。本文作者认为:本研究中SG组小鼠肌力的改善可能与重组人生长激素影响骨骼肌形态及代谢机能有关。
局灶性脑缺血后,小鼠前肢的使用情况具有不对称性,损伤越重,越倾向于使用健侧前肢。本研究通过圆筒实验评估小鼠患侧前肢使用率的结果显示:损伤后1 d,小鼠患侧肢体使用率均明显降低,提示脑缺血再灌注损伤后小鼠出现明显的偏瘫现象,爬壁过程中更依赖于健侧前肢。损伤后2 d分别对小鼠进行14 d生长激素和生理盐水干预的结果显示:与SS组比较,SG组小鼠患侧肢体使用率明显升高,表明重组人生长激素有利于脑缺血再灌注损伤小鼠偏瘫肢体运动功能的恢复。HEREDIA等[19]通过糖丸抓取实验评估重组人生长激素对单侧额叶皮质损伤大鼠运动功能的影响,发现治疗结束后大鼠患侧肢体使用率明显升高,与本研究结果一致。
大鼠脑皮质缺血模型中,行为学的改善与SYN1免疫阳性物质的表达升高显著相关[20]。SYN1是一种钙结合糖蛋白,特异性地位于轴突终末的突触前囊泡膜上,与突触的形成、成熟和可塑性密不可分[21-22]。研究[23-25]显示:IS的发病与修复过程中,存活的神经元可通过轴突出芽形成不同的分支,与原有的突触后位点或新的突触后位点发生接触构成新的突触,同时激活处于休眠状态的侧支和突触联系,从而完成神经回路改造与突触重塑。而脑损伤后运动功能障碍恢复的关键在于受损区域的皮质重建和神经细胞修复,这与突触重塑的发生密切相关[26-27]。本研究采用免疫印迹法检测SYN1表达水平的结果显示:治疗结束后,与SS组比较,SG组小鼠梗死灶周围区域中SYN1表达水平明显升高,提示生长激素能够促进脑缺血再灌注损伤小鼠梗死灶周围区域中SYN1表达。SANCHEZ-BEZANILLA等[5]发现:重组人生长激素治疗能够促进脑缺血大鼠梗死灶周围区域中AMPA受体亚单位GluR1蛋白的表达,提高梗死灶周围区域突触可塑性。本研究进一步证实了生长激素在促进IS后突触可塑性中的重要作用。本文作者推测:生长激素改善IS小鼠运动功能的机制之一是提高突触的可塑性,即生长激素可能是通过增强SYN1的表达,促进脑组织轴突再生和突触重构,进而对受损的运动传导通路起修补作用,加速运动功能的恢复。
综上所述,脑缺血再灌注损伤会导致小鼠出现运动功能障碍,外周注射重组人生长激素可以改善小鼠受损的运动功能,其机制可能与促进梗死灶周围区域中SYN1的表达,从而诱导神经发生并增强突触可塑性有关。重组生长激素在局灶性脑缺血再灌注小鼠运动功能的作用机制尚需进一步研究。

