人参糖蛋白对少弱精症小鼠生精障碍的改善作用
单梦瑶,王维纲,董金香,田建明,宋莲莲,陈英红,房晓雪,邱智东,罗浩铭,朱迪夫
(1.长春中医药大学药学院中药药剂实验室,吉林 长春 130117;2.吉林医药学院附属医院中医科,吉林 吉林 132013;3.吉林省中医药科学院中药二所,吉林 长春 130012;4.长春中医药大学药学院药物化学与中药化学教研室,吉林 长春 130117;5.长春中医药大学药学院生物制药与保健食品教研室,吉林 长春 130117)
少弱精症是近年来临床常见的病症,多导致男性不育症,已占男性不育病因的75%。因环境污染和生活压力带来的影响日益加剧,男性患有少弱精症的人数逐年升高,发病率呈上升趋势[1-2],主要表现在精子总数与精子质量的明显下降。目前,少弱精症的病因病机尚不明确,致病因素较多且临床缺少特效治疗药物[3]。现阶段临床上常采用经验性药物治疗,例如采用促性腺激素和促性腺激素释放激素等激素疗法,或采用L-肉碱和维生素E治疗,以及采用辅助生殖技术和手术治疗提高生育率。现有药物单用疗效并不显著,临床常采用联合用药的方式,药物带来了多种不良反应,且辅助生殖技术要求高、成功率低且价格昂贵,因此经验性药物及辅助技术在临床推广受到一定限制[4-7]。近年来,中医药治疗少弱精症优势较为明显,市场已有的中成药生精胶囊和麒麟丸均显示出了独特的疗效[8-9]。
人参(Panax ginseng C.A.Mey)被誉为百草之王,具有补气固脱、健脾补肺和安神益智的作用[10-12]。研 究[13-16]显 示:人 参 具 有 改 善 男 性 性 功能障碍的作用,其作用机制可能与睾丸中诱导精子生成并激活和增加精原干细胞中胶质细胞源性神经营养因子(glialcellline-derivedneurotrophicfactor,GDNF)的表达有关,也可能与以内皮细胞和血管神经为介导的一氧化氮(nitric oxide,NO)释放有关,或是人参中有效成分影响Cyp11a1基因的表达,增强睾丸功能,影响器官形态与生殖系统发育。因此,人参在改善生精障碍和治疗少弱精症方面有很好的开发前景。
本课题组针对人参糖蛋白(Panax ginsengglycoproteins,PGG)进行研究。本课题组[17]检测PGG荧光标记后的小鼠体内药物的组织分布和靶向效率结果显示:PGG在小鼠脑组织和睾丸组织有明显的靶向性趋势,具有透过血脑屏障和血睾屏障的可能性。为探讨PGG对少弱精症的治疗作用,本研究采用环磷酰胺建立小鼠少弱精症模型,在此基础上给予小鼠PGG,在体内研究PGG促进小鼠生殖功能的生物活性,并初步探讨其作用机制。本实验旨在为深度开发PGG提供依据,为少弱精症治疗药物的研究奠定基础。
1 材料与方法
1.1 动物、主要试剂和仪器昆明种小鼠60只,均为雄性,体质量(20±1)g,由辽宁长生生物技术股份有限公司提供,动物生产许可证号:SCXK(辽)2015-0001。PGG(长春中医药大学自制),生精胶囊(遵义廖元和堂药业有限公司),注射用环磷酰胺(德国Baxter Oncology GmbH公司),小鼠ELISA试剂盒(江苏绿叶生物科技有限公司),苏木精-伊红(hematoxylin eosin,HE)试剂盒(山东西亚化学股份有限公司),生理盐水(石家庄四药有限公司),甲醇(天津市富宇精细化工有限公司)。Olympus BX51光学显微镜(日本Olympus公司),NIS-ELEMNT BR型图像分析系统(日本Nikon公司),BI2000图像分析仪(成都泰盟科技有限责任公司),i30计数器(广东省深圳市海天地科技有限公司),Leica RM 2255型石蜡切片机和Leica EG1140石蜡包埋机(德国Leica公司)。
1.2 PGG理化性质测定和结构分析按文献[18]的方法测定PGG的中性糖构成比、酸性糖构成比和蛋白质构成比,进行相对分子质量分布测定、组成糖分析、氨基酸分析和甲基化分析。
1.3 PGG在小鼠睾丸组织中分布检测按文献[17]方法对PGG进行荧光标记,观察其在小鼠脏器组织中的分布情况。采集小鼠睾丸组织,并置于-20℃冰箱中冻存20 min后,将组织连续切片,置于载玻片上,放入动物荧光成像仪中,观察小鼠睾丸组织中荧光分布情况。拍摄条件:拍摄像素:2×2,FOV:10,激发波长:480 nm,发射波长:535 nm,曝光时间:2 s。
1.4 生精胶囊和PGG剂量设计阳性对照药物:生精胶囊,临床用量为0.4 g/粒×12粒/人/日,折算成小鼠的等效剂量为700 mg·kg-1;根据文献[19-20],PGG的低、中和高剂量分别设为100、200和400 mg·kg-1。
1.5 小鼠少弱精症模型制备[21]取60只雄性小鼠,随机选取10只小鼠作为正常组,腹腔注射生理盐水10 mL·kg-1,其余小鼠腹腔注射环磷酰胺30 mg·kg-1,每日1次,连续7 d,建立小鼠少弱精症模型。与正常组比较,造模小鼠精子总数、精子活率和精子活力明显降低,精子畸形率明显升高,则表明造模成功。
1.6 动物分组和给药处理将小鼠随机分为正常组、模型组、阳性对照组(生精胶囊,700 mg·kg-1)、低剂量PGG组(100 mg·kg-1PGG)、中剂量PGG组(200 mg·kg-1PGG) 和 高 剂 量PGG组(400 mg·kg-1PGG),每组10只。正常组和模型组小鼠灌胃等体积纯净水,其他各组小鼠分别灌胃相应药液,每日1次,连续给药28 d。
1.7 各组小鼠精子检查给药结束次日取材,称量小鼠体质量、脱臼处死,打开腹腔,取出双侧睾丸,分离两侧附睾组织,置入含有提前预热至37℃、1 mL生理盐水的小平皿中,采用眼科剪刀剪碎,静置5 min,吸管吹打均匀。取悬液滴于细胞计数板中,立即置于显微镜下计精子总数、活精子数、畸形精子数、前进运动精子数(a级精子数+b级精子数),a级精子:表示精子快速直线向前运动,直线运动;b级精子:表示精子缓慢或呆滞向前移动,缓慢运动;并计算精子活率、精子畸形率和精子活力。精子活率=活精子数/精子总数×100%;精子畸形率=(头、尾断裂的精子数)/精子总数×100%;精子活力=(a级精子数+b级精子数)/精子总数×100%。另取50μL悬液滴至载玻片上,盖玻片纵向涂一线条,均匀涂片。置室温自然干燥,甲醇固定5 min,干燥,1%伊红染色1 h,用水轻冲,干燥,获得各组小鼠精子观察图。
1.8 各组小鼠脏器系数测定取小鼠睾丸(双)、前列腺+贮精囊(双)、包皮腺(双)和提肛肌称质量,分别计算睾丸、前列腺+贮精囊、包皮腺和提肛肌脏器系数。脏器系数=(脏器质量或脏器平均质量/小鼠体质量)×100%,单位均为mg·100 g-1。
1.9 HE染色检测各组小鼠睾丸组织病理形态表现取小鼠右侧睾丸组织,4%多聚甲醛溶液固定24 h,进行梯度乙醇脱水透明。将固定后的组织横切,取0.5 cm组织块,采用石蜡包埋,制备5μm切片,组织切片置于60℃烘箱中烘烤1 h,冷却至室温。
将组织切片浸入二甲苯中浸泡10 min,更换二甲苯后再浸泡10 min,采用100%、95%、90%和80%梯度乙醇水化,水冲洗,水化后的切片置入苏木精染液中浸泡5~20 min,细胞核染成紫蓝色,水冲洗3~5 min,1%盐酸酒精分化5~30 s,水冲洗1~3 min,弱碱性水溶液返蓝30~60 s,水充分冲洗5~10 min,充分水化后的切片直接入伊红染色液中浸泡5~15 min,细胞质染成粉红色,蒸馏水稍洗,采用90%、95%和100%梯度乙醇脱水,二甲苯透明,中性树胶封片。观察各组小鼠睾丸组织病理形态表现。
1.10 各组小鼠生精小管形态指标测量测量各组小鼠睾丸组织中12个生精小管内生精细胞层厚度,取平均值。生精细胞层厚度反映生精细胞分化成熟程度,厚度值越高,生精细胞分化层级越高,生精细胞数量越多,精子生成和成熟进程越高。
测量各组小鼠睾丸组织中5个类圆形生精小管切面内生精细胞层横截面的面积,取平均值。生精细胞层横截面面积反映动物生精能力,横截面面积越大,生精细胞数量越多,生精能力越强,生成精子总数越多。
1.11 各组小鼠血清性激素水平检测末次给药1 h后,小鼠眼眶采血,将血样以3 000 r·min-1离心10 min,分离血清,采用ELISA法检测各组小鼠血清睾酮(testosterone,T)、卵泡刺激素(follicle stimulating hormone,FSH)和 催 乳 素(prolactin,PRL)水平,具体操作步骤按照试剂盒说明书进行。
1.12 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组小鼠精子总数、脏器系数、生精小管中生精细胞层厚度和生精细胞层横截面面积及血清性激素水平经正态性检验呈正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用t检验。精子活率、精子畸形率和精子活力组间两两比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 PGG的理化性质和结构分析PGG是相对分子质量为12 690(100%)的大分子混合物,中性糖、酸性糖和蛋白质构成比分别为45.4%、4.3%和51.1%。PGG单糖组成为甘露糖(21.01%)、葡萄糖(26.53%)、N-乙酰葡萄糖或N-乙酰半乳糖(12.17%)、半乳糖(28.23%)和岩藻糖(9.78%)。氨基酸检测结果显示:PGG主要含有15种氨基酸,其中谷氨酸(13.724%)、精氨酸(6.227%)和赖氨酸(6.19%)居多[17]。甲基化分析和单糖组成分析结果表明:PGG的主链部分是由→2)-Man-(1→,→4)-Rha-(1→,→4)-Fuc-(1→,→6)-Gal-(1→,→3)-Gal-(1→,→4)-GalA-(1→,→4)-GlcNAc-(1→,→4)-GalNAc-(1→组成,支链主要由→3,6)-Man-(1→,2,6)-Man-(1→,2,5)-Man-(1→组成,末端主要由1→)-Fuc,1→)-Glc,1→)GlcNAc or 1→)-GalNAc组成。
2.2 PGG在小鼠睾丸组织中的分布PGG在小鼠睾丸组织处大量富集,睾丸组织的生精小管内有较强荧光信号表达,主要集中在生精小管内生精细胞表面。见图1。
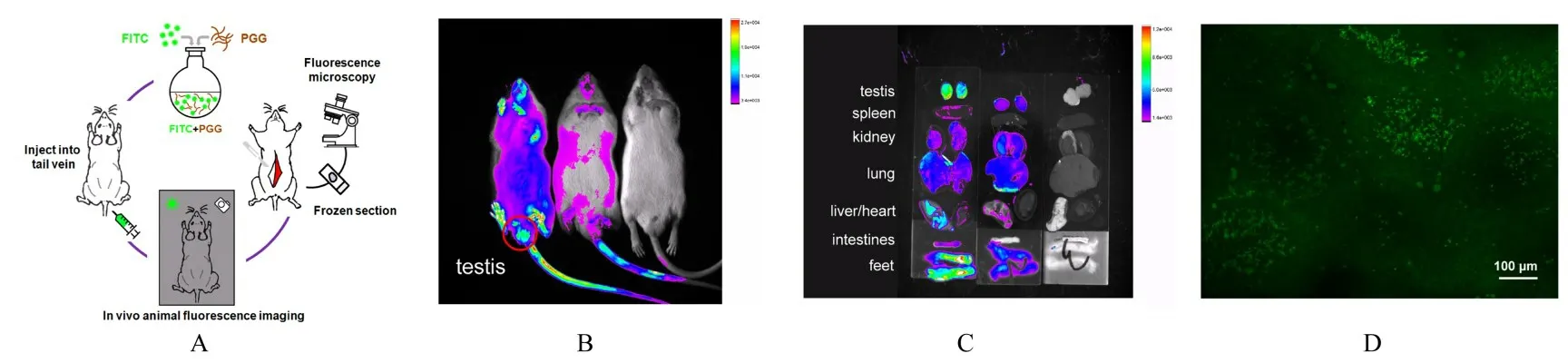
图1 PGG在小鼠睾丸组织中的荧光分布Fig.1 Fluorescence distribution of PGG in testis tissue of mice
2.3 各组小鼠精子总数、精子活率、精子畸形率和精子活力与正常组比较,模型组小鼠精子总数明显降低(P<0.01);与模型组比较,生精胶囊组、中和高剂量PGG组小鼠精子总数明显升高(P<0.05)。与正常组比较,模型组小鼠精子活率明显降低(P<0.01);与模型组比较,生精胶囊组、中剂量PGG组和高剂量PGG组精子活率明显升高(P<0.01)。与正常组比较,模型组小鼠精子畸形率明显升高(P<0.01);与模型组比较,生精胶囊组、中剂量PGG组和高剂量PGG组小鼠精子畸形率明显降低(P<0.05或P<0.01)。与正常组比较,模型组小鼠精子活力明显降低(P<0.01);与模型组比较,生精胶囊组、中剂量PGG组和高剂量PGG组精子活力明显升高(P<0.05或P<0.01)。见表1和图2。

图2 各组小鼠精子形态表现(×100)Fig.2 Morphology of sperm of mice in various groups(×100)
表1 各组小鼠精子总数、精子活率、精子畸形率和精子活力Tab.1 Total number of sperm,survival rates of sperm,malformation rates of sperm,and motilities of sperm of mice in various groups (n=10,±s)
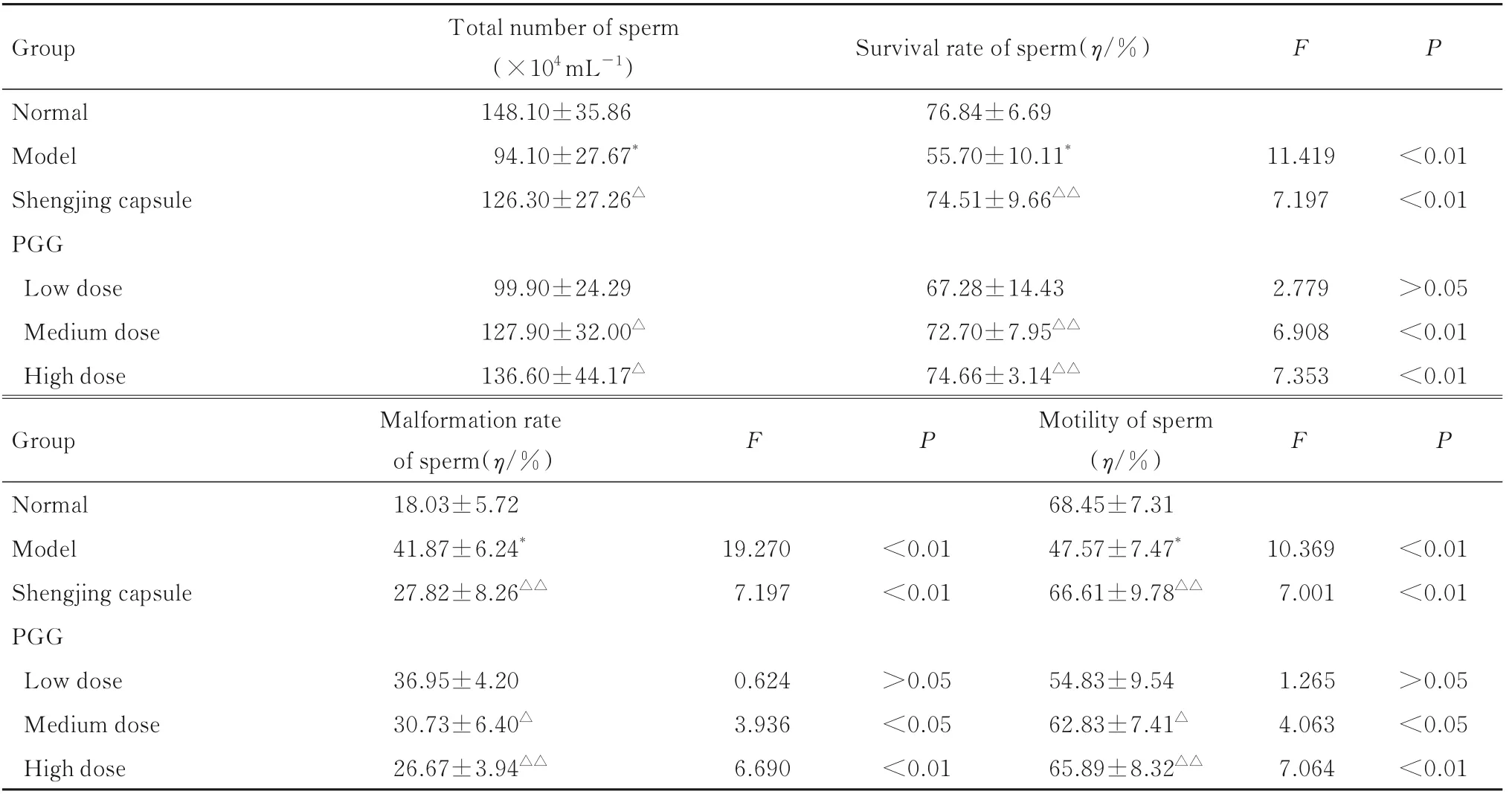
表1 各组小鼠精子总数、精子活率、精子畸形率和精子活力Tab.1 Total number of sperm,survival rates of sperm,malformation rates of sperm,and motilities of sperm of mice in various groups (n=10,±s)
*P<0.01 compared with normal group;△P<0.05,△△P<0.01 compared with model group.
Group Survival rate of sperm(η/%)F P Normal Model Shengjing capsule PGG Low dose Medium dose High dose Total number of sperm(×104 mL-1)148.10±35.86 94.10±27.67*126.30±27.26△76.84±6.69 55.70±10.11*74.51±9.66△△11.419 7.197<0.01<0.01 99.90±24.29 127.90±32.00△136.60±44.17△67.28±14.43 72.70±7.95△△74.66±3.14△△2.779 6.908 7.353>0.05<0.01<0.01 Group F P F P Normal Model Shengjing capsule PGG Low dose Medium dose High dose Malformation rate of sperm(η/%)18.03±5.72 41.87±6.24*27.82±8.26△△19.270 7.197<0.01<0.01 Motility of sperm(η/%)68.45±7.31 47.57±7.47*66.61±9.78△△10.369 7.001<0.01<0.01>0.05<0.05<0.01 36.95±4.20 30.73±6.40△26.67±3.94△△0.624 3.936 6.690>0.05<0.05<0.01 54.83±9.54 62.83±7.41△65.89±8.32△△1.265 4.063 7.064
2.4 各组小鼠各类脏器系数与正常组比较,模型组小鼠睾丸和前列腺+贮精囊脏器系数明显降低(P<0.05或P<0.01),包皮腺和提肛肌脏器系数差异无统计学意义(P>0.05)。与模型组比较,生精胶囊组和各剂量PGG组小鼠睾丸、前列腺+贮精囊、包皮腺和提肛肌脏器系数差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠各类脏器系数T ab.2 Different kinds of organ coefficients of mice in various groups [n=10,±s,w B/(mg·100 g-1)]
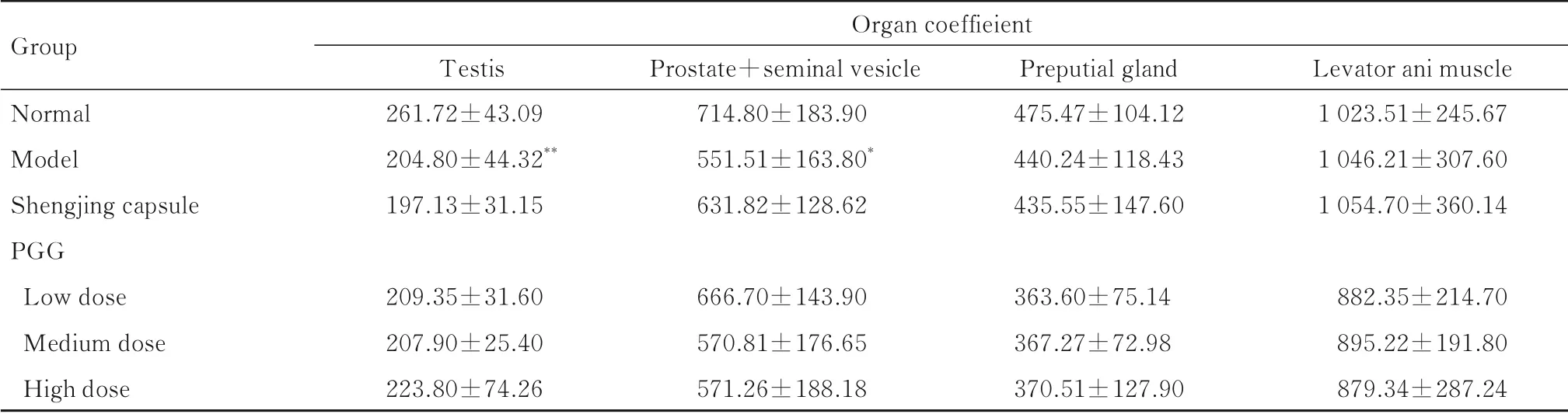
表2 各组小鼠各类脏器系数T ab.2 Different kinds of organ coefficients of mice in various groups [n=10,±s,w B/(mg·100 g-1)]
*P<0.05,**P<0.01 compared with normal group.
2.5 各组小鼠睾丸组织病理形态表现各组小鼠睾丸组织病理学结果显示:正常组小鼠睾丸组织生精细胞排列具有层次,所占面积较大,各级生精细胞数量丰富,精子分化形成过程中的各级细胞均易见,管腔内可见较多精子。与正常组比较,模型组小鼠睾丸组织生精上皮变薄,生精细胞层次和结构疏松、排列紊乱,生精过程中的各级细胞受损,分化异常,管腔内见少量精子或未见精子。与模型组比较,生精胶囊组和各剂量PGG组小鼠睾丸组织生精上皮表现为生精障碍的程度得到有效缓解,生精细胞层增厚,多见生精过程中的各级细胞,精子分化形成过程得到明显改善,管腔内精子总数增加,随着PGG剂量增加效果越明显。见图3。
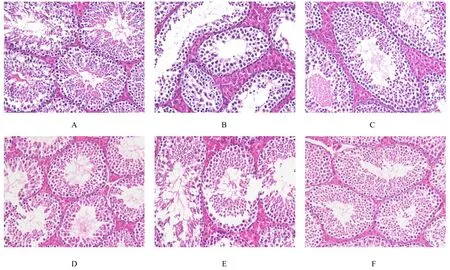
图3 各组小鼠睾丸组织病理形态表现(HE,×400)Fig.3 Pathomorphology of testis tissue of mice in various groups(HE,×400)
2.6 各组小鼠生精小管中生精细胞层厚度和生精细胞层横截面面积与正常组比较,模型组小鼠生精小管中生精细胞层厚度和生精细胞层横截面面积明显减小(P<0.01)。与模型组比较,生精胶囊组和各剂量PGG组小鼠生精小管中生精细胞层厚度和生精细胞层横截面面积明显增加(P<0.05或P<0.01)。见表3。
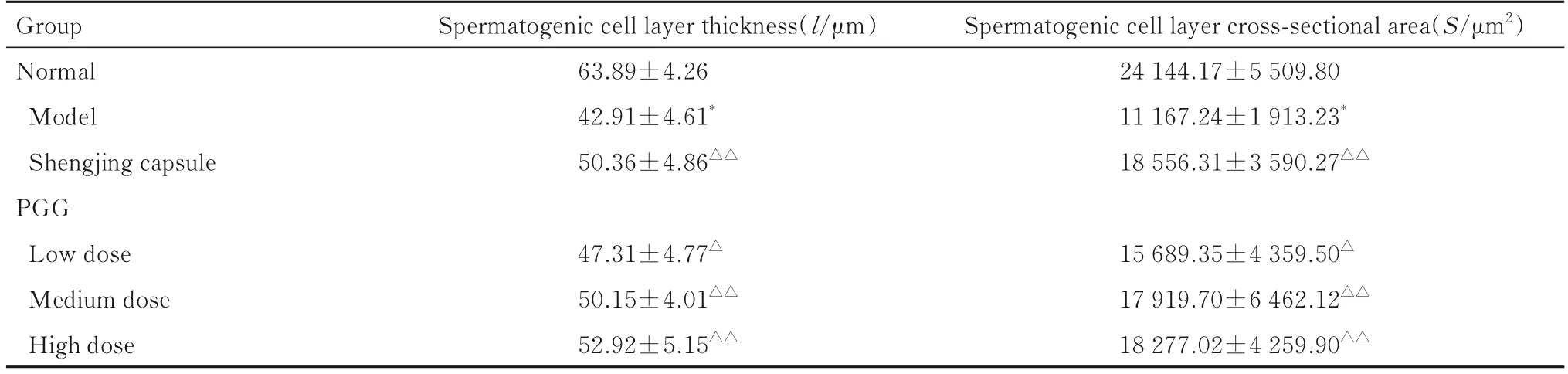
表3 各组小鼠生精小管内生精细胞层厚度和横截面面积Tab.3 Spermatogenic cell layer thickness and spermatogenic cell layer cross-sectional areas in seminiferous tubules of mice in various groups (n=10,x±s)
2.7 各组小鼠血清性激素水平与正常组比较,模型组小鼠血清T、FSH和PRL水平明显降低(P<0.05或P<0.01)。与模型组比较,生精胶囊组、中剂量PGG组和高剂量PGG组小鼠血清T水平明显升高(P<0.05或P<0.01),生精胶囊组和各剂量PGG组小鼠血清FSH水平明显升高(P<0.05或P<0.01),各剂量PGG组小鼠血清PRL水平明显升高(P<0.01)。见表4。
表4 各组小鼠血清性激素水平Tab.4 Levels of sex hormones in serum of mice in various groups (n=10,±s)
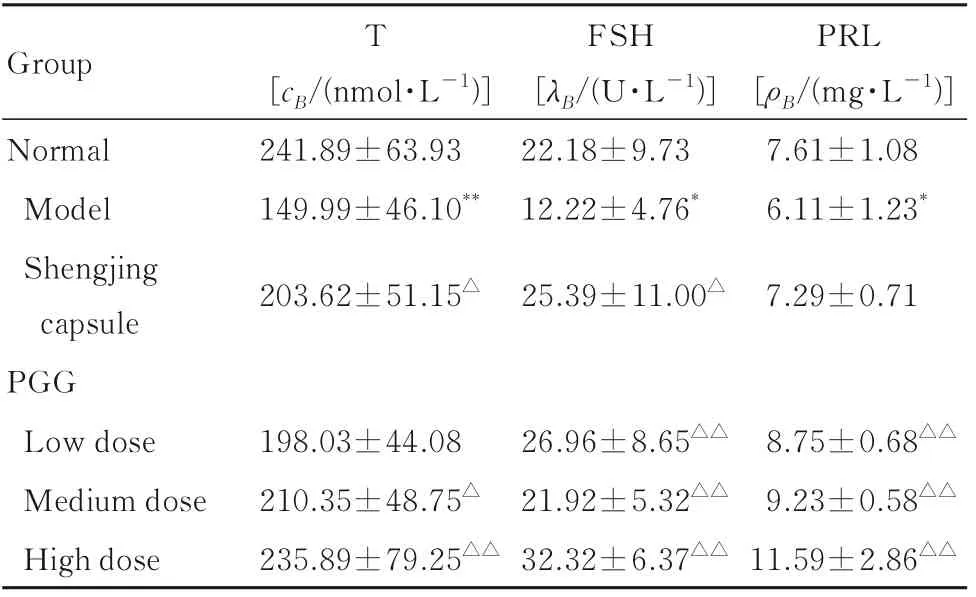
表4 各组小鼠血清性激素水平Tab.4 Levels of sex hormones in serum of mice in various groups (n=10,±s)
*P<0.05,**P<0.01 compared with normal group;△P<0.05,△△P<0.01 compared with model group.
Group T Normal Model Shengjing capsule PGG Low dose Medium dose High dose[cB/(nmol·L-1)]241.89±63.93 149.99±46.10**FSH[λB/(U·L-1)]22.18±9.73 12.22±4.76*PRL[ρB/(mg·L-1)]7.61±1.08 6.11±1.23*203.62±51.15△25.39±11.00△7.29±0.71 8.75±0.68△△9.23±0.58△△11.59±2.86△△198.03±44.08 210.35±48.75△235.89±79.25△△26.96±8.65△△21.92±5.32△△32.32±6.37△△
3 讨 论
近年来,随着人们对人参多糖及其复合物的研究不断系统和深入,对PGG的生物活性有了新的认识。前期研究[22-24]证实:PGG具有改善睡眠、增强学习记忆功能、镇静催眠和镇痛等多方面的作用。生精障碍即精子发生障碍,是引发男性不育的重要原因,其致病因素多样,一些无精子症或少精子症等大部分是由生精障碍引起的。本研究结果显示:PGG可提高精子数量和质量,提高小鼠血清T、FSH和PRL水平,可有效改善少弱精症小鼠的生精障碍。
环磷酰胺是常用的抗肿瘤药物和免疫抑制剂,具有生殖毒性,可对生精干细胞进行破坏,影响p53和Fas/FasL等途径,从而诱导生殖细胞畸形、遗传物突变和凋亡[25]。研究[26]显示:环磷酰胺可引起无精症或少精症,导致不育或畸形的发生。本研究采用环磷酰胺建立小鼠少弱精症模型,探讨PGG对少弱精症小鼠生精障碍的改善作用。与正常组比较,模型组小鼠的精子总数、精子活率和精子活力降低,精子畸形率升高,以上结果说明造模成功。小鼠精子总数、精子活率、精子畸形率和精子活力实验结果显示:生精胶囊组和各剂量PGG组小鼠上述指标均有改善,且具有剂量依赖性,即中和高剂量PGG对少弱精症具有明显的治疗作用,表明PGG可促进精子发生,增强精子质量。小鼠脏器系数反映生殖器官的发育情况及损害情况[27],与模型组比较,生精胶囊组和各剂量PGG组小鼠睾丸、前列腺+贮精囊、包皮腺和提肛肌脏器系数差异无统计学意义,结果表明PGG对脏器无明显毒害或修复损伤作用。睾丸组织病理形态结果需要结合精子检查的相关指标综合分析,因细胞不能明确分层,造模后会出现细胞成分、种类、形态复杂,排列紊乱等情况,不利于客观评价结果。为最大可能排除干扰,减小误差,本研究采用计算生精小管中生精细胞层厚度和生精细胞层横截面面积的方式进行评价。本研究结果显示:经生精胶囊和各剂量PGG治疗后,小鼠睾丸组织中生精障碍均得到有效改善,且对PGG具有剂量依赖性,表明PGG可恢复生精上皮细胞形态和结构,推动细胞分化进程,逐步恢复分化秩序和功能,增加精子数量,有效改善少弱精症。
T是雄性激素的重要组成部分,其水平与睾丸生精功能密切相关,具有促进精子生成与成熟,提升精子数量与质量的作用[28-29]。FSH作用于支持细胞分泌T,PRL虽然不被认为是一种“经典”的性激素,但其可能在男性内分泌控制中发挥作用。本研究结果显示:模型组小鼠血清T、FSH和PRL水平明显低于正常组,经各剂量PGG治疗后,小鼠血清性激素水平提高,且具有剂量依赖性,高剂量PGG组小鼠血清T、FSH和PRL水平高于中剂量PGG组和低剂量PGG组。PGG可能是通过提高血清性激素水平从而改善少弱精症小鼠生精障碍,但其对性激素作用的机制需要进一步的研究和探讨。
综上所述,PGG对少弱精症小鼠的生精障碍具有明显的改善作用,本研究结果为研究改善生精状况、提高精子活力和提高生殖质量提供了实验依据。

