雄激素受体辅调节因子BAP18在大鼠睾丸细胞中的表达及其意义
孙士莹,孙 戈,林 琳,赵 越
(1.中国医科大学生命科学学院 教育部医学细胞生物学重点实验室,辽宁 沈阳 110122;2.安徽医科大学第二附属医院妇产科,安徽 合肥 230601)
在哺乳动物的睾丸和附睾中,精原细胞产生成熟的精子,这一过程受到精小管中包括睾丸间质细胞和睾丸支持细胞在内的一系列细胞和其中分子相互作用的精确调控,揭示睾丸细胞中关键分子机制具有重要意义[1]。雄激素在体内主要活性形式包括睾 酮 (testosterone, T) 和 双 氢 睾 酮(dihydrotestosterone,DHT),是 雄 激 素 受 体(androgen receptor,AR)的主要配体。AR作为性激素受体超家族成员之一,通常在体内被雄激素激活,特别是在人类精子发生过程中调控大量的AR靶基因的激活[2-4]。本课题组前期研究[5]显示:溴区PHD结构域转录因子(bromodomin PHD domain transcription factor,BPTF)相 关 蛋 白18(BPTF associated protein 18,BAP18)是一个功能未知的蛋白质,相对分子质量为18 000,可以在具有AR转录系统的果蝇体内上调AR的转录活性,并促进男性前列腺癌和去势型前列腺癌的肿瘤进程。BAP18在其蛋白氮端含有1个SANT结构域,因此被认为可以与其他染色质重塑蛋白共同广泛地参与染色质重塑过程和基因转录调控过程。然而,关于BAP18和AR在睾丸细胞中如何发挥作用目前尚未见相关文献报道。本研究探讨BAP18对AR介导基因转录的调控作用,旨在为雄性睾丸细胞异常的研究提供理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器R2C和15P-1、TM 3、TM 4和22Rv1细胞由中国医科大学生命科学学院染色质生物研究室保存,其中R2C和TM 3为大鼠睾丸间质细胞,TM 4和15P-1为大鼠睾丸支持细胞,22Rv1为人前列腺癌细胞(作为对照)。DMEM高糖培养基和1640培养基购自美国Thermo Scientific公司,胎牛/马血清购自美国BI公司,TRIzol购自美国Invitrogen公司,实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)相关试剂购自日本TaKaRa公司,BAP18和AR等相关抗体购自美国CST公司,Western blotting相关试剂购自上海碧云天生物科技有限公司,T和DHT购自美国Sigma公司(T 5411和D073)。蛋白电泳转移系统购自美国Bio-Rad公司,PCR扩增仪购自美国ABI公司,全自动酶标仪购自法国巴德斯公司。
1.2 细胞培养本实验所采用R2C细胞采用含2.5%胎牛血清和15%马血清的混合血清及1%青霉素/链霉素双抗的Ham’s F12培养基,15P-1和22Rv1细胞采用含10%胎牛血清和1%青霉素/链霉素双抗的高糖DMEM培养基。TM 3和TM 4细胞则采用含5%马血清/2.5%胎牛血清混合血清的F12/DMEM 1∶1混合培养基培养。所有细胞均置于37℃、5%CO2的培养箱中培养。
1.3 质粒的构建BAP18质粒构建于带有FLAG标签的PcDNA 3质粒中[5]。
1.4 RT-qPCR法检测细胞中目的基因mRNA表达水平总RNA采用TRIzol进行分离。采用PrimeScriptTMRT-qPCR试剂盒对总RNA(2μg)进行逆转录。实时聚合酶链反应采用SYBR预混Ex Taq试剂盒在Mx3000P仪器(Agilent StrataGene)上进行。正向和反向引物如下:BAP18 F 5′-ACCCAAGAAGATGACGTCCG-3′,BAP18 R 5-′CACAGAAGTCAAAGGGCGAG-3′;AR F 5′-TTCCCAAAGAAGCCGACAGT-3′,AR R 5′-CCAGTCACAAAGCTCCGCTA-3′;STAR F 5′-CTGCAGGACTCAGGACCTTG-3′,STAR R 5′-ACACAGCTTGAACGTAGCGA-3′;HSD3B1 F 5′-GTTTGTGGGCCAGAGGATCA-3′,HSD3B1 R 5′-TAGGATGGTCTGCCTGGG-AA-3′;CYP17A 1 F 5′-TGGAGGCCACTATCC-GAGAA-3′, CYP17A 1 R 5′-CATGGGATCCGGGACGTTAG-3′;DDX25 F 5′-TCTCGTCCATCCCAGGAAGA-3′,DDX25 R 5′-AGTGGAGAGCTGGGATCCTT-3′。以GAPDH作为内参,结果代表至少3次的独立实验结果。反应条件:95℃预变性60 s,95℃变性15 s,60℃退火15 s,72℃延伸45 s,共40个循环。以U 6或GAPDH作为内参,采用2-△△Ct法 计算细胞中目的基因mRNA表达水平。
1.5 Western blotting法检测细胞中目的蛋白表达水平收集细胞,提取细胞总蛋白质,BCA法检测蛋白质的浓度,取35μg蛋白质经10%SDSPAGE分离,210 mA恒流下进行湿转,将蛋白质转移至PVDF膜上,5%BSA室温封闭2 h后加入一抗,在4℃孵育过夜,第2天采用TBST洗去游离抗体,加入HRP标记的山羊抗小鼠或兔IgG二抗,室温孵育1 h;TBST洗膜3次,每次10 min,ECL发光液显色。显色结果采用Image Lab软件分析灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH蛋白条带灰度值。
1.6 蛋白质免疫共沉淀(proteinimmunoprecipitation,co-IP)法检测蛋白与蛋白的相互作用细胞全提取液采用特定的抗体4℃过夜持续孵育。第2天,采用protein G磁珠继续孵育2~4 h。磁珠在孵育后离心分离,然后采用冰PBS洗涤3次,最后采用20~30μL SDS-loading煮沸后行Western blotting实验。
1.7 荧光素酶双基因报告实验检测细胞中荧光素酶活性采用AR(20 ng)、肾素荧光素酶质粒(pRL)(2 ng)和BAP18质粒共转染R2C细胞,细胞转染严格按照jetPrime转染试剂的说明进行。转染后4 h,细胞换液培养于无血清DMEM培养基中,并添加乙醇或10-8mol·L-1T或DHT。24 h后收集细胞,并采用前期研究[6]所述的荧光素酶双基因报告实验检测系统检测细胞中荧光素酶活性。
1.8 统计学分析采用GraphPad Prism 8统计软件进行统计学分析。睾丸细胞中AR和BAP18 mRNA和蛋白表达水平,细胞中荧光素酶活性,BAP18过表达后细胞中BAP18、AR、STAR、HSD3B1、CYP17A 1和DDX25 mRNA表达水平及CYP17A 1蛋白表达水平符合正态分布,以±s表示,组间比较采用Student’st检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠睾丸细胞中AR和BAP18 mRNA和蛋白表达水平RT-qPCR检测结果显示:睾丸细胞R2C和15P-1细胞中BAP18 mRNA表达水平低于15P-1细胞。Western blotting法检测大鼠睾丸细胞中AR和BAP18蛋白表达的结果显示:AR主要在睾丸R2C细胞中高表达,在其他细胞中表达水平较低,其他各类细胞中,22Rv1细胞中BAP18蛋白表达水平最高。见图1和2。
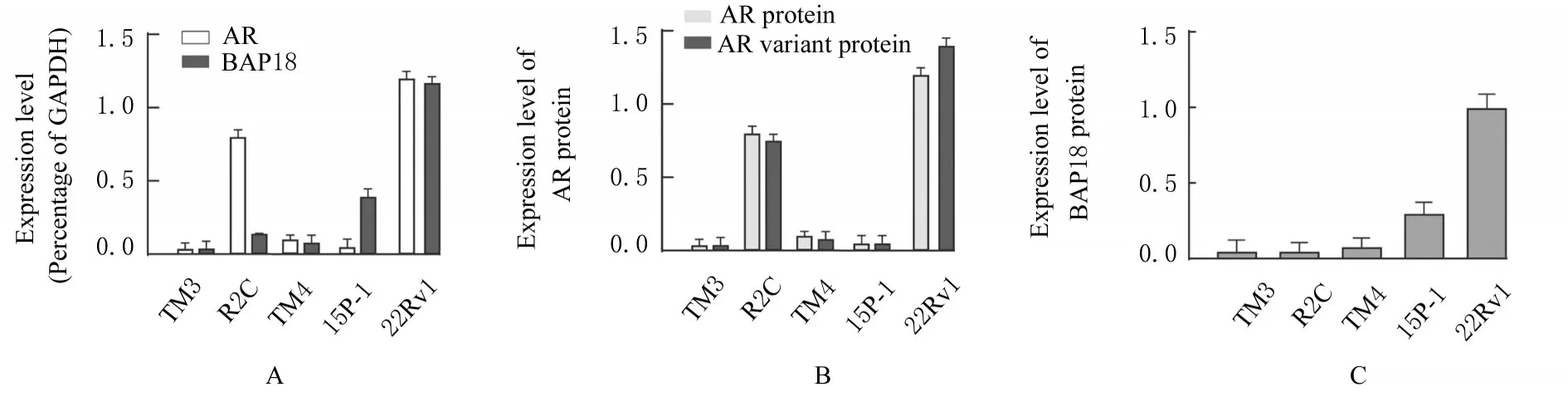
图1 睾丸细胞中AR和BAP18 mRNA和蛋白表达水平Fig.1 Expression levels of AR and BAP18 m RNA and protein in testicular cells
2.2 细胞中荧光素酶活性在R2C细胞中BAP18可以与野生型AR相互作用(图3)。荧光素酶双基因报告实验结果显示:在R2C细胞中同时外源转染定量BAP18表达质粒后,在DHT的作用下,细胞中荧光素酶活性升高近3倍,而在T的作用下,细胞中荧光素酶活性升高1.5倍(图4)。

图2 Western blotting法检测睾丸细胞中AR和BAP18蛋白表达电泳图Fig.2 Electrophoregram of expressions of AR and BAP18 proteins in testicular cells detected by Western blotting method
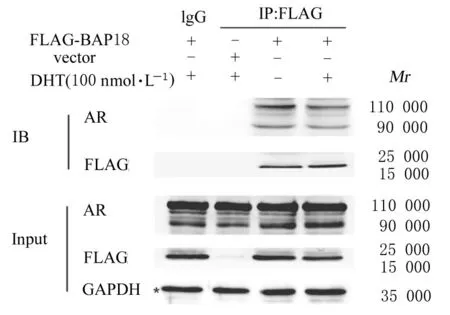
图3 R2C细胞中BAP18与AR的相互作用Fig.3 Interaction of BAP18 and AR in R2C cells
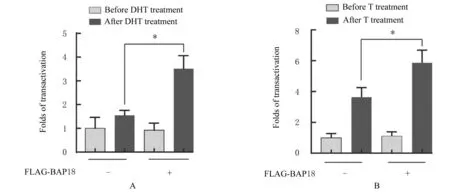
图4 DHT(A)和T(B)作用后BAP18过表达组细胞中荧光素酶活性Fig.4 Luciferaseactivitiesin cellsin BAP18over-expression group after treated with DHT(A)and T(B)
2.3 BAP18过表达前后细胞中相关基因mRNA表达水平R2C细胞中过表达BAP18后,经溶解DHT的溶剂EtOH、T和DHT作用后,细胞中AR、STAR、HSD3B1和DDX25 mRNA表达水平与BAP18过表达前比较差异无统计学意义(P>0.05),而CYP17A 1 mRNA表达水平高于BAP18过表达前(P<0.05);T和DHT作用后,细胞中CYP17A 1 mRNA表达水平均高于T和DHT作用前(P<0.05)。见表1。
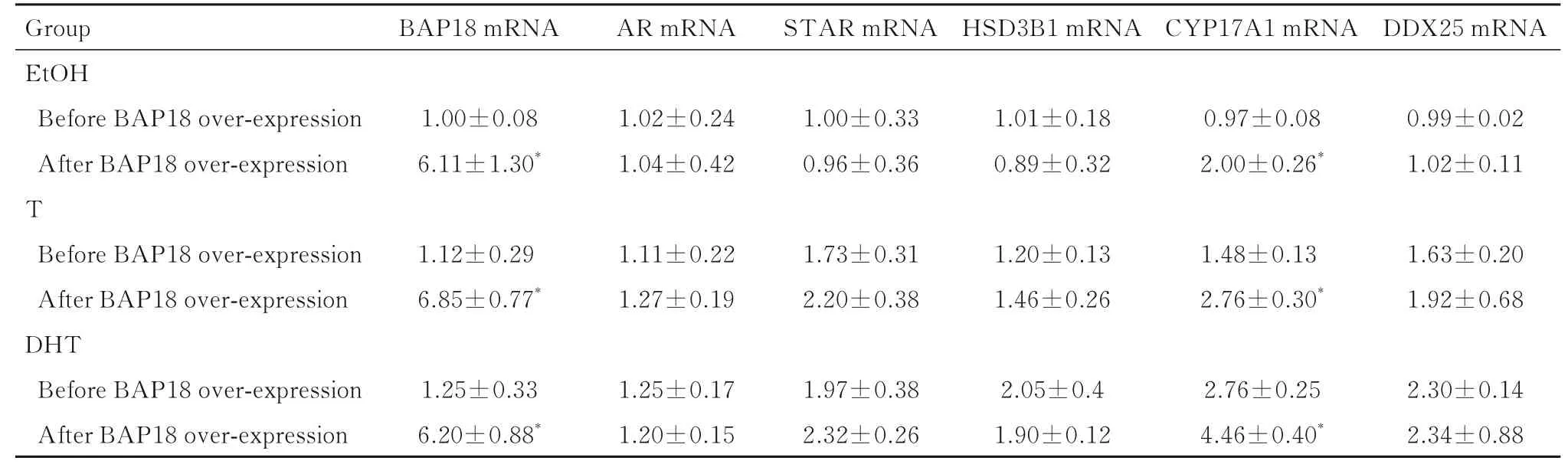
表1 BAP18过表达前后R2C细胞中BAP18、AR、STAR、HSD3B1、CYP17A1和DDX25 mRNA水平Tab.1 Expression levels of BAP18,AR,STAR,HSD3B1,CYP17A1,and DDX25 mRNA in R2C cells before and after over-expression of BAP18 (n=3,x±s)
2.4 BAP18过表达前后细胞中相关蛋白表达水平R2C细胞中过表达BAP18后,T和DHT作用后CYP17A 1蛋白表达水平明显高于T和DHT作用前(P<0.05),但T和DHT作用前后细胞中DDX25蛋白表达水平比较差异无统计学意义(P>0.05)。见图5。
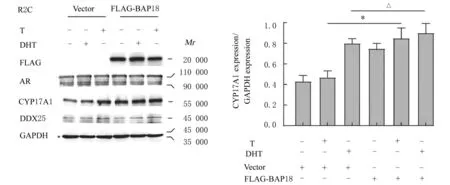
图5 BAP18过表达前后细胞中CYP17A 1蛋白表达电泳图(A)和直条图(B)Fig.5 Electrophoregram(A)and histogram(B)of expression of CYP17A 1 protein in cells before and after BAP18 overexpression
3 讨 论
AR信号通路在精子发生和成熟过程中起重要作用[7-8]。虽然人们对AR辅调节因子在睾丸中的作用已经有了一定的了解,但关于睾丸间质细胞中AR介导的基因转录分子机制尚不清楚,睾丸中通过AR信号通路调节间质细胞生物学功能的确切机制尚不清楚[4,9]。本研究中结果显示:BAP18可以在多种睾丸细胞中表达,其中包括睾丸间质细胞和睾丸支持细胞R2C和TM 3及睾丸间质细胞TM 4和15P-1。BAP18作为在睾丸间质细胞中全新的AR辅调节因子可以与AR相互作用并上调AR介导的基因转录。BAP18可以在睾酮和DHT的作用下特异性调控CYP17A 1的表达,提示BAP18在睾丸细胞生理过程中可能起重要作用。
AR目前是雄激素在睾丸中的唯一受体,且在不同的细胞中发挥时空特异性作用[10-11]。尽管精子的生存和成熟需要雄激素且成熟的精子中并不表达AR,但成熟睾丸中支持细胞、间质细胞、管周肌样细胞、血管内皮细胞和血管平滑肌细胞均表达雄激 素 受 体[12-13]。研 究[14-17]显 示:成 人 的 睾 丸 间 质细胞中有稳定的AR表达,且AR随睾丸发育成熟度和不同细胞功能周期性表达。与AR相关的周期性表达蛋白有潜在的调节睾丸生理功能的作用[7,12]。本研究结果显示:AR主要在大鼠睾丸间质细胞R2C细胞中表达,在其他3种大鼠睾丸细胞中表达量极低,而BAP18在4种大鼠睾丸细胞种均有表达。提示BAP18可能不止在睾丸间质细胞中发挥作用,而在睾丸支持细胞中也有可能发挥独立于AR的其他作用。
在睾丸组织中,T是调控精子发生过程中最主要的雄激素[7,18-19]。研究[20-21]显示:睾丸组织中T是由睾丸间质细胞对促黄体激素(luteinizing hormone,LH)反应而产生,继而由旁分泌通路分散至生精小管中的睾丸支持细胞中,与AR相互作用调控生精生理过程。睾丸间质细胞中雄激素信号通路被广泛认为在精子发生过程包括CYP17A 1、HSD17B3、HSD3B6、STAR、DDX25、RLF、LHR和TSP-2等类固醇酶的表达至关重要[15,22]。本研究结果显示:BAP18可以通过AR介导的基因转录显著影响CYP17A 1 mRNA和蛋白表达水平。过表达BAP18在无T或DHT作用下,CYP17A 1 mRNA和蛋白的表达水平仍可以升高。若BAP18表达水平存在变化,睾丸间质细胞的T合成通路有可能受到严重影响,最终可能会导致精子发生和成熟障碍。BAP18在睾丸精子发生和男性精子成熟障碍症的治疗过程中可能发挥重要作用。

