黄芩素对大鼠神经病理痛的镇痛作用及其机制
刘晓华,房冰莹,韩 曼,乔海法,于远望
(1.陕西中医药大学生理学教研室,陕西 咸阳 712046;2.陕西省针药结合重点实验室,陕西 咸阳 712046)
神经病理痛是外周感觉神经因损伤或疾病引起的疼痛。现有镇痛药对神经病理痛的镇痛效果欠佳,且常伴有严重的不良反应[1]。明确神经病理痛的发病机制,探寻新的分子靶点,进而研发新的镇痛药物是目前急需攻克的临床难题。黄芩素是从中药黄芩中提取的一种黄酮类有效成分。近年来黄岑素的抗炎和抗氧化等功能不断得到证实[2]。黄芩素对炎症痛的镇痛作用明显[3],研究[4]显示:黄芩素还可明显减轻大鼠坐骨神经损伤后的痛行为,但其机制尚不清楚。
近年来胶质细胞源性神经营养因子(glial cellderived neurotropic factor,GDNF)在疼痛研究领域备受关注,GDNF可从不同环节调控痛觉信息的传递[5]。GDNF在不同神经病理痛动物模型中均表现出显著的镇痛作用[6]。研究[7]显示:磷酸化转录因子cAMP反应元件结合蛋白(phosphorylated transcription factor cAMP response element binding protein,p-CREB)可促进多巴胺能神经元中GDNF基因的转录,使GDNF合成增加。有研究[8-9]显示:黄芩素可通过p-CREB通路发挥对多巴胺能神经的保护作用,但黄芩素对神经病理痛的镇痛作用是否与GDNF有关联目前尚不清楚。本研究以大鼠慢性缩窄性神经损伤(chronic constriction injury,CCI)为神经病理痛模型,探讨黄芩素对神经病理痛的镇痛作用及其机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器实验选用健康、雄性SD大鼠48只,平均体质量250 g,购自成都达硕实验动物有限公司,动物生产许可证号:SCXK(川)2018-030。黄芩素购自美国Sigma公司,兔抗鼠c-Fos一抗(B7963)、兔抗鼠GDNF一抗(AB244211)和荧光二抗驴抗兔IgG(Alexa Fluor488)均购自美国Abcam公司。von Frey纤毛机械刺激针购自美国IITC公司,热刺激仪购自美国LifeScience公司,冰冻切片机购自德国Leitz公司,生物显微镜购自日本Olympus公司。
1.2 动物分组和CCI模型建立将48只大鼠随机分为假手术组、模型组和黄芩素组,每组16只。各组大鼠腹腔注射5%水合氯醛(7 mL·kg-1)麻醉后,暴露游离一侧坐骨神经干,采用4-0丝线间隔1 mm结扎4次,逐层缝合组织。假手术组大鼠暴露坐骨神经后不做结扎。手术后1 d,通过痛行为测定确定造模是否成功。造模成功后黄芩素组开始腹腔注射黄芩素20 mg·kg-1,连续注射7 d。
1.3 各组大鼠痛行为测定各组大鼠手术前测定基础痛阈值,术后1 d开始,每隔3 d测量1次,持续28 d。大鼠患侧机械缩足反射阈值(mechenaical withdral threshold,MWT)测定:up-down法推算大鼠的机械缩爪阈值。测定前大鼠置于有机玻璃箱内适应30 min后,采用von Frey纤毛丝刺激大鼠后肢足底中部,持续时间≤4 s,大鼠出现缩足或舔足行为视为阳性反应,否则为阴性反应。测定从2 g纤毛刺激开始,当该力度不能引起阳性反应时,给予相邻大一级力度刺激;如出现阳性反应则给予相邻小一级力度刺激。如此连续进行,直至出现第一次阳性和阴性反应差异,重复测定5次。最大力度为15 g,大于此值时记为15 g,每次刺激间隔30 s。
大鼠患侧足底热缩足反射潜伏期(thermal withdrawal latency,TWL)测定:MWT测定完成后,将大鼠置于有机玻璃盒中适应20 min后开始测定TWL。热刺激仪照射动物患侧足底,记录缩足逃避反应的时间作为热刺激潜伏期。每只大鼠重复测量3次,每次间隔5 min,取3次平均值。如超过20 s大鼠仍无缩足或抬腿反应则停止照射,以免引起实验动物照射部位组织灼伤。
1.4 免疫荧光染色检测各组大鼠脊髓背角组织中c-Fos阳性细胞数和背根神经节(dosal root ganglion,DRG)中GDNF荧光强度实验第11天,分别从各组取6只大鼠,采用免疫荧光染色测定各组大鼠脊髓背角组织中c-Fos阳性细胞数。其余大鼠在第28天行为学检测完毕后,检测DRG中GDNF荧光强度。给予大鼠10%水合氯醛腹腔麻醉,4%多聚甲醛经心脏灌注固定。取患侧L 2和L 3 DRG或相应脊髓节段置于4%多聚甲醛后固定12 h后转移至30%蔗糖中脱水,制备冰冻切片(25μm),每只大鼠取5张切片,一抗(GDNF 1∶200,c-Fos 1∶200)4℃过夜。荧光二抗驴抗兔IgG室温下孵育1 h后,PBST漂洗,裱片。阴性对照除一抗为抗体封闭液外,其余操作均相同。Olympus显微镜下观察结果并拍照。根据文献[10]对c-Fos表达采用Image J图像软件进行计数,对GDNF表达采用Image J图像软件进行荧光强度分析。
1.5 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析。各组大鼠MWT、TWL和脊髓背角组织中c-Fos阳性细胞数及GDNF荧光强度均以±s表示。多组间比较采用单因素方差分析,组间两两比较采用SNKq检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠MWT各组大鼠基础MWT比较差异无统计学意义(P>0.05)。与术前比较,手术后1 d,模型组和黄芩素组大鼠MWT降低(P<0.05);手术前后假手术组大鼠MWT比较差异无统计学意义(P>0.05)。后续不同时间点检测结果显示:与假手术组比较,模型组大鼠MWT均降低(P<0.05),维持在低阈值水平;黄芩素组大鼠MWT在给药第3天开始升高,后续时间点均维持在较高水平,与假手术组比较差异无统计学意义(P>0.05)。见图1。
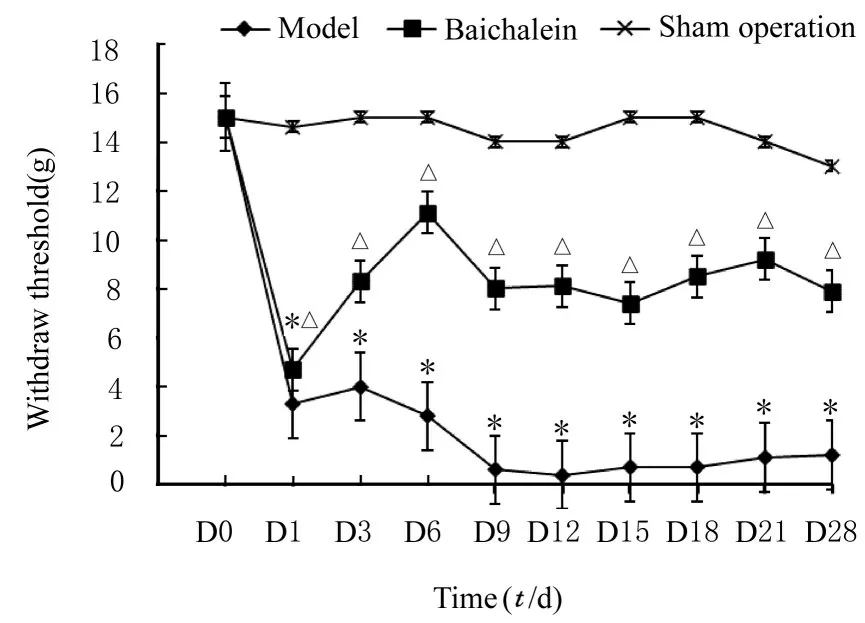
图1 各组大鼠MWTFig.1 MWT of rats in various groups
2.2 各组大鼠TWL各组大鼠基础TWL比较差异无统计学差异(P>0.05)。与手术前比较,手术后1 d,模型组和黄芩素组大鼠TWL明显降低(P<0.05);手术前后假手术组大鼠TWL比较差异无统计学意义(P>0.05)。后续不同时间点检测结果显示:与假手术组比较,模型组大鼠TWT均降低(P<0.05);黄芩素组大鼠TWL在给药第3天开始升高,后续时间点均维持在较高水平;与模型组比较,黄芩素组大鼠术后各时间点TWL均升高(P<0.05)。见图2。

图2 各组大鼠TWLFig.2 TWL of rats in various groups
2.3 各组大鼠脊髓背角组织中c-Fos阳性细胞数C-Fos蛋白为即刻早期表达蛋白,可以反映神经元的激活状态。各组大鼠实验第11天采用免疫荧光法检测脊髓背角组织中c-Fos表达的结果显示:假手术组大鼠脊髓背角组织中c-Fos阳性细胞数为(12±5)个,模型组大鼠脊髓背角组织中c-Fos阳性细胞数为(198±90)个。与假手术组比较,模型组大鼠脊髓背角组织中c-Fos阳性细胞数明显升高(P<0.05)。黄芩素组大鼠c-Fos阳性细胞数为(68±48)个,较模型组明显降低(P<0.05)。见图3。

图3 各组大鼠脊髓背角组织中c-Fos的表达(免疫荧光,Bar=100μm)Fig.3 Expressions of c-Fos in spinal dorsal horn tissue of ratsin variousgroups(Immunofluorescence,Bar=100μm)
2.4 各组大鼠DRG中GDNF荧光强度DRG是传递痛觉的一级神经元所在的部位。假手术组大鼠DRG中GDNF荧光强度为80±69,模型组大鼠DRG中GDNF荧光强度为55±41;与假手术组比较,模型组大鼠DRG中GDNF荧光强度明显降低(P<0.05)。黄芩素组大鼠DRG中GDNF荧光强度为82±71,较模型组明显升高(P<0.05),见图4。

图4 各组大鼠DRG中GDNF荧光强度(免疫荧光,Bar=100μm)Fig.4 Fluorescenceintensitiesof GDNF in DRG of ratsin variousgroups(Immunofluorescence,Bar=100μm)
3 讨 论
本研究采用大鼠CCI神经病理痛模型,利用行为学和免疫荧光化学方法研究黄芩素对神经病理痛的镇痛作用及其机制。本研究结果显示:黄芩素可明显提高CCI模型大鼠机械痛阈值和热痛阈值,抑制CCI模型大鼠脊髓背角组织中c-Fos蛋白的表达,并可翻转CCI大鼠DRG中GDNF的表达。上述结果提示:黄芩素素对神经病理的镇痛作用可能与其促进GDNF的表达有关。
以往有关黄芩素镇痛作用的研究[3-4]主要关注炎症性疼痛和癌症痛等疼痛。有关黄芩素对外周神经压迫引起的神经病理痛的作用目前尚未见相关研究报道。本研究结果显示:黄芩素对大鼠坐骨神经慢性压迫引起的机械痛敏和热痛敏行为有明显的缓解作用。脊髓背角是痛觉信息传递的第2级神经元所在的部位。c-Fos蛋白为即刻早期蛋白,当神经元兴奋时,其表达水平迅速升高,常被当作神经元激活标志物。本研究结果显示:模型组大鼠脊髓背角组织中c-Fos阳性细胞数明显高于假手术组,黄芩素组大鼠脊髓背角组织中c-Fos阳性细胞数明显低于模型组,说明黄芩素对坐骨神经压迫引起的痛觉信息传递具有抑制作用,且其调控作用的部位位于初级感觉神经元。以往研究[11-12]显示:抗炎药物对神经病理痛的镇痛作用并不理想,提示黄芩素是通过其他途径对CCI大鼠模型产生的镇痛作用。
DRG初级伤害性感受神经元兴奋性增加是神经病理痛发生的始发因素。本课题组以往研究[13]显示:DRG初级感觉神经元的兴奋性在外周神经损伤时明显增强。外周神经受损时,DRG初级感觉神经元中伤害性感受相关受体表达增加,炎症因子的作用和神经元中痛觉相关信号分子水平的变化等参与初级感觉神经元兴奋性的增加。DRG中约60%神经元表达GDNF相关受体。GDNF对痛觉分子异常表达有多靶点抑制作用,GDNF还可以从不同环节调控痛觉信息的传递[14],对不同神经病理痛动物模型均表现出明显的镇痛作用[6]。有研究[15]显示:大鼠脊髓损伤后,DRG中GDNF表达水平明显降低。但是外周神经损伤后,DRG中GDNF的表达是否发生改变尚未见报道。本研究结果显示:坐骨神经慢性压迫后,大鼠DRG中GDNF表达水平明显降低;提示外周神经损伤时,初级感觉神经元中GDNF表达的变化参与神经病理痛的发生。
本研究结果显示:腹腔注射黄芩素可明显调节CCI大鼠DRG中GDNF的表达,说明黄芩素对神经病理痛的镇痛作用与其调节GDNF的表达有关。黄芩素可促进蛋白分子合成和分泌[16-17],增加施万(Schwann)细胞对神经损伤的修复功能[18]。黄芩素对GDNF表达的影响作用已被最近的一项研究[19]证实。但黄芩素对GDNF表达的调节机制尚需进一步研究。以往研究[7]显示:黄芩素可通过转录因子p-CREB发挥对多巴胺能神经元的保护作用;p-CREB是调节GDNF的关键转录因子。因此,黄芩素对DRG内GDNF表达的调节可能通过p-CREB发挥作用。

