木犀草素抑制ROS/TXNIP/NLRP3信号通路激活对小鼠急性呼吸窘迫综合征的改善作用
曲海新,袁二伟,郭卫平,张雅静,马文霞,吴 丹
(1.河北北方学院附属第一医院新生儿科,河北 张家口 075000;2.河北北方学院附属第一医院儿科,河北 张家口 075000)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是常见的肺部炎性疾病,肺部感染、创伤和脓毒症等是ARDS的主要致病因素,其临床特征为低氧血症、肺水肿及进行性呼吸衰竭等,是造成重症监护室患者死亡的重要原因[1-2]。肺实质弥漫性炎症和强烈的氧化应激是ARDS的主要发病机制,减轻炎症并降低氧化应激水平是其有效的治疗策略[3-4]。木犀草素是一种具有较强抗菌、抗氧化和抗炎等药理活性的天然黄酮类化合物,广泛存在于木犀草、黄芩、紫苏和金银花等药材中,可上调抗氧化基因的表达,通过抗炎及抗氧化作用减轻脓毒症诱导的急性肺损伤[5],木犀草素还是治疗ARDS的中药方剂清肺承气汤的重要起效成分[6],因而推测木犀草素对ARDS可能有很好的防治作用。NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体作为引发炎症的重要信号分子,在各种肺部疾病的发生发展中起着重要调控作用,活性氧(reactive oxygen species,ROS)和硫氧还蛋白结合蛋白(thioredoxin binding protein,TXNIP)是NLRP3上游调节分子,降低其表达水平,可抑制NLRP3信号激活,减轻炎症,改善肺组织损伤,因而ROS/TXNIP/NLRP3信号能作为ARDS的重要治疗靶点[7-9]。本研究构建ARDS小鼠模型,探讨木犀草素调控ROS/TXNIP/NLRP3信号通路对ARDS小鼠的保护作用,为ARDS的治疗提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器BALB/c雄性小鼠购自河南斯克贝斯生物科技股份有限公司,动物生产许可证号:SCXK(豫)2020-0005,SPF级,体质量为20~22 g。分笼饲养于本院动物中心,动物房温度为21℃~25℃,相对湿度为50%~55%,照明12 h/12 h明暗交替循环,动物实验符合3R原则。木犀草素(批号724C021)、脂多糖(lipopolysaccharide,LPS)(批号320V 0319)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性检测试剂盒、过氧化氢酶(catalase,CAT)活性检测试剂盒、HE染色试剂盒、BCA蛋白浓度测定试剂盒(PC0020)、小鼠白细胞介素1β(interleukin-1β,IL-1β)ELISA试剂盒、高效RIPA裂解液(R0010)、小鼠白细胞介素18(interleukin-18,IL-18)ELISA试剂盒和小鼠肿瘤坏 死 因 子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(SEKM-0034)购自北京索莱宝科技有限公司,组织ROS检测试剂盒购自南京建成生物工程研究所,邻苯三酚(pyrogallol,PG)购自美国Selleck公司,兔源GAPDH一抗、兔源NLRP3一抗、兔源caspase-1一抗、兔源caspase-4一抗、兔源TXNIP一抗和羊抗兔二抗购自美国Abcam公司。动物血气分析仪(型号GEM 3500)购自上海玉研科学仪器有限公司,肺功能检测仪(型号S-980A I)购自四川思科达科技有限公司,电子天平(型号BSA 224S-CW)购自德国Sartorius公司,酶标仪(型号Spectra Max M 2/M 2e)购自美国Molecular device公司,倒置荧光显微镜(型号DMI3000B)和冰冻切片机(型号CM 3050S)购自德国Leica公司,多样品组织匀浆机(型号Tissuelyser-192)购自上海净信公司,垂直电泳槽(型号VE180)、转移电泳槽(型号VE 186)和电泳仪(型号EPS300)购自上海天能科技有限公司,凝胶成像仪(型号ChemiDoc XRS+)购自美国Bio-Rad公司。
1.2 ARDS小鼠模型制备和动物分组ARDS模型制备方法参考文献[10]:将LPS加入0.9%氯化钠溶液中溶解混匀配置为4.3 mg·kg-1,向小鼠气管中滴注LPS溶液,翻转小鼠并抬起其头颅,使药液均匀进入其两肺中,约6 h后观察小鼠行为,若其出现精神萎靡不振,食欲减退,少动,呼吸急促等症状,提示ARDS模型构建成功。将模型小鼠随机分为模型组、木犀草素组、PG组和木犀草素+PG组,每组12只;另选出12只小鼠作为对照组,给予气管滴注等量生理盐水。将木犀草素和PG加入生理盐水中溶解混匀,分别制成2 g·L-1木犀草素[11]药液、7.5 g·L-1PG[12]溶液、木犀草素(2 g·L-1)及PG(7.5 g·L-1)的混合药液,药物干预组小鼠以10 mL·kg-1木犀草素药液、PG溶液、木犀草素及PG的混合药液分组腹腔注射,使木犀草素的剂量达到20 mg·kg-1,PG的剂量达到75 mg·kg-1,模型组和对照组小鼠均腹腔注射10 mL·kg-1生理盐水,每天注射1次,共进行5 d。
1.3 各组小鼠肺功能检测和标本收集各组小鼠于药物处理结束后24 h,以小动物肺功能检测仪测定呼气峰流速(peak expiratory flow,PEF)、吸气阻力(resistance inspiratory,Ri)和每分钟通气量(minute ventilation,MV)值,作为评判小鼠肺功能的指标。然后颈椎脱臼处死小鼠,自颈动脉取血1.3 mL,取0.6 mL血进行动脉血氧分压(arterial partial pressure of oxygen,PaO2)检测,剩余血液经离心后,吸出上清保存于-80℃环境中;小鼠开胸取出双肺,右肺组织行湿质量/干质量(wet weight/dry weight,W/D)比值测定,左肺组织中剪下约0.9 g组织保存于液氮中,再剪下0.3 g组织采用单细胞悬液制备仪制备单细胞悬液,剩余肺组织漂洗后,浸没在包埋剂中,以液氮快速冰冻成块后,采用冰冻切片机做常规病理切片备用。
1.4 各组小鼠PaO 2和肺W/D比值的检测将“1.3”步骤中的小鼠动脉血置于小动物血气分析仪中,测定其PaO2值。称量“1.3”步骤中的小鼠右肺湿质量,然后置入烘烤箱中脱水,称量其干质量,计算W/D比值。
1.5 各组小鼠肺组织病理形态表现观察取出“1.3”步骤中的肺组织冰冻切片,复温后,浸入冰丙酮中固定,采用试剂盒参照其说明书行HE染色,蒸馏水漂洗后切片,采用显微镜观察各组小鼠肺组织病理形态表现并拍照,每张切片任意采集5个视野。
1.6 各组小鼠肺组织中ROS、GSH-Px、CAT水平及血清IL-18、IL-1β、TNF-α水平检测取“1.3”步骤中制备的各组小鼠肺组织单细胞悬液,根据ROS测定试剂盒说明书步骤检测肺组织中ROS水平。取出“1.3”步骤中保存在液氮中的肺组织,置于高效RIPA裂解液中,通过组织匀浆机制备成匀浆液,4℃离心后采用BCA法检测其蛋白总浓度,取出0.1 mL,采用试剂盒参照其说明书步骤检测肺组织中GSH-Px及CAT水平。取出“1.3”步骤中保存在-80℃中的血清,以冰水浴提取解冻后,采用试剂盒参照其说明书步骤检测血清IL-18、IL-1β和TNF-α水平。
1.7 各组小鼠肺组织中TXNIP/NLRP3通路相关蛋白TXNIP、caspase-1、caspase-4和NLRP3表达水平检测取肺组织蛋白样品液,100℃煮沸5 min,蛋白变性后,各组取20μg总蛋白,于120 V恒压下电泳1 h,使蛋白分离后,通过湿转(40 mA、75 min)将其转移至PVDF膜,以5%脱脂奶粉溶液室温孵育1.5 h,以薄刀片将目的蛋白TXNIP、caspase-1、caspase-4和NLRP3自膜上裁下,以相对应的兔源一抗孵育(4℃、10 h),TBST洗膜(3次、每次5 min),以羊抗兔二抗孵育(室温、1.5 h),洗膜(3次、每次5 min,TBST),ECL显色,拍照后采用Image J软件分析蛋白条带的灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.8 统计学分析采用SPSS 24.0统计软件进行统计学分析。各组小鼠MV、PEF、Ri、W/D比值和PaO2,血清IL-18、IL-1β和TNF-α水平,肺组织中GSH-Px、CAT和ROS水平及TXNIP、caspase-1、caspase-4和NLRP3蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSDt检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠MV、PEF和Ri与对照组比较,模型组小鼠MV和PEF均降低(P<0.05),Ri升高(P<0.05)。与模型组比较,木犀草素组小鼠MV及PEF升高(P<0.05),Ri降低(P<0.05);与模型组比较,PG组小鼠MV和PEF降低(P<0.05),Ri升高(P<0.05);与PG组比较,木犀草素+PG组小鼠MV和PEF升高(P<0.05),Ri降低(P<0.05);与木犀草素组比较,木犀草素组小鼠MV和PEF降低(P<0.05),Ri升高(P<0.05)。见表1。
表1 各组小鼠MV、PEF和RiTab.1 MV,PEF,and Riof mice in various groups(n=12,±s)

表1 各组小鼠MV、PEF和RiTab.1 MV,PEF,and Riof mice in various groups(n=12,±s)
*P<0.05 vs control group;△P<0.05 vs model group;#P<0.05 vs PG group;○P<0.05 vs luteolin group.
Ri(kPa.s·L-1)25.05±2.52 60.13±6.68*79.85±7.18△25.21±2.63△59.98±7.04#○Group Control Model PG Luteolin Luteolin+PG MV(V/mL)7.71±0.68 2.82±0.35*1.15±0.13△7.66±0.74△2.85±0.42#○PEF(mL·s-1)62.45±6.56 39.38±3.43*20.84±2.12△62.17±6.26△39.42±3.78#○
2.2 各组小鼠W/D比值和PaO 2与对照组比较,模型组小鼠W/D比值升高(P<0.05),PaO2降低(P<0.05)。与模型组比较,木犀草素组小鼠W/D比值降低(P<0.05),PaO2升高(P<0.05);PG组小鼠W/D比值升高(P<0.05),PaO2降低(P<0.05)。见表2。
表2 各组小鼠W/D比值和PaO 2Tab.2 W/D ratios and PaO 2 of mice in various groups(n=12,±s)

表2 各组小鼠W/D比值和PaO 2Tab.2 W/D ratios and PaO 2 of mice in various groups(n=12,±s)
*P<0.05 vs control group;△P<0.05 vs model group;#P<0.05 vs PG group;○P<0.05 vs luteolin group.
PaO2(P/mmHg)98.79±9.67 55.86±4.18*37.08±3.27△98.57±10.23△56.01±6.24#○Group Control Model PG Luteolin Luteolin+PG W/D 4.42±0.39 6.78±0.56*8.65±0.61△4.55±0.33△6.74±0.70#○
2.3 各组小鼠肺组织病理形态学表现对照组小鼠肺泡结构清晰完好,肺间质无水肿和炎性细胞浸润,肺组织无损伤;模型组小鼠肺泡壁变厚,肺泡塌陷变形,肺间质水肿伴有大量炎性细胞浸润,肺组织有严重病理损伤;与模型组和木犀草素+PG组比较,木犀草素组小鼠上述肺组织损伤均明显改善;PG组小鼠上述肺组织损伤均明显加重。见图1。

图1 各组小鼠肺组织病理形态表现(HE,×400)Fig.1 Pathomorphology of lung tissue of mice in various groups(HE,×400)
2.4 各组小鼠肺组织中GSH-Px和CAT水平与对照组比较,模型组小鼠肺组织中GSH-Px和CAT水平降低(P<0.05)。与模型组比较,木犀草素组小鼠肺组织中GSH-Px和CAT水平均升高(P<0.05),PG组小鼠肺组织中GSH-Px和CAT水平均降低(P<0.05)。见表3。

表3 各组小鼠肺组织中GSH-Px和CAT水平Tab.3 Levels of GSH-Px and CAT in lung tissue of mice in various groups [n=12,x±s,λB/(U·mg-1)]
2.5 各组小鼠血清IL-18、IL-1β和TNF-α水平与对照组比较,模型组小鼠血清IL-18、IL-1β和TNF-α水平均升高(P<0.05)。与模型组比较,木犀草素组小鼠血清IL-18、IL-1β和TNF-α水平均降低(P<0.05),PG组小鼠血清IL-18、IL-1β和TNF-α水平均升高(P<0.05)。见表4。
表4 各组小鼠血清IL-18、IL-1β和TNF-α水平Tab.4 Levels of serum IL-18,IL-1β,and TNF-αof mice in various groups (n=12,±s)
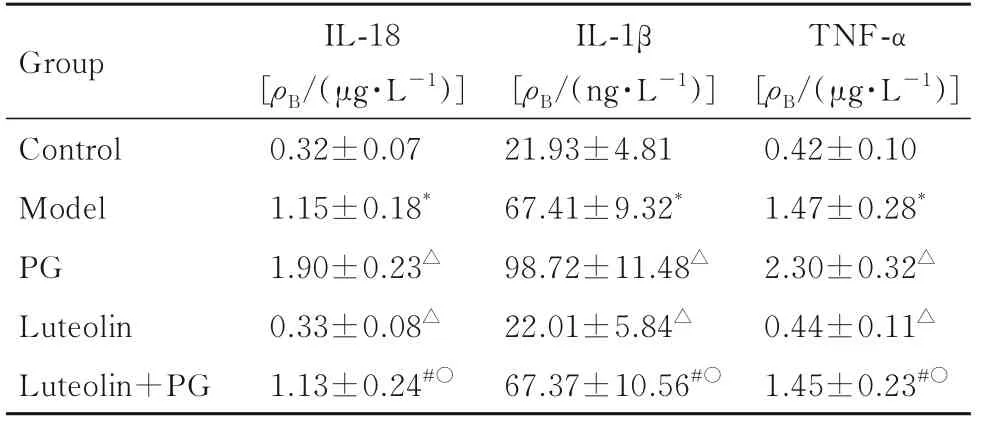
表4 各组小鼠血清IL-18、IL-1β和TNF-α水平Tab.4 Levels of serum IL-18,IL-1β,and TNF-αof mice in various groups (n=12,±s)
*P<0.05 vs control group;△P<0.05 vs model group;#P<0.05 vs luteolin+PG group;○P<0.05 vs luteolin group.
TNF-α[ρB/(μg·L-1)]0.42±0.10 1.47±0.28*2.30±0.32△0.44±0.11△1.45±0.23#○Group Control Model PG Luteolin Luteolin+PG IL-18[ρB/(μg·L-1)]0.32±0.07 1.15±0.18*1.90±0.23△0.33±0.08△1.13±0.24#○IL-1β[ρB/(ng·L-1)]21.93±4.81 67.41±9.32*98.72±11.48△22.01±5.84△67.37±10.56#○
2.6 各组小鼠肺组织中ROS水平和TXNIP、caspase-1、caspase-4及NLRP3蛋白表达水平与对照组比较,模型组小鼠肺组织中ROS水平和TXNIP、caspase-1、caspase-4及NLRP3蛋白表达水平均升高(P<0.05)。与模型组比较,木犀草素组小鼠肺组织中ROS水平和TXNIP、caspase-1、caspase-4及NLRP3蛋白表达水平均降低(P<0.05),PG组小鼠肺组织中ROS水平和TXNIP、caspase-1、caspase-4及NLRP3蛋白表达水平均升高(P<0.05)。见图2和表5。
表5 各组小鼠肺组织中ROS水平和TXNIP、caspase-1、caspase-4及NLRP3蛋白表达水平Tab.5 Levels of ROS and expression levels of TXNIP,caspase-1,caspase-4,and NLRP3 proteins in lung tissue of mice in various groups (n=12,±s)
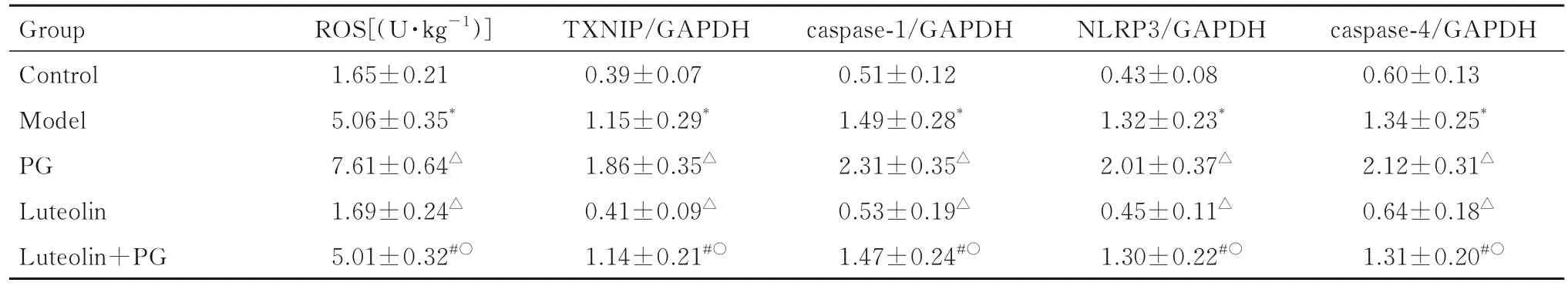
表5 各组小鼠肺组织中ROS水平和TXNIP、caspase-1、caspase-4及NLRP3蛋白表达水平Tab.5 Levels of ROS and expression levels of TXNIP,caspase-1,caspase-4,and NLRP3 proteins in lung tissue of mice in various groups (n=12,±s)
*P<0.05 vs control group;△P<0.05 vs model group;#P<0.05 vs PG group;○P<0.05 vs luteolin group.
Group Control Model PG Luteolin Luteolin+PG ROS[(U·kg-1)]1.65±0.21 5.06±0.35*7.61±0.64△1.69±0.24△5.01±0.32#○caspase-4/GAPDH 0.60±0.13 1.34±0.25*2.12±0.31△0.64±0.18△1.31±0.20#○TXNIP/GAPDH 0.39±0.07 1.15±0.29*1.86±0.35△0.41±0.09△1.14±0.21#○caspase-1/GAPDH 0.51±0.12 1.49±0.28*2.31±0.35△0.53±0.19△1.47±0.24#○NLRP3/GAPDH 0.43±0.08 1.32±0.23*2.01±0.37△0.45±0.11△1.30±0.22#○
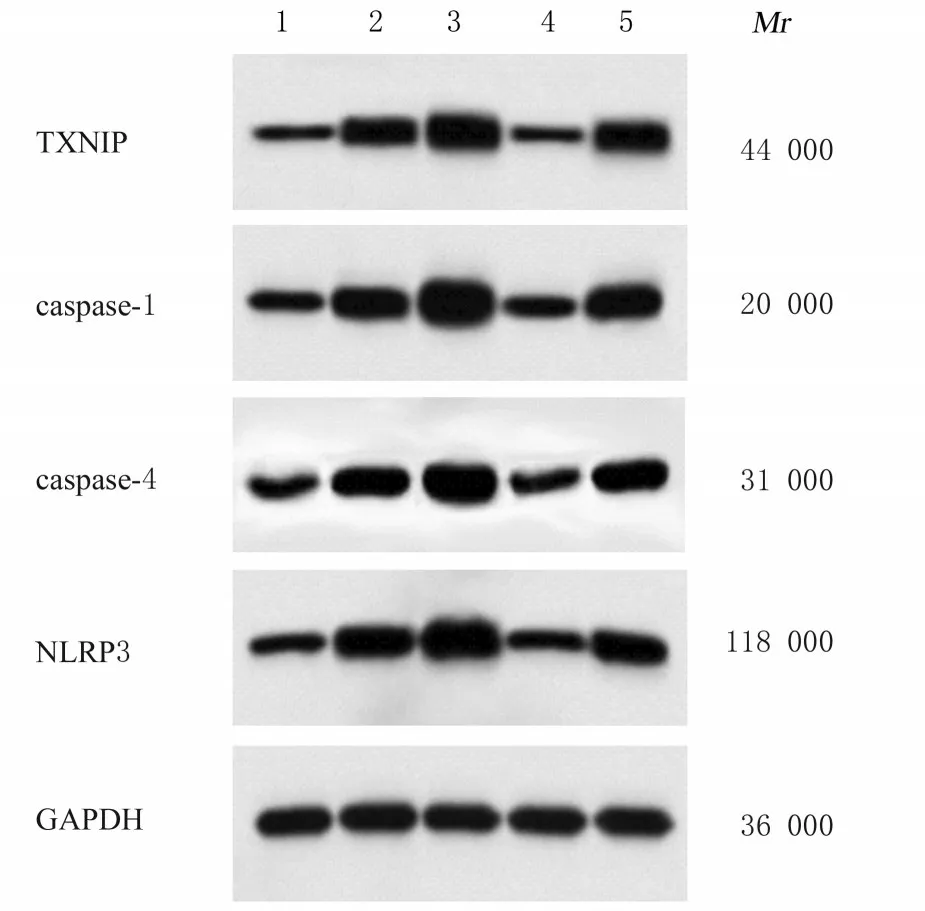
图2 各组小鼠肺组织中TXNIP、caspase-1、caspase-4及NLRP3蛋白表达电泳图Fig. 2 Electrophoregram of expressions of TXNIP,caspase-1,caspase-4,and NLRP3 proteins in lung tissue of mice in various groups
3 讨 论
ARDS作为一种炎性细胞活化失控导致的严重肺部炎性疾病,临床治疗以机械通气、控制原发病和液体管理等手段为主,但疗效并不理想,病死率仍高达40%左右,极大威胁人类生命安全,探寻更为有效的治疗方法具有重大临床意义[13-14]。本研究采用气管滴注LPS溶液的方法建立ARDS小鼠模型的结果显示:LPS可诱导炎性介质ROS、IL-18、IL-1β和TNF-α大量产生,降低抗氧化因子GSH-Px和CAT的水平,引起剧烈的肺内炎症及氧化应激,造成肺泡壁变厚,肺泡塌陷变形,大量炎性细胞浸润肺间质,导致小鼠发生严重肺水肿,肺功能指标Ri明显升高,MV、PEF和PaO2明显降低,表明LPS造成了严重的肺功能损伤,表示ARDS模型建立成功。
ARDS患者在各种内外因素刺激下,体内抗炎因子与促炎因子表达失衡,引发强烈的炎性细胞因子风暴,造成肺部严重的炎症和过氧化损伤,是其主要致病基础,减轻炎症和过氧化反应可抑制肺上皮细胞凋亡,是改善ARDS患者肺泡毛细血管通透性 及 肺 损 伤 的 有 效 策 略[15-16]。研 究[17-19]显 示:木犀草素作为一种天然抗炎和抗氧化化合物,可抑制NLRP3炎性小体表达,减轻关节炎症,还可降低哮喘幼鼠气道炎症因子水平,阻碍炎症发生发展,改善其肺组织损伤,因而可推测木犀草素可能通过抑制炎症而治疗ARDS。本研究采用木犀草素处理ARDS小鼠发现:木犀草素可清除ROS,降低血清炎性因子IL-18、IL-1β和TNF-α水平,抑制肺组织炎症及氧化应激反应,缓解肺水肿,提高肺组织中抗氧化酶GSH-Px及CAT水平,降低肺功能指标Ri,升高MV、PEF和PaO2,减轻肺损伤,修复肺功能,改善ARDS症状,提示木犀草素可阻碍肺内过氧化和炎症反应,改善肺功能损伤,本研究结果证实了木犀草素对ARDS具有很好的治疗作用。
ROS是引发机体强烈炎症及过氧化反应的重要信号分子,可促进TXNIP和NLRP3表达,激活炎性细胞,促使致炎因子分泌,参与介导各种因素所致的急性肺损伤的发病及进展过程,减少ROS释放,下调TXNIP及NLRP3蛋白表达,可减弱LPS诱导的氧化应激和炎性细胞风暴,缓解肺组织炎症及过氧化损伤,最终减轻急性肺损伤症状,由此可知,ROS/TXNIP/NLRP3信号是很有前景的ARDS治疗靶点[20-22]。本研究采用ROS诱导剂PG处理ARDS小鼠,发现其可上调TXNIP和NLRP3表达,促进炎症及氧化应激进展,加重肺组织及肺功能损伤,表明ROS/TXNIP/NLRP3信号参与介导ARDS的致病过程,以木犀草素治疗ARDS小鼠,可降低ARDS小鼠ROS水平及TXNIP、caspase-1和NLRP3蛋白表达水平,表明木犀草素可抑制ROS/TXNIP/NLRP3信号激活,而以ROS诱导剂PG和木犀草素联合处理ARDS小鼠时,PG可减弱木犀草素对小鼠肺部炎症及氧化应激的抑制作用,并降低木犀草素对小鼠肺组织及肺功能的保护作用,表明木犀草素是通过下调ROS/TXNIP/NLRP3表达从而减轻肺部炎症与氧化应激和缓解小鼠肺损伤并改善其肺功能的。
综上所述,木犀草素可明显减少各种致病因素引发的ROS及炎性细胞因子过度释放,明显减弱炎性细胞因子风暴,阻碍炎症发生发展,降低氧化应激水平,缓解ARDS小鼠双肺病理损伤,修复其肺功能,阻滞ROS/TXNIP/NLRP3信号传导是木犀草素治疗ARDS的作用机制之一。

