沉默解旋酶BLM基因对结直肠癌细胞伊立替康化疗敏感性的影响及其机制
曹秋婷,韩竞春,张晓飞
(大连大学附属新华医院肿瘤一科,辽宁 大连 116021)
伊立替康(irinotecan)又称CPT-11,是临床治疗转移性结直肠癌(colorectal cancer,CRC)的一、二线化疗药物,但其耐药性的产生导致部分患者治疗失败,而这一现象严重限制了CPT-11的临床应用,并给CRC患者带了巨大的健康和经济负担[1-2]。研究[3-4]显示:耐药性的产生可能与肿瘤相关基因的异常表达相关。近期研究[5-7]证实:布卢姆综合征解旋酶(Bloom’s syndrome helicase,BLM)高表达于包括CRC在内的多种肿瘤组织中,且与肿瘤的发生进展密切相关。针对膀胱癌耐药性的研究[8-9]显示:沉默或下调BLM能明显改善肿瘤细胞的化疗敏感性。而这可能与BLM在细胞中的功能相关,如基因分子功能研究[10]显示:BLM主要参与DNA损伤反应中的缺陷、断裂和重组等过程,并能维持基因组与染色体的稳定。但在CRC患者中,尚不明确CPT-11耐药性产生的相关机制是否与BLM异常表达有关。本研究筛选高表达BLM的CRC RKO和DLD1细胞,探讨改善CRC患者临床预后的新思路。
1 材料与方法
1.1 细胞、实验动物、主要试剂和仪器人CRC细胞系HT-29、Lovo、HCT-116、RKO和DLD1购自美国模式培养物研究所(American Type Culture Collection,ATCC)。6周龄雄性BALB/c裸鼠购自大连医科大学实验动物中心,动物生产许可证号:SCXK(辽)2018-0003。RPMI-1640培养基、胎牛血清(fetal bovine serum,FBS)和1%青-链霉素混合液(美国Hyclone公司),TUNEL试剂盒(瑞士Roche公司),SYBR Green PCR master mix试剂盒和PrimeScript RT反转录试剂盒(日本TaKaRa公司),CCK-8试剂和CPT-11(美国Sigma公司),DAB显色试剂盒(南京建成生物科技有限公司),Ki-67细胞增殖检测试剂盒(美国Thermo公司),BCA蛋白测定试剂盒和RIPA试剂(美国Pierce公司),兔抗BLM和细胞周期素D1(Cyclin D1)、B细胞淋巴瘤2(B cell lymphoma 2,Bcl-2)和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(美国Cell Signaling Technology公司),AnnevinⅤ-FITC/PI试剂盒(美国BD公司),PI细胞周期检测试剂盒和HRP标记的山羊抗兔二抗(上海碧云天生物技术有限公司),兔抗Bcl-2关联死亡启动子(Bcl-2 associated death promoter,Bad)、裂解的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate specific proteinase 3,cleaved caspase-3)、周期蛋白依赖性激酶4(cyclin-dependent protein kinase 4,CDK4)、周期蛋白依赖性激酶6(cyclin-dependent protein kinase 6,CDK 6)、细胞周期依赖性蛋白激酶抑制因子1A (cyclin-dependent kinase inhibitor 1A,p21)和β-actin(美国Abcam公司),携带沉默BLM 的 shRNA (5′-GAAACTAGTCTCGGCACTTCT-3′)及 阴 性 对 照 序 列shRNA(5′-CAACAAGATGAAGAGCACCAA-3′)的 重 组 慢病毒颗粒载体(LV-shBLM与LV-shNC)由上海汉恒生物科技有限公司设计和包装(慢病毒滴度为5×107TU·μL-1),实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)引物由上海生工合成。FACSCalibur™流式细胞仪(美国BD Biosciences),超净工作台(美国Thermo公司),RT-PCR仪和凝胶成像系统(美国Bio-Rad公司)。
1.2 细胞培养和慢病毒感染采用含10%FBS、1%青-链霉素和2 mmol·L-1谷氨酰胺的RPMI-1640培养CRC HT-29、Lovo、HCT-116、RKO及DLD1细胞。所有细胞均置于含5%CO2、37℃恒温培养箱中培养。取生长状态良好的RKO和DLD1细胞,按每孔2×105个细胞接种至24孔板中,培养过夜后,按感染复数(multiplicity of infection,MOI)=20进行感染细胞,同时加入5 mg·L-1聚凝胺以提高感染效率,在含5%CO2、37℃恒温培养箱中培养8 h后,弃去含病毒的培养液,更换为含10%FBS和2 mmol·L-1L-谷氨酰胺的RPMI-1640培养液,继续培养48 h后,采用荧光显微镜观察慢病毒感染细胞中绿色荧光表达。最后加入2 mg·L-1嘌呤霉素筛选7 d,以获得稳定感染的RKO和DLD1细胞。
1.3 CCK-8法检测各组细胞存活率取感染LVshBLM(LV-shBLM组)与LV-shNC(LV-shNC组)的RKO和DLD1细胞,调整密度后,按每孔2×104个细胞的密度接种至96孔板中,并采用200μL含不同浓度(0、0.1、1.0、10.0、100.0、200.0和400.0μmol·L-1)CPT-11的RPMI-1640培养液培养。培养48 h后,每孔加入10μL CCK-8试剂,继续置于含5%CO2、37℃恒温培养箱中培养2 h,采用酶标仪于450 nm波长处测定每孔吸光度(A)值。将0μmol·L-1CPT-11设为对照组,计算各组细胞存活率,并绘制曲线,分析CPT-11对各组RKO和DLD1细胞的半数抑制浓度(half inhibitory concentration,IC50)值。细胞存活率=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。每组每个浓度设置6个复孔,实验单独重复3次。
1.4 细胞处理和分组根据CCK-8法检测的CPT-11对RKO和DLD1细胞的IC50值,分别将RKO和DLD1细胞分为LV-shNC组、CPT-11+LV-shNC组和CPT-11+LV-shBLM组。将各组细胞置于含5%CO2、37℃恒温培养箱中培养24 h,用于后续实验检测。
1.5 RT-qPCR法检测各组CRC细胞中BLM mRNA表达水平TRIzol法提取HT-29、Lovo、HCT-116、RKO和DLD1细胞及慢病毒感染后的RKO和DLD1细胞中总RNA,按照逆转录试剂盒说明书方法将其逆转录为cDNA,取适量cDNA根据SYBR green RT-PCR试剂盒建议的反应体系和条件进行RT-PCR,反应条件:95℃预变性30 s,95℃变性5 s,55℃退火20 s,72℃延伸20 s,共40个循环。RT-PCR引物序列:BLM-F 5′-ACAGTAAATGCCTGATGGACCT-3′,BLM-R 5′-ATTGGGTATGTGAATGCTGGT-3′; β-actin-F 5′-TGACGTGGACATCCGCAAAG-3′,β-actin-R 5′-CTGGAAGGTGGACAGCGAGG-3′。以β-actin作为内参,采用2-ΔΔCt法计算BLM mRNA表达水平。实验单独重复3次。
1.6 流式细胞术检测不同细胞周期各组细胞百分率取各组RKO和DLD1细胞,常规消化后,取约2×105个细胞,预冷PBS洗涤后,1 500 r·min-1离心5 min,取底层细胞沉淀,加入3.5 mL预冷的70%乙醇溶液,充分混匀并置于4℃固定过夜,再次离心后,加入20μL(50 mg·L-1)RNase重悬细胞,37℃水浴消化30 min,随后再加入20μL(50 mg·L-1)PI染色液,避光孵育30 min,200目滤膜过滤细胞团块,最后上机分析不同细胞周期各组细胞百分率。实验单独重复3次。
1.7 Western blotting法检测各组CRC细胞中BLM、Cyclin D1、CDK4、CDK6、p21、Bcl-2、Bax、Bad和cleaved caspase-3蛋白表达水平预冷PBS洗涤待测的HT-29、Lovo、HCT-116、RKO和DLD1细胞和经慢病毒感染的RKO和DLD1细胞,总蛋白采用RIPA裂解液提取,采用BCA蛋白测定试剂盒检测蛋白浓度,加热变性后,取约30μg蛋白样品经10%SDS-PAGE凝胶电泳分离,转移至PVDF膜上后,采用5%脱脂奶粉进行抗体封闭,TBST缓冲液充分洗膜后,依次加稀释后的一抗:BLM(1∶500)、Bcl-2(1∶800)、Bax(1∶800)、Bad(1∶800)、cleaved caspase-3(1∶1 000)、Cyclin D1(1∶800)、CDK 4(1∶800)、CDK 6(1∶800)、p21(1∶800)、β-actin(1∶2 000),置于4℃条件下摇床孵育过夜,次日TBST缓冲液再次洗涤,再加入辣根过氧化物酶标记的山羊抗兔二抗(1∶5 000)于室温下孵育1 h后,采用ECL试剂于凝胶成像系统中检测蛋白条带信号强度,采用Image J软件分析条带灰度值,以β-actin作为内参对照,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。实验单独重复3次。
1.8 AnnexinⅤ-FITC/PI染色结合流式细胞术检测各组细胞凋亡率收集各组RKO和DLD1细胞,按照AnnexinⅤ-FITC/PI试剂盒说明书进行染色。细胞收集后采用细胞凋亡试剂Buffer调整细胞密度,取约1×106个细胞置于流式管中,依次加入5μL AnnexinⅤ-FITC和5μL PI室温下避光孵育15 min,随后采用流式细胞术分析各组细胞凋亡率。细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/细胞总数×100%。实验单独重复3次。
1.9 裸鼠皮下移植瘤模型制备15只裸鼠饲养于SPF级动物房中,适应性饲养1周后,随机分为LV-shNC组、CPT-11+LV-shNC组和CPT-11+LV-shBLM组,每组5只。于各组小鼠左侧腋窝皮下注射约含5×106mL-1感染LV-shNC或LVshBLM的DLD1细胞悬液200μL,其中按参考文献[11]的方法对CPT-11+LV-shNC组和CPT-11+LV-shBLM组小鼠隔天经腹腔注射溶于生理盐水的CPT-11(4 mg·kg-1),LV-shNC组小鼠同频次注射等体积的生理盐水。每3 d测量肿瘤的长度和宽度,肿瘤体积=(长度×宽度2)/2,监测接种42 d内的肿瘤体积变化。42 d后处死各组小鼠,取肿瘤组织进行免疫组织化学染色,观察肿瘤组织中BLM和Ki-67阳性表达率,TUNEL染色检测细胞凋亡率。本研究的动物实验经过本院伦理委员会批准,相关实验操作符合国际动物研究指导原则。
1.10 移植瘤组织的免疫组织化学染色和TUNEL染色免疫组织化学染色:取各组裸鼠的移植瘤组织,于4%甲醛溶液中固定24 h,石蜡包埋并切片至厚度约为4μm,二甲苯脱蜡,梯度酒精水化,切片经微波加热进行抗原修复,以3%过氧化氢溶液阻断内源性过氧化物酶,PBS洗涤后,山羊血清进行抗体封闭,随后加入兔抗小鼠BLM(1∶300)与Ki-67(1∶500)一抗,4℃条件下孵育过夜,次日充分洗涤后,加入辣根过氧化物酶标记的山羊抗兔二抗(1∶1 000),再加入DAB试剂显色5 min,自来水冲洗后,苏木精复染,再次脱水透化,封片进行显微镜观察。其中细胞核为蓝色,BLM和Ki-67阳性表达为棕黄色或黄褐色,BLM或Ki-67阳性表达率=BLM或Ki-67阳性细胞数/总细胞数×100%。TUNEL染色:按前述方法进行固定,石蜡包埋,切片,脱蜡水化等步骤后按照TUNEL试剂盒说明书进行染色,37℃下避光孵育1 h,DAB显影与苏木精复染后,显微镜下观察拍照。每个切片随机选择10个视野进行分析,计算TUNEL阳性表达率。其中TUNEL阳性染色的细胞核为棕黄色,TUNEL阳性表达率=TUNEL阳性细胞数/总细胞数×100%。
1.11 统计学分析采用SPSS 21.0统计软件进行统计学分析。CRC细胞中BLM mRNA和蛋白表达水平,各组CRC细胞存活率,不同细胞周期细胞百分率,细胞凋亡率和细胞中Cyclin D1、CDK4、CDK6、p21、Bcl-2、Bax、Bad和cleaved caspase-3表达水平及各组裸鼠皮下移植瘤体积均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSDt检验。各组裸鼠肿瘤组织中BLM、Ki-67和TUNEL阳性表达率以百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 BLM在CRC细胞中的表达RT-PCR和Western blotting检测结果显示:BLM mRNA和蛋白在HT-29、Lovo、HCT-116、RKO和DLD1细胞中均有表达,与HT-29、Lovo和HCT-116细胞比较,RKO和DLD1细胞中BLM mRNA和蛋白表达水平升高(P<0.05)。因此,选择RKO和DLD1细胞进行后续相关实验。见图1。
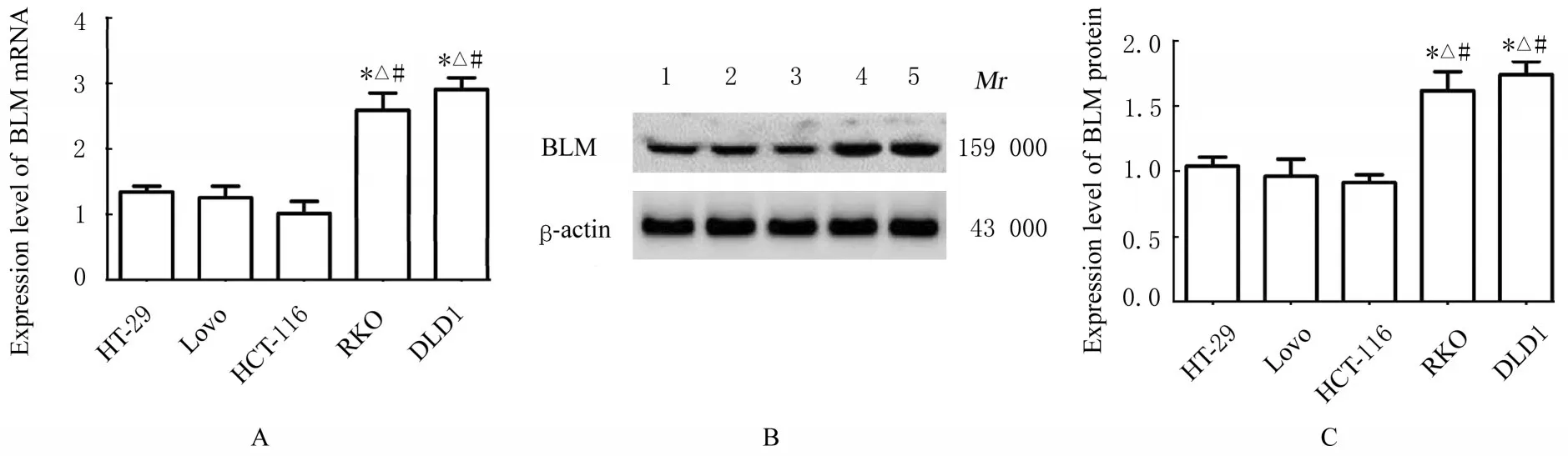
图1 RT-PCR和Western blotting法检测各种细胞中BLM mRNA和蛋白表达水平Fig.1 Expression levels of BLM mRNA and protein in different kinds of cells detected by RT-PCR and Western blotting methods
2.2 荧光显微镜下慢病毒感染CRC细胞的效率荧光显微镜观察结果表明:感染LV-shNC和LVshBLM的RKO和DLD1细胞中均可见绿色荧光表达,细胞感染效率可达80%以上。见图2。RT-qPCR检测结果显示:与感染LV-shNC的RKO(1.00±0.08)或DLD1(1.00±0.11)细胞比较,感染LV-shBL的MRKO(0.24±0.09)和DLD1细胞(0.11±0.03)中BLM mRNA表达水平明显降低(P<0.01)。
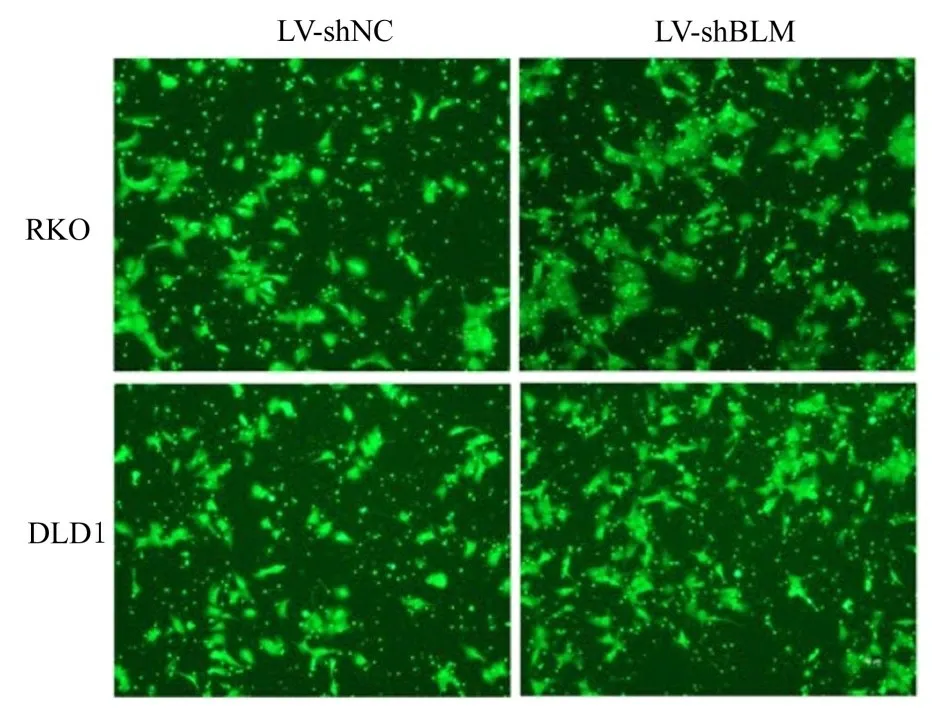
图2 荧光显微镜观察慢病毒感染的RKO和DLD1细胞形态表现(×200)Fig.2 Morphology of RKO and DLD1 cells infected with lentivirus observed under fluorescence microscope(×200)
2.3 各组RKO和DLD1细胞存活率CCK-8细胞实验检测结果显示:与感染LV-shNC的RKO或DLD1细胞比较,CPT-11作用后,感染LVshBLM的RKO或DLD1细胞存活率降低,且与LV-shNC组RKO[(71.24±13.11)μmol·L-1]或DLD1[(68.09±15.73)μmol·L-1]细 胞 比较,CPT-11对LV-shBLM组RKO[(21.44±7.40)μmol·L-1]或DLD1细 胞[(17.61±12.14)μmol·L-1]的IC50值明显降低(P<0.05)。见图3。

图3 CCK-8法检测2组RKO(A)和DLD1(B)细胞存活率Fig.3 Survival rates of RKO(A)and DLD1(B)cells in two groups detected by CCK-8 assay
2.4 不同细胞周期各组CRC细胞百分率与LVshNC组比较,CPT-11+LV-shNC与CPT-11+LV-shBLM组G0/G1期和S期RKO或DLD1细胞百分率明显升高(P<0.05),而G2/M期细胞百分率明显降低(P<0.05),其中CPT-11+LV-shBLM组G0/G1期和S期细胞百分率较CPT-11+LVshNC组明显升高(P<0.05),而G2/M期细胞百分率明显降低(P<0.05),见图4和5。

图4 流式细胞术检测不同细胞周期各组CRC细胞百分率Fig.4 Percentages of CRC cells at different cell cycles in various groups detected by flow cytometry
2.5 各组细胞中细胞周期相关蛋白表达水平Western blotting法检测细胞周期相关蛋白表达水平结果显示:与LV-shNC组比较,CPT-11+LV-shNC和CPT-11+LV-shBLM组RKO和DLD1细胞中Cyclin D1、CDK 4及CDK 6蛋白表达水平明显升高(P<0.05),而细胞周期抑制蛋白p21表达水平明显降低(P<0.05);与CPT-11+LV-shNC组比较,CPT-11+LV-shBLM组上述细胞周期相关蛋白表达水平升高(P<0.05)。见图6。
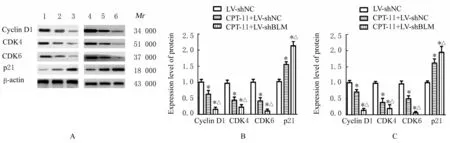
图6 Western blotting法检测各组细胞中细胞周期相关蛋白表达水平Fig.6 Expression levels of cell cycle-related proteins in cells in various groups detected by Western blotting method
2.6 各组CRC细胞凋亡率与LV-shNC组比较,CPT-11+LV-shNC和CPT-11+LV-shBLM组RKO或DLD1细胞凋亡率均升高(P<0.05),且CPT-11+LV-shBLM组RKO或DLD1细胞凋亡率较CPT-11+LV-shNC组 升 高(P<0.05)。见图7和8。
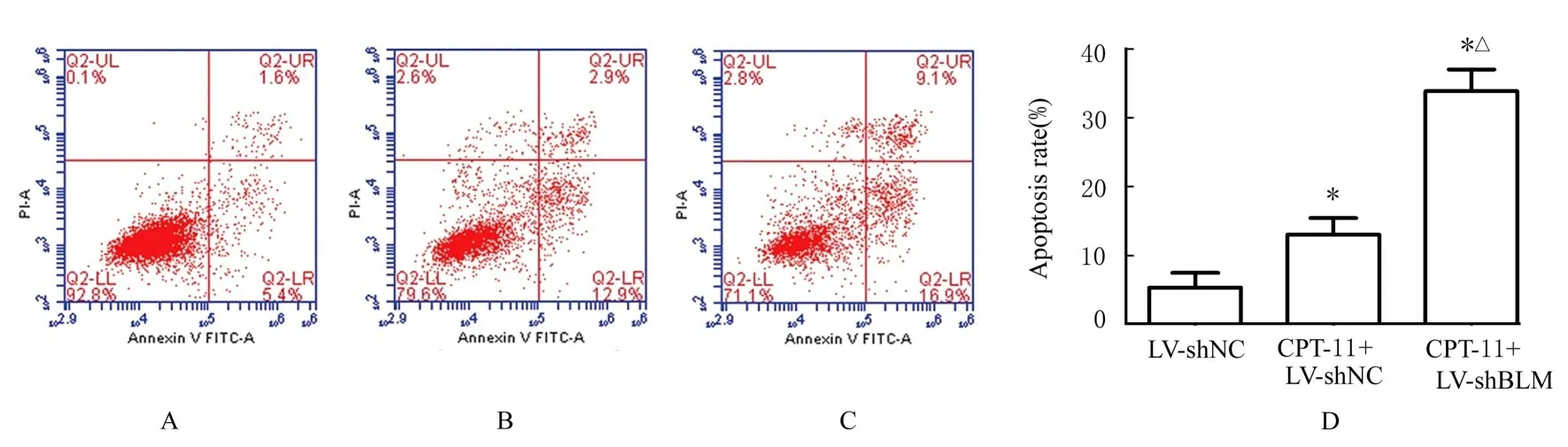
图7 流式细胞术检测各组RKO细胞凋亡率Fig.7 Apoptotic rates of RKO cells in various groups detected by flow cytometry
2.7 各组细胞中BLM和凋亡相关蛋白表达水平Western blotting法检测结果显示:与LVshNC组比较,CPT-11+LV-shNC和CPT-11+LV-shBLM组RKO或DLD1细胞中BLM蛋白及抗凋亡蛋白Bcl-2表达水平降低(P<0.05),而促凋亡蛋白Bax、Bad和cleaved caspase-3表达水平均明显升高(P<0.05);与CPT-11+LV-shNC组比较,CPT-11+LV-shBLM组RKO或DLD1细胞中BLM蛋白及抗凋亡蛋白Bcl-2表达水平降低(P<0.05),而促凋亡蛋白Bax、Bad和cleaved caspase-3表达水平升高(P<0.05)。见图9。
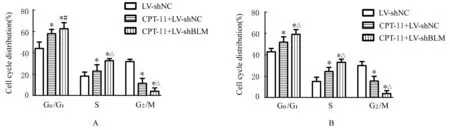
图5 不同细胞周期各组CRC细胞百分率Fig.5 Percentages of CRC cells at different cell cycles in various groups
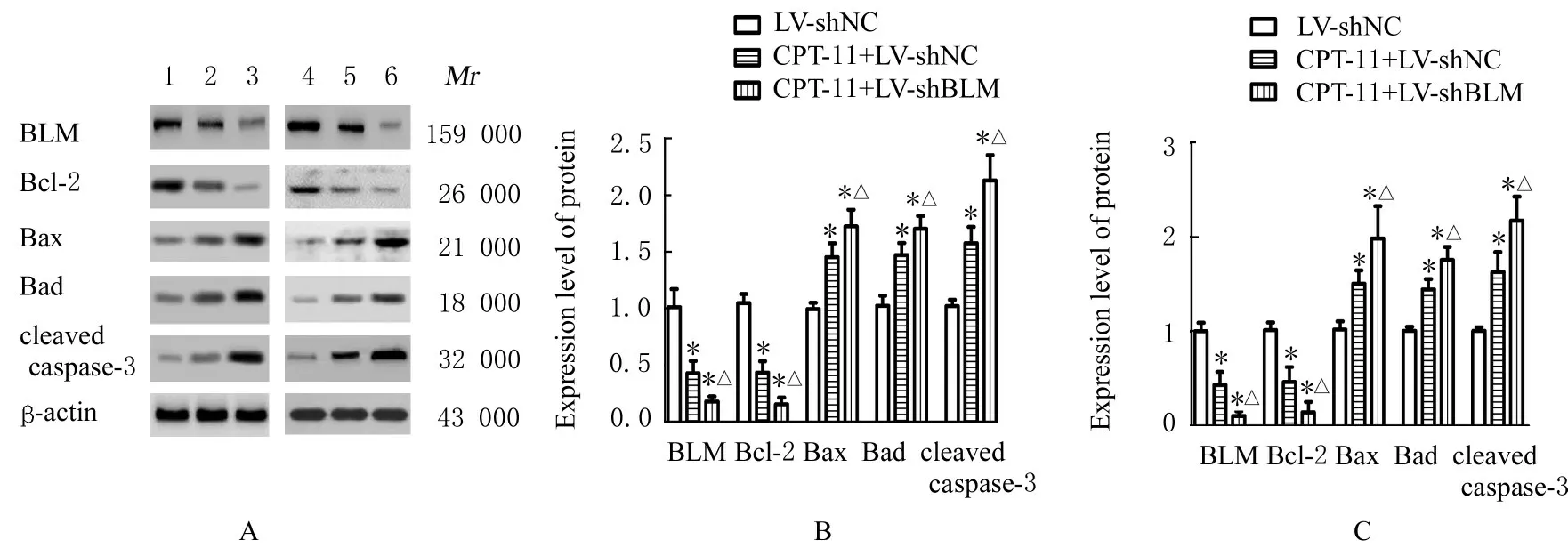
图9 Western blotting法检测各组细胞中BLM和凋亡相关蛋白表达电泳图(A)和直条图(B,C)Fig.9 Electrophoregram(A)and histogram(B,C)of expressions of BLM and apoptosis-related proteins in cells in various groups detected by Western blotting method
2.8 各组裸鼠皮下移植体积和肿瘤组织中BLM、Ki-67及TUNEL阳性表达率与LV-shNC组比较,CPT-11+LV-shNC组和CPT-11+LV-shBLM组裸鼠肿瘤体积明显降低(P<0.05),而CPT-11+LV-shBLM组裸鼠肿瘤体积较CPT-11+LVshNC组降低(P<0.05),见图10和11。肿瘤组织中BLM、Ki-67和TUNEL染色结果显示:LVshNC组肿瘤组织中BLM、Ki67和TUNEL阳性表达率分别为73.12%、52.06%和33.11%,CPT-11+LV-shNC组肿瘤组织中BLM、Ki-67和TUNEL阳性表达率为48.14%、37.19%和49.05%,CPT-11+LV-shBLM组肿瘤组织中BLM、Ki-67和TUNEL阳性表达率为25.51%、13.47%及72.36%。与LV-shNC组比较,CPT-11+LV-shNC组和CPT-11+LV-shBLM组肿瘤组织中BLM及Ki-67阳性表达率明显降低(P<0.05),TUNEL阳性表达率明显升高(P<0.05)。见图12。

图8 流式细胞术检测各组DLD1细胞凋亡率Fig.8 Apoptotic rates of DLD1 cells in various groups detected by flow cytometry
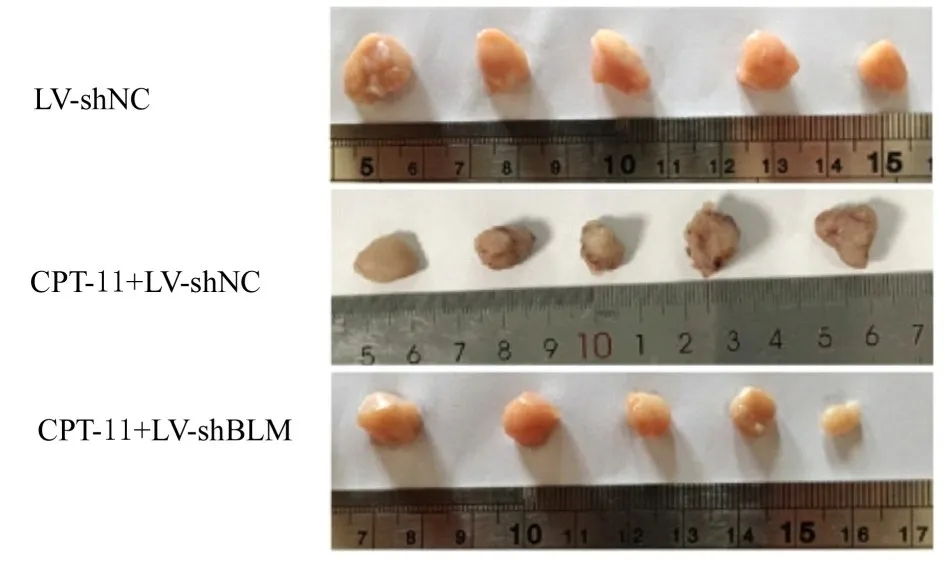
图10 各组裸鼠皮下移植瘤形态表现Fig.10 Morphology of subcutaneous transplanted tumor of nude mice in various groups
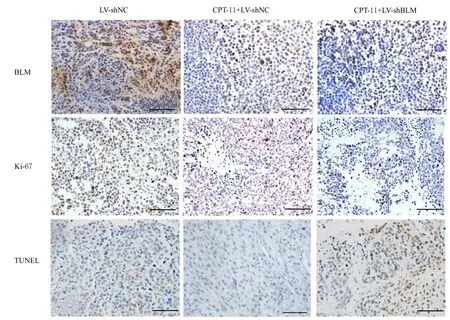
图12 免疫组织化学染色观察各组裸鼠肿瘤组织中BLM、Ki-67和TUNEL的表达(Bar=25μm)Fig.12 Expressions of BLM,Ki-67,and TUNEL in tumor tissue of nude mice in various groups detected by immunohistochemical staining(Bar=25μm)
3 讨 论

图11 各组裸鼠皮下移植瘤体积Fig.11 Volumes of subcutaneous transplanted tumor of nude mice in various groups
CRC是世界范围内发病率和死亡率最高的恶性肿瘤之一,而肿瘤细胞对化疗药物表现出内在的耐药性是导致CRC死亡率居高不下的重要原因[3-4,12]。属于喜树碱类衍生物的CPT-11是近年来治疗转移性CRC的主要化疗药物,但由于CRC细胞对其化疗不敏感性的广泛存在,导致其临床应用疗效不理想。药理作用机制研究[13-15]显示:喜树碱及其衍生物主要通过抑制拓扑异构酶Ⅰ的作用,能快速而有效地改变DNA的结构,阻滞其再连接过程,从而促使DNA损伤,破坏其复制,最终诱导细胞发生凋亡。因此,肿瘤细胞中DNA损伤修复作用严重影响抗癌治疗。本研究结果显示:在体内外沉默CRC细胞中BLM表达可通过抑制肿瘤细胞的周期进展,从而促进化疗药物CPT-11诱导的细胞凋亡,而这可能与沉默BLM表达可阻滞CRC细胞中DNA损伤修复有关。
BLM属于RecQ家族,后者是细胞中一类重要的DNA解旋酶,该家族主要利用ATP水解所产生的能量进行分解DNA双链分子,从而纠正并修复错配的碱基对以降低自身或外界环境中诱导DNA损伤[16-17]。既往研究[5]显示:BLM在多种肿瘤组织或细胞呈异常高表达现象。研究[18-19]显示:在肺癌、胃癌、鼻咽癌和卵巢癌等细胞中,BLM mRNA和蛋白表达水平均明显高于正常细胞,推测BLM可能作为上述肿瘤治疗的潜在特异性分子靶标。QIAN等[20]在前列腺癌中研究表明:BLM在前列腺癌组织和细胞中的表达明显高于正常组织和前列腺增生的细胞,同时,shRNA敲除BLM可抑制前列腺癌细胞的增殖,促进其凋亡。VOTINO等[7]通过对CRC公开数据库的全基因组分析发现:BLM在CRC组织中过表达,且与肿瘤的低分化和较短的生存期密切相关。此外,在化疗耐药性的研究领域中,冯大林等[8]和吴萍等[9]在前列腺癌细胞对顺铂及丝裂霉素C化疗敏感性的相关研究中发现:BLM基因低表达的前列腺癌细胞对上述化疗药物更敏感,而利用shRNA敲除其表达能明显降低肿瘤细胞的化疗抵抗。本研究结果表明:沉默或敲除CRC中BLM表达能明显提高细胞对CPT-11的化疗敏感性;同时,结合CPT-11与BLM相关作用进一步对上述现象的分子机制研究表明:沉默BLM可能通过抑制促细胞周期蛋白Cyclin D1、CDK4和CDK 6的表达而上调周期阻滞相关蛋白p21的表达,从而促使CRC细胞出现DNA合成前期的G1期和合成期的S期阻滞,而分布于DNA合成后期的G2期细胞百分率明显降低。这种现象与细胞周期活动中DNA的合成过程相关。
众所周知,细胞的周期活动可分为间期与分裂期,而间期又可具体分为DNA合成前期(即G0/G1期)、DNA复制合成期(即S期)和即将进入分裂期的合成后期(G2/M期)[21-23]。BLM主要参与DNA的修复,故沉默其表达能通过加剧CPT-11诱导的DNA损伤,抑制DNA的合成过程,从而阻碍CRC细胞进入分裂期。凋亡相关实验也同样显示:沉默BLM表达能明显促进CPT-11诱导的CRC细胞中凋亡相关蛋白Bax、Bad和cleaved caspase-3的表达,而抑制抗凋亡蛋白Bcl-2的表达。本课题组还在裸鼠中对上述细胞实验的相关结论进行了体内检测,结果同样表明:沉默CRC细胞中BLM表达能促进CPT-11的化疗敏感性。
综上所述,沉默CRC细胞中BLM表达可能通过抑制肿瘤细胞的细胞周期进展,从而促进化疗药物CPT-11诱导的细胞凋亡,最终在体内外改善肿瘤细胞的化疗抵抗。但本课题组仅在实验室阶段对上述方面进行了初步探讨,对于CRC细胞的其他恶性表征(如侵袭和转移性)以及临床应用中的作用及其相关机制仍需进一步研究。

