利多卡因对帕金森模型PC12细胞的保护作用及其机制
黄笑尘,李 浩,王保华,李 凯,3
(1.长春中医药大学附属医院麻醉科,吉林 长春 130117;2.吉林大学公共卫生学院劳动卫生与环境卫生学教研室,吉林 长春 130021;3.吉林大学中日联谊医院麻醉科,吉林 长春 130033)
帕金森病(Parkinson’s disease,PD)是影响全球老年人的排名第二位的常见进行性神经系统退行性疾病[1]。研究[2-3]显示:截至2005年,全球有接近460万人受到PD的影响;预计到2030年,PD发病人数可能增至900万以上。PD为多种内在因素和外界环境因素交互导致的级联反应所致,是α-突触核蛋白(α-synuclein,α-syn)的积聚、氧化应激的产生、线粒体功能缺陷、内质网应激障碍、神经炎症产生和钙离子稳态失衡及单胺氧化酶B(monoamine oxidase B,MAO-B)活性降低等多种病理生理机制共同参与的机制过程[4-9]。研究[10]显示:Wnt/β连环蛋白(β-catenin)通路与PD之间存在一定的联系,激活Wnt/β-catenin信号通路可使多巴胺神经递质再生,在PD小鼠模型中激活该通路可以延缓PD的发生发展[11]。利多卡因是一种酰胺类局部麻醉药,可用于区域麻醉和静脉治疗室性心律失常。利多卡因不仅具有抗炎特性,还具有钠通道阻滞作用,所以广泛应用于临床围手术期。近年来有研究者[12-13]发现:利多卡因在围手术期可以减少神经细胞的凋亡,并发挥一定的保护作用,但具体机制尚不明确。本研究采用1-甲基-4苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)作用于PC12细胞建立体外PD模型,给予细胞利多卡因的同时给予Wnt/β-catenin信号通路抑制剂重组dickkopf-1(DKK 1)蛋白抑制该通路,探讨利多卡因是否通过Wnt/β-catenin信号通路在氧化应激引起的PD损伤中起到保护作用。
1 材料与方法
1.1 细胞、主要试剂和仪器大鼠肾上腺嗜铬细胞瘤PC12细胞购自中国科学院细胞库。DMEM高糖培养基和胎牛血清(以色列BI公司),CCK-8试剂(美国APEx BIO公司),活性氧(reactive oxygen species,ROS)检测试剂盒和BCA蛋白定量试剂盒(上海碧云天生物公司),ECL发光试剂盒(上海莫纳生物科技有限公司),Wnt配体蛋白1(Wnt ligand protein 1,Wnt1)、磷酸化糖原合成酶激酶3β(phosphorylated-glycogen synthase kinase-3β,p-GSK-3β)抗体(爱博泰克生物科技有限公司),β-catenin、糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)抗体和DKK 1抑制剂(美国Abcam公司),半胱氨酸天冬氨酸蛋白酶3(cysteine aspartic acid protease 3,caspase 3)和GAPDH抗体(美国Proteintech公司),MPTP(美国Sigma公司),盐酸利多卡因注射液(遂成药业股份有限公司),逆转录试剂盒和实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR)试剂盒(上海莫纳生物有限公司)。凝胶电泳系统、电转系统和实时定量PCR仪(美国Bio-Rad公司)。
1.2 PC12细胞培养PC12细胞采用含10%胎牛血清和1%青-链霉素双抗的DMEM高糖培养基,置于5%CO2、37℃细胞培养箱中培养。当细胞生长至70%~80%时进行传代和冻存。
1.3 CCK-8法确定MPTP的处理浓度和时间将处于对数生长期的PC12细胞以1×105个/孔的密度接种至96孔板中,并采用含10%胎牛血清的高糖DMEM培养基培养。MPTP处理时将PC12细胞分为空白组、对照组(0 mmol·L-1MPTP)和不同 浓 度(0.2、0.4、0.8、1.6和3.2 mmol·L-1)MPTP组,置于培养箱中培养6、12、24和48 h。取出细胞培养板,在每孔中加入10μL CCK-8溶液,混匀,培养箱中继续孵育2 h,然后轻轻振荡混匀,在酶标仪490 nm处测量各孔吸光度(A)值,计算细胞存活率。细胞存活率=[(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)]×100%。
1.4 CCK-8法和Western blotting法确定利多卡因的处理浓度和时间将处于对数生长期的PC12细胞以1×105个/孔的密度接种至96孔板中,并采用含10%胎牛血清的高糖DMEM培养基培养。利多卡因处理时将PC12细胞分为空白组、对照组(0 g·L-1利多卡因)和不同浓度(0.001、0.010、0.100、0.200、0.400、0.600、0.800和1.000 g·L-1)利多卡因组,置于培养箱中培养1、2、6、12和24 h。取出细胞培养板,在每孔中加入10μL CCK-8溶液,混匀,培养箱中继续孵育2 h,然后轻轻振荡混匀,在酶标仪490 nm处测量各孔A值,计算细胞存活率。细胞存活率=[(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)]×100%。
Western blotting法确定利多卡因最佳浓度时将PC12细胞分为对照组、MPTP组、MPTP+0.2 g·L-1利多卡因组、MPTP+0.6 g·L-1利多卡因组和MPTP+1.0 g·L-1利多卡因组。
1.5 PC12细胞分组确定MPTP和利多卡因浓度后将细胞分为对照组、MPTP组、MPTP+利多卡因组、MPTP+利多卡因+DKK1组和MPTP+DKK1组。
1.6 流式细胞术检测各组PC12细胞中ROS水平PC12细胞经MPTP和利多卡因等一系列药物处理后,采用无EDTA的胰酶对细胞进行消化,于15 mL离心管中离心,弃上清,加入1 mL PBS重悬管底细胞,移入2 mL EP管中,根据ROS检测试剂盒的说明书进行操作。ROS水平=实验组ROS阳性细胞百分率/对照组ROS阳性细胞百分率。
1.7 ELISA法检测各组PC12细胞上清中炎症因子表达水平按试剂盒要求加样后,以空白孔调零,于450 nm波长处依序测量各孔A值。拟合模型采用Logistic曲线(四参数)。根据ELISA试剂盒说明书计算各组细胞上清液中白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平。
1.8 RT-qPCR法检测各组PC12细胞中Wnt1、β-catenin和GSK-3βmRNA表达水平采用总RNA提取试剂盒提取总RNA,并将样品逆转录为cDNA,37℃温育2 min、55℃温育15 min、85℃温育5 min。按照RT-qPCR试剂盒说明书进行实验,预变性95℃×10 min,变性95℃×10 s,退火55℃×10 s,延伸72℃×30 s,40个循环。以GAPDH为内参,采用2-△△Ct法计算目的基因表达水平。引物序列见表1。

表1 目的基因引物序列Tab.1 Primer sequences of target genes
1.9 Western blotting法检测各组PC12细胞中Wnt1、β-catenin、GSK-3β、p-GSK-3β和caspase 3蛋白表达水平收集各组PC12细胞,采用含蛋白酶抑制剂的RIPA裂解液提取总蛋白,采用BCA蛋白定量试剂盒检测细胞浓度,调整为统一浓度后100℃、5 min进行蛋白变性,于-20℃保存。加入蛋白样品进行电泳后,转至PVDF膜上,5%脱脂奶粉室温封闭2 h,加入Wnt1、β-catenin、GSK-3β、p-GSK-3β和caspase 3一抗(1∶1 000),4℃冰箱过夜;TBST溶液清洗3次后加入二抗(1∶2 000),室温孵育2 h,TBST洗膜后,加入ECL显影液,全自动化学发光成像分析系统曝光。以GAPDH为内参,采用Image J软件分析目的蛋白表达水平,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参条带灰度值。
1.10 统计学分析采用Excel录入数据,采用SPSS 24.0统计软件进行统计学分析。各组细胞存活率,细胞中ROS水平,细胞上清中IL-1β、IL-6和TNF-α水平,细胞中Wnt1、β-catenin和GSK-3βmRNA表达水平,细胞中Wnt1、β-catenin、GSK-3β、p-GSK3β和caspase 3蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNKq检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 MPTP造模浓度和时间与正常组比较,0.2~3.2 mmol·L-1MPTP组细胞存活率差异均有统计学意义(P<0.05)。当MPTP浓度为0.8 mmol·L-1、作用时间为24 h时,细胞存活率为75%,因此,确定MPTP的造模浓度为0.8 mmol·L-1,时间为24 h。见图1。

图1 各组细胞存活率Fig.1 Survival rates of PC12 cells in various groups
2.2 利多卡因最佳作用浓度和时间与对照组比较,PC12细胞存活率在给予0.001~1.000 g·L-1利多卡因作用6 h后明显降低(P<0.05)。当利多卡因浓度为0.200 g·L-1时,P<0.01;当利多卡因浓度≥0.400 g·L-1时,P<0.01。因此,本实验确定0.2 g·L-1为 低 浓 度,0.6 g·L-1为 中 浓 度,1.0 g·L-1为高浓度,再采用Western blotting法选取利多卡因最佳作用浓度为中浓度0.6 g·L-1。利多卡因作用6 h后,与对照组比较,MPTP和MPTP+0.200 g·L-1利多卡因组PC12细胞中Wnt1蛋白表达水平降低(P<0.05),caspase 3蛋白表达水平升高(P<0.05);与MPTP组比较,MPTP+0.200 g·L-1利 多 卡 因、MPTP+0.600 g·L-1利 多 卡 因组和MPTP+1.000 g·L-1利多卡因组PC12细胞中Wnt1蛋白表达水平升高(P<0.05),MPTP+0.600 g·L-1利 多 卡 因组和MPTP+1.000 g·L-1利多卡因组PC12细胞中caspase-3蛋白表达水平降低(P<0.05);与MPTP+0.200 g·L-1利 多 卡 因 组 比 较,MPTP+0.600 g·L-1利多卡因组PC12细胞中Wnt1蛋白表达水平升高(P<0.05),caspase 3蛋白表达水平降低(P<0.05),MPTP+1.000 g·L-1利多卡因组PC12细胞中Wnt1和caspase 3蛋白表达水平降低(P<0.05);与MPTP+0.600 g·L-1利 多 卡 因 组 比 较,MPTP+1.000 g·L-1利多卡因组PC12细胞中Wnt1和caspase-3蛋白表达水平降低(P<0.05)。见图2、图3和表2。
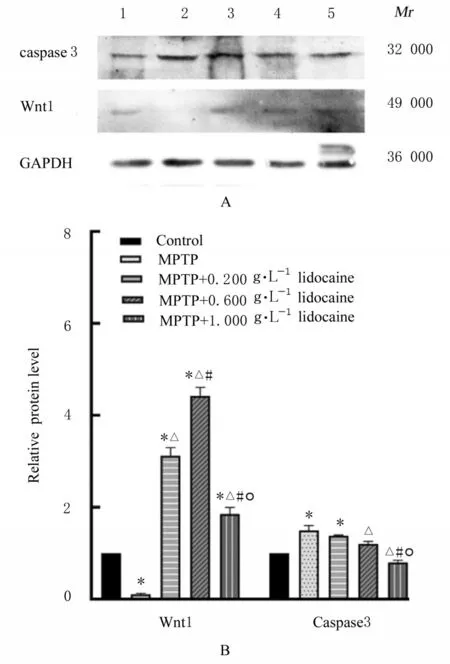
图3 利多卡因作用6 h后各组细胞中Wnt1和caspase 3蛋白表达电泳图(A)和直条图(B)Fig.3 Electrophoregram (A) and histogram (B) of expressions of Wnt1 and caspase 3 proteins in cells in various groups after treated with lidocaine for 6 h detected by Western blotting method
表2 利多卡因作用6 h后各组PC12细胞中Wnt1和caspase 3蛋白表达水平Tab.2 Expression levels of Wnt1 and caspase 3 proteins in PC12 cells in various groups after treated with lidocaine for 6 h(n=3,±s)

表2 利多卡因作用6 h后各组PC12细胞中Wnt1和caspase 3蛋白表达水平Tab.2 Expression levels of Wnt1 and caspase 3 proteins in PC12 cells in various groups after treated with lidocaine for 6 h(n=3,±s)
*P<0.05 vs control group;△P<0.05 vs MPTP group;#P<0.05 vs MPTP+0.200 g·L-1 lidocaine group;○P<0.05 vs MPTP+0.600 g·L-1 lidocaine group.
caspase 3 0.537±0.007 0.815±0.045*0.755±0.005*0.660±0.020△0.436±0.02△#○47.21<0.01 Group Control MPTP MPTP+0.200g·L-1 lidocaine MPTP+0.600 g·L-1 lidocaine MPTP+1.000 g·L-1 lidocaine F P Wnt1 0.360±0.010 0.035±0.005*1.105±0.045*△1.575±0.055*△#0.630±0.008*△#○337.0<0.01

图2 利多卡因作用6 h时各组细胞存活率Fig.2 Survival rates of PC12 cells in various groups after treated with lidocaine for 6 h
2.3 各组细胞中ROS水平与对照组比较,MPTP组PC12细胞中ROS水平明显升高(P<0.05);与MPTP组比较,MPTP+利多卡因组PC12细 胞 中ROS水 平 降 低(P<0.05);与MPTP+利多卡因组比较,MPTP+利多卡因+DKK1组PC12细胞中ROS水平升高(P<0.05)。见图4和表3。

图4 流式细胞术检测各组PC12细胞中ROS水平Fig.4 ROS levels in PC12 cells in various groups detected by flow cytometry
表3 各组PC12细胞中ROS水平Tab.3 ROS levels in PC12 cells in various groups(n=3,±s,η/%)

表3 各组PC12细胞中ROS水平Tab.3 ROS levels in PC12 cells in various groups(n=3,±s,η/%)
*P<0.05 vs control group;△P<0.05 vs MPTP group;#P<0.05 vs MPTP+lidocaine group;○P<0.05 vs MPTP+lidocaine+DKK1 group.
ROS level 1.215±0.005 7.875±0.935*1.47±0.050△3.005±0.035*△#4.390±0.090*△#○41.59<0.01 Group Control MPTP MPTP+lidocaine MPTP+lidocaine+DKK 1 MPTP+DKK 1 F P
2.4 各组PC12细胞上清中IL-1β、IL-6和TNF-α水平与对照组比较,MPTP组PC12细胞中IL-1β、IL-6和TNF-α水平均升高(P<0.05);与MPTP组比较,MPTP+利多卡因组PC12细胞中IL-1β、IL-6和TNF-α水平均降低(P<0.05);与MPTP+利多卡因组比较,MPTP+利多卡因+DKK 1组PC12细胞中IL-1β、IL-6和TNF-α水平升高(P<0.05)。见表4。
表4 各组PC12细胞上清中IL-1β、IL-6和TNF-α水平Tab.4 Levels of IL-1β,IL-6,and TNF-αin supernatant of PC12 cells in various groups [n=3,±s,ρB/(ng·L-1)]

表4 各组PC12细胞上清中IL-1β、IL-6和TNF-α水平Tab.4 Levels of IL-1β,IL-6,and TNF-αin supernatant of PC12 cells in various groups [n=3,±s,ρB/(ng·L-1)]
*P<0.05 vs control group;△P<0.05 vs MPTP group;#P<0.05 vs MPTP+lidocaine group;○P<0.05 vs MPTP+lidocaine+DKK1 group.
2.5 各 组 细 胞 中Wnt1、β-catenin和GSK-3β mRNA表达水平与对照组比较,MPTP组PC12细胞中Wnt1和β-catenin mRNA表达水平降低(P<0.05),GSK-3βmRNA表达水平升高(P<0.05);与MPTP组比较,MPTP+利多卡因组PC12细胞中Wnt1和β-catenin mRNA表达水平升高(P<0.05),GSK-3βmRNA表达水平降低(P<0.05)。见图5。
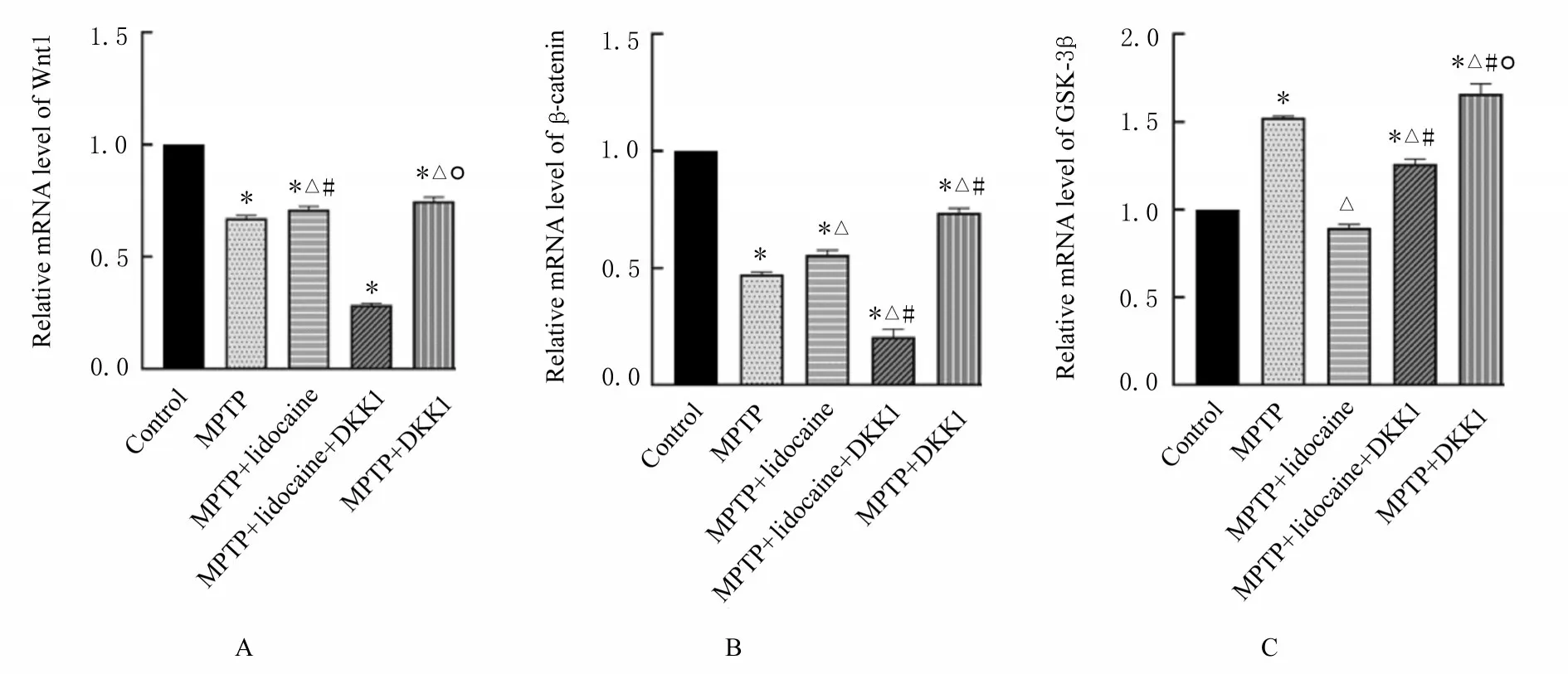
图5 各组PC12细胞中Wnt1、β-catenin和GSK-3βmRNA表达水平Fig.5 Expression levels of Wnt1,β-catenin,and GSK-3βm RNA in PC12 cells in various groups
2.6 各 组 细 胞 中Wnt1、β-catenin、GSK-3β、p-GSK-3β和caspase 3蛋白表达水平与对照组比较,MPTP组PC12细胞中Wnt1和β-catenin蛋白表达水平降低(P<0.05),GSK-3β、p-GSK-3β和caspase 3蛋白表达水平升高(P<0.05);与MPTP组比较,MPTP+利多卡因组PC12细胞中Wnt1和β-catenin蛋白表达水平升高(P<0.05),GSK-3β、p-GSK-3β和caspase 3蛋白表达水平降低(P<0.05)。见图6、图7和表5。
表5 各组PC12细胞中Wnt1、β-catenin、GSK-3β、p-GSK-3β和caspase 3蛋白表达水平Tab.5 Expression levels of Wnt1,β-catenin,GSK-3β,p-GSK-3β,and caspase 3 proteins in PC12 cells in various groups(n=3,±s)

表5 各组PC12细胞中Wnt1、β-catenin、GSK-3β、p-GSK-3β和caspase 3蛋白表达水平Tab.5 Expression levels of Wnt1,β-catenin,GSK-3β,p-GSK-3β,and caspase 3 proteins in PC12 cells in various groups(n=3,±s)
*P<0.05 vs control group;△P<0.05 vs MPTP group;#P<0.05 vs MPTP+lidocaine group;○P<0.05 vs MPTP+lidocaine+DKK1 group.
Group Control MPTP MPTP+lidocaine MPTP+lidocaine+DKK 1 MPTP+DKK 1 F P caspase 3 0.544±0.006 0.580±0.010*0.288±0.003*△0.351±0.021*△#0.705±0.015*△#○209.5<0.01 Wnt1 0.961±0.008 0.563±0.011*0.609±0.011*△0.399±0.008*△#0.427±0.095*△#690.2<0.01 β-catenin 0.975±0.005 0.408±0.004*0.476±0.010*△0.340±0.010*△#0.490±0.010*△#2 325<0.01 GSK-3β 0.517±0.004 0.568±0.008*0.503±0.004*△0.729±0.010*△#0.721±0.005*△#342.5<0.01 p-GSK-3β 0.545±0.005 0.772±0.014*0.419±0.004*△0.519±0.005△#0.575±0.015*△#190.6<0.01
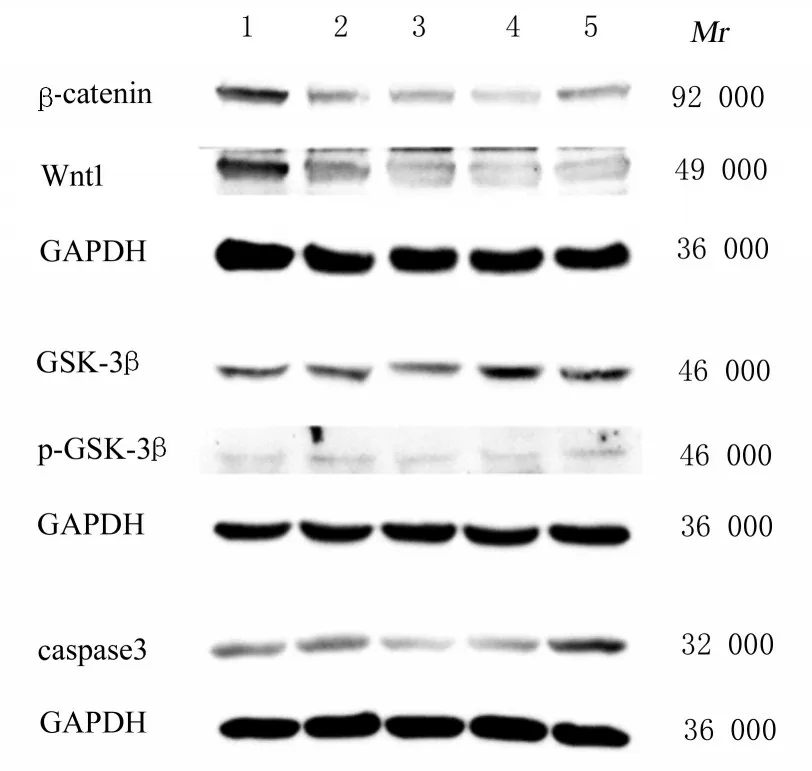
图6 Western blotting法检测各组PC12细胞中Wnt1、β-catenin、GSK-3β、p-GSK-3β和caspase 3蛋白表达电泳图Fig.6 Electrophoregram of expressions of Wnt1,β-catenin,GSK-3β,p-GSK-3β,and caspase 3 proteins in PC12 cells in various groups detected by Western blotting method

图7 各组PC12细胞中Wnt1、β-catenin、GSK-3β、p-GSK-3β和caspase 3蛋白表达水平Fig.7 Expression levels of Wnt1,β-catenin,GSK-3β,p-GSK-3β,and caspase 3 proteins in PC12 cells in various groups
3 讨 论
PD为排名第二位神经退行性(neurodegenerative diseases,ND)疾病,60岁以上人口中约1%患该疾病[14]。尽管多巴胺能替代疗法已经可以大大改善PD患者的临床症状,但对于其具体的发病机制了解仍然有限[15]。PD的发病机制复杂,临床多以对症治疗为主,尚无相应药物可以阻止PD的进展,因此对于这种ND患者的围手术期神经保护显得尤为重要。本研究通过PD体外细胞模型寻找PD的发病机制,并且探讨麻醉剂利多卡因是否通过Wnt/β-catenin信号通路在PD模型中对PC12细胞发挥保护作用,为PD的治疗提供理论依据。
氧化应激在PD的发病机制中起重要作用。ROS在细胞中积聚,使抗氧化酶的活性降低,由于其他活化氧化酶失去平衡,可导致中枢神经系统(central nervous system,CNS)的细胞发生功能障碍和细胞凋亡[16-18]。目前,神经毒素MPTP的活性成分MPP+被广泛应用于PD体内体外模型[19]。本研究结果表明:经MPTP诱导的PD模型PC12细胞中ROS水平明显高于对照组,此结果与前人研究[20-21]一致,说明MPTP可使PC12细胞发生氧化应激。加入利多卡因后,PC12细胞中ROS水平明显降低,再加入Wnt/β-catenin信号通路抑制剂DKK 1后,ROS水平又升高,表明利多卡因可以降低细胞中MPTP带来的氧化损伤,并且可能是通过Wnt/β-catenin信号通路发挥抑制氧化应激的产生,从而达到一定的保护作用。
研究[22]显示:Wnt/β-catenin信号通路在炎症疾病和神经系统疾病中均起重要作用,特别是在细胞凋亡存活过程中发挥关键作用。利多卡因也被证实可以抑制巨噬细胞中脂多糖(lipopolysaccharide,LPS)诱导的炎症细胞因子的分泌,并在小鼠模型中发挥抗炎作用[23-24]。本研究结果显示:利多卡因可抑制PC12细胞中IL-1β、IL-6及TNF-α的释放,同时抑制细胞凋亡的发生。加入DKK1后,细胞中IL-1β、IL-6和TNF-α释放及caspase 3表达增加,细胞凋亡增多,提示利多卡因可能是通过Wnt/β-catenin信号通路发挥抗炎和抗凋亡作用。
有研究[25]显示:Wnt/β-catenin信号通路启动级联反应,在整个生命过程中正常的胚胎发育和几乎所有组织和器官系统中均至关重要。研究[26-29]显示:在PD模型中发现Wnt/β-catenin信号通路发生异常,提示Wnt/β-catenin信号通路障碍很有可能是PD发病机制之一。而GSK-3β是一种丝氨酸/苏氨酸蛋白激酶,在多种疾病的病理生理过程中起重要作用。本研究采用RT-qPCR法和Western blotting法进一步验证结果显示:MPTP可明显降低PD模型中Wnt和β-catenin mRNA和蛋白表达水平,上调GSK-3β和p-GSK-3β的表达;而给予利多卡因治疗后结果相反,在同时给予抑制剂DKK 1后,结果再次发生逆转;上述结果提示利多卡因可以在MPTP诱导的PD模型PC12细胞中激活Wnt/β-catenin信号通路。
综上所述,利多卡因对MPTP诱导的PD模型PC12细胞有一定保护作用,可显著降低细胞中ROS的生成及抑制促炎性细胞因子的释放,同时还可显著下调凋亡蛋白caspase 3的表达,其作用机制可能是通过Wnt/β-catenin信号通路发挥保护作用。本研究为利多卡因对神经细胞的保护作用提供了理论和实验依据,未来应进一步结合动物实验和临床研究探讨利多卡因的保护作用,为PD的治疗提供新方案。

