在比较中选择在选择中优化
曹先 杨军峰


摘要: CO2的实验室制取是初中化学重要的学习内容之一,探究的重点通常为CO2发生装置的选择与优化,但对试剂的选择、优化较少涉及。本文依据“元素守恒”思想,结合化学史和实验对CO2实验室制取中药品的选择进行多维度探究,突破知识难点,激发学生学习兴趣,发展学生“科学探究与创新思维”“证据推理与模型认知”等化学学科核心素养。
关键词: CO2的实验室制取;元素守恒;药品选择;教学设计
文章编号:1008-0546(2022)06x-0090-03 中图分类号:G632.41 文献标识码: B
doi:10.3969/j.issn.1008-0546.2022.06x.024
一、问题的提出
CO2的实验室制取是九年级学生必须完成的八个基础化学实验之一,《义务教育化学课程标准(2011年版)》的内容要求是:初步学习 CO2的实验室制法
[1]即要求学生学会有关制取二氧化碳的方法,对制
取气体的一般思路有基本了解,包括药品的选择、装置的设计、实验的方法等[2]。实验室制取气体的一般思路如图1所示[3]:
在教学实践中,教师大多聚焦于 CO2发生装置的选择与优化,反应原理的选择,气体纯度、反应条件以及反应速率等,对于如何依据质量守恒定律选择药品,如何依据药品价格等对药品进行优化关注较少[4]。基于以上认识,笔者通过重构教材的内容结构,设计了“实验室制取二氧化碳的药品选择”的实验探究课。
二、教学设计
1.教学目标
(1)依据“化学反应前后元素种类不变”,从常见物质中挑选出实验室可以制取CO2的物质,树立元素守恒的思想。
(2)能结合药品价格、状态及反应条件对实验室可以制取CO2的药品进行筛选与优化,增强学生节约成本、降低能耗等意识。
(3)通过物质组成分析以及猜想假设、史料研读、实驗设计等途径,发展学生“科学探究与创新思维”“证据推理与模型认知”等学科核心素养。
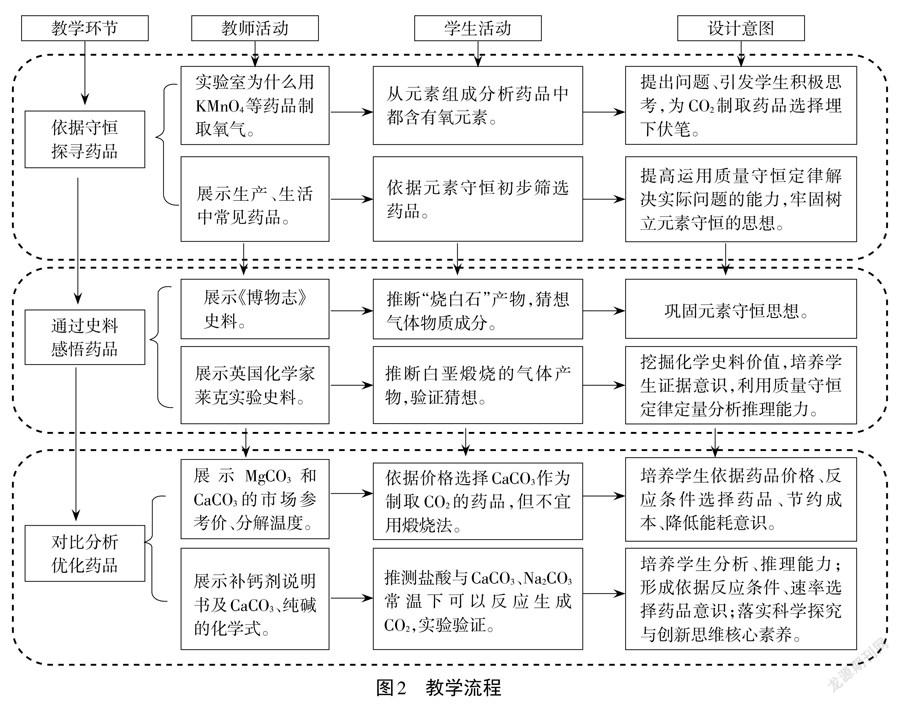
2.教学流程(见图2)
三、教学实录
环节一依据守恒探寻药品
[回顾]实验室为什么选用KMnO4、KClO3、H2O2等试剂制取O2?
[学生]因为它们的组成中都含有氧元素,分解后都能生成氧气。
[问题]C、NaCl、CaCO3、MgCO3、NH4Cl 这些物质,哪些有可能用于制取CO2?你判断的依据是什么?
[学生1]C、CaCO3、MgCO3可能会用于制取CO2。
[学生2]依据化学反应前后元素的种类不变,C、 CaCO3、MgCO3组成中都含有碳元素,可能会用于制取 CO2。
[问题]C如何生成CO2?该方法是否适用于实验室制取较为纯净的二氧化碳?为什么?
[学生1]碳和氧气点燃后生成CO2。
[学生2]木炭还原氧化铜粉末生成CO2。
[学生3]碳和氧气点燃后还会生成CO,得不到纯净的 CO2。木炭还原氧化铜粉末需要高温条件,实验操作繁琐且耗能大。二者都不适合实验室制取二氧化碳。
[问题]CaCO3、MgCO3都含有碳元素,能否制取 CO2?
环节二通过史料感悟药品
[问题]西晋张华在《博物志》中有“烧白石作白灰”的记载,就是将白石(主要成分是 CaCO3)加热到900℃左右会有白灰(CaO)生成。请判断还有别的物质生成吗?张华为什么没有记载?你认为该物质可能是什么?
[学生1]依据元素守恒,不可能只生成CaO,还应该有含碳的物质生成。
[学生2]张华没有说明可能生成了气体。
[学生3]气体可能是CO2,也可能是CO,还可能二者都有。
[问题]1755年,英格兰化学家布莱克做了类似实验,将白垩(主要成分是 CaCO3)煅烧,发现质量减了44%。你认为气体是什么?理由是什么?白垩煅烧的化学反应方程式如何书写?
[学生1]气体是 CO2。依据质量守恒定律,假如白垩的质量为100份,则其完全煅烧后会生成56份质量的CaO,若生成气体是CO2,质量正好是44份。这与布莱克实验数据吻合。
[学生2]白垩(石灰石)煅烧的化学反应方程式为 CaCO3 CaO+CO2↑
环节三对比分析优化药品
[问题]事实证明煅烧 MgCO3也会发生类似煅烧 CaCO3的反应(分解温度为700℃),它们的市场参考价:500 g碳酸镁374元,500 g碳酸钙20元。你会选择哪一种药品?
[学生1]还需要考虑试剂的价格。
[学生2]从价格的角度考虑,实验室制取 CO2最好选择白垩(石灰石)。
[问题]用高温煅烧白垩(石灰石)的方法是否适合实验室制取CO2?
[学生1]实验室常用的加热仪器是酒精灯,火焰的最高温度为500℃,不能达到反应的要求。
[学生2]如此高的温度需要耗费大量的能源且不安全,不适合实验室制取CO2。
[问题]实验室制取 CO2气体还需考虑反应的条件。如果选择价格相对便宜的白垩(石灰石)作为制取CO2的药品之一,我们该如何让它在较为温和的条件下放出CO2气体呢?下面是生活中常用的补钙剂及相关信息(见图3)。
仔细观察后猜想:难溶于水的碳酸钙中的钙元素是如何被人体吸收的?
[学生1]应该是碳酸钙和胃液中的稀盐酸发生了反应,生成了可溶物被人体吸收了。
[学生2]从不良反应“嗳气,胃肠胀气”等推测有 CO2气体产生。
[演示]碳酸钙D3颗粒与稀盐酸反应并验证产生的气体是CO2。
[学生]大理石与稀盐酸确实发生了反应,生成的气体能使澄清石灰水变浑浊,证明是CO2气体。
[问题]厨房中的纯碱(主要成分 Na2CO3)与碳酸钙的组成有何相似之处?你认为碳酸钠与稀盐酸可以反应产生CO2吗?
[学生1]都含有碳酸根离子(CO -)。
[学生2]它们的组成相似,应该会产生CO2。
[分组实验]Na2CO3粉末、CaCO3粉末、块状大理石分别与稀盐酸反应。观察反应速率的快慢。
[学生1]都有 CO2生成,但使用 Na2CO3粉末与 CaCO3粉末产生CO2的速率很快,不利于收集气体。
[学生2]块状大理石产生CO2的速率适中,有利于收集气体。实验室可以用块状大理石和稀盐酸反应制取CO2。
[问题]块状大理石和稀盐酸属于“电性”反应,即正价元素与负价元素结合。化学反应方程式如何书寫?
[学生1]CaCO3+2HCl〓CaCl2+H2O+CO2↑。
[学生2]从药品的来源、价格的低廉、操作的简便性和安全性等多方面考虑,在实验室里,稀盐酸与块状大理石反应的速率适中,最适宜做实验室制取CO2的原料。
四、教学反思
本教学设计引导学生根据质量守恒定律在众多化学物质中快速筛选出实验室制取CO2的合适药品,强化学生的“元素守恒”思想,帮助学生构建气体制取中药品选择的思维模型,通过对 CO2发现史中部分史料的分析,培养学生基于证据进行分析推理的能力。通过对比 CaCO3、MgCO3、Na2CO3组成和结构,预测它们在一定条件下都可以产生CO2,渗透“结构决定性质”的基本观念,学生从微观层面认识物质的水平得到提高。通过创新实验,既适当拓展了教材内容,有利于学生掌握知识、开阔视野,又有利于培养学生的探究精神,学生真正学会在实验室制取气体时如何选择试剂。
总之,CO2的实验室制法是巩固和深化气体物质实验室制取的思路和方法、训练基本实验技能及发展学生科学探究能力的重要载体[5]。教师在教学中应该充分挖掘其中蕴含的学科价值与学科思想,在引导学生掌握学科知识、基本技能、基本方法的同时,培养学生正确的价值观念、必备品格和关键能力。
参考文献
[1]中华人民共和国教育部.义务教育化学课程标准(2011年)[S].北京:北京师范大学出版社,2012.
[2]娄延果.课程标准案例式导读与学习内容要点[M].吉林:东北师范大学出版社,2012.
[3]王荣桥等.2021年中考化学复习备考研究[J].中学化学教学参考,2021(03):41-49.
[4]缪徐.“二氧化碳制取的研究”教学设计及点评[J].中学化学教学参考,2009(03):18-21.
[5]杨梓生,吴菊华,林红梁.初中化学教材与教学微研究(上册)[M].上海:上海教育出版社,2017.

