靶向模拟Bt Cry1C蛋白抗虫功能的人源化基因工程抗体筛选及鉴定
徐重新 张霄 刘媛 仲建锋 谢雅晶 卢莉娜 高美静 刘贤金
(江苏省农业科学院农产品质量安全与营养研究所 江苏省部共建国家重点实验室培育基地-江苏省食品质量安全重点实验室, 南京 210014)
Bt Cry蛋白是苏云金芽胞杆菌(Bacillus thuringiensis,Bt)在代谢过程中产生的蛋白质类伴胞晶体次生代谢产物,对多种农林害虫具有广谱特异性毒杀作用,是目前研究最成熟、应用最广的微生物农药[1]。现已报道的Bt Cry蛋白多达数百种,其中Cry1Aa、Cry1Ab、Cry1B、Cry1C和Cry1F等在应用上最为常见,特别是用于转基因抗虫作物改造,品种涉及水稻、玉米、大豆、马铃薯、番茄、棉花、烟草等全球主要大宗农作物[2]。据国际农业生物技术应用服务组织最新统计数据显示,转Bt Cry蛋白基因作物推广应用范围几乎涵盖了五大洲所有农业生产大国,为全世界减少化学农药投入使用和保障农产品稳定生产作了重要贡献,蕴藏着巨大的商业价值[3]。然而,随着转Bt Cry蛋白基因作物长时间、大范围推广应用,其加速害虫抗药性以及可能存在的生态安全风险等问题饱受非议,一直是社会舆论关注的热点[4-5]。挖掘新型安全生物源性抗虫材料,特别是探索可替代Bt Cry蛋白抗虫功能的生物活性材料是当今绿色生物农药领域研究热点。
丹麦免疫学家Jerne教授在1974年提出“免疫网络学说”并首次定义抗独特型抗体(anti-idiotype antibody,Anti-Id)的概念,指出机体免疫级联反应过程中可以针对抗体可变区特定区域产生抗体的抗体(即抗独特型抗体),后经血清反应分型鉴定划分为α、β、γ和ε四种类型,其中β类型的抗独特型抗体因具有“内影像”的特性,从而展示出与抗原相同的抗原决定簇,因而具备模拟抗原部分结构或生物学功能的特性[6]。目前在生物医药领域和农业免疫检测领域已经有采用抗独特型抗体技术制备可替代抗原结构或功能的生物安全类似物等方面研究的报道。Hanoux等[7]获得了可模拟人朊蛋白抗原关键功能表位的抗独特型多克隆抗体,可用于替代人朊蛋白用于疾病治疗。Lan等[8]获得了可模拟生长激素与受体结合的鼠源抗独特型单克隆抗体,其能对生长激素起到明显的拮抗抑制作用,可用于生长激素类疾病治疗。Shu等[9]和Qiu等[10]依托抗独特型抗体技术分别成功制备获得了伏马毒素和Bt Cry1Ab蛋白的抗独特型基因工程纳米抗体,均能替代Bt Cry全长蛋白用于相应农产品样品检测。
目前国内外尚无采用抗独特型抗体技术制备可模拟Bt Cry蛋白抗虫功能类似物的研究报道。Cry 1C作为Bt Cry蛋白家族较为典型的代表性成员,特别对鳞翅目害虫具有良好的杀虫效果,是转Bt基因水稻较为常见的类型,因此探索具备模拟Cry 1C蛋白抗虫活性的新型蛋白类生物材料用于替代Cry 1C蛋白应对稻作农业靶标害虫具有重要意义。英国剑桥大学构建的人源化噬菌体展示单链抗体库库容量和多样性高达108,是目前商品化应用较广的库源材料,因其单链抗体基因来源于人类,理论上对人类免疫系统不会造成明显的异源排斥反应,因此如果能从该库中获得具有模拟Bt Cry抗虫功能的人源化单链抗体,那么其作为生物农药制剂或转基因材料用在食用农作物靶标害虫防控上,对人类健康来说更加具备潜在的安全优势。基于此,研究以Bt Cry1C抗虫蛋白为模拟对象,采用抗独特型抗体制备技术,以Bt Cry1C蛋白多克隆抗体作为包被靶点抗原,以剑桥大学研发的优质商品化大容量人源化噬菌体展示抗体库为库源材料,通过抗原特异性抗体高通量靶向筛选与分析鉴定,从供试库源中靶向淘筛具有可模拟Bt Cry1C蛋白抗虫功能的抗独特型基因工程抗体材料,为新型安全生物抗虫蛋白人工定向创制探索全新路径。
1 材料与方法
1.1 材料
Bt Cry1C蛋白购于上海佑隆生物科技有限公司。Bt Cry1C蛋白多克隆抗体由省部共建国家重点实验室培育基地-江苏省食品质量安全重点实验室前期制备[11]。人源化噬菌体展示单链抗体库(库容量为108CFU/mL)、KM13辅助噬菌体和E. coli TG1均购于购自英国剑桥大学分子生物学实验室和蛋白质基因工程中心。稻纵卷叶螟(三龄幼虫)由扬州绿源生物化工有限公司提供,小菜蛾(三龄幼虫)由江苏省农业科学院农业部农产品质量安全控制技术与标准重点实验室提供。全自动酶标仪购于美国Thermo公司,96孔酶标板和细胞培养瓶购于美国Corning 公司。Anti-M13[HRP]单克隆抗体、羊抗兔IgG[HRP]单克隆抗体、超微量分光光度计购于北京Sigma-Aldrich 公司。卡那霉素、氨苄青霉素购自美国Sigma 公司。DNA marker购于北京全式金生物技术有限公司。其他试剂均购于北京GE Healthcare Life Sciences China公司。
1.2 方法
1.2.1 扩增人源化噬菌体展示单链抗体库 取人源化噬菌体展示单链抗体库菌种母液加入到2×TY-AG培养基(含终浓度为100 μg/mL的氨苄青霉素和1%的葡萄糖)中培养,直至菌液OD600值达到0.4。从中取50 mL菌液,并向其加入5 μL 滴度为1×1012CFU /mL的KM13辅助噬菌体,在37℃水浴锅中孵育30 min,以3 300×g离心10 min,弃掉上清液,沉淀的菌种以100 mL 2×TY-AKG培养基(含终浓度为100 μg /mL的氨苄青霉素、50 μg /mL的卡那霉素,以及1%的葡萄糖)重悬,随即置于30℃摇床中培养过夜。次日将培养物以3 300× g离心30 min,取上清液预冷后,加入20 mL PEG/NaCl溶液,再以3 300× g离心30 min,弃掉上清液,沉淀物以4 mL PBS溶液重悬。最后重悬液以11 600×g离心10 min,收集上清液即为扩增的人源化噬菌体展示单链抗体库。扩增后的人源化噬菌体展示单链抗体库滴度参照Lee等[12]报道方法执行。
1.2.2 Bt Cry1C蛋白抗独特型噬菌体展示单链抗体富集淘筛 取3 mL浓度为100 μg/mL的Bt Cry1C多克隆抗体蛋白溶液加入到细胞培养瓶中并于4℃静置过夜。次日以PBS溶液洗瓶。取1 mL扩增后的人源化噬菌体展示单链抗体库(滴度定量为1010CFU /mL)溶液与4 mL MPBS溶液(含3%的脱脂奶粉)充分混匀,随后加入到经洗涤的细胞培养瓶中,以25 r/min缓慢摇动1 h,接着再静置1 h。以PBST溶液(含0. 05%的吐温-20)洗瓶后,加入1 mL胰蛋白酶溶液用于洗脱与瓶内吸附的Bt Cry1C多克隆抗体蛋白特异性结合的人源化噬菌体单链抗体。收集洗脱液即为第一轮富集的Bt Cry1C蛋白抗独特型噬菌体展示单链抗体次库,经侵染E.coli TG1宿主菌后即可用于次级库扩增和投入下一轮富集淘筛。按照上述步骤再进行3轮Bt Cry1C蛋白抗独特型噬菌体展示单链抗体的富集淘筛过程,上一轮富集库经扩增后用于投入下一轮富集淘筛,包被的Bt Cry1C多克隆抗体蛋白浓度分别递减为50、25和10 μg/mL。各轮次富集淘筛效果参照Zhang等[13]报道的多克隆噬菌体ELISA法和库噬菌体投入/产出比法进行分析。
1.2.3 Bt Cry1C蛋白抗独特型噬菌体展示单链抗体分离与鉴定 将最后一轮富集的噬菌体单链抗体库溶液加入到处于对数生长期的E.coli TG1中并于37℃水浴锅中孵育1 h,随即将菌液涂布到TYEAG固体培养基(含终浓度为100 μg/mL的氨苄青霉素和1%的葡萄糖)上,置于37℃培养箱中培养过夜。次日,随机挑取单菌落接种到每孔含有100 μL 2×TY-AG培养基的96孔板中并于37℃培养箱中培养过夜。次日每孔取2 μL菌液转接到新的每孔含有100 μL 2×TY-AG培养基的96孔板中,经37℃水浴锅中孵育2 h,接着向每孔菌液中加入25 μL滴度为1×1012CFU /mL的KM13辅助噬菌体,然后转移到30℃水浴锅中孵育2 h。随即以1 800× g离心10 min,弃掉上清液,每孔沉淀的菌种以150 μL 2×TY-AK培养基重悬,并置于30℃培养箱培养过夜,再以1 800×g离心30 min,上清液即含有与单菌落对应的扩增的噬菌体展示抗体颗粒。各孔上清液中抗独特型噬菌体展示单链抗体与Bt Cry1C蛋白多克隆抗体的结合活性参照Xu等[14]报道的单克隆噬菌体ELISA法和PCR扩增及序列分析进行鉴定。
1.2.4 Bt Cry1C蛋白抗独特型噬菌体展示单链抗体分型鉴定 取经鉴定为阳性的Bt Cry1C蛋白抗独特型噬菌体展示单链抗体单菌落培养物按1.2.1方法进行扩增并将滴度定量到1010CFU/mL备用。
①抗体间接竞争ELISA法(IC-ELISA)。取96孔板,每孔加入100 μL浓度为2 μg/mL 的Bt Cry1C蛋白溶液并于4℃静置过夜。次日以PBST溶液洗板后,然后以MPBS溶液封闭2 h。洗板后,加入50 μL浓度为10 μg/mL的Bt Cry1C多克隆抗体蛋白溶液和系列体积梯度(0、5、10、20、30、40、50 μL)的上述扩增的Bt Cry1C蛋白抗独特型噬菌体展示单链抗体溶液混合物并于37℃培养箱孵育2 h。洗板后,每孔加入100 μL羊抗兔IgG[HRP]单克隆抗体稀释溶液(母液以PBS溶液按1∶5 000稀释)并于37℃水浴锅中孵育1 h。洗板后,每孔加入100 μL TMB显色液并于37℃培养箱中避光反应15 min,随即每孔加入50 μL 2 mol/L的H2SO4溶液终止反应,最后测定OD450值。对照组为50 μL浓度为10 μg/mL的Bt Cry1C多克隆抗体蛋白溶液和系列体积梯度(0、5、10、20、30、40、50 μL)与Bt Cry1C蛋白不相关的抗独特型单链抗体混合物。
②受体间接竞争ELISA法(IC-ELISA)。取96孔板,每孔加入100 μL浓度为5 μg/mL 的小菜蛾BBMV(稻纵卷叶螟BBMV)蛋白溶液并于4℃静置过夜。按上述步骤进行“洗板-封闭-再洗板”过程,接着加入50 μL浓度为2 μg/mL的Bt Cry1C蛋白溶液和系列体积梯度(0、5、10、20、30、40、50 μL)的上述扩增的Bt Cry1C蛋白抗独特型噬菌体展示单链抗体溶液混合物并于37℃培养箱孵育2 h。洗板后,每孔加入100 μL浓度为10 μg/mL的Bt Cry1C多克隆抗体蛋白溶液并于37℃培养箱中孵育2 h。按上述步骤进行“洗板-封闭-洗板-加羊抗兔IgG[HRP]-再洗板-显色-终止-测OD450值”。对照组为50 μL浓度为2 μg/mL的Bt Cry1C蛋白溶液和系列体积梯度(0、5、10、20、30、40、50 μL)与Bt Cry1C蛋白不相关的抗独特型单链抗体混合物。
1.2.5 靶标蛋白对Bt Cry1C蛋白抗独特型噬菌体展示单链抗体的抑制活性测定 采用间接竞争ELISA法(IC-ELISA)测定Bt Cry1C蛋白多克隆抗体(Bt Cry1C pAbs)、稻纵卷叶螟BBMV和小菜蛾BBMV对经鉴定为Bt Cry1C蛋白β类型抗独特型噬菌体展示单链抗体(命名为E8-Anti-Id scFv)的抑制活性。取96孔板,每孔加入100 μL浓度为10 μg/mL 的Bt Cry1C蛋白多克隆抗体溶液并于4℃静置过夜。次日将96孔板按1.2.4描述步骤进行“洗板-封闭-再洗板”过程,然后加入50 μL滴度定量为1010CFU /mL的E8-Anti-Id scFv溶液和50 μL系列浓度梯度(0.1、0.5、1、2、4、8、10、100 μg/mL)的靶标蛋白(Bt Cry1C pAbs、C.medinalis BBMV、P.xylostella BBMV)溶液并于37℃培养箱中孵育2 h。洗板后,每孔加入100 μL anti-M13[HRP]单克隆抗体稀释溶液(1∶3 000稀释)并于37℃水浴锅中孵育2 h。洗板后,按照1.2.4描述步骤进行“显色-终止-测OD450值”过程。以[(P-S-N)]/(P-N)]×100%计算公式绘制上述3种供试靶标蛋白对E8-Anti-Id scFv的标准曲线图。其中P代表阳性对照的OD450值(测试样品为50 μL滴度定量为1010CFU/mL的E8-Anti-Id scFv溶液+50 μL PBS溶液),S代表各标准的OD450值(测试样品为50 μL滴度定量为1010PFU的E8-Anti-Id scFv溶液和50 μL系列浓度梯度的靶标蛋白溶液),N代表阴性对照的OD450值(测试样品为50 μL PBS溶液)。
1.2.6 Bt Cry1C蛋白抗独特型噬菌体展示单链抗体抗虫活性测定 采用制剂浸叶法测定Bt Cry1C蛋白抗独特型噬菌体展示单链抗体抗(E8-Anti-Id scFv)对稻纵卷叶螟和小菜蛾的杀虫活性。供试的E8-Anti-Id scFv样品为溶于PBS溶液中的噬菌体展示单链抗体(滴度为1.2×108CFU/mL),阳性对照为溶于PBS溶液中的Bt Cry1C蛋白(浓度为20 μg/mL),阴性对照为PBS溶液。取新鲜水稻叶片和甘蓝叶片分别投入到上述3种供试的样品中浸渍15 min,取出叶片晾干,然后分别置于培养皿中。挑取处于三龄幼虫阶段的稻纵卷叶螟和小菜蛾,按每个培养皿20头的虫子数分别投入到经过浸药处理的水稻叶片和甘蓝叶片上进行生测饲养实验。每24 h记录一次培养皿中供试虫子的状态,每个处理组重复3次实验。供试虫子校正死亡率计算方法和误差分析均参照仲建锋等[15]报道方法执行。
2 结果
2.1 Bt Cry1C蛋白抗独特型噬菌体基因工程抗体富集
通过多轮 “投入-吸附-洗脱-扩增-再投入”过程,原始库中能与靶标抗原结合的噬菌体抗体即可被逐渐捕获并得到富集。如表1所示,以梯度浓度的Bt Cry1C蛋白多克隆抗体为包被抗原,将各轮次投入库滴度定量在1010CFU /mL的同等水平条件下,经过4轮次的富集淘筛过程,最后一轮产出的噬菌体滴度由第一轮的3.32×106CFU /mL逐渐上升到了3.12×109CFU/mL,投入产出比提高了近750倍。进一步采用多克隆噬菌体ELISA法测定各轮次富集的噬菌体展示抗体颗粒与Bt Cry1C蛋白多克隆抗体的结合活性,结果如图1所示,各轮富集后的噬菌体展示抗体对Bt Cry1C蛋白多克隆抗体的ELISA结合活性的平均值分别为0.316、0.541、0.649和0.716,而原始库为0.209。最后一轮富集库中的噬菌体多克隆抗体颗粒对Bt Cry1C蛋白多克隆抗体的ELISA结合活性较原始库提高了近3.4倍。两种不同测定方法均显示经过4轮次生物淘筛,原始库中能与Bt Cry1C蛋白多克隆抗体结合的噬菌体展示抗体颗粒(即含Bt Cry1C蛋白抗独特型噬菌体基因工程抗体)得到了有效富集,这为下一步靶标单克隆噬菌体抗体高效筛选创造了条件。

表1 各轮次生物淘筛过程中噬菌体颗粒的投入和产出Table 1 Input and output of phage particles in each round of biopanning

图1 各轮次富集噬菌体颗粒对Bt Cry1C蛋白多克隆抗体的多克隆噬菌体ELISA Fig. 1 Polyclonal phage ELISA of each round of enriched library phage particles for Bt Cry1C pAbs(Polyclonal antibodies)
2.2 阳性Bt Cry1C蛋白抗独特型基因工程抗体筛选与鉴定
以阳性反应OD450值/阴性反应OD450值(P/N)>2.1为阳性克隆的判定标准,如图2所示,从第4轮富集库中共淘筛获得了9个阳性克隆。其中ELISA值最高的是编号为E8的阳性克隆(命名为E8-Anti-Id scFv),OD450值达到0.968,阴性为0.118,P/N值=8.2。采用特异性PCR扩增分析,结果显示,上述9个阳性克隆均含有与人源化单链抗体基因大小相符的目的条带(图3)。经过测序及其核酸比对,均存在典型人源特征的4个重链骨架区(H-FR1-4)、3个重链可变区(H-CDR1-3)和4个轻链骨架区(H-FR1-4)、3个轻链可变区(H-CDR1-3)(图4)。由此确证,阳性Bt Cry1C毒素抗独特型人源单链抗体获得成功筛选,可供后续进一步抗体特性和生物活性分析。
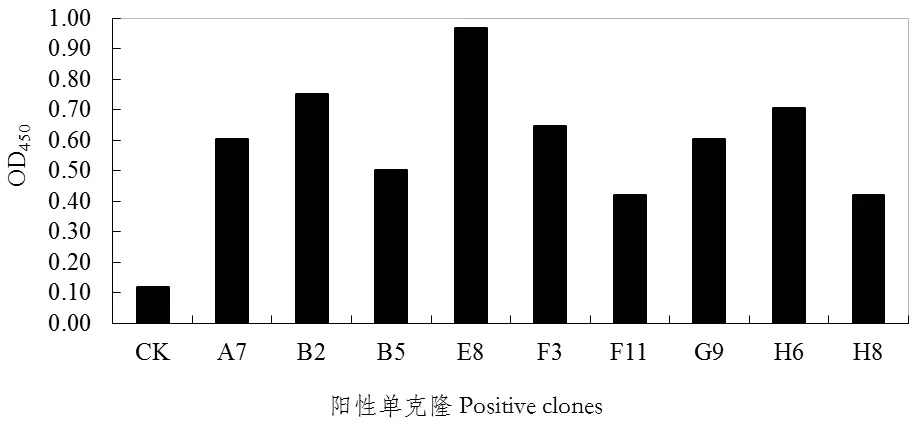
图2 阳性克隆对Bt Cry1C蛋白多克隆抗体的单克隆噬菌体ELISA Fig. 2 Monoclonal phage ELISA of positive clones for Bt Cry1C pAbs

图3 阳性单克隆人源单链抗体基因PCR扩增产物Fig. 3 PCR amplified products of positive monoclonal human scFvs genes
图4 阳性单克隆人源单链抗体基因对应氨基酸序列比对Fig. 4 Amino acid sequences aligment of positive monoclonal human scFvs genes
2.3 Bt Cry1C蛋白抗独特型噬菌体基因工程抗体分型及其靶标蛋白结合能力
如图5-A所示,以Bt Cry1C蛋白作为固相包被原,供试的Bt Cry1C蛋白抗独特型噬菌体基因工程抗体(E8-Anti-Id scFv)能明显竞争Bt Cry1C蛋白多克隆抗体与Bt Cry1C蛋白结合,而对照组中Bt Cry1C蛋白不相关的抗独特型单链抗体则没有表现出任何抑制活性。与此同时,分别以Bt Cry1C蛋白靶标受体稻纵卷叶螟BBMV(图5-B)和小菜蛾BBMV(图5-C)作为固相包被原,供试的E8-Anti-Id scFv能明显竞争Bt Cry1C蛋白与其靶标受体稻纵卷叶螟BBMV和小菜蛾BBMV结合,而对照组中Bt Cry1C蛋白不相关的抗独特型单链抗体对这两种受体均没有表现出任何抑制活性。由此证实供试的E8-Anti-Id scFv确实属于β类型抗独特型抗体,具备模拟Bt Cry1C蛋白部分结构或生物活性特性。采用间接竞争ELISA法(图6),测得E8-Anti-Id scFv靶标蛋白Bt Cry1C蛋白多克隆抗体、小菜蛾BBMV和稻纵卷叶螟BBMV对其抑制中浓度(IC50)分别为2.625、3.638和4.605 μg/mL,符合高结合活性特征。

图5 基于间接竞争ELISA法的E8-Anti-Id scFv分型测定Fig. 5 Determination of the type of E8 -Anti-Id scFv based on IC-ELISA

图6 基于间接竞争ELISA法的E8-Anti-Id scFv竞争抑制率测定Fig. 6 Determination of the competitive inhibition of E8 -Anti-Id scFv based on IC-ELISA
2.4 Bt Cry1C蛋白抗独特型噬菌体基因工程抗体室内生测
稻纵卷叶螟和小菜蛾分别以PBS溶液(CK-)、Bt Cry1C蛋白溶液(CK+)和Bt Cry1C蛋白抗独特型噬菌体基因工程抗体(E8-Anti-Id scFv)溶液浸渍处理过后的水稻叶片和甘蓝叶片为食,饲养效果如图7所示,CK-组饲养的虫子生长状态正常,CK+组饲养的虫子发生大量死亡现象,而以E8-Anti-Id scFv溶液处理的虫子同样出现死亡现象,但死亡量均达不到CK+组程度。经多组实验科学测算(表2),以滴度为1.2×108CFU /mL浓度条件下的噬菌体展示形式的E8-Anti-Id scFv溶液处理后的水稻叶片为食,稻纵卷叶螟在24 h、48 h和72 h内的校正死亡率为29.83%、44.32%和52.82%,其中72 h内对稻纵卷叶螟的杀虫活性达到供试浓度为20 μg/mL的原Bt Cry1C蛋白(校正死亡率为72.15%)溶液的73.21%;而以同样滴度浓度条件下的噬菌体展示形式的E8-Anti-Id scFv溶液处理后的甘蓝叶片为食,小菜蛾在24 h、48 h和72 h内的校正死亡率为26.38%、48.99%和58.69%,其中72 h内对小菜蛾的杀虫活性达到供试浓度为20 μg/mL的原Bt Cry1C蛋白(校正死亡率为75.36%)溶液的77.87%。由此说明,采用抗独特型抗体技术靶向制备的Bt Cry1C蛋白抗独特型噬菌体基因工程抗体(E8-Anti-Id scFv)在一定程度上具备模拟Bt Cry1C蛋白部分结构和生物学活性的功能。
表2 E8-Anti-Id scFv对小菜蛾和稻纵卷叶螟室内杀虫活性Table 2 Insecticidal activities of E8-Anti-Id scFv to C. medinalis and P. xylostella indoor

图7 E8-Anti-Id scFv在48 h内对稻纵卷叶螟和小菜蛾室内杀虫效果Fig. 7 Insecticidal effects of E8-Anti-Id scFv to C. medinalis and P. xylostella at 48 h indoor
3 讨论
英国剑桥大学构建的人源化噬菌体展示单链抗体库是目前商品化应用较为广泛的大容量优质基因工程抗体库源材料,应用范围已涉及生物医药和分子诊断以及农业危害物免疫检测等领域[16-18]。研究选取该库作为优质库源材料,一方面寄希望于该库的大容量和多样性为富集淘筛获得到Bt Cry1C蛋白抗独特型抗体,特别是捕获β类型的具备模拟Bt Cry1C蛋白抗虫功能的抗独特型基因工程抗体提供了更大的可能性;另一方也希望得利于该库单链抗体的人源化属性特征,从中淘筛获得的可模拟Bt Cry1C蛋白抗虫功能的抗体材料在后期应用上对人类更为安全,因为人源化抗体理论上对人体免疫系统几乎不存在异源免疫排斥反应。
商品化的噬菌体抗体库主要优势在于可供筛选的对象广,只要库容量足够大,多样性足够丰富,理论上就可以适用于所有抗原特异性抗体的筛选,这也意味着能成功筛选到靶标抗体的难度会很大、效率也会较低。从实验结果来看,通过4轮富集淘筛,在大规模分离单克隆和高通量分析过后,只获得9个具备Bt Cry1C蛋白抗独特型抗体特征的阳性克隆,且仅有1个阳性克隆符合β类型,这也从侧面印证了商品化抗体库的不足之处。因此,为了更为精准地靶向淘筛具有模拟抗原结构和生物活性的抗独特型抗体,优化库源材料和筛选策略极为必要。从库源材料来看,以抗原的抗体为免疫原,通过免疫动物然后构建抗原偏向性免疫噬菌体抗体库作为库源材料,这样相当于借助动物机体免疫反应在动物体内进行了靶标抗独特型抗体及其基因的富集,这样的库再投入淘筛过程,在筛选概率和效率上显然较非免疫的随机库要更高,这种策略在免疫检测用抗体筛选上已有报道可供借鉴[19]。从筛选策略来看,贯穿富集筛选整个过程的各个步骤都可能影响筛选效率。首先固相包被的抗体材料,通过酶切方式将非抗原结合片段去掉,以F(ab)2活性片段作为包被靶点,使抗独特型抗体更容易被捕获,可以提高富集筛选效率[20];其次富集筛选和鉴定过程中的蛋白封闭液,通过交替使用不同类型的蛋白封闭液,能极大减少库中非靶标抗体残留,从而有效的将靶标抗体捕获,进而提高阳性率[21]。
研究中靶向淘筛获得的具有模拟Bt Cry1C蛋白抗虫功能的噬菌体展示形式的抗独特型噬菌体基因工程抗体(E8-Anti-Id scFv),在噬菌体滴度为1.2×108CFU/mL浓度条件下,对供试的水稻常见靶标害虫稻纵卷叶螟和叶菜类常见靶标害虫小菜蛾展示出较为明显的杀虫活性,初步具备进一步研究的价值和深入挖掘应用的潜力。但其对供试的两种典型的靶标害虫致死率均低于60%,且抗虫活性只能达到浓度为20 μg/mL的原Bt Cry1C蛋白的75%左右,因此就目前呈现效果来看,该材料到可替代原Cry1C蛋白进行示范应用仍然可能存在很大差距。因供测试的E8-Anti-Id scFv是以噬菌体展示形式存在,其浓度只能采用噬菌体滴度进行初步定量,而供试的Cry1C是以其蛋白质量浓度进行定量的,两者定量方式不一样,因此两种供试的材料所呈现出的抗虫效果在各自浓度方式上并没有太直接的可比性,仅仅只是作为初步参照对比。就E8-Anti-Id scFv材料本身价值来说,还有待后续进一步深入研究,特别是有必要对该抗体材料进行克隆表达制备出具有稳定活性的纯单链抗体蛋白,以便用于分析其具体的抗虫谱、抗虫活性值以及与其他Bt Cry蛋白是否存在交互抗性等关键性评价指标。本研究采用抗独特型抗体创制路径,首次从人源化噬菌体展示抗体库中成功靶向淘筛得到了具备可初步模拟Cry1C蛋白抗虫功能的单链抗体材料,无论是技术路径还是抗虫材料本身都是极大的创新,为绿色生物农药创新发展提供了潜在可行的实例依据。此外,由于噬菌体展示形式的基因工程抗体因其表型与基因型一致,获得靶标抗体的同时也捕获了其对应基因[22],因此E8-Anti-Id scFv即便是存在抗虫活性不强的问题,在后续研究中仍然可以借助诸如定点饱和突变技术[15]、链置换技术[23]、易错PCR技术[24]等目前较为成熟的抗体体外亲和成熟技术在基因水平上对其进行定向改造,有望大幅度提高其杀虫活性,从而进一步推进其应用价值。
4 结论
基于抗独特型抗体理论和技术,成功获得了具备初步模拟Bt Cry1C蛋白抗虫功能的人源单链抗体,实现了靶向创制可模拟Bt Cry蛋白杀虫功能的新型抗体材料,可作为优质的抗虫基因工程抗体模板,为后续改造研究创造了可能。

