R2R3-MYB转录因子PnMYB1调控三七皂苷生物合成
雷君 陈勤 邓兵 张金渝 刘迪秋 崔秀明 葛锋
(1. 昆明理工大学生命科学与技术学院,昆明 650500;2. 云南省三七资源可持续利用重点实验室,昆明 650500; 3. 云南省农业科学院药用植物研究所,昆明 650205)
三 七[Panax notoginseng(Burk.)F. H. Chen]为五加科人参属药用植物,作为中国传统中药已有400多年的使用历史,其根、茎、花和剪口均可入药。三七具有止血、活血、化瘀、防治心血管疾病等药理作用[1],其主要活性成分为三萜皂苷,通过甲羟戊酸途径合成[2]。目前,已从三七中分离出70多种三萜皂苷,这些皂苷根据苷元结构可分为原人参二醇型和原人参三醇型。与同属的人参、西洋参不同,三七中主要含有的单体皂苷为人参皂苷R1、Re、Rb1、Rd和Rg1[3]。虽然三七皂苷具有很高的药用价值,但由于结构复杂,很难用化学方法合成。因此,研究三七皂苷的生物合成规律对利用合成生物学技术生产三七皂苷具有重要意义。
基因转录的完成是通过基因启动子区域与转录因子(DNA结合蛋白)来抑制或激活来共同实现[4]。转录因子包括两个结构域,分别是DNA结合域和蛋白质激活或抑制结构域,这两个结构域可以实现基因转录过程中的抑制或激活过程,基因表达功能的实现,植物次生代谢物的生物合成由转录因子 调控[5-6]。
根据结构域不同,真核生物中含有多生物学功能的MYB类别,MYB属于多类别转录因子中的一种,MYB结构域都存在于MYB类转录因子中。根据数量和重复结构,MYB可分为四类,分别为:4R-MYB亚类、R1R2R3-MYB亚类、R2R3-MYB亚类、MYB-related亚类,在植物体中普遍存在的是R2R3-MYB亚类[7]。随着对MYB转录因子研究的深入,越来越多的报道表明R2R3-MYB转录因子对植物体内萜类化合物的合成具有调控作用。如在云杉中过表达MYB类PtMYB14转录因子能够显著提高云杉中萜类物质的产量[8];在长春花中过表达CrBPF1转录因子基因能够提高长春花中吲哚生物碱和萜类物质生物合成的相关酶基因的转录水平,进而调控吲哚生物碱和萜类物质的生物合成[9];虎杖的PcMYB1转录因子对植物木质素合成具有负调控作用[10];灯盏花的EbMYB6转录因子对羟基肉桂酸代谢有一定的抑制作用[11]。这些研究表明,植物中的分MYB类转录因子可能广泛参与萜类次生代谢产物的合成调控。
为了探讨三七中MYB转录因子是否能够调控三萜皂苷的生物合成,本研究根据前期从三七中筛选获得与茉莉酸甲酯应答元件JERE cis-element响应的PnMYB1基因片段,利用RACE技术获得PnMYB1基因全长;构建过表达PnMYB1三七细胞系,研究PnMYB1与三七皂苷生物合成途径中重要关键酶基因的互作与表达调控,揭示PnMYB1对三七皂苷生物合成的调控机制,为建立高效调控三七皂苷生物合成策略提供了理论参考和依据。
1 材料与方法
1.1 材料
以本实验室保存的三七细胞为实验材料。大肠杆菌(Escherichia coli)感受态细胞购自生工生物科技有限公司(中国上海);pGEM-T克隆载体购自Promega公司;农杆菌EHA105感受态和植物表达载体pCAMBIA1300S载体为本实验室所保存。T4 DNA连接酶和各种限制性内切酶购自日本TaKaRa公司;三七总皂苷、人参皂苷R1、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Re和人参皂苷Rd标准品购自国家药物和生物制品控制研究所(中国北京);所使用的所有其他化学品均购自生工生物科技有限公司(中国上海)。胶回收试剂盒和质粒抽提试剂盒购自生工生物科技有限公司(中国上海);NucleoTrap® mRNA Mini kits和PCR Clean-Up Kit购于 德 国MACHEREY-NAGEL公 司;SMARTerTM RACE cDNA Amplification Kit购自美国Clontech公司。反转录试剂盒GoScriptTM Reverse Transcriptase System和GoTaq® qPCR Master Mix购自Promega公司;Universal GenomeWalker 2.0、NucleoSpin Gel and PCR Clean-Up购自TaKaRa。
主要仪器为:高效液相色谱仪(安捷伦1260),色谱柱GRACE VisionHT C18HL(250 mm×4.6 mm,5 μm)。本实验所用引物均委托上海生工生物工程有限公司合成,加入适量的 Nuclease-free ddH2O溶解引物,使得引物浓度为10 μmol/L。具体引物序列见表1、表2。

表1 实时荧光定量PCR的引物Table 1 Primers used for qRT-PCR

表2 启动子克隆的引物Table 2 Primers used for promoter clone
1.2 方法
1.2.1 RACE cDNA文库的制备及PnMYB1全长cDNA克隆 本研究采用改良的异硫氰酸胍法提取三七愈伤组织总RNA[12-13]。使用试剂盒Nucle-oTrap® mRNA Mini kits从三七总RNA中纯化分离获得三七poly(A)RNA。采用试剂盒SMARTerTMRACE cDNA Amplification Kit制备获得5'RACE-Ready cDNA。利用酵母单杂交系统获得了PnMYB1基因的3'端 序 列[14]。以RACE-Ready cDNA为 模 板,采用cDNA末端快速扩增(RACE)技术,获得了PnMYB1基因的5'端序列。利用上述克隆的末端序列设计引物,获得PnMYB1的全长cDNA。用特异性引物PnMYB1-BamH I-F(5'-GGATCCATGGGGAGG AGCCCTTGCTCTGC-3')和PnMYB1-EcoR I-R(5'-GAA TTCTCAAGACAGCCAATCTCCTCCGGAC-3')PCR扩增PnMYB1。将PnMYB1全长cDNA的PCR产物克隆连接到pGEM-T载体中进行测序。
1.2.2 序列特征与系统发育分析 氨基酸和核苷酸序列比较-BLAST;氨基酸序列相似性分析-DNAMAN;构建Neighbor-joining系统-MEGA 6.0。
1.2.3 PnMYB1植物表达载体的构建及植物转化 重组载体pGEM-T-PnMYB1。pCAMBIA1300S双酶切反应使用到EcoR I和BamH I两个酶切位点。连接这两个DNA片段,得到植物表达质粒pCAMBIA1300S-PnMYB1。
利用冻融法在根癌农杆菌EHA105感受态细胞中转入重组载体pCAMBIA1300S-PnMYB1[15]。将转化的农杆菌感受态细胞于28℃摇床,200 r/min振荡培养4 h,并涂布于LB固体培养基上(其中添加卡那霉素和利福平,终浓度分别为50 mg/L的和25 mg/L),于28℃培养箱倒置培养48 h。筛选出的阳性单菌落接种于含有上述相同抗生素的LB液体培养基中,振荡培养至OD600至0.6-0.8,离心收集菌体。然后用MGL液体培养基(其中添加乙酰丁香酮,终浓度为40 mg/L)重悬菌体,振荡培养至OD600至0.6-0.8,接入野生型三七细胞,使三七细胞完全浸没于菌液中,于25℃摇床,120 r/min共培养20 min后,将细胞转移到的MS固体培养基中(其培养基中添加40 mg/L乙酰丁香酮),25℃下培养3 d,然后转入含400 mg/L头孢霉素的MS固体培养基上培养15 d。除菌培养后,将三七愈伤细胞转接至三七筛选培养基(其中添加卡那霉素和潮霉素B,终浓度分别为50 mg/L的和25 mg/L),约45 d左右继代一次,经过4-5次的筛选,可获得过表达PnMYB1基因三七细胞系。
1.2.4 利用PCR技术鉴定转基因细胞系 用十六烷基三甲基溴化铵(CTAB)法从愈伤组织中提取基因组DNA,用PCR方法鉴定hpt II(正向引物为5'-GAAGTGCTTGACATTGGGGA AT-3',反向引物为5'-AGATGTTGGCGACCTCGTATT-3')基因片段。PCR扩增程序为:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,32个循环;72℃ 延伸90 s,16℃保温。1.2%的琼脂糖凝胶电泳检测PCR产物,并将PCR产物送测序。比对测序结果和载体上的抗性基因的序列。
1.2.5 实时荧光定量PCR(qRT-PCR)检测 提取过表达PnMYB1基因三七细胞系和未转PnMYB1基因的三七细胞株系总RNA,利用试剂盒GoScriptTMReverse Transcriptase System 反转录成cDNA。获得的cDNA作为qRT-PCR的模板,使用表1中引物用以检测鲨烯合成酶(PnSS)、鲨烯环氧酶(PnSE)、达玛烯二醇合成酶(PnDS)、环阿屯醇合成酶(PnCAS)和PnMYB1的基因表达水平,选取GADPH作为内参基因。根据试剂盒GoTaq® qPCR Master Mix说明书进行操作,qRT-PCR反应扩增程序为:95℃ 2 min;95℃ 15 s,55℃ 30 s,72℃ 30 s,循环40次。采用2-ΔΔCT方法对实验数据进行处理并分析结果[16]。
1.2.6 三萜皂苷的定量分析 收集过表达PnMYB1基因三七细胞和未转PnMYB1基因的三七细胞,烘干至恒重,并研磨成粉末。取约0.5 g粉末加入50 mL 70%甲醇的试管中浸泡过夜,超声处理1.5-2.0 h。离心收集上清液,挥发干溶剂。用10 mL蒸馏水溶解挥发干溶剂后的残余物,再用10 mL水饱和正丁醇萃取3次。将萃取液收集干燥,用70%甲醇溶解至25 mL。最后,根据标准曲线(y=35.2527x+0.21149,R2=0.9993)计算出各样品中三七总皂苷的含量,其中x为样品在550 nm处的吸光度,y为三七总皂苷的含量(%,W/W)。
用高效液相色谱法(HPLC)对过表达PnMYB1基因和未转PnMYB1基因三七细胞中主要单体皂苷进行检测。色谱条件为:流动相为乙腈(A)/水(B),流速为1.0 mL/min,柱温为30℃,检测波长203 nm,采用乙腈(A)/水(B)进行梯度洗脱:0-20 min,20%的A和80%的B;20-45 min,46%的A和54%的B;45-60 min,55%的A和45%的B;60-75 min,100%的A。通过将峰面积和保留时间与标准曲线进行比较(表3),对每个单体皂苷进行了鉴定和定量分析。

表3 五种重要单体皂苷线性回归方程Table 3 Linear regression equations for five major monomer saponins
1.2.7 染色体步移法克隆启动子 采用CTAB法提取三七基因组DNA,用RNase A消化处理,得到符合染色体步移条件的三七基因组DNA。然后将DNA分成5段,分别用限制性内切酶Dra Ⅰ、EcoR V、Pvu II和Stu Ⅰ酶切。试剂盒NucleoSpin Gel and PCR Clean-Up说明书表明:纯化酶切产物后,利用T4 DNA连接酶将GenomeWalker Adaptors与纯化产物进行连接。最后,设计PnCAS、PnDS和PnSS基因的特异性引物(表2),根据试剂盒Universal GenomeWalker 2.0的使用手册进行两轮PCR扩增,获得启动子序列。
1.2.8 GUS活性分析 为了阐明PnMYB1能否与三七皂苷生物合成关键酶的基因启动子相互作用,将部分启动子与GUS报告基因融合,构建了PBI 121-PnDSP1、PBI 121-PnCASP1、PBI 121-PnSSP1和PBI 121-PnSEP1表达载体,并转化烟草,最后对烟叶中的GUS活性进行定量分析。利用GUS终止反应液将1 mmol/L 的4-MU溶液稀释成50 nmol/L,100 nmol/L,200 nmol/L,400 nmol/L,500 nmol/L和1 000 nmol/L浓度梯度的4-MU溶液。然后以GUS终止反应液为对照,利用荧光分光光度计在激发光波长为365 nm,发射光波长为455 nm的条件下测定各浓度4-MU溶液的荧光值,从而得到4-MU浓度和荧光值的标准曲线。以牛血清白蛋白为标准,用Protein Assay kit测定蛋白质含量。
2 结果
2.1 PnMYB1转录因子属于R2R3-MYB转录因子 家族
根据酵母单杂交筛选获得的PnMYB1基因部分3'末端序列,并通过SMART RACE策略获得PnMYB1的cDNA。结果表明,PnMYB1基因全长1 014 bp,开放阅读框、编码氨基酸、分子量、等电点的量值分别为723 bp、240、27.36 kD、PI 8.99。与其他植物R2R3-MYB类转录因子的氨基酸序列比较,PnMYB1与 桉 树EgMYB1(CAE09058.1)、玉米ZmMYB3(NP_001105949.1)、丹 参SmMYB39(KC213793)、柳枝稷PvMYB4d(AEM17351.1)有较高的相似性(图1),表明从三七中克隆获得的PnMYB1转录因子基因可能属于R2R3-MYB转录因子家族。

图1 氨基酸序列比对Fig. 1 Amino acid sequence alignment
为分析PnMYB1与其它植物的MYB转录因子基因的系统进化关系,本实验分析了PnMYB1与其它植物的17个MYB转录因子的系统进化关系,采用Neighbor-joining方法构建了他们的氨基酸序列系统进化树(图2)。系统进化树分析表明,所有转录因子分为四大类,分别代表MYB转录因子的4个亚家族:4R-MYB、R1R2R3-MYB、R2R3-MYB和MYBrelatd。PnMYB1转录因子蛋白与R2R3-MYB类蛋白聚为一支,且其序列与胡萝卜DcMYB5的相似性最高,进一步说明PnMYB1属于R2R3-MYB类转录因子。已有报道表明,一些关于R2R3-MYB类转录因子在植物次生代谢物的合成调控起关键作用,如胡萝卜中DcMYB5转录因子可以有效调控花青素的生物合成[17];苹果中MdMYB12转录因子调控花青素和黄酮醇的合成[18]。因此,本研究获得的PnMYB1转录因子有可能对三七皂苷的合成具有调控作用。
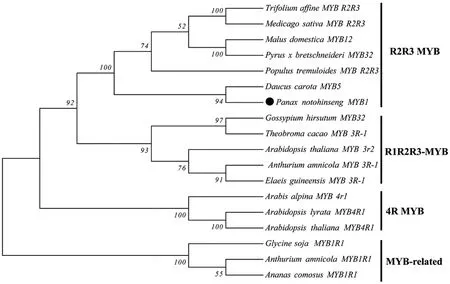
图2 PnMYB1系统进化树分析Fig. 2 Phylogenetic tree analysis of PnMYB1
2.2 转基因细胞中相关基因的表达分析
获得了过表达PnMYB1的转基因三七细胞系。PnMYB1在转基因细胞系(T1-T6)中的表达水平高于非转基因细胞系(WT)。其中T5细胞系中,PnMYB1的表达量增加了2倍(图3-E)。此外,由于PnFPS、PnSE、PnDS、PnSS和PnCAS基因均为三七皂苷生物合成的关键酶基因,因此它们的基因表达水平的上调对三七皂苷的合成具有调控作用。与非转基因细胞系(WT)转基因细胞系中PnFPS、PnDS和PnSE的表达水平显著升高。然而,PnSS (图3-D)和PnCAS(图3-F)的表达水平没有受到明显的影响。这些结果表明,PnMYB1转录因子在三七细胞中的过表达可以调节与皂苷生物合成相关的一些关键基因的表达。

图3 三七细胞系T1-T6的PnFPS(A)、PnDS(B)、PnSE(C)、PnSS(D)、PnMYB1(E)和PnCAS(F)基因相对表达量Fig. 3 Relative expressions of gene PnFPS(A),PnDS(B),PnSE(C),PnSS(D),PnMYB1(E)and PnCAS(F)in the T1-T6 cell lines of P. notoginseng
2.3 PnMYB1促进了三七皂苷的生物合成
为了确定PnMYB1在细胞中的过表达是否会影响三萜皂苷的生物合成,进行了三萜皂苷的含量分析。结果表明,6株转PnMYB1三七细胞系的总皂苷含量都得到了显著性提高,T1、T2、T3、T4、T5和T6的皂苷含量分别为未转基因三七细胞的1.38、1.39、1.73、1.45、1.37和1.53倍(图4)。采用高效液相色谱法(HPLC),对转基因三七细胞中单体皂苷R1、Rg1、Re、Rb1和Rd含量进行测定(图5)。PnMYB1高表达细胞系中5种单体皂苷的含量均高于非转基因细胞系。其中T3株系中Re含量最高,高达25.3 mg/g(图6-C)。T3细胞系中的单体皂苷R1(图6-A)、Re(图6-C)、Rb1(图6-D)和 Rd(图6-E)的含量为所有细胞株系中最高。PnMYB1转基因细胞系中Rg1的平均含量约为非转基因细胞系的1.47倍(图4)。在本研究中,PnMYB1转基因细胞中Rd含量的增加最为显著,这表明过表达PnMYB1不仅会影响三七总皂苷的生物合成,而且会改变三七中单体皂苷的比例。
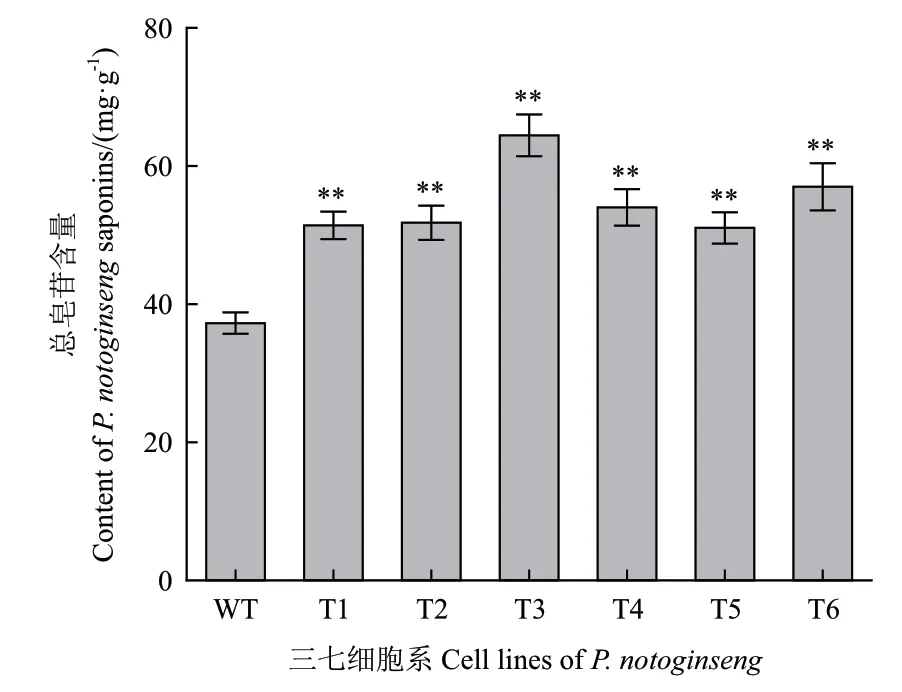
图4 三七细胞系总皂苷含量Fig. 4 Content of total saponins in the cell lines of P. notoginseng

图5 转PnMYB1三七细胞系的HPLC分析Fig. 5 HPLC analysis of transformed PnMYB1 P. notoginseng cell line

图6 三七细胞系T1-T6单体皂苷R1(A)、Rg1(B)、Re(C)、Rb1(D)和Rd(E)含量Fig. 6 Contents of monomer saponins R1(A),Rg1(B),Re(C),Rb1(D)and Rd(E)in T1-T6 transgenic cell lines of P. notoginseng
上述结果表明,PnMYB1在三七细胞中过表达可以促进三七皂苷的生物合成。但PnMYB1是转录因子基因,并不直接参与皂苷的生物合成,为了进一步明确PnMYB1促进皂苷合成的机制,接下来将探讨PnMYB1是否通过调节直接参与皂苷生物合成的关键酶基因的表达来间接实现对皂苷合成的调控。
2.4 PnMYB1能够与皂苷生物合成途径关键酶基因启动子相互作用
根据图3的结果,两个关键酶(PnDS和PnSE)的基因表达水平随着PnMYB1的过表达而增加,而另外两个基因(PnSS和PnCAS)的表达没有明显变化。PnDS和PnSE是三萜皂苷生物合成的关键酶。在过表达PnMYB1的三七细胞中,三萜皂苷含量的增加可能是由于PnDS和PnSE表达水平升高所致。
本研究对单独转染不同启动子的烟叶和不同启动子与PnMYB1共转染的烟叶的荧光值进行了分析,以定量测定GUS活性。结果表明,与单独转染PnCAS或PnSS启动子的烟叶相比,共转染PnMYB1和启动子的烟叶GUS活性没有显著变化(图7),说明PnMYB1不能与PnCAS和PnSS启动子相互作用。然而,共转染PnMYB1和PnSE启动子的烟叶表现出比单独转染PnSE启动子的烟叶更高的GUS活性(图7)。将PnDS启动子和PnMYB1共转染烟草叶片也得到了相似的结果(图7)。说明 PnMYB1转录因子可以与PnDS和PnSE的启动子相互作用,PnMYB1转录因子可能通过作用于PnDS和PnSE基因的启动子来调节PnDS和PnSE基因的表达,进而间接实现对三七皂苷生物合成的调控。

图7 GUS荧光活性分析Fig. 7 GUS fluorescence activity analysis
3 讨论
MYB类转录因子在调节次生代谢产物生物合成和响应非生物胁迫方面具有重要作用[19-20]。目前已从非洲菊[21]、葡萄[22]、红掌[23]等不同物种中分离和鉴定了多个MYB转录因子。本研究从三七中克隆得到PnMYB1,对其保守结构域的预测和分析表明,PnMYB1转录因子中含有两个保守的MYBDNA-Binding结构域,表明PnMYB1转录因子可能属于R2R3-MYB家族。PnMYB1转录因子与来自其他不同物种的R2R3-MYB家族的多重序列比对表明三七R2R3-MYB转录因子的保守结构域可能参与次生代谢过程的调节[24]。此外,系统进化树分析表明,PnMYB1与胡萝卜中的DcMYB5具有高度相似性,与R2R3-MYB类蛋白聚为一支。这些结果进一步说明PnMYB1属于R2R3-MYB类转录因子。
有报道称可通过人参皂苷生物合成关键酶基因在人参属植物中过表达,从而增加人参皂苷的积累,例如,过表达鲨烯合成酶可以增加人参中人参皂苷和植物甾醇的含量[25]。我们的前期研究证实,在三七中同时过表达3-羟基-3-甲基-戊二酰基辅酶A还原酶(PnHMGR)和PnSS基因或过表达法尼基焦磷酸合成酶(PnFPS)基因可以促进三萜皂苷的生物合成[26]。这些已有报道大多通过直接调控合成途径中关键酶基因的表达来调节次生代谢过程。近年来,随着人们对次生代谢途径及其调控机制的进一步认识,基于转录因子的代谢工程已成为提高目标代谢物合成量的有效方法。本研究成功地揭示了PnMYB1转录因子对三七皂苷生物合成的调控作用。
R2R3-MYB转录因子通常作用于功能相关的几个基因,以此调节所涉及代谢途径的多个步骤[27]。转录因子具有对次生代谢物生物合成途径“多点调控”的优势,比直接调控单个关键酶基因表达更加有效,同时避免了导入多个关键酶基因可能导致细胞组成型致死的后果,这意味着转录因子可以更高效地控制代谢途径。PnDS、PnSS和PnSE是三七皂苷生物合成的的关键酶基因;PnCAS是植物甾醇生物合成的关键酶基因,与PnDS具有共享前体2,3-氧化鲨烯,因此PnCAS可能成为间接参与调节三七皂苷生物合成的关键基因。在本研究中,随着PnMYB1基因的过表达,PnFPS、PnDS、PnSE的表达水平显著升高,而PnSS和PnCAS的表达水平几乎不变,关键酶基因表达水平的提高促进了皂苷的生物合成。三七中的主要单体皂苷具有重要的药理活性,如降血糖活性(Rg1)、抗氧化活性(Re)[28]、治疗心脑血管疾病(Rd)、抗肿瘤活性(Rg3)和神经保护活性(Rb1)[29-30]。本研究表明,与野生型相比,转基因细胞中5种主要单体皂苷(R1、Rg1、Re、Rb1和Rd)的含量均有提高,但增加的程度各不相同。目前,我们已知PnMYB1可以通过调控三七皂苷骨架形成的关键酶基因表达来影响皂苷的合成,在三萜骨架形成后,经不同种类的三萜皂苷骨架修饰酶(细胞色素P450、糖基转移酶)进行骨架修饰,合成原人参二醇型和原人参三醇型单体皂苷,包括R1、Rg1、Re、Rb1和Rd等。由于PnMYB1过表达后,各种单体皂苷的增加量明显不同,PnMYB1很可能对皂苷骨架修饰酶基因的表达也有一定调控作用,但由于细胞色素P450和糖基转移酶属超基因家族[31],数量众多,PnMYB1调控皂苷骨架修饰酶基因的研究有一定难度。下一步,我们将重点关注转录因子对三七皂苷骨架修饰相关的细胞色素P450和糖基转移酶基因的表达影响。
4 结论
本研究揭示了R2R3-MYB类转录因子PnMYB1对三七皂苷生物合成的调控作用。通过PnMYB1基因在三七细胞中过表达,促进了三七细胞中三七皂苷的生物合成,并进一步阐明PnMYB1通过与皂苷生物合成途径关键酶基因的启动子相互作用,提高皂苷合成关键酶基因的表达水平,进而促进三七皂苷的合成。

