草棉同源多倍体后代筛选及性状鉴定
杨亚杰 李昱樱 申状状 陈天 荣二花 吴玉香
(山西农业大学农学院,太谷 030801)
棉花是一种重要的经济作物,其优质高产对于我国国民经济具有重要意义。草棉和亚洲棉是二倍体栽培种,与陆地棉和海岛棉相比,草棉和亚洲棉种植面积较少,但草棉具有其它棉种所没有的优良性状,如极早熟性、高抗旱性和抗卷曲叶病毒等[1]。同时A1组的草棉和A2组的亚洲棉是世界上仅有的现存二倍体A染色体组棉种,在棉属异源四倍体棉种起源及供体种问题上,Wendel等[2]和Palmer等[3]认为A1是四倍体棉种A基因组的祖先供体种,但多年来普遍一致的看法是A1组的草棉和A2组的亚洲棉都可能是异源四倍体棉种A基因组的祖先供体种[4],最新研究表明所有现存的A基因组可能起源于一个共同的祖先A0,且异源四倍体的形成早于A1和A2的物种形成[5]。
同源多倍体指增加的染色体组来自同一物种,一般是由二倍体的染色体直接加倍产生的。同一物种经过染色体加倍形成的多倍体,称为同源多倍体。同源多倍体在植物界是比较常见的,如马铃薯是一个天然的同源四倍体[6],香蕉是天然的同源三倍体[7]。除了自然界天然存在的多倍体以外,人工诱导多倍体的产生也成为研究热点,如水稻[8]、南瓜[9]、油菜[10]等用化学药剂处理也获得了同源四倍体;三倍体西瓜[11]、葡萄[12]、柑橘[13]等都是采用人工的方法获得的。植物多倍体化具有增大组织器官、增强抗逆性、创造新种质等优点[14]。例如,Bhattarai等[15]诱导的四倍体非洲菊比二倍体具有更大的气孔和更宽、更厚的叶片,且四倍体的花冠变厚,舌状花变宽,花变大等;尚小红等[16]对二倍体及同源四倍体木薯进行干旱胁迫,结果表明四倍体木薯产生较强的抗氧化能力,并通过赤霉素(GA)、玉米素核苷(ZR)和脱落酸(ABA)的协同作用,可以延长四倍体叶片的功能期,从而比二倍体更抗旱;Yin等[17]对草棉和纳尔逊氏棉(G. nelsonii)利用远缘杂交和染色体加倍方法获得了异源四倍体新种质(A1A1G3G3),并进行了形态学、细胞学和流式细胞仪鉴定,且新种质可以与陆地棉杂交获得可育后代。
目前关于草棉同源多倍体的研究鲜有报道,本实验室前期以草棉为材料加倍诱变获得了同源多倍体草棉,本研究以草棉同源多倍体后代S1为材料,对其后代进行筛选,从流式细胞仪、形态学、细胞学和SRAP分子标记来进行鉴定,以期筛选出育性稳定且综合性状优良的草棉多倍体新种质用于生产和下一步遗传研究。
1 材料与方法
1.1 材料
本研究所用材料:二倍体红星草棉(A1A1,2n=2x=26),以及由实验室前期经过多倍体诱变所得的草棉同源多倍体后代S1。将材料于2020年5月同时种植于温室花盆中进行后期观察和鉴定。
1.2 方法
1.2.1 流式细胞仪测定 将二倍体草棉诱变后收获的种子(S1)进行播种,长成健康植株后进行流式细胞倍性鉴定,筛选出三倍体和四倍体草棉。分析步骤如下:(1)取0.5 cm2的嫩叶切碎,放于培养皿中,加入400 μL裂解液用于提取完整细胞核,静置10 s。(2)用30 μm微孔过滤膜将其过滤至样品管中。(3)向样品管中加入染液1 600 μL,染色约10 s。(4)上机测试(CyFlow Space,Sysmex Partec)。
1.2.2 形态性状鉴定 对经过流式细胞倍性鉴定的草棉同源多倍体植株与亲本二倍体草棉分别进行长势和形态观察,包括植株、叶片和花等形态性状,并进行拍照。在棉花整体进入蕾期后,从不同倍性棉花相同节位处选择无病虫害且生长健康的完全展开叶片进行观察和测量分析,包括形状、大小、颜色和厚度等性状。在开花期,将草棉三倍体和四倍体完全展开的花与二倍体进行比较分析,包括苞叶、花萼、花瓣、柱头、花药等相关性状,比较分析其差异性,从形态学角度鉴定不同倍性草棉的差异。
1.2.3 细胞学观察
1.2.3.1 气孔保卫细胞和叶绿体数测定 取新鲜棉花叶片洗净,切取主叶脉周围1 cm×1 cm大小叶片浸于卡诺氏固定液(无水乙醇∶冰乙酸=3∶1)中脱色10 h以上;将脱色后的叶片用蒸馏水清洗几次,取约2 mm×2 mm大小置于载玻片上,下表皮朝上,滴2滴1%的I2-KI溶液染色2-5 min,之后盖上盖玻片;在显微镜10×40倍下统计气孔密度,取10个视野作为重复;在显微镜10×100倍的视野下,测量气孔长度和统计叶绿体数,取30个气孔作为重复。
1.2.3.2 花粉母细胞减数分裂及花粉粒统计 在不同倍性草棉开花期,取新鲜的长约3-5 mm的花蕾(或当天开放的花朵),用镊子剥去苞叶、花萼和花瓣,将4-6粒花药置于干净载玻片上,滴2滴改良卡宝品红染液,用解剖针尖部将花药轻轻压碎使花粉母细胞挤出,之后用镊子去除肉眼可见杂质,盖上盖玻片,用酒精灯微热,最后用滤纸覆盖染色区域,用拇指在其正上方垂直轻压盖玻片以吸去多余染液。在显微镜10×40倍下选取600个花粉母细胞进行减数分裂行为观察,并进行多分体和花粉粒统计。
1.2.4 SRAP分子标记鉴定 采用相关序列多态性(sequence-related amplified polymorphism,SRAP)分子标记进行同源多倍体草棉的多态性鉴定。利用博迈德生物提供的CTAB植物基因组DNA快速提取试剂盒,对选取的二、三、四倍体草棉新鲜幼嫩叶片提取DNA。SRAP-PCR反应体系共10 μL,包含5 μL的2×Taq PCR MasterMix(含染料),2 μL正向和反向引物(10 μmol/L),2 μL去离子水,1 μL模板DNA(50 ng/μL)。扩增程序为94℃预变性5 min;94℃变性45 s,35℃退火45 s,72℃延伸1 min,5个循环;94℃变性45 s,52℃退火45 s,72℃延伸1 min,35个循环;72℃延伸10 min;4℃保存。通过8%非变性聚丙烯酰胺凝胶电泳检测,之后进行银染和显影[18]。SRAP引物序列来自Li等[19]的文献,由生物工程股份有限公司合成,引物序列见表1。

表1 SRAP扩增引物Table1 SRAP amplification primers
1.2.5 数据分析 采用Excel软件进行数据处理和图表绘制,采用SPSS 23.0进行统计分析,各处理的比较采用最小显著差(LSD)法(α=0.05),图表中所用数据均为平均值±标准差。
2 结果
2.1 流式细胞仪鉴定结果
用流式细胞仪对9株材料进行倍性鉴定,提取叶片细胞的DNA含量进行分析。表2结果显示,二倍体对照的峰值在189左右,三倍体的峰值在284左右,四倍体的峰值在380左右。在所测9个材料中,结果表明有3株(材料2-4)为四倍体植株,5株(材料5-9)为三倍体植株,材料1为二倍体对照。
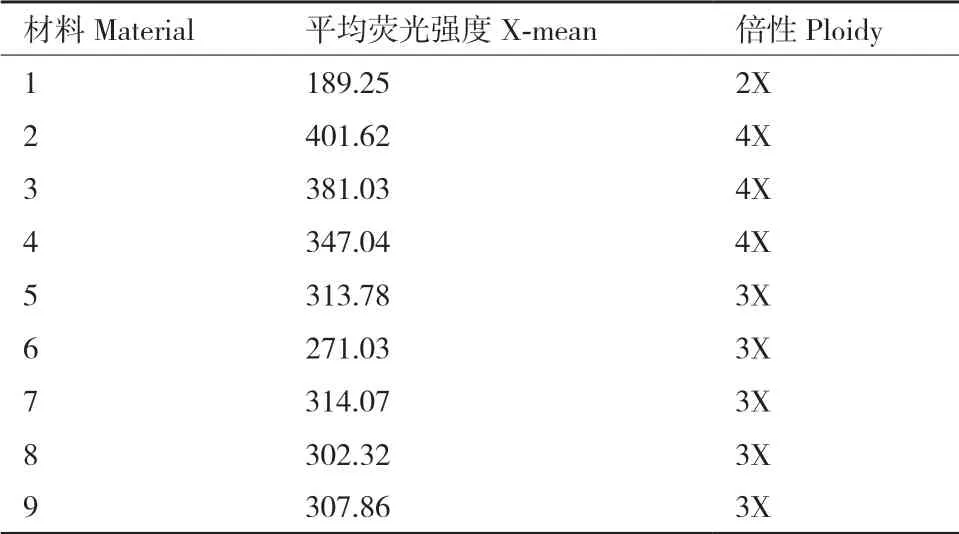
表2 不同倍性材料的荧光峰值Table 2 Fluorescence peaks of different ploidy materials
2.2 形态学鉴定结果
2.2.1 植株及叶片形态比较 由于诱变导致的基因组变化,使不同倍性的植株在形态上产生了很大的变化(图1)。二、三和四倍体草棉植株均呈直立生长,其中二倍体草棉枝叶较多,叶片较小且叶色翠绿;三倍体和四倍体草棉植株明显矮小,分枝数量较少,但茎秆较二倍体粗壮,叶片也较二倍体增大,叶色浓绿。结果表明草棉经染色体加倍后,多倍体植株生长明显受阻。

图1 草棉二倍体(A)、三倍体(B)、四倍体(C)植株比较Fig. 1 Comparison of plant among diploid(A),triploid (B)and tetraploid(C)G. herbaceum
经观察不同倍性植株的叶片也产生了很大的变化,由图2可知,二倍体草棉叶片较小,呈阔叶状,颜色翠绿,叶裂刻较深,有3-5个叶裂片;三倍体草棉叶片较大,叶形与二倍体草棉相似,叶色较深;四倍体草棉的叶片明显大于二倍体草棉,叶色浓绿,叶片厚度也比二倍体草棉厚,且有明显的皱缩,靠近基部的左右两个叶裂没有二倍体草棉明显。

图2 不同倍性草棉的叶片形态比较(标尺:20 mm)Fig. 2 Leaf morphology comparison among different ploidy G. herbaceum(Ruler:20 mm)
2.2.2 不同倍性草棉花的形态性状比较 草棉多倍体花的形态在不同倍性之间也产生了很大差异,而比较其中的变化也在一定程度上反映了不同倍性棉花之间的联系。对二倍体、三倍体和四倍体草棉的花进行比较(图3-图5),分析其形态性状表明:二倍体草棉的花冠呈黄色,花朵和苞叶均较小,花瓣边缘呈锯齿状,5片花瓣中有1片明显较小,花瓣基部有深红色花斑,花药橘黄色、较小、全部散粉(图3-A,图4,图5左)。三倍体草棉的花冠呈白色,花朵较大,苞叶窄长,花瓣边缘不规则,花斑较小甚至没有,淡紫色花斑,花药淡黄色、多为干瘪、仅少量散粉(图3-B,图5右)。四倍体草棉的花冠为黄色、较二倍体深,花朵和苞叶均较二倍体宽大,花瓣边缘规则、平整,有紫红色花斑,花药黄色、较大、部分散粉(图3-C,图4,图5左)。

图3 草棉二倍体(A)、三倍体(B)、四倍体(C)花的形态比较Fig. 3 Comparison of flower morphology among diploid(A),triploid(B)and tetraploid(C)G. herbaceum

图4 二倍体和四倍体草棉的花朵及雌雄蕊比较(标尺:20 mm)Fig. 4 Flowers,pistil and stamens comparison between diploid and tetraploid G. herbaceum(Ruler:20 mm)

图5 不同倍性草棉的花的分解图(标尺:20 mm)Fig. 5 Decomposition map of flowers among different ploidy G. herbaceum(Ruler:20 mm)
2.3 细胞学鉴定结果
2.3.1 叶片气孔性状观察和鉴定 叶片的气孔性状是指气孔的大小、气孔密度和保卫细胞对中的叶绿体数,是判断植物倍性的重要细胞学指标。对不同倍性草棉的叶片气孔性状进行统计分析(图6),由表3结果得知,二、三和四倍体草棉在气孔密度、气孔长度和叶绿体数上都存在着显著差异(P<0.05);随着倍性的增加,气孔密度呈下降趋势,而气孔长度和叶绿体数均呈上升趋势。本研究结果和前人研究结果一致[20]。

图6 不同倍性草棉的叶片气孔比较(标尺:20 μm)Fig. 6 Leaf stomatal comparison among different ploidy G. herbaceum(Ruler:20 μm)

表3 不同倍性草棉的叶片气孔性状统计Table 3 Stomatal character statistics of leaves among different ploidy G. herbaceum
2.3.2 花粉母细胞减数分裂观察和测定 为了进一步研究不同倍性草棉的细胞遗传学特性,本试验对二、三和四倍体草棉的减数分裂行为分别进行观察,三者的减数分裂行为均有正常和异常两种表现(图7)。由表4得知:在二倍体草棉的600个多分体中,分别有1个单分体(0.17%),2个二分体(0.33%),25个三分体(4.17%),569个正常四分体(94.83%),1个异常四分体(0.17%)和2个其他多分体(0.33%)。在三倍体草棉的600个多分体中,分别有15个单分体(2.50%),4个二分体(0.67%),60个三分体(10.00%),324个正常四分体(54.00%),5个异常四分体(0.83%)和195个其他多分体(32.50%)。在四倍体草棉的600个多分体中,分别有13个单分体(2.17%),14个三分体(2.33%),442个正常四分体(73.67%),5个异常四分体(0.83%)和126个其他多分体(21.00%)。观察得知,三倍体的四分体染色不均匀,四倍体较二倍体染色浅,说明四倍体的育性正在恢复,还有待于进一步稳定。
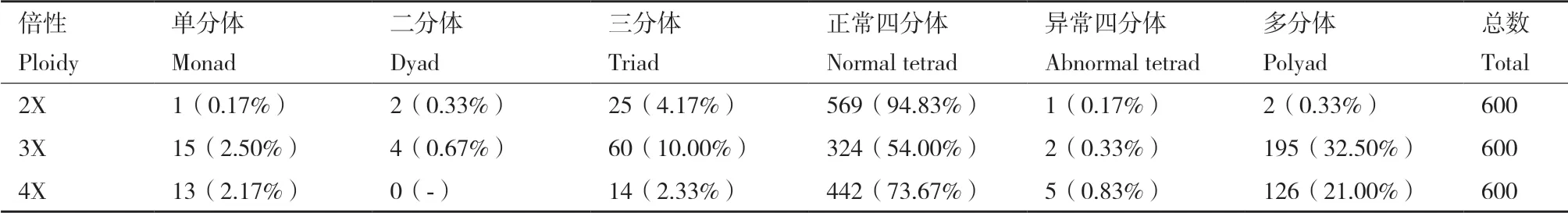
表4 不同倍性草棉减数第二次分裂末期的多分体数量及比例Table 4 Number of multispores in telophase II of different ploidy G. herbaceum

图7 不同倍性草棉的正常和异常减数分裂行为(标尺:20 μm)Fig. 7 Normal and abnormal meiosis behavior of different ploidy G. herbaceum(Ruler:20 μm)
2.3.3 不同倍性草棉花粉粒统计结果 由于染色体数目的加倍,使不同倍性草棉的花粉粒也产生了很大的变化,对花粉粒进行统计可以反映不同倍性草棉大致的育性情况(图8)。由表5看出,二、三和四倍体草棉的花粉粒直径存在显著差异,随着倍性的增加,花粉粒直径呈上升趋势。此外,在二倍体草棉的600个花粉粒中,有572个正常花粉粒(占95.33%),28个为异常花粉粒(占4.67%);三倍体的600个花粉粒中,有353个正常花粉粒(占58.83%),247个为异常花粉粒(占41.17%);四倍体的600个花粉粒中,有466个正常花粉粒(占77.67%),134个为异常花粉粒(占22.33%)。

表5 不同倍性草棉的花粉粒统计Table 5 Pollen grains statistics among different ploidy G. herbaceum

图8 不同倍性草棉的正常和异常花粉粒(标尺:20 μm)Fig. 8 Normal and abnormal pollen grains of different ploidy G. herbaceum(Ruler:20 μm)
2.4 SRAP分子鉴定结果
对5对正向引物和5对反向引物组成的25对引物组合进行筛选,最终选用14对引物对二、三和四倍体草棉进行DNA水平上的分析。对14组条带进行统计分析(表6),与2X相比,3X共有297条清晰条带,其中有240条与2X相同,20条缺失,37条新增条带,遗传比例分别为80.81%、6.73%和12.46%;4X共有299条清晰条带,其中有229条与2X相同,32条缺失,39条新增条带,遗传比例分别为76.59%、10.37%和13.04%。
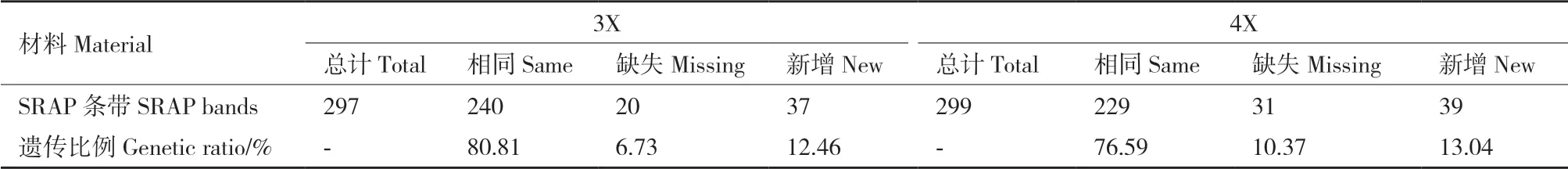
表6 不同倍性草棉的SRAP多态性来源Table 6 Resources of SRAP polymorphism among different ploidy G. herbaceum
此外,14组引物条带扩增出的分子量范围均在50-500 bp之间。在这14组引物条带中,3X在引物组合Me 2/Em 1、Me 2/Em 3、Me 3/Em 1、Me 3/Em 3、Me 4/Em 3中除了扩增出与2X完全一致的条带外还出现了新的条带;在引物Me 2/Em 5、Me 4/Em 2中仅出现了条带的缺失;其余7组引物中既有条带的缺失也有新增的条带。4X在引物组合Me 4/Em 1中仅扩增出与2X完全一致的条带(图9-B);在引物Me 3/Em 1、Me 3/Em 3中除了相同的条带还出现特异条带;在引物Me 1/Em 5、Me 2/Em 4、Me 2/Em 5、Me 3/Em 2中仅出现条带的缺失;剩余引物中既有条带的缺失也有特异条带。以上结果得知,3X和4X不仅扩增出与2X完全一致的条带,还出现了条带的缺失与新的特异性条带,且随着倍性的增加,相同条带变得更宽更亮(图9),表明染色体加倍之后基因产生了剂量效应,以及在加倍过程中可能出现了染色体重排,从分子水平上进一步证明同源多倍体草棉的真实性。

图9 SRAP引物在不同倍性草棉中的扩增结果Fig. 9 Amplification results of SRAP primers among different ploidy G. herbaceum
3 讨论
3.1 多倍化导致新表型性状的产生及原因
表型变异是自然选择的重要依据,因此,多倍化导致表型创新是关于多倍化能否促进物种多样化争论的焦点[21]。新形成的多倍体显著特征是基因组不稳定,进而进行快速重构,使多个基因组在细胞核内稳定共存[22-23],所以二倍体亲本在经历多倍化后,本身已进化完美的减数分裂行为会被扰乱,在新形成的多倍体中经常会出现非整倍体、染色体重排与其他类型基因结构变异[24-26]。本研究中,染色体加倍获得的草棉同源多倍体S1播种鉴定表明不仅有四倍体植株,也有三倍体植株,并且不同倍性的草棉植株在形态学和细胞学方面的差异明显。除基因组结构改变外,多倍体植株也会发生基因表达的变化,例如,Xu等[27]对两个亚种粳稻和籼稻及其F1杂种与四倍体后代进行表型性状与基因表达分析发现,约有42%和50%的同源基因在杂种和多倍体中出现明显的基因表达差异,并导致不同杂种与多倍体后代个体间产生了明显的表型性状分化。在本研究中,观察到不同倍性草棉植株个体间表型性状差异明显,包括植株、叶片、气孔、花、花粉粒等性状,因此推断二倍体草棉经过染色体加倍后,其多倍体后代基因组间需要重新进行功能分配,进而产生新的表型性状及差异。
3.2 多倍体鉴定方法探讨
通过形态观察可以初步筛选出变异植株,也是简单快速的方法。当诱变材料较多时,采用形态学进行初步鉴定,能大大减少工作量。器官巨大化是多倍体植株重要的指标之一,在许多研究报道中早已被证实[13,28]。在本试验中草棉多倍体植株的叶片比二倍体宽厚,有明显皱缩,颜色较深,花器官明显增大,生长缓慢。经过流式细胞倍性鉴定后,前期通过形态观察初步筛选的植株全部为多倍体。通过解剖叶片结构,观察测量气孔大小、气孔密度和保卫细胞对中的叶绿体数也可以间接鉴定植株倍性,随着倍性的增加,气孔密度降低,气孔大小和叶绿体数目增大。Chen等[29]采用秋水仙碱处理芦笋获得了四倍体诱变植株,发现四倍体芦笋的气孔密度约为二倍体的一半,而叶绿体数量是二倍体的两倍,以及气孔长度和宽度略大于二倍体植株。所以气孔密度、保卫细胞的长度和叶绿体数目也是鉴定植株倍性的重要依据,该方法易取材,损伤小,操作简单,但当鉴定群体中存在嵌合体和非整倍体植株时就难以区分。本试验中,通过对不同倍性的草棉叶片进行解剖学观察,其各自的气孔密度、气孔长度和保卫细胞对中的叶绿体数目均符合上述规律。此外,花粉粒直径的大小也与此相似,多倍体的花粉粒直径比二倍体的显著增大。
花粉母细胞减数分裂过程是否正常,是花粉可育的关键。研究表明多倍体减数分裂的异常行为要明显多于原始二倍体[30-31]。同时,植株在经历多倍化后,新形成的多倍体物种中不同的染色体组间需要重新进行功能分配,这常常导致其在进化初期阶段的育性迅速降低[32]。本研究中,二倍体、三倍体和四倍体草棉的正常四分体占比分别为94.83%、54.00%和73.67%,正常花粉粒占比分别为95.33%、58.83%和77.67%。同源四倍体草棉正常花粉粒比例较二倍体低,这可能是存在较多的异常多分体,进而导致异常花粉粒的产生;也可能是正常四分体也会发生染色体减少或丢失[33];还可能是正常配子形成的成熟花粉粒受到外界不良环境的影响。此外,我们对不同倍性草棉进行花粉粒统计时,发现花粉粒的成熟时期具有不同步性,同一花蕾的不同花药之间会存在花粉粒和四分体同时出现。因此同源四倍体草棉的育性仍需进一步恢复和稳定。
对于同源多倍体植株也可以进行分子鉴定。彭滢等[34]对16株四倍体枳橙植株进行SSR鉴定,其扩增带型与二倍体完全相同。SRAP分子标记鉴定是一种新型的基于PCR的标记系统,本研究利用SRAP分子标记方法,多倍体扩增出与二倍体完全一致的条带,且条带变得更宽更亮,证实了同源多倍体草棉的真实性。同时还发现,同源四倍体的多态性比例(23.41%)比三倍体(19.19%)高,这可能是二倍体草棉通过秋水仙碱诱导成同源四倍体过程中,引起了碱基序列改变,形成可与引物杂交的新位点,或是同源四倍体的等位基因发生了漂移,从而表现出基因组DNA多态性[35]。三倍体是草棉同源多倍体后代S1通过流式细胞筛选获得的,其染色体组介于二倍体和四倍体之间,因此具有的DNA特异性片段比例没有四倍体高。研究还发现除不同倍性草棉之间存在较大遗传差异外,四倍体和三倍体内部植株之间也表现出差异。
从Delaat[36]首次采用流式细胞术检测植物倍性水平以来,该方法受到研究者的青睐,广泛应用于各种植物倍性鉴定中[29,37]。较传统的形态学鉴定和细胞学鉴定相比,其检测通量高,精准度高。本试验经流式细胞仪检测结果得出,在草棉同源多倍体后代S1中,有3株四倍体和5株三倍体,但该结果还需结合染色体压片技术对植株倍性进行更准确的鉴定。
以上鉴定方法可以直接或间接证实多倍体植株的真实性,此外,人工诱变的多倍体植株能否成功结铃是判断多倍体育性恢复及稳定的标准之一。本试验于2021年1月温室收获了3株草棉同源四倍体S2种子,而5株同源三倍体草棉均不能结铃。本研究所用材料冬天都保存于温室,同源四倍体草棉植株能平安在温室越冬,而二倍体草棉不能越冬全部死亡,进一步说明了四倍体植株抗寒性明显优于二倍体植株。所以我们期望筛选出育性稳定且综合性状优良的草棉同源四倍体新种质用于生产和下一步遗传研究。而三倍体草棉可以作为棉花育种的桥梁材料,比如加倍成六倍体草棉,或者再与其它栽培棉杂交获得新的种质材料。
4 结论
在同源多倍体草棉后代S1中鉴定出3株四倍体和5株三倍体;形态学和细胞学鉴定发现多倍体表现出显著的优势;SRAP分子鉴定证实了同源多倍体草棉的真实性,以及在加倍过程中发生了染色体重排。同时,获得同源四倍体草棉S2种子。

