逐步添加法制备单链环状DNA的影响因素探究*
樊一乔, 安 然,2**, 李 琦, 李 敬, 梁兴国,2
(1. 中国海洋大学食品科学与工程学院,山东 青岛 266003;2. 青岛海洋科学与技术国家实验室海洋药物与生物制品功能实验室,山东 青岛 266235)
环状DNA具有线性DNA不具备的动力学和拓扑学特点,因此环状DNA作为DNA纳米技术的重要组成部分被人们广泛关注[1-3]。Zheng等[4]以单链环状DNA为基本单元成功制备了DNA纳米管结构;多个课题组以单链环状DNA为原料,制备了2个或多个DNA环相互穿套的连环结构(Catenane),并将其制备成可控的分子开关或分子机器等[1,3,5-7]。相对于线性DNA,环状DNA不易被核酸外切酶降解,在溶液中单一分散、不易聚合,这些特性决定了其在药物运输、基因调控、疾病诊断和基因治疗等领域的应用更具优越性[4,8-10]。此外,单链环状DNA还与滚环扩增技术等以环状DNA为元件的核酸检测技术密切相关[5,11-12]。因此,单链环状DNA在分子生物学、医学和生物技术等方面应用广泛。
然而,单链环状DNA难以大量制备成为了目前制约以环状DNA研究和应用的一个难题。通常,其制备是利用一条与单链DNA两端互补的DNA短链(Splint),使单链DNA两端靠近,在连接酶作用下使单链封闭成环(见图1A)。但在生成由一条单链DNA首尾相接的单倍环的同时,也会产生由多条单链DNA首尾相接生成的副产物(见图1B、C),且随着单链DNA浓度的增大,副产物的比例会急剧增加。因此为减少副产物产生,目前在大多数研究中,单链DNA浓度不超过0.5 μmol/L甚至为nmol/L级别[1,8,13-15],这就使得单链环状DNA的产量受到制约,从而增加了对其研究和应用的难度。
针对上述问题,且考虑到已成环产物的存在不影响环化反应,An等[16]提出了一种新型的逐步添加法成环,即每次向成环体系中加入少量单链DNA,使其在低浓度下充分成环后再次加入单链DNA,重复多次,这样可使单链DNA的成环浓度始终处于较低水平的同时,最终累积得到高浓度的单链环状DNA(见图2)。然而,该研究并未深入探讨利用逐步添加法制备单链环状DNA时的影响因素和具体制备条件的确定方法。因此本文拟围绕逐步添加法成环过程中,连接酶Buffer浓度、单链DNA的添加浓度、添加间隔时间、反应温度等多方面因素进行探讨,找到逐步添加法的关键因素,以指导逐步添加法中各条件的确定方法,为单链环状DNA的高效大量制备提供技术支持。
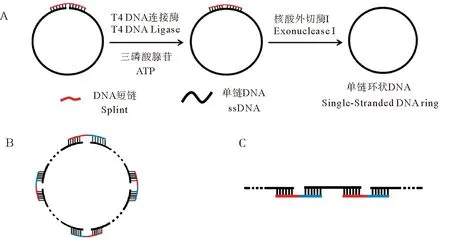
图1 单链环状DNA的制备(A)及制备时产生的副产物(B和C)
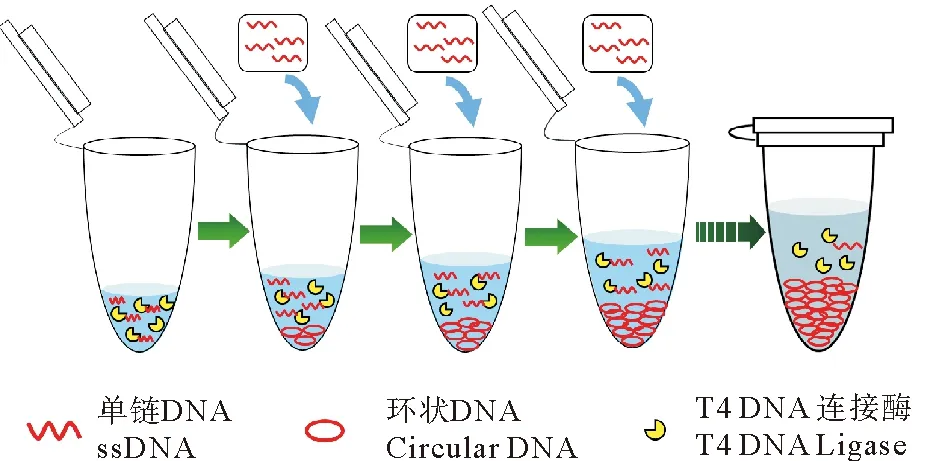
图2 逐步添加法制备单链环状DNA示意图
1 材料和方法
1.1 实验材料与仪器
T4 DNA 连接酶、10× T4 DNA 连接酶Buffer(400 mmol/L Tris-HCl,100 mmol/L MgCl2,100 mmol/L DTT,5 mmol/L ATP(pH=7.8,25℃))购于Thermo Fisher Scientific公司;SYBR Green Ⅱ购于Sigma公司;DNA单链(见表1)由苏州金唯智生物科技公司合成;其他实验试剂均为国产分析纯试剂;PCR仪购于杭州博日科技有限公司;旋转式真空浓缩机购于德国Marin Christ公司;真空泵购于美国圣斯特公司;聚丙烯酰胺凝胶电泳装置购于北京六一仪器厂;凝胶成像仪购于BIO-RAD公司。

表1 连接成环所用的单链DNA及短链Splint序列

Note: Splint-L1, Splint-L2, Splint-L3 assist the oligonucleotides L1-72, L2-67, L3-33 in ligating, respectively; The underlined and double underlined sequences of Splint-L1, Splint-L2, Splint-L3 combine with the underlined and double underlined sequences of oligonucleotides L1-72, L2-67, L3-33, respectively.
1.2 一步法连接成环反应
20 μL的总反应体系:0.1× T4 DNA连接酶Buffer(4 mmol/L Tris-HCl,1 mmol/L MgCl2,1 mmol/L DTT,0.05 mmol/L ATP(pH=7.8,25 ℃)),0.5 μmol/L 5’端磷酸化的单链DNA,1 μmol/L Splint短链DNA,5 Weiss U T4 DNA连接酶。连接反应前先将上述组分混匀后置于PCR仪中,30 ℃反应10~60 min,65 ℃ 10 min使连接酶变性。典型的连接反应条件为:0.1× T4 DNA连接酶Buffer,0.5 μmol/L 5’端磷酸化的单链DNA,单链DNA与Splint的摩尔浓度比例为1∶2,5 Weiss U T4 DNA连接酶。
1.3 逐步添加法连接成环反应
管1为制备液体系(20 μL):10 Weiss U T4 DNA连接酶,8 μmol/L Splint短链DNA,0.1× T4 DNA连接酶Buffer(4 mmol/L Tris-HCl,1 mmol/L MgCl2,1 mmol/L DTT,0.05 mmol/L ATP(pH=7.8,25 ℃));管2为添加液体系(20 μL):0.1× T4 DNA连接酶Buffer(4 mmol/L Tris-HCl,1 mmol/L MgCl2,1 mmol/L DTT,0.05 mmol/L ATP(pH=7.8,25 ℃)),4 μmol/L 5’端磷酸化的单链DNA。每间隔一定时间向管1制备液体系(只含Splint)加入管2的添加液(只含成环单链DNA),分10次添加,以确保每次加入的单链DNA充分反应成环;添加液添加完毕后延长反应5~10 h后结束反应;反应温度为25 ℃。
1.4 产物分析
连环产物浓度较低(如0.1~0.5 μmol/L)时,为使产物更易检测,需要将产物进行真空浓缩,然后加少量水复溶至1 μmol/L。产物用10%变性聚丙烯酰胺凝胶电泳进行检测。SYBR Green II染色10~15 min后利用凝胶成像仪成像。用Image Lab软件定量分析条带亮度,计算每条泳道中单链环状DNA条带占所有条带的百分比,得出连接产物中单链环状DNA的产率。
2 结果
2.1 T4 DNA连接酶Buffer的浓度对成环的影响
为探究各种因素对成环效率及副产物产生的影响,本研究选取了一条72 nt的单链DNA(L1-72)用于成环实验,其两端不具有稳定二级结构,不会干扰与Splint结合。Splint长度为12 nt,各有6 nt与成环链的两端互补。由于拓扑结构不同,DNA单链连接成环后迁移速率变慢,可与DNA单链显著区分开。An等[16]提出低浓度Buffer能减少成环副产物产生,是逐步添加法中不可忽视的因素之一。因此为确定逐步添加法过程中Buffer浓度,本研究探究了7种不同的T4 DNA连接酶Buffer浓度对连接成环的影响。图3结果显示,Buffer浓度对DNA的成环影响显著,当浓度大于0.1×时,副产物开始出现;当浓度为0.01×时,连接酶效率急剧降低,仅有极少量的环状DNA产生。因此,适宜的T4 DNA连接酶Buffer浓度为0.1~0.05×。本实验选择0.1× T4 DNA连接酶Buffer作为最终逐步添加法的Buffer浓度。
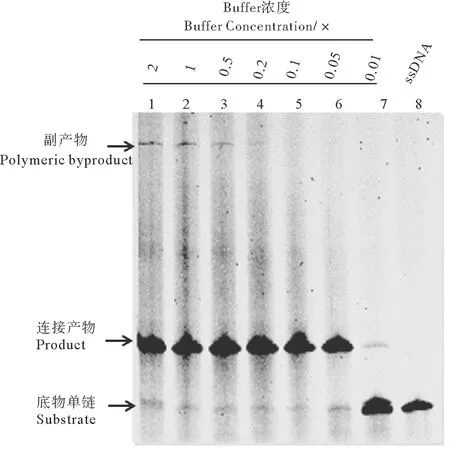
(泳道 1~7:T4 DNA 连接酶 Buffer浓度分别为2~0.01×;泳道 8:L1-72;25 ℃连接6 h。Lane 1-7: The concentration of T4 DNA Ligase Buffer is 2~0.01×; Lane 8: L1-72; Ligation at 25 ℃ for 6 h.)
图3 不同浓度T4 DNA连接酶Buffer对成环的影响
Fig.3 Effects of the concentration of T4 DNA Ligase Buffer on the yield of single-stranded DNA rings
2.2 单链DNA的浓度对成环的影响
利用逐步添加法制备单链环状DNA时,DNA浓度是影响成环效率的重要因素之一,控制成环体系中单链DNA的恒定浓度是减少副产物产生的关键,因此本研究探究了6种不同的单链DNA浓度对成环的影响。结果显示,当单链DNA的浓度大于0.5 μmol/L时,连接产物中均有副产物出现;当单链DNA的浓度小于或等于0.5 μmol/L时,产物均只有单链环状DNA(见图4)。也就是说,对于L1-72链,逐步添加法每次向制备液体系加入添加液后,单链DNA的浓度需保持在0.5 μmol/L以下,以避免副产物的产生与积累。
2.3 添加间隔时间对成环效率的影响
在逐步添加法中,若2次添加单链DNA之间的间隔时间过短,则会使剩余单链DNA较多,累积超过一定浓度后可能导致副产物产生。图5中表示不同反应时间下的环状DNA产率。结果显示,反应时间在10~15 min时,单链环状DNA的收率均低于70%,体系中剩余成环单链DNA较多;而当反应时间大于或等于20 min后,单链环状DNA的收率可达89%且趋于稳定。因此,对于成环单链L1-72,逐步添加法的添加间隔时间应控制在20 min以上。
2.4 反应温度对成环效率的影响
反应温度是影响单链DNA连接成环的因素之一,温度会影响酶的活性以及Splint和单链DNA的结合从而影响环状结构的收率。本研究探究了5种不同反应温度对成环速率的影响,不同温度下连接15 min的结果如图6所示。结果显示,当温度为25 ℃时,单链环状DNA的收率最高,达到了78%;而其他温度下单环的收率相对较小,如37 ℃时连接成环的效率仅为21%,成环率远低于25 ℃。因此对于单链DNA L1-72,制备环状结构时最佳温度为25 ℃,后续实验也均在该条件下进行。
2.5 Splint加入量和Splint的GC含量对成环效率的影响
Splint与成环单链DNA的比例及Splint GC含量可能会影响Splint与单链DNA的结合效率,从而影响单链环状DNA的产率。因此,本研究考察了二者对于环状DNA产率的影响,结果如图7所示。当Splint与单链DNA比例为0.5∶1~10∶1时,产物中均只有环状结构条带,未产生副产物。这表明,在逐步添加法中可一次性加入高浓度Splint,不需分次添加。

(泳道 1~6:单链DNA终浓度分别为5~0.1 μmol/L;泳道 7:L1-72;30 ℃反应6 h。Lane 1~6: The concentration of the single-stranded DNA is 5~0.1 μmol/L; Lane 7: L1-72; Ligation at 30 ℃ for 6 h.)
图4 不同浓度单链DNA制备环状结构的电泳结果
Fig.4 Effects of the concentration of the single-stranded
DNA on preparing of single-stranded DNA rings
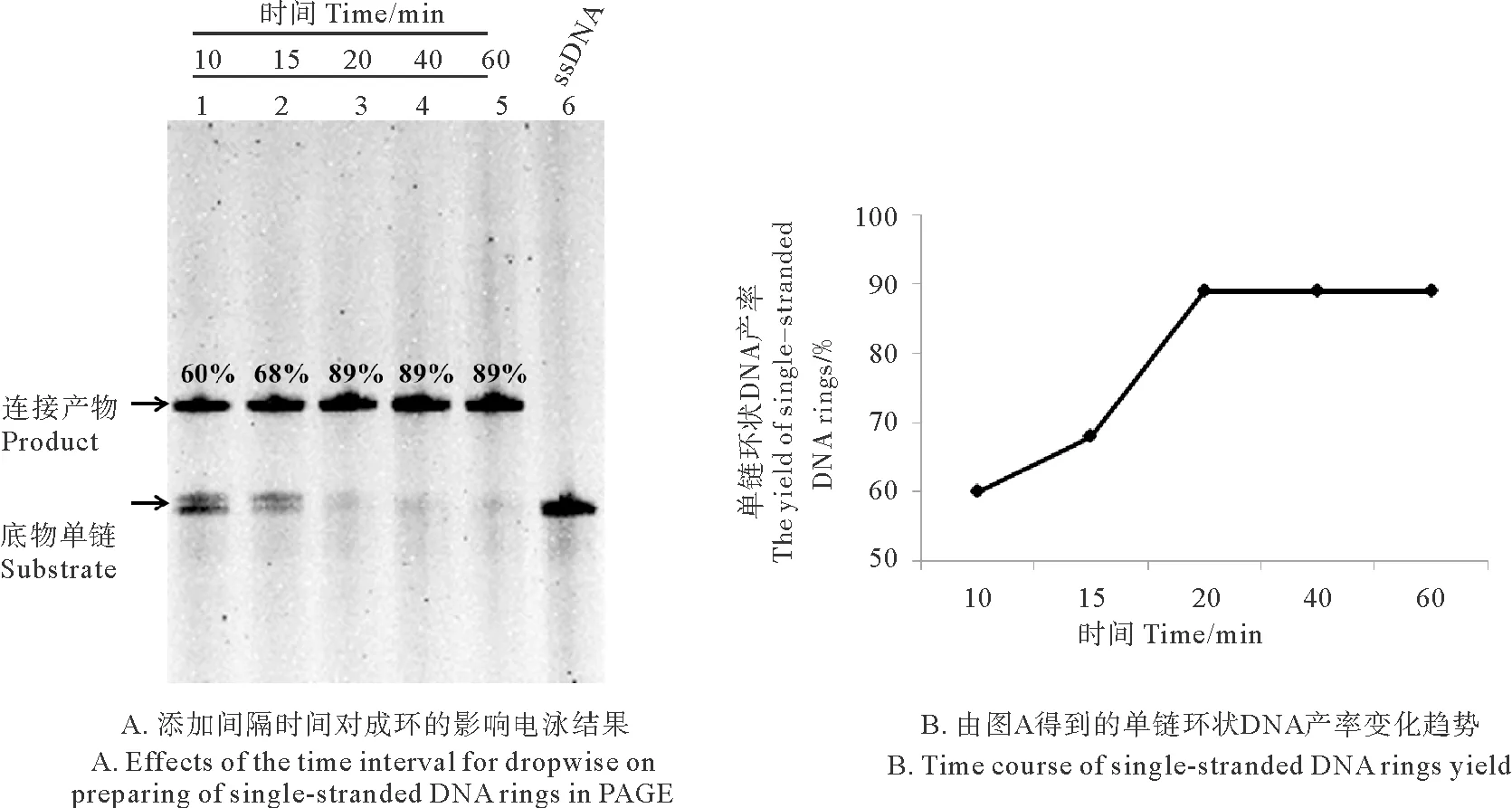
(A:泳道 1~5:单链DNA L1-72分别反应10~60 min;泳道 6:L1-72。 A: Lane 1~5: The time of the single-stranded DNA for ligation into circular DNA is 10~60 min; Lane 6: L1-72.)
图5 添加间隔时间对成环效率的影响
Fig.5 Effects of the time interval for dropwise on the yield of single-stranded DNA rings
当Splint的GC含量适中时(50%),单链DNA成环效果最好;Splint的GC含量过高或过低均会降低连接效率。Splint GC含量较低时(33%),其与单链DNA结合部分熔点低,在较高的连接温度下二者难以结合,如随着温度升高,Splint GC含量较低(33%)的单环得率急剧下降(30 ℃仅为8%)。因此,在设计成环单链末端位置时,应选择适中的GC含量(Splint的GC含量为50%左右)。
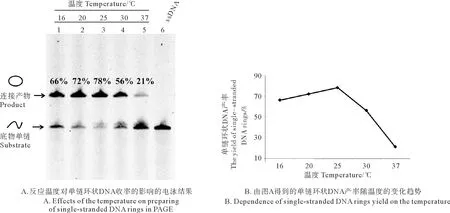
(A:泳道1~5:反应温度分别为16~37 ℃;泳道 6:L1-72;反应时间15 min。A: Lane 1~5: The temperature is 16~37 ℃; Lane 6: L1-72; The time of Ligation is 15 min.)
图6 反应温度对单链环状DNA收率的影响
Fig.6 Effects of the temperature on the yield of single-stranded DNA rings

(A:泳道 1~5中L1-72与Splint-L1的比例为:0.5∶1~10∶1;泳道 6:L1-72;25 ℃连接10 h。B:泳道 1~3、5~7、9~11:20~30 ℃时,GC含量不同的Splint对单链DNA L1-33、L1-72、L1-67成环效率的影响;连接时间15 min。A: Lane 1~5: The ratio of Splint-L1 to single-stranded DNA is 0.5∶1~10∶1; Lane 6: L1-72; Ligation at 25 ℃ for 10 h. B: Lane 1~3, 5~7, 9~11: Impact of GC content of the splint on the yield of single-stranded DNA rings when the temperature is 20~30 ℃; The time of ligation is 15 min.)
图7 Splint对单链环状DNA收率的影响
Fig.7 Influence of the Splint on the yield of single-stranded DNA rings
2.6 常规一步法与逐步添加法对比
根据上述结果,针对L1-72单链DNA,逐步添加法中应考虑的关键条件为:0.1× T4 DNA连接酶Buffer、添加间隔时间为20 min、反应温度为25 ℃。根据此条件,图8中对比了将所有单链DNA和其他辅助试剂(包括Splint、连接酶等)一次性加入成环体系中的常规一步法和逐步添加法制备单链环状DNA的结果。可以发现,一步法连接产物中,均有副产物产生,单链环状DNA得率分别为78%(1×Buffer)和86%(0.1×Buffer),而利用逐步添加法制备单链环状结构,环状DNA的产率达99%。
3 讨论
本文针对逐步添加法制备单链环状DNA,探究了单链DNA浓度、添加间隔时间等因素对制备单链环状DNA的影响,得出了影响逐步添加法制备单链环状DNA的关键因素。其中,T4 DNA连接酶Buffer浓度、逐次加入后体系中单链DNA浓度、添加间隔时间、温度、Splint GC含量是逐步添加法制备环状结构时的必需考虑条件,是减少或避免副产物产生的关键,而Splint与单链DNA比例(0.5∶1~10∶1)、酶使用量在一定范围内(1~10 Weiss U)对成环效率影响不大。
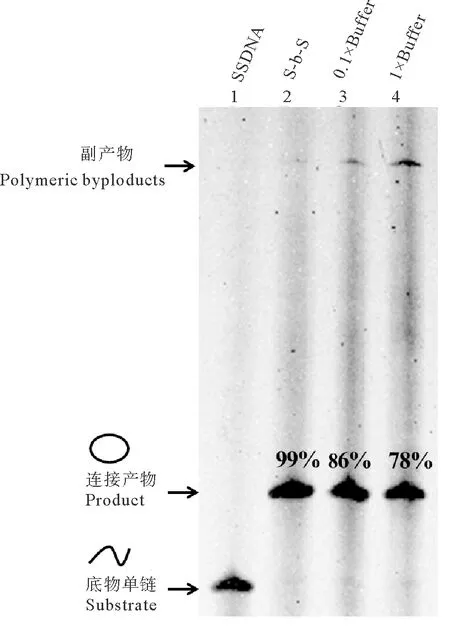
(泳道 1:L1-72;泳道 2为逐步添加法制备结果;泳道 3~4为一步法连接结果;泳道 2~4:T4 DNA 连接酶Buffer浓度分别是0.1×、0.1×和1×;L1-72终浓度2 μmol/L;25 ℃连接10 h;逐步添加法中,每隔20 min向制备液体系中加入一定量的添加液,分10次添加。Lane 1: L1-72; Lane 2: The result of preparation of single-stranded DNA rings by “Step-by-Step” method; Lane 3~4: The result of conventional “One-Step” cyclization; Lane 2~4: The concentration of the T4 DNA Ligase Buffer is 0.1×, 0.1× and 1×; The concentration of the single-stranded DNA is 2 μmol/L; Ligation at 25 ℃ for 10 h; Add the additive solution into the preparation system every 20 min for 10 times in the “Step-by-Step” method.)
图8 一步法与逐步添加法制备单链环状DNA的结果比较
Fig.8 Comparision of single-stranded DNA rings
prepared by different methods
本研究发现,T4 DNA连接酶Buffer浓度对于副产物的产生影响较大,随着T4 DNA连接酶Buffer浓度降低,副产物急剧减少,这与An等[16]的研究结果一致。Mg2+是T4 DNA连接酶的依赖型辅因子[17-18],在低Mg2+浓度下,T4 DNA连接酶催化活性不受明显影响,同时还可以降低副产物产生[16]。当使用0.1~0.05× Buffer时,Mg2+浓度处于较低水平(0.5~1 mmol/L),由于DNA带负电荷而使得分子间斥力变大,分子间的连接效率受到约束,从而抑制了副产物的产生。
当L1-72浓度高于0.5 μmol/L时,连接产物中会出现副产物,这是因为体系中单链DNA浓度增高,分子间距离减小,碰撞几率增大,分子内连接成环的同时分子间连接的几率同时增大,产生大分子副产物;反之则分子间接触几率降低,以分子内连接为主,反应更倾向于自身环化。同时,添加间隔时间若过短,则体系中尚有未连接的单链DNA,再次加入单链DNA后导致未反应的底物浓度产生积累,多次积累后浓度达到较高水平,则同样会增加分子间反应几率,导致副产物产生。由于在不同条件下,连接酶效率不同,因此在制备不同单链环状DNA时,逐步添加法的添加间隔时间需要通过实验进行确定。
另外,当温度为25 ℃时,L1-72连接得到单链环状DNA的收率最高,这可能是由于在25 ℃时酶活较高,且该温度下Splint与成环单链DNA的杂交程度较好,因而在逐步添加法中,温度对单链环状DNA制备效率的影响较大,需要通过实验进行确定;而酶活不受明显影响时,Splint的GC含量会影响成环效率。Splint的GC含量适中时,Splint与单链DNA杂交情况较好,可能会使连接过程中的腺苷化、去腺苷化反应[17]速率更快速,使单环收率增高;若Splint GC含量过低或过高,均有可能降低连接效率,可考虑适当延长反应时间。而Splint与单链DNA的比例、连接酶使用量并不影响单链环状结构收率,与An等[16]方法相比,Splint及T4 DNA连接酶在逐步添加法中可在初始时一次性加入制备液中,不需分次添加,进一步简化了逐步添加法步骤,提高了制备效率。
以单链DNA L1-72为例,逐步添加法可使制备2 μmol/L的单链环状DNA的产率达99%。当成环体系为1 mL时,产量可达46.3 μg,相比于传统的制备方法(0.5 μmol/L,产率为81%,见图3 泳道 2),产量可提高至4.9倍。当成环链0.5 μmol/L时,虽然应用常规一步法在低浓度下也可制备得到产率较高的单链环状DNA,但后续的旋蒸、醇沉等浓缩步骤不仅操作复杂,还会造成产物的一定损失,难以达到高效、大量制备的效果;而使用逐步添加法制备的高浓度环状DNA,可直接用于常规实验,显著提高制备效率,为以单链环状DNA为基础的研究提供极大便利。
4 结语
本文研究了单链环状DNA制备过程中各主要因素对单链环状DNA制备的影响,确定了逐步添加法制备过程中的关键条件,能够为逐步添加法的具体过程提供指导,从而实现大量单链环状DNA的高效制备。对于一条随机的DNA单链,利用逐步添加法大量制备环状结构时,应考虑的主要关键因素为:T4 DNA连接酶Buffer浓度、每次加入后单链DNA浓度、添加间隔时间、温度、Splint GC含量。本研究为单链环状DNA的制备提供了技术参考,从而能够为以单链环状DNA为基础的纳米结构技术、核酸检测及疾病诊断治疗等研究奠定基础。

