伏马毒素B1对猪体外成熟卵母细胞凋亡与自噬的影响
李文慧,贺依静,姜瑶,赵红宇,彭磊,李佳,芮荣,剧世强
伏马毒素B1对猪体外成熟卵母细胞凋亡与自噬的影响
李文慧,贺依静,姜瑶,赵红宇,彭磊,李佳,芮荣,剧世强*
南京农业大学动物医学院,南京 210095
【目的】探究伏马毒素B1(fumonisin B1,FB1)对猪卵母细胞体外成熟的影响及其潜在的作用机制, 为临床有效防治FB1所致的生殖毒性损伤提供理论参考。【方法】采集猪卵丘-卵母细胞复合体(cumulus oocyte complexes, COCs)进行随机分组,在体外成熟培养过程中分别用不同浓度FB1(0、10、20和30 μg·mL-1)处理44 h后,统计卵母细胞第一极体(first polar body, PB1)排出和激活后胚胎发育情况;通过免疫荧光染色结合共聚焦显微镜技术进一步检测FB1对卵母细胞减数分裂进程和细胞骨架结构的影响;为进一步探究FB1对猪卵母细胞毒性损伤的作用机制,分别采用JC-1、Annexin V-FITC和LC3A/B荧光染色检测各组卵母细胞内线粒体功能、早期凋亡和自噬水平,并在此基础上,进一步通过Western blotting分析了凋亡/自噬相关蛋白的表达情况。【结果】FB1处理对卵母细胞成熟具有明显的抑制作用,PB1排出率呈浓度依赖性下降,当FB1浓度达到20 μg·mL-1以上时,PB1排出率显著降低(<0.01),并使卵母细胞孤雌激活后胚胎的卵裂率及囊胚率均显著降低(<0.01),对卵母细胞的发育潜力有一定的损伤作用。细胞周期分析结果表明,FB1处理还会导致减数分裂周期进程紊乱,使阻滞在生发泡破裂期(germinal vesicle breakdown,GVBD)的卵母细胞比例显著升高(<0.01)成功发育至第二次减数分裂中期(metaphase II,MII)细胞比例明显下降(<0.01),同时,卵母细胞中纺锤体异常的比例显著升高(<0.01)、胞膜上的微丝分布显著减少(<0.05)。进一步的研究结果表明,与对照组相比,FB1处理组卵母细胞线粒体膜电位明显降低(<0.05),线粒体功能受损,同时,FB1处理组卵母细胞早期凋亡率显著增加(<0.01),细胞自噬水平也显著升高(<0.01)。Western blotting分析结果显示,FB1处理组卵母细胞中促凋亡蛋白BAX和自噬蛋白LC3A/B II的表达均显著上调(<0.05),抑凋亡蛋白BCL2的表达显著下调(<0.05),提示早期凋亡和自噬的发生。【结论】FB1对猪卵母细胞体外成熟及其激活后胚胎发育具有明显的毒性损伤作用,致使减数分裂周期阻滞,纺锤体结构紊乱、微丝分布减少和线粒体损伤,其毒性作用机制与诱导卵母细胞凋亡和自噬有关。
猪卵母细胞;伏马毒素B1;细胞骨架;凋亡;自噬
0 引言
【研究意义】伏马毒素是轮枝镰刀菌()、层生镰刀菌()等真菌产生的次生代谢产物,广泛分布于世界各地的粮食作物中,其中,玉米和以玉米为原料的制品最容易被伏马毒素污染[1]。在目前已发现的28种伏马毒素类似物中,伏马毒素B1(fumonisin B1,FB1)的污染最为广泛,且毒性最强,对动物及人类健康造成极大的威胁[2]。近年来,关于FB1的污染及其毒性作用已成为相关领域的研究热点。【前人研究进展】FB1可通过受污染的农作物及饲料等途径进入动物体,引起机体产生多种毒性,包括肝毒性[3]、肾毒性[4]、免疫毒性[5]、神经毒性[6-7]和发育毒性[8]等,严重危害动物及人类健康。此外,FB1慢性中毒还是细胞癌变的重要诱发因素[9],国际癌症研究机构(International Agency for Research on Cancer,IARC)还将FB1列为2B类致癌物[1]。已有研究证实FB1的毒性作用机制与扰乱鞘脂代谢、诱导氧化应激、触发细胞凋亡、调节自噬水平密切相关[10-13]。近年来关于FB1的生殖毒性也越来越受到关注。GBORE等[14]研究发现饲料中添加FB1会导致公猪精液质量显著下降。HENRY等[15]证明肉鸡胚胎中注射FB1后,胚胎死亡率显著增加。还有证据表明FB1具有致母体及胚胎双重毒性,FB1不仅会引起母体生殖功能损伤,还会通过胎盘屏障影响胎儿正常发育[8, 16-17]。SOMOSKöI等[18]发现在小鼠早期胚胎发育过程中联合使用FB1和T-2毒素处理可显著降低囊胚发育率。由于FB1与叶酸转运体的高亲和力会导致叶酸代谢紊乱,从而引起胚胎发育期间的叶酸缺乏综合征,导致生长迟缓和发育异常,胚胎神经管缺陷(NTDs)等[8]。此外,新近研究结果表明FB1可影响猪颗粒细胞增殖和类固醇的产生,提示FB1可能对猪卵母细胞也具有潜在生殖毒性[19]。【本研究切入点】然而,目前有关FB1的生殖毒性研究,主要集中在对雄性动物和妊娠期胚胎发育的毒性上,而有关FB1对雌性动物的生殖毒性研究甚少,尤其是FB1对哺乳动物卵母细胞是否具有毒性作用目前尚不明确。【拟解决的关键问题】本研究旨在探讨FB1对猪卵母细胞体外成熟的影响及其潜在的作用机制。本试验以体外培养的猪卵母细胞为研究模型,利用免疫荧光染色、蛋白免疫印迹等方法检测了FB1对猪卵母细胞体外成熟、发育潜力、细胞周期进程、纺锤体装配以及微丝分布的影响,并从线粒体功能、细胞凋亡和自噬调节机制上深入探究了FB1的毒性作用,为临床上有效防治FB1所致的生殖毒性损伤提供理论参考。
1 材料与方法
试验于2019年10月至2020年10月在南京农业大学动物医学院动物生殖生物学实验室进行。
1.1 主要试剂与仪器
伏马毒素B1(FB1),美国sigma公司产品;四甲基异硫氰酸罗丹明标记的鬼笔环肽(TRITC Phalloidin),翊圣生物科技公司(上海)产品;兔抗α-Tubulin抗体,英国Abcam公司产品;兔抗LC3 A/B抗体,美国CST公司产品;兔抗BCL-2抗体,美国Proteintech公司产品;兔抗BAX抗体,Bioss公司(北京)产品;线粒体膜电位检测试剂盒(JC-1)、辣根过氧化物酶标记山羊抗兔IgG(H+L),碧云天生物科技公司(上海)产品;TRITC标记羊抗兔IgG(H+L),华安生物科技公司(杭州)产品;Annexin V-FITC凋亡检测试剂盒,诺唯赞生物科技公司(南京)产品;其他试剂若无特殊标注均购自美国sigma公司。激光共聚焦荧光显微镜,德国Zeiss公司产品;电泳仪和琼脂糖凝胶成像系统,美国Bio-Rad公司产品;CO2培养箱,美国Thermo公司产品;CRY-3细胞融合仪,新芝生物科技公司(宁波)产品。
1.2 猪卵母细胞采集与培养
试验所用猪卵巢均来自南京本地屠宰场,离体后立即置入含有青、链霉素的37°C无菌生理盐水的保温瓶中,2 h内运送至试验室。用10 mL一次性注射器从直径3—6 mm的卵泡中抽取卵丘-卵母细胞复合体(cumulus oocyte complexes,COCs),在体视显微镜下挑选胞质均匀、紧密包裹3层及3层以上卵丘细胞的COCs,用TCM 199成熟培养液洗3次后随机分组放入提前平衡12 h以上的TCM 199成熟培养液中,于38.5°C、5% CO2和饱和湿度的培养箱中进行体外成熟培养[20]。分别在体外培养28 h或44 h后,用0.1%透明质酸酶消化去除卵丘细胞,收集卵母细胞进行后续试验。
1.3 FB1处理
将FB1用二甲基亚砜溶解为5 μg·μL-1的储存液,于-20°C保存。将收集到的COCs进行随机分组,分别置于已添加不同浓度FB1(0,10,20和30μg·mL-1)的TCM 199成熟培养液中进行体外成熟培养,分析不同浓度FB1对猪卵母细胞体外成熟的影响。
1.4 卵母细胞激活与胚胎体外培养
收集各组胞质均匀、胞膜完整、且排出第一极体(first polar body,PB1)的发育至第二次减数分裂中期(metaphase II,MII)的卵母细胞进行孤雌激活。用细胞融合仪施加1.5 kV/cm的直流电压,80 µs脉宽和1次脉冲电激活卵母细胞后,移至化学激活液(含2 mmol·L-1的6-二甲氨基嘌呤和5μg·mL-1细胞松弛素B的PZM-3胚胎培养液)孵育4 h进行化学辅助激活。激活后的胚胎置入提前平衡12 h以上的PZM-3胚胎培养液中,于38.5°C、5% CO2和饱和湿度的培养箱中连续培养168 h[21-22]。在培养48 h后,统计胚胎卵裂率,培养168 h后统计囊胚发育率。
1.5 免疫荧光染色与激光共聚焦成像
收集各组卵母细胞,用4%多聚甲醛室温固定30 min后移入1% TritonX-100中室温通透8 h,再用1%的牛血清白蛋白(bovine serum albumin,BSA)37°C封闭1 h。对于微管染色,卵母细胞与鼠抗α-tubulin- FITC单克隆抗体(1﹕200)于37°C避光孵育2 h;对于微丝染色,卵母细胞与TRITC标记的Phalloidin(1﹕100)于37°C避光孵育1 h;对于自噬染色,卵母细胞与兔抗LC3A/B抗体(1﹕100)于4°C孵育12 h后,再与TRITC标记的二抗37°C孵育1 h。最后,卵母细胞与Hoechst 33342于37°C避光染核15 min后甘油封片,置于激光共聚焦荧光显微镜下观察并拍照。
1.6 线粒体膜电位(Δψm)检测
按照线粒体膜电位检测(JC-1)试剂盒说明书配制染色工作液,将洗涤好的卵母细胞移入提前在37°C温育好的JC-1染色工作液中,37°C避光孵育30 min。最后用甘油封片,置于激光共聚焦荧光显微镜下观察并拍照。用Image J软件分析红、绿色荧光强度的相对比值,即得出细胞的线粒体膜电位值Δψm。
1.7 Annexin-V-FITC凋亡检测
按照Annexin-V-FITC凋亡检测试剂盒说明书介绍的方法,将洗涤好的卵母细胞置于含10% Annexin- V-FITC染色工作液中,在37°C避光孵育20 min后,用4%多聚甲醛室温固定30 min,甘油封片,置于激光共聚焦荧光显微镜下观察统计卵母细胞凋亡率。
1.8 荧光强度分析
采用Image J软件分析荧光强度,经过相同的染色步骤和一致的共聚焦显微镜拍摄参数获得卵母细胞荧光图像,软件分析图片目的区域单位面积的平均荧光强度,计算所有测量值的平均值,处理组卵母细胞测量平均值与对照组卵母细胞测量平均值的比值即为相对平均值。
1.9 蛋白免疫印迹
每组收集100枚卵母细胞,经含β-巯基乙醇的裂解液裂解后置于沸水中煮沸10 min。根据蛋白大小选用12%分离胶和4%浓缩胶进行聚丙烯酰胺凝胶电泳分离样品总蛋白。电泳结束后采用半干转移法将凝胶上的蛋白转印到PVDF膜上。经5%脱脂奶粉室温封闭1 h后,PVDF膜与一抗4°C孵育12 h,洗膜3次,每次10 min,接着PVDF膜与对应的二抗37°C孵育1 h,洗膜3次,每次10 min。最后,PVDF膜与ECL发光液(1﹕1配制)孵育1 min后,置于凝胶成像系统中曝光显影并拍照。采用Image J软件进行蛋白条带灰度分析。
1.10 数据分析
每次试验所用的卵母细胞均来自同一批次的卵巢,每组进行3次以上重复试验,且每组卵母细胞不少于25枚。采用Graph Pad Prism 5.0软件进行独立样本t测验或单因素方差分析(analysis of variance,ANOVA)。所有试验数据用平均数± 标准误表示。<0.05判为差异显著。
2 结果
2.1 不同浓度FB1对猪卵母细胞第一极体排出率的影响
为研究不同浓度FB1对卵母细胞体外成熟的影响,在TCM 199成熟培养液中分别添加0,10,20和30 μg·mL-1FB1,培养44 h后,在体视显微镜下观察PB1排出情况。如图1所示,对照组中大部分卵母细胞(74.97%3.42%)排出PB1,发育至MII期,而在不同浓度FB1处理组中,随着FB1浓度的增加,PB1排出率呈现出浓度依赖性下降的趋势,当FB1作用浓度达到20和30 μg·mL-1时,PB1排出率显著下降至(49.882.45)%(<0.01)和(33.203.04)%(<0.001)。以上结果提示,FB1处理显著抑制PB1排出,导致卵母细胞成熟失败。由于20 μg·mL-1FB1处理导致卵母细胞成熟率显著降低,具有统计学差异(<0.01),且仍有部分卵母细胞可以发育到MII期,有利于激活后进一步评价胚胎发育潜力,故选取20 μg·mL-1作为后续试验的FB1处理浓度。

A:卵母细胞体外培养44 h后的形态(黑色箭头指向第一极体);B:不同浓度FB1处理对PB1排出率的影响
2.2 FB1对卵母细胞激活后胚胎发育潜力的影响
为进一步探讨FB1对猪卵母细胞发育潜力的影响,挑选出FB1处理后仍发育至MII期的卵母细胞进行孤雌激活,在PZM-3胚胎培养液中进行胚胎培养,分别在培养48和168 h后,检查卵裂和囊胚发育情况。如图2所示,FB1处理组中有(58.732.96)%的胚胎发生了卵裂,(15.021.27)%的胚胎发育到了囊胚期,与对照组相比,卵裂率和囊胚率均显著降低(<0.01)。这些结果显示,FB1处理还会进一步影响卵母细胞激活后胚胎的发育能力。
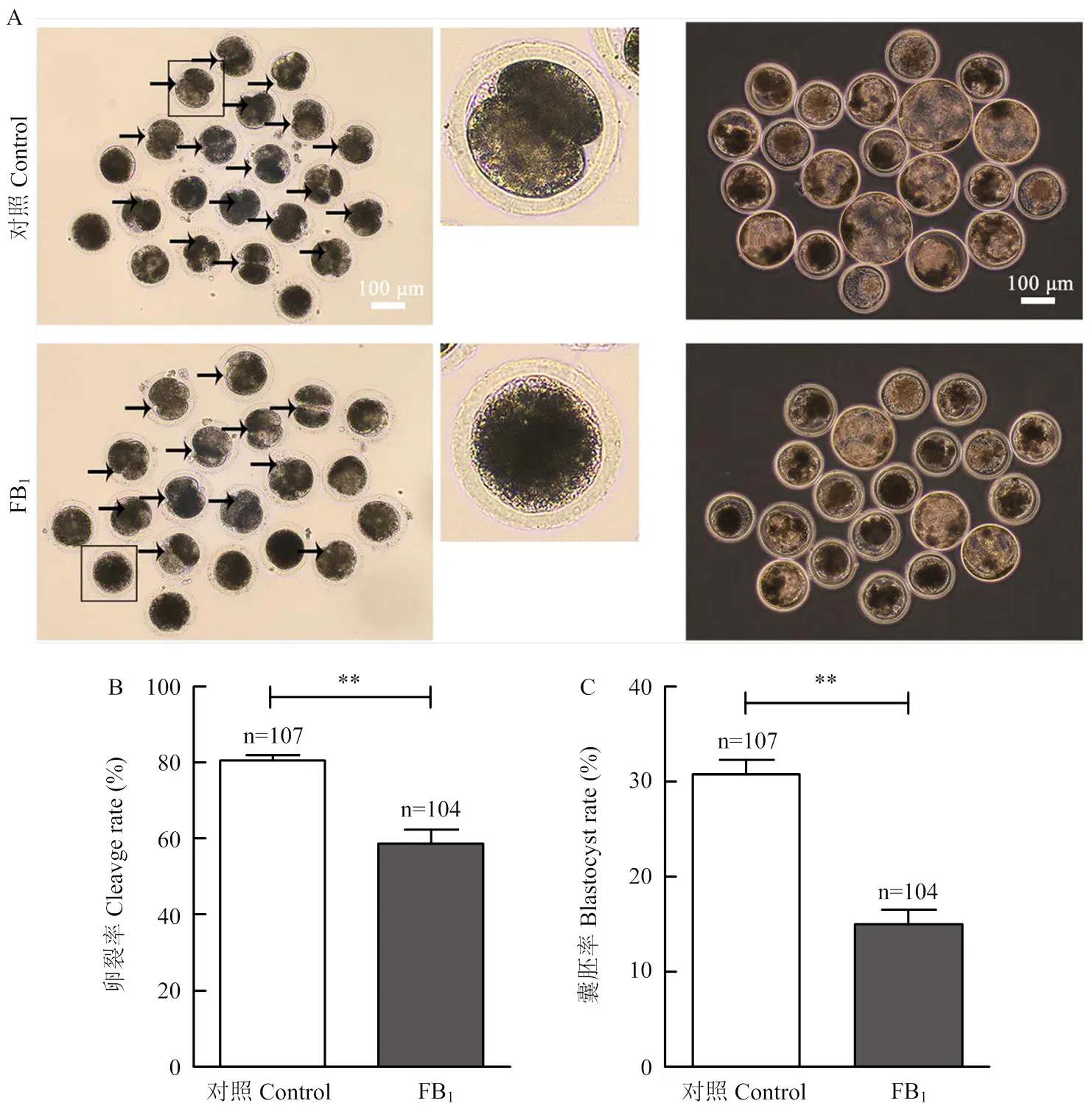
A:2细胞/4细胞胚胎和囊胚的形态(黑色箭头指向卵裂的胚胎);B:卵裂率;C:囊胚率
2.3 FB1对猪卵母细胞减数分裂进程的影响
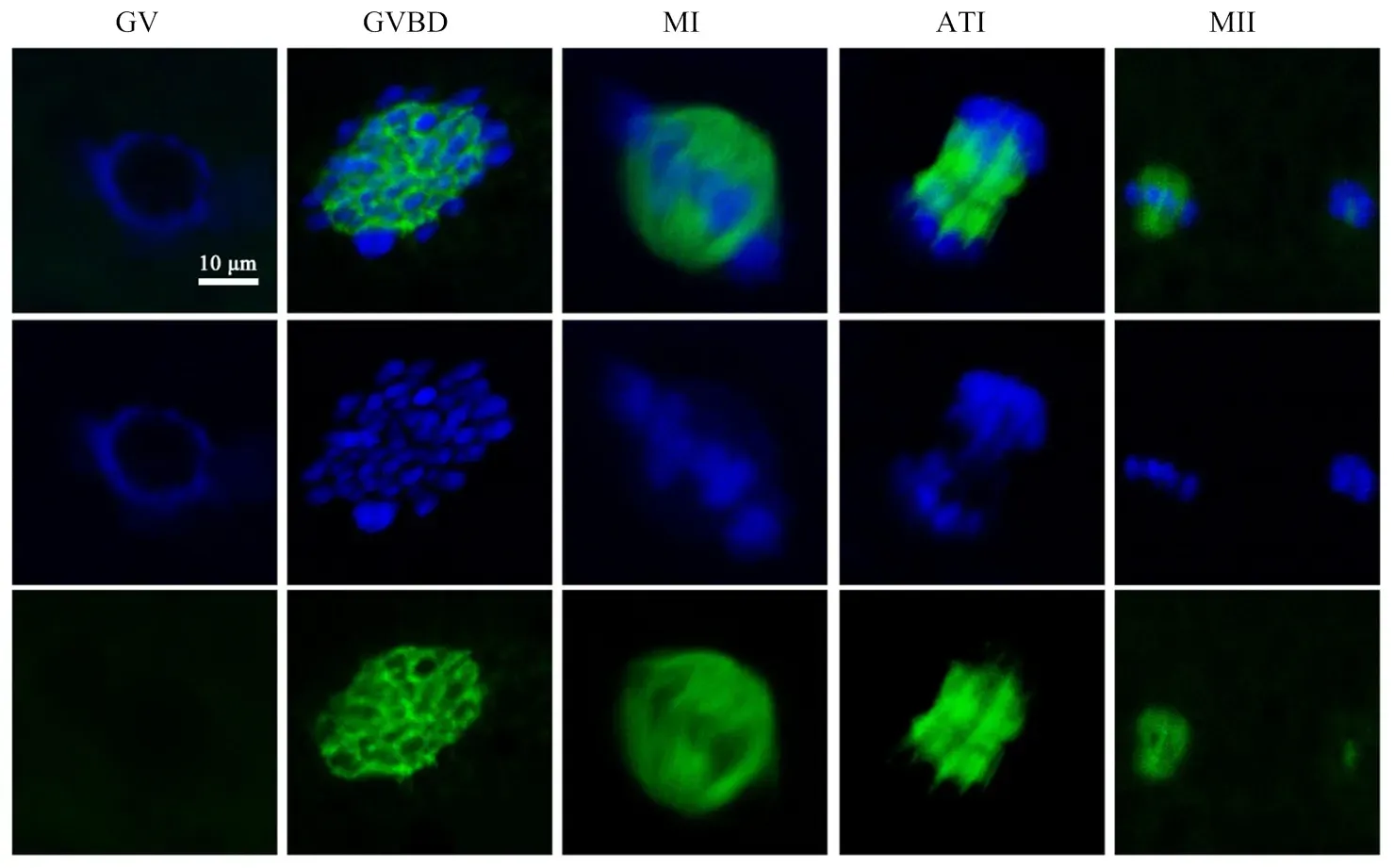
为探究FB1处理导致卵母细胞成熟失败的原因,我们通过免疫荧光染色与共聚集成像技术分析了FB1处理44 h后卵母细胞减数分裂周期进程的变化情况。首先,研究了猪卵母细胞成熟过程中正常细胞骨架的动态分布规律,结果如图3所示,根据减数分裂各时期纺锤体微管及染色体的结构特征[20],将减数分裂过程分为5个时期:生发泡期(germinal vesicle,GV)、生发泡破裂期(germinal vesicle breakdown,GVBD)、第一次减数分裂中期(metaphase I,MI)、第一次减数分裂后期-末期(anaphase-telophase I,ATI)、第二次减数分裂中期(metaphase II,MII)。在GV期,染色质呈环状,有完整的核膜;在GVBD期,核膜破裂,染色质凝聚成染色体,微管聚集在凝聚的染色体周围形成网状结构;在MI期,同源染色体在赤道板上重组排列,与微管组装形成典型的中期双极纺锤体。在ATI期,通过纺锤体牵引成功分离同源染色体,微管分布在两组染色体之间。在MII期,PB1排出,微管和重组染色体在皮质下组装成新的减数分裂纺锤体。
细胞周期统计结果如图4所示,对照组大部分卵母细胞排出PB1,发育至MII期(75.832.45)%,只有少量卵母细胞停留在GVBD期(10.831.80)%,然而FB1处理组中MII期卵母细胞比例显著减少至(51.222.72)%(<0.01),同时GVBD期卵母细胞比例显著增加至(29.700.77)%(<0.01)。综上结果表明,FB1处理会扰乱猪卵母细胞减数分裂的周期进程,并使细胞成熟分裂阻滞在GVBD期。
2.4 FB1对猪卵母细胞纺锤体结构的影响
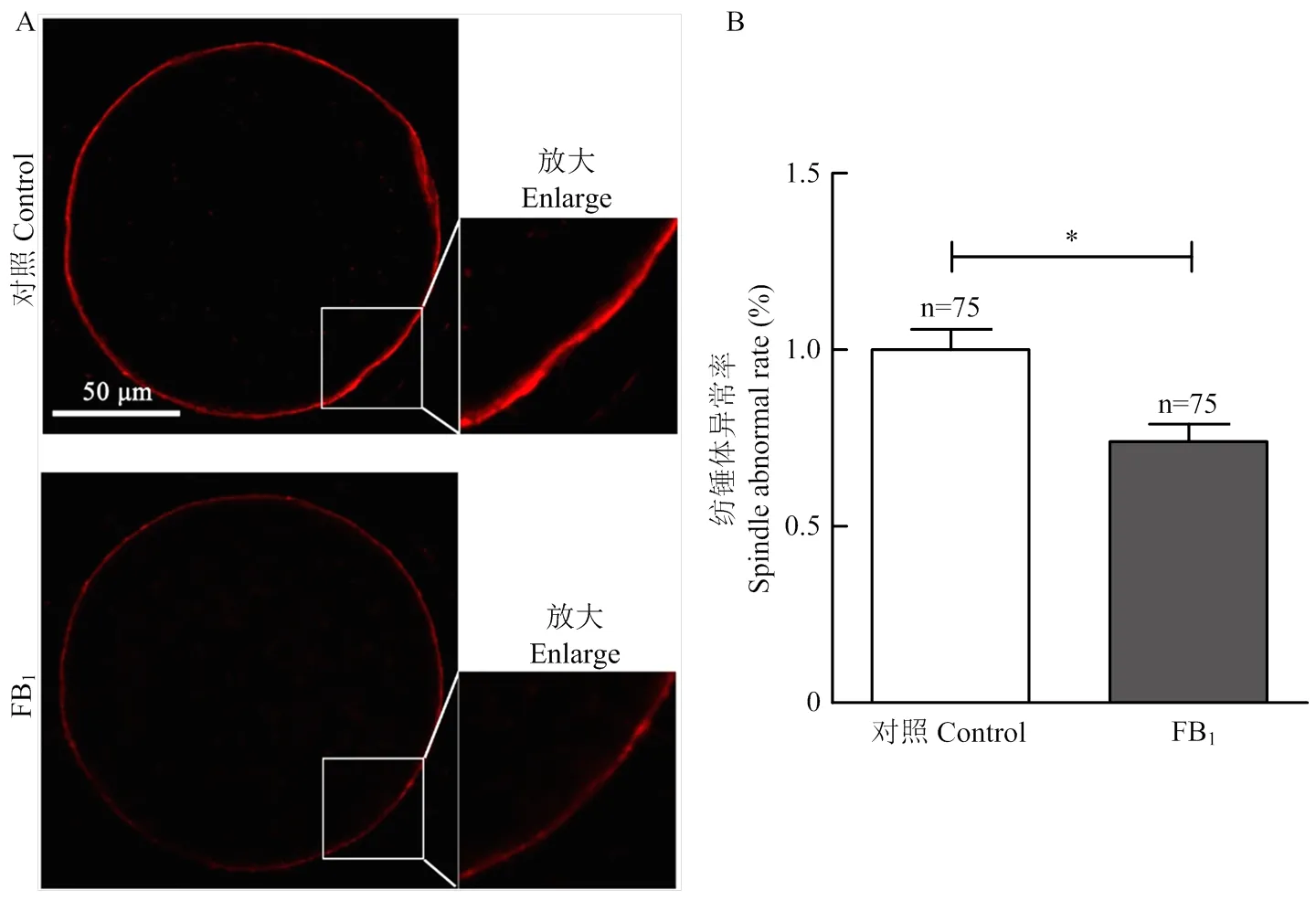
为了探究FB1处理引起卵母细胞减数分裂阻滞在GVBD期而不能发育至MI期的原因,我们进一步检测了FB1处理28 h后的卵母细胞纺锤体的组装情况。如图5所示,对照组卵母细胞的染色体聚集排列在赤道板上,两侧的微管蛋白α-tubulin装配成典型的纺锤体结构,显示出较低的纺锤体异常率(26.371.84)%。与对照组相比,FB1处理后卵母细胞纺锤体异常率显著升高至(51.411.77)%(<0.01),表现为微管结构紊乱、染色体排列不齐。这一结果表明,FB1处理导致MI期卵母细胞纺锤体结构异常。
2.5 FB1对猪卵母细胞微丝表达与分布的影响
通过微丝荧光染色分析了FB1处理对MI期卵母细胞微丝表达与分布的影响。结果如图6所示,对照组和FB1处理组中卵母细胞的微丝信号均定位在细胞膜上,但与对照组卵母细胞膜上较强的微丝信号相比,FB1处理组卵母细胞膜上的微丝荧光信号显著减弱(1.000.05 VS 0.740.04,<0.05)。以上结果提示,FB1干扰了MI期卵母细胞胞膜上的微丝表达与分布。
蓝色:染色体;绿色:微管 Blue: chromosome; green: tubulin
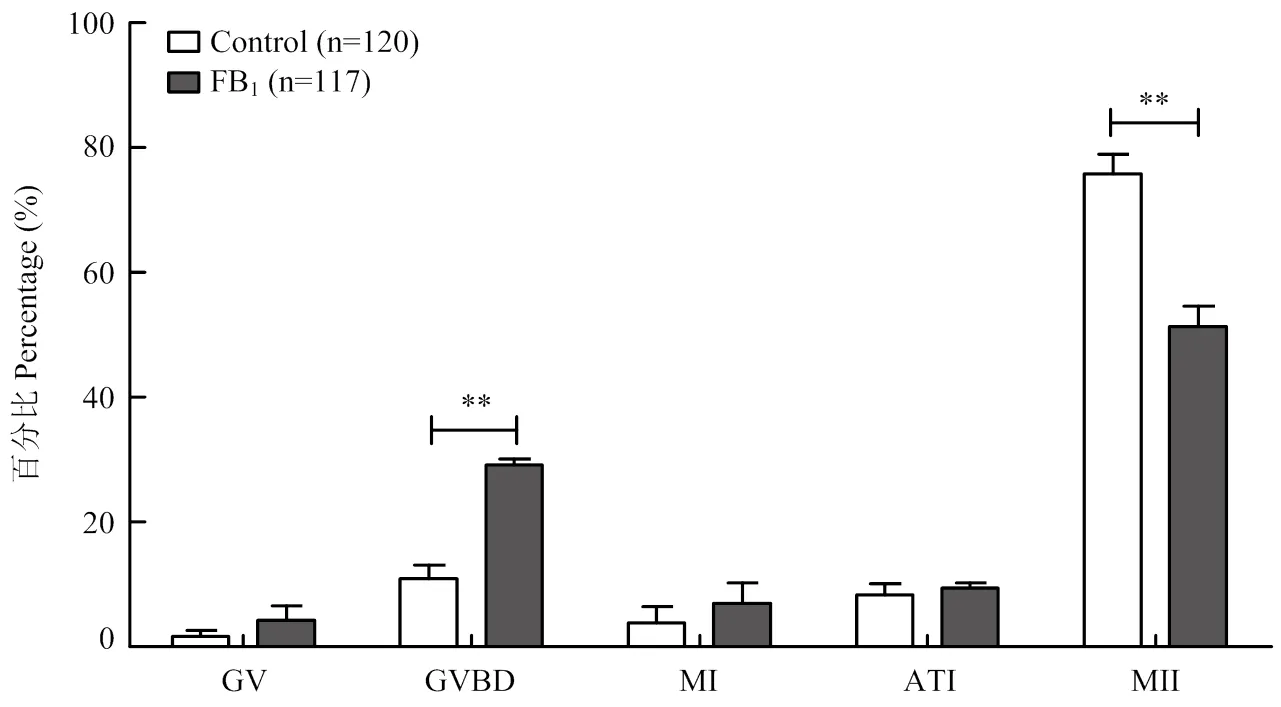
GV:生发泡期;GVBD:生发泡破裂期;MI:第一次减数分裂中期;ATI:第一次减数分裂后-末期;MII:第二次减数分裂中期

A:纺锤体结构和染色体排列的代表性图像(蓝色:染色体;绿色:微管);B:纺锤体异常百分比
A:微丝分布的代表性图像(红色:微丝);B:胞膜上微丝的相对平均荧光强度
2.6 FB1对猪卵母细胞线粒体膜电位的影响
试验进一步研究了FB1对猪卵母细胞线粒体膜电位的影响。结果如图7所示,与对照组相比,FB1处理组卵母细胞中的JC-信号(即红/绿荧光强度比值)显著降低(1.000.06 VS 0.670.02,<0.05),指示线粒体膜电位的下降[23]。以上结果提示,FB1作用后,猪卵母细胞的线粒体膜电位受到损伤,发生了明显的去极化。
2.7 FB1对猪卵母细胞早期凋亡的影响
本试验使用Annexin V-FITC对卵母细胞进行早期凋亡染色鉴定,结果如图8所示,与对照组相比,FB1处理组中卵母细胞膜上呈现清晰且强烈的绿色荧光信号,提示发生了早期凋亡[20]。统计分析显示FB1处理组凋亡卵母细胞比例(45.74%3.79%)显著高于对照组(15.54%1.12%,<0.01)。蛋白免疫印迹分析结果也显示,与对照组相比,FB1处理组中BAX蛋白表达显著增加(1.000.08 VS 1.870.09,<0.05),BCL2蛋白表达显著下降(1.000.05 VS 0.570.09,<0.05)。以上结果提示,FB1处理诱导猪卵母细胞发生了凋亡。
2.8 FB1对猪卵母细胞自噬水平的影响
为了研究FB1处理是否会导致卵母细胞自噬的发生,我们检测了卵母细胞中自噬的生物标记LC3的表达情况。结果如图9所示,在对照组卵母细胞胞质中仅有少量的自噬红色荧光信号,而FB1处理组卵母细胞胞质中的红色荧光强度显著增加(1.000.05 VS 1.600.04,<0.01)。接着,通过免疫印迹的方法检测了LC3A/B蛋白的表达。结果表明,FB1处理组中LC3A/B II的蛋白表达水平明显高于对照组(1.000.09 VS 2.030.26,<0.05),提示自噬水平升高[24]。以上结果提示,FB1处理导致猪卵母细胞发生自噬,这可能是导致卵母细胞成熟率下降及发育能力降低的原因之一。
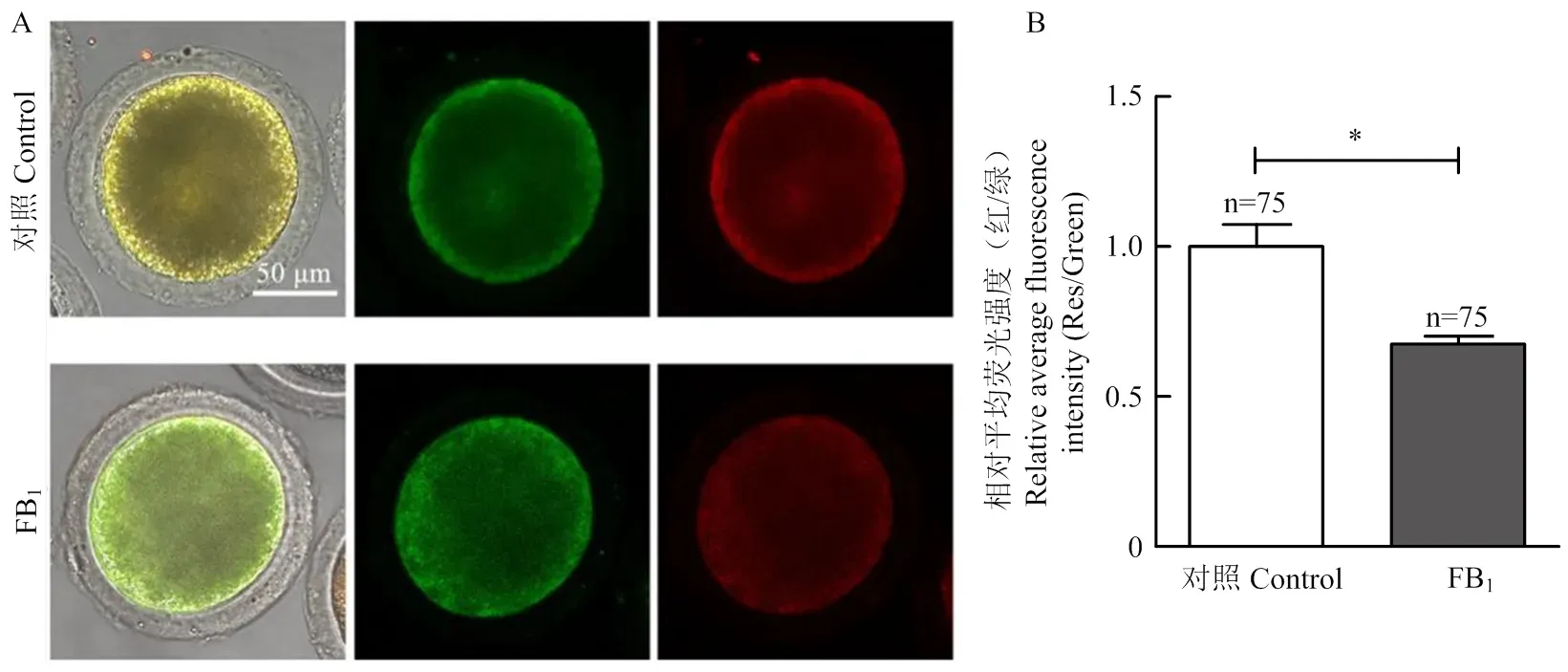
A:JC-1染色的代表性图像(绿色:JC-1单体;红色:JC-1聚集体;黄色:合并图);B:JC-1红/绿信号的相对平均荧光强度

A:Annexin-V-FITC染色的代表性图像和早期凋亡率(绿色:Annexin V荧光信号);B:BAX和BCL2蛋白表达
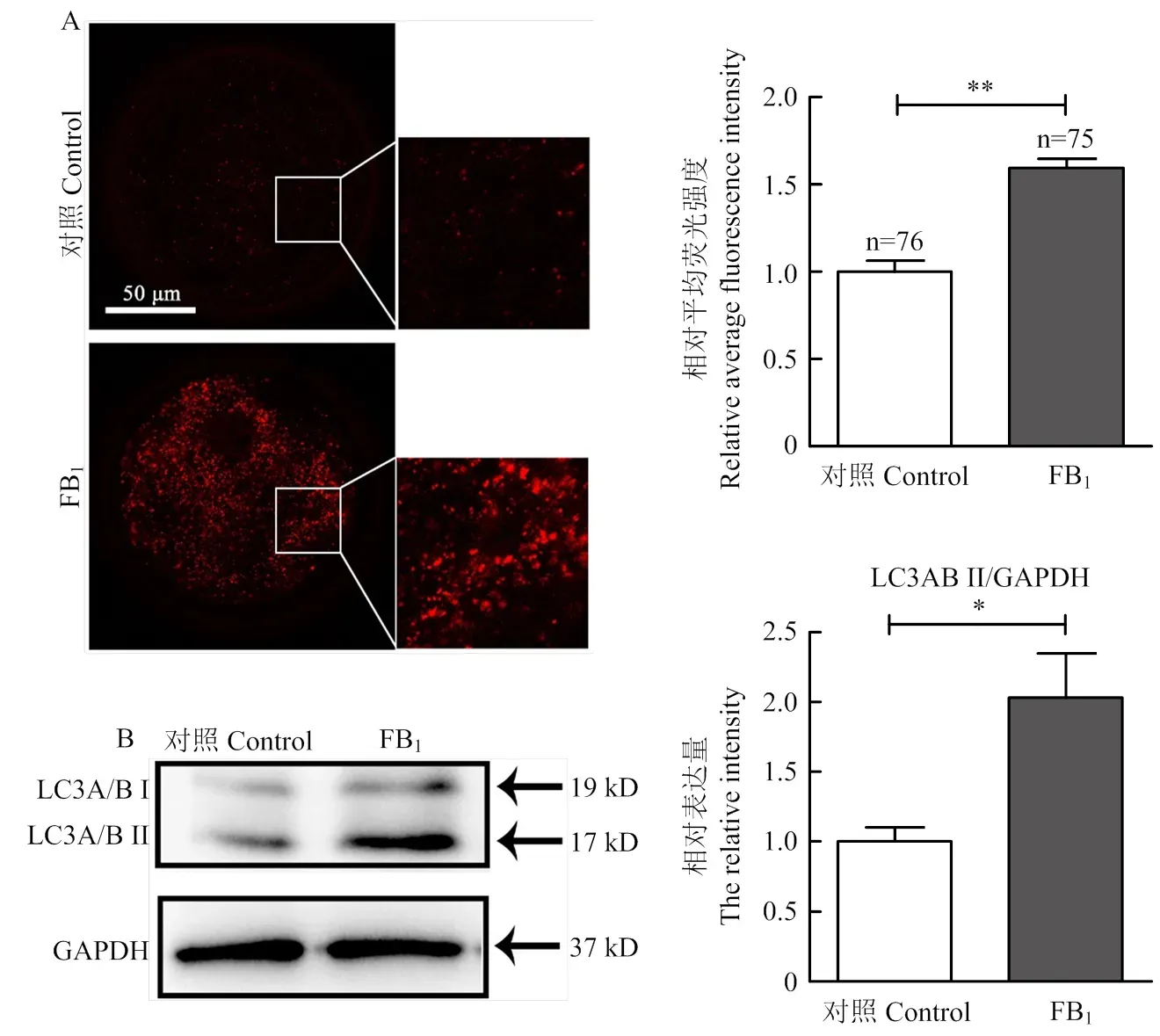
A:LC3A/B染色的代表性图像和LC3A/B信号的相对平均荧光强度(红色:LC3荧光信号);B:LC3A/B蛋白表达
3 讨论
近年来,FB1污染食品和饲料已成为一个日益严重的问题,体内及体外研究均表明FB1会对动物生殖系统造成严重危害[16-17, 19]。但FB1是否会对动物生殖细胞直接产生毒性损伤,目前尚不明确。本研究以体外成熟进程中的猪卵母细胞为研究对象,结合间接免疫荧光染色、蛋白免疫印迹等试验方法,探讨了FB1对猪卵母细胞体外成熟的影响及潜在的作用机制。结果表明,FB1可显著抑制猪卵母细胞体外成熟及其激活后早期胚胎发育,其毒性作用机制与诱导细胞骨架损伤、触发凋亡和激活自噬密切相关。
3.1 FB1对猪卵母细胞体外成熟的影响
哺乳动物卵母细胞减数分裂是精密复杂的生物学过程,该过程能否正常进行直接影响到后期胚胎的发育,而PB1的顺利排出是判定卵母细胞成熟的重要评估指标[25-26]。笔者的研究结果首先发现,当FB1剂量达20μg·mL-1以上时,卵母细胞PB1排出率被显著抑制,激活后胚胎的卵裂与囊胚胎发育率也明显降低,提示FB1处理不仅对卵母细胞体外成熟具有明显抑制作用,还会进一步影响卵母细胞的发育潜力。哺乳动物卵母细胞成熟分裂包括两次连续的减数分裂,而两次减数分裂的顺利完成与细胞骨架及细胞周期进程的精密协调密切相关[27]。本研究发现FB1处理会扰乱猪卵母细胞减数分裂的周期进程,并使细胞分裂阻滞在GVBD期。之前在其他多种细胞类型的研究结果也证实FB1可通过扰乱细胞周期来发挥其细胞毒性作用[28-30]。本研究结果表明FB1可诱导猪卵母细胞减数分裂周期阻滞在GVBD期,导致卵母细胞成熟失败。
纺锤体组装和微丝分布在减数分裂过程中至关重要,微丝肌动蛋白调节减数分裂纺锤体的迁移并启动PB1排出进程,而微管形成纺锤体牵引着染色体排列在赤道板上,并牵引染色体发生分离,这些事件中的任何错误都可能导致细胞周期停止[31]。由于FB1处理导致细胞周期停滞在GVBD期,我们检测了MI期卵母细胞的细胞骨架结构。结果发现FB1处理导致MI期卵母细胞纺锤体结构紊乱、微丝分布减弱。这一结果提示FB1对猪卵母细胞的纺锤体结构和微丝分布具有明显的毒性损伤作用。ZHAO等[32]研究发现FB1处理可破坏和解聚人脐静脉内皮细胞的细胞骨架结构,并改变微丝结合蛋白的mRNA表达。这些研究表明FB1可通过损伤细胞骨架系统进而影响细胞周期进程。细胞内的能量需求以及微管、微丝等细胞器的迁移都与线粒体密切相关,线粒体功能对于卵母细胞成熟分裂和早期胚胎发育至关重要,而线粒体膜电位是线粒体活性的重要指标,在ATP产生、氧化还原平衡、信号转导和代谢过程中起着重要作用[33-34]。研究表明发育潜能越好的卵母细胞,线粒体膜电位值越高[35]。最新研究表明线粒体是FB1的重要分子靶点,诱导线粒体功能障碍是FB1毒性的一个重要作用机制[36]。ARUMUGAM等[37]在人肝癌(HepG2)细胞上的一项研究发现FB1处理HepG2细胞24 h后,导致线粒体膜电位显著降低。为了进一步研究FB1潜在的毒性作用机制,我们检测了FB1对猪卵母细胞线粒体功能的影响。结果表明,FB1处理后,卵母细胞线粒体膜电位显著下降,提示FB1处理导致卵母细胞线粒体受损。
3.2 FB1对猪卵母细胞潜在的毒性作用机制
细胞凋亡是卵母细胞和胚胎质量的重要评估参数[38]。已有研究表明,线粒体在细胞凋亡中发挥核心作用,其膜电位的下降是细胞早期凋亡的标志性事件[20, 34]。多项研究表明FB1处理可诱导不同细胞系发生凋亡[13, 39-42]。通过Annexin-V染色,我们发现经FB1处理后大量卵母细胞发生早期凋亡。促凋亡因子BAX和抑凋亡因子BCL2在调控凋亡中发挥重要作用,在线粒体介导的凋亡通路中,异常的细胞内信号导致BAX的激活,抑制BCL2的表达,诱导线粒体释放细胞色素C,形成凋亡小体或启动CASPASE级联激活,导致凋亡发生[34, 43]。为进一步验证FB1对猪卵母细胞的毒性作用机制是否与线粒体介导的凋亡有关,我们对FB1处理后卵母细胞BAX和BCL2的蛋白表达进行了检测分析,结果发现,BAX蛋白表达显著上升,而BCL2蛋白表达显著下降,这些结果进一步表明FB1处理致使卵母细胞发生凋亡,这可能是FB1诱导卵母细胞毒性损伤的又一重要作用机制。
自噬是细胞中错误折叠蛋白和受损细胞器的降解过程,在多种生理过程中发挥着重要作用。正常生理状态下,细胞的自噬能力处于基础水平,当细胞处于应激状态时,如能量缺乏、病原体感染或是暴露于不良环境中时,自噬水平会被迅速诱导升高以回收细胞质物质来生产能量,其中,自噬调节细胞死亡是自噬最重要的功能之一[44]。已有研究表明过度或长期的自噬可引发细胞毒性作用[45]。YIN等和ZHANG等[39-40]研究发现FB1处理可通过激活自噬诱导MARC-145肾细胞和玉米螟昆虫血细胞自噬性细胞死亡。本研究结果显示FB1处理组卵母细胞LC3A/B的荧光强度显著升高,LC3A/B II的蛋白表达水平升高,提示卵母细胞自噬水平显著升高。综合以上结果表明FB1还可通过诱导细胞发生自噬,导致猪卵母细胞体外成熟失败。
4 结论
本研究结果证明伏马毒素B1处理可扰乱减数分裂周期进程,破坏细胞骨架和线粒体功能致使第一极体排出失败,最终导致卵母细胞成熟受到抑制。伏马毒素B1对猪卵母细胞的毒性损伤作用机制与诱导细胞凋亡与自噬密切相关。本研究结果为深入了解伏马毒素B1的生殖毒性作用及其机制提供了试验依据,也为临床上有效防治伏马毒素B1的生殖毒性损伤提供了理论参考。
[1] KAMLE M, MAHATO D K, DEVI S, LEE K E, KANG S G, KUMAR P.Fumonisins: impact on agriculture, food, and human health and their management strategies.Toxins, 2019, 11(6): 328.doi:10.3390/toxins11060328.
[2] RHEEDER J P, MARASAS W F O, VISMER H F.Production of fumonisin analogs byspecies.Applied and Environmental Microbiology, 2002, 68(5): 2101-2105.doi:10.1128/AEM.68.5.2101- 2105.2002.
[3] ARUMUGAM T, GHAZI T, CHUTURGOON A.Fumonisin B1epigenetically regulates PTEN expression and modulates DNA damage checkpoint regulation in HepG2 liver cells.Toxins, 2020, 12(10): 625.doi:10.3390/toxins12100625.
[4] STOEV S D, GUNDASHEVA D, ZARKOV I, MIRCHEVA T, ZAPRYANOVA D, DENEV S, MITEV Y, DASKALOV H, DUTTON M, MWANZA M, SCHNEIDER Y J.Experimental mycotoxic nephropathy in pigs provoked by a mouldy diet containing ochratoxin A and fumonisin B1.Experimental and Toxicologic Pathology, 2012, 64(7/8): 733-741.doi:10.1016/j.etp.2011.01.008.
[5] STOCKMANN-JUVALA H, ALENIUS H, SAVOLAINEN K.Effects of fumonisin B(1) on the expression of cytokines and chemokines in human dendritic cells.Food and Chemical Toxicology, 2008, 46(5): 1444-1451.doi:10.1016/j.fct.2007.12.004.
[6] Domijan A M.Fumonisin B(1): a neurotoxic mycotoxin.Arhiv za higijenu rada i toksikologiju.2012,63(4): 531-544.doi: 10.2478/ 10004-1254-63-2012-2239.
[7] GBORE F A.Brain and hypophyseal acetylcholinesterase activity of pubertal boars fed dietary fumonisin B1.Journal of Animal Physiology and Animal Nutrition, 2010, 94(5): e123-e129.doi:10.1111/j.1439-0396.2010.00992.x.
[8] LUMSANGKUL C, CHIANG H I, LO N W, FAN Y K, JU J C.Developmental toxicity of mycotoxin fumonisin B1in animal embryogenesis: an overview.Toxins, 2019, 11(2): 114.doi:10.3390/ toxins11020114.
[9] SUN G J, WANG S K, HU X, SU J J, HUANG T R, YU J H, TANG L L, GAO W M, WANG J S.Fumonisin B1contamination of home- grown corn in high-risk areas for esophageal and liver cancer in China.Food Additives & Contaminants, 2007, 24(2): 181-185.doi:10.1080/ 02652030601013471.
[10] LIU X Y, FAN L H, YIN S T, CHEN H, HU H B.Molecular mechanisms of fumonisin B1-induced toxicities and its applications in the mechanism-based interventions.Toxicon, 2019, 167: 1-5.doi:10.1016/j.toxicon.2019.06.009.
[11] DESAI K N, SULLARDS M C, ALLEGOOD J, WANG E, SCHMELZ E M, HARTL M, HUMPF H U, LIOTTA D C, PENG Q, MERRILL A H Jr.Fumonisins and fumonisin analogs as inhibitors of ceramide synthase and inducers of apoptosis.Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, 2002, 1585(2/3): 188-192.doi:10.1016/S1388-1981(02)00340-2.
[12] STOCKMANN-JUVALA H, MIKKOLA J, NAARALA J, LOIKKANEN J, ELOVAARA E, SAVOLAINEN K.Oxidative stress induced by fumonisin B1 in continuous human and rodent neural cell cultures.Free Radical Research, 2004, 38(9): 933-942.doi:10.1080/ 10715760412331273205.
[13] KIM S H, SINGH M P, SHARMA C, KANG S C.Fumonisin B1actuates oxidative stress-associated colonic damage via apoptosis and autophagy activation in murine model.Journal of Biochemical and Molecular Toxicology, 2018, 32(7): e22161.doi:10.1002/jbt.22161.
[14] GBORE F A.Reproductive organ weights and semen quality of pubertal boars fed dietary fumonisin B1.Animal, 2009, 3(8): 1133-1137.doi:10.1017/S1751731109004467.
[15] HENRY M H, WYATT R D.The toxicity of fumonisin B1, B2, and B3, individually and in combination, in chicken embryos.Poultry Science, 2001, 80(4): 401-407.doi:10.1093/ps/80.4.401.
[16] CORTINOVIS C, PIZZO F, SPICER L J, CALONI F.mycotoxins: effects on reproductive function in domestic animals—A review.Theriogenology, 2013, 80(6): 557-564.doi:10.1016/j.theriogenology.2013.06.018.
[17] 郭隽, 张立实, 彭双清.镰刀菌毒素生殖发育毒性研究进展.中国食品卫生杂志, 2013(5): 474-478.
GUO J, ZHANG L S, PENG S Q.Review of reproductive and developmental toxicity studies oftoxins.Chinese Journal of Food Hygiene, 2013(5): 474-478.(in Chinese)
[18] SOMOSKŐI B, KOVÁCS M, CSEH S.Effects of T-2 and Fumonisin B1 combined treatment onmouse embryo development and blastocyst quality.Toxicology and Industrial Health, 2018, 34(5): 353-360.doi:10.1177/0748233718764039.
[19] CORTINOVIS C, CALONI F, SCHREIBER N B, SPICER L J.Effects of fumonisin B1 alone and combined with deoxynivalenol or Zearalenone on porcine granulosa cell proliferation and steroid production.Theriogenology, 2014, 81(8): 1042-1049.doi:10.1016/j.theriogenology.2014.01.027.
[20] SHI F Y, LI W H, ZHAO H Y, HE Y J, JIANG Y, NI J, ABBASI B, RUI R, JU S Q.Microcystin-LR exposure results in aberrant spindles and induces apoptosis in porcine oocytes.Theriogenology, 2020, 158: 358-367.doi:10.1016/j.theriogenology.2020.09.031.
[21] CUI P P, ABBASI B, LIN D F, RUI R, JU S Q.Aurora A inhibition disrupts chromosome condensation and spindle assembly during the first embryonic division in pigs.Reproduction in Domestic Animals, 2020, 55(5): 584-593.doi:10.1111/rda.13655.
[22] YANG C X, WANG P C, LIU S, MIAO J K, LIU X M, MIAO Y L, DU Z Q.Long noncoding RNA 2193 regulates meiosis through global epigenetic modification and cytoskeleton organization in pig oocytes.Journal of Cellular Physiology, 2020, 235(11): 8304-8318.doi:10.1002/jcp.29675.
[23] DING Z M, AHMAD M J, MENG F, CHEN F, WANG Y S, ZHAO X Z, ZHANG S X, MIAO Y L, XIONG J J, HUO L J.Triclocarban exposure affects mouse oocytematuration through inducing mitochondrial dysfunction and oxidative stress.Environmental Pollution, 2020, 262: 114271.doi:10.1016/j.envpol.2020.114271.
[24] MAN W R, GU J, WANG B, ZHANG M M, HU J Q, LIN J, SUN D, XIONG Z Y, GU X M, HAO K K, GUO B L, WEI G L, ZHANG L, SONG R, LI C Y, WANG H C, SUN D D.SHANK3co-ordinately regulates autophagy and apoptosis in myocardial infarction.Frontiers in Physiology, 2020, 11: 1082.doi:10.3389/fphys.2020.01082.
[25] REYES J M, ROSS P J.Cytoplasmic polyadenylation in mammalian oocyte maturation.Wiley Interdisciplinary Reviews: RNA, 2016, 7(1): 71-89.doi:10.1002/wrna.1316.
[26] 黄向月, 熊显荣, 韩杰, 杨显英, 王艳, 王斌, 李键.KDM1A在牦牛卵泡发育过程中的表达.中国农业科学, 2019, 52(24): 4624-4631.doi:10.3864/j.issn.0578-1752.2019.24.016.
HUANG X Y, XIONG X R, HAN J, YANG X Y, WANG Y, WANG B, LI J.Expression pattern of KDM1A in the development of yak follicles.Scientia Agricultura Sinica, 2019, 52(24): 4624-4631.doi:10.3864/j.issn.0578-1752.2019.24.016.(in Chinese)
[27] BRUNET S, MARO B.Cytoskeleton and cell cycle control during meiotic maturation of the mouse oocyte: integrating time and space.Reproduction (Cambridge, England), 2005, 130(6): 801-811.doi:10.1530/rep.1.00364.
[28] ZHANG H, ZHANG L Y, DIAO X, LI N, LIU C L.Toxicity of the mycotoxin fumonisin B1on the insect Sf9 cell line.Toxicon, 2017, 129: 20-27.doi:10.1016/j.toxicon.2017.01.018.
[29] MARIN D E, GOUZE M E, TARANU I, OSWALD I P.Fumonisin B1 alters cell cycle progression and interleukin-2 synthesis in swine peripheral blood mononuclear cells.Molecular Nutrition & Food Research, 2007, 51(11): 1406-1412.doi:10.1002/mnfr.200700131.
[30] 秦伟森.伏马菌素FB1对人脐静脉血管内皮细胞的毒性作用研究[D].广州: 华南农业大学, 2016.
QIN W S.Cellular and relevant factors of toxicity of fumonisin B1in human umbilical vein endothelial cells[D].Guangzhou: South China Agricultural University, 2016.(in Chinese)
[31] SUN S C, KIM N H.Molecular mechanisms of asymmetric division in oocytes.Microscopy and Microanalysis, 2013, 19(4): 883-897.doi:10.1017/S1431927613001566.
[32] ZHAO X, WANG Y, LIU J L, ZHANG J H, ZHANG S C, OUYANG Y, HUANG J T, PENG X Y, ZENG Z, HU Z Q.Fumonisin B1affects the biophysical properties, migration and cytoskeletal structure of human umbilical vein endothelial cells.Cell Biochemistry and Biophysics, 2020, 78(3): 375-382.doi:10.1007/s12013-020-00923-4.
[33] AL-ZUBAIDI U, LIU J, CINAR O, ROBKER R L, ADHIKARI D, CARROLL J.The spatio-temporal dynamics of mitochondrial membrane potential during oocyte maturation.Molecular Human Reproduction, 2019, 25(11): 695-705.doi:10.1093/molehr/gaz055.
[34] BOCK F J, TAIT S W G.Mitochondria as multifaceted regulators of cell death.Nature Reviews Molecular Cell Biology, 2020, 21 (2): 85-100.doi:10.1038/s41580-019-0173-8.
[35] TARAZONA A, RODRÍGUEZ J, RESTREPO L, OLIVERA-ANGEL M.Mitochondrial activity, distribution and segregation in bovine oocytes and in embryos produced.Reproduction in Domestic Animals, 2006, 41(1): 5-11.doi:10.1111/j.1439-0531.2006.00615.x.
[36] SHEIK ABDUL N, MARNEWICK J L.Fumonisin B1-induced mitochondrial toxicity and hepatoprotective potential of rooibos: an update.Journal of Applied Toxicology, 2020, 40(12): 1602-1613.doi:10.1002/jat.4036.
[37] ARUMUGAM T, PILLAY Y, GHAZI T, NAGIAH S, ABDUL N S, CHUTURGOON A A.Fumonisin B1-induced oxidative stress triggers Nrf2-mediated antioxidant response in human hepatocellular carcinoma (HepG2) cells.Mycotoxin Research, 2019, 35(1): 99-109.doi:10.1007/s12550-018-0335-0.
[38] 潘阳阳, 李秦, 崔燕, 樊江峰, 杨琨, 何俊峰, 余四九.EGF、EGFR在牦牛卵母细胞中的表达及对胚胎发育能力的作用.中国农业科学, 2015, 48(12): 2439-2448.doi:10.3864/j.issn.0578-1752.2015.12.017.
PAN Y Y, LI Q, CUI Y, FAN J F, YANG K, HE J F, YU S J.The expression of EGF and EGFR in yak oocyte and its function on development competence of embryo.Scientia Agricultura Sinica, 2015, 48(12): 2439-2448.doi:10.3864/j.issn.0578-1752.2015.12.017.(in Chinese)
[39] YIN S T, GUO X, LI J H, FAN L H, HU H B.Fumonisin B1induces autophagic cell death via activation of ERN1-MAPK8/9/10 pathway in monkey kidney MARC-145 cells.Archives of Toxicology, 2016, 90(4): 985-996.doi:10.1007/s00204-015-1514-9.
[40] ZHANG H, DIAO X, LI N, LIU C L.FB1-induced programmed cell death in hemocytes of.Toxicon, 2018, 146: 114-119.doi:10.1016/j.toxicon.2018.02.052.
[41] KHAN R B, PHULUKDAREE A, CHUTURGOON A A.Fumonisin B1induces oxidative stress in oesophageal (SNO) cancer cells.Toxicon, 2018, 141: 104-111.doi:10.1016/j.toxicon.2017.12.041.
[42] CHEN J, YANG S H, HUANG S, YAN R, WANG M Y, CHEN S, CAI J, LONG M, LI P.Transcriptome study reveals apoptosis of porcine kidney cells induced by fumonisin B1via TNF signalling pathway.Food and Chemical Toxicology, 2020, 139: 111274.doi:10.1016/j.fct.2020.111274.
[43] D'ORSI B, MATEYKA J, PREHN J H M.Control of mitochondrial physiology and cell death by the Bcl-2 family proteins Bax and Bok.Neurochemistry International, 2017, 109: 162-170.doi:10.1016/j.neuint.2017.03.010.
[44] DENTON D, XU T Q, KUMAR S.Autophagy as a pro-death pathway.Immunology and Cell Biology, 2015, 93(1): 35-42.doi:10.1038/icb.2014.85.
[45] FULDA S, KÖGEL D.Cell death by autophagy: emerging molecular mechanisms and implications for cancer therapy.Oncogene, 2015, 34 (40): 5105-5113.doi:10.1038/onc.2014.458.
Effects of FB1on Apoptosis and Autophagy of Porcine OocytesMaturation
LI WenHui, HE YiJing, JIANG Yao, ZHAO HongYu, PENG Lei, LI Jia, RUI Rong, JU ShiQiang*
College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095
【Objective】The purpose of this study was to investigate the effects of fumonisin B1(FB1) on porcine oocytematuration and its potential mechanism, so as to provide the theoretical reference for effective prevention and treatment of reproductive toxicity injury caused by FB1in the clinic.【Method】Porcine cumulus oocyte complexes (COCs) were collected and randomly divided into groups, and treated with different concentrations of FB1(0, 10, 20 and 30 μg·mL-1) for 44 h duringmaturation, respectively.Then, the first polar body (PB1) extrusion and embryo development after activation of oocytes were analyzed, and the effects of FB1on meiotic progression and cytoskeleton structure of oocytes were further detected by immunofluorescence staining and combined with confocal microscopy.In order to further explore the mechanism of FB1on toxic injury of porcine oocytes, the JC-1, Annexin V-FITC and LC3A/B fluorescence staining were used to detect mitochondrial function, early apoptosis and autophagy levels in oocytes, respectively.On this basis, the expression of apoptosis/autophagy related to proteins were further analyzed by Western blotting.【Result】FB1treatment had significant inhibitory effects on oocyte maturation, while PB1 extrusion rate decreased in a concentration-dependent manner.When the concentration of FB1reached more than 20 μg·mL-1, the PB1 extrusion was significantly decreased (<0.01), and the cleavage rate and blastocyst rate of the embryos after oocytes parthenogenetic activation were significantly decreased (<0.01),damaging the development potential of oocytes to a certain extent.And the cell cycle analysis showed that FB1treatment also disordered the meiotic cycle progression, resulting in a significant increase in the proportion of oocytes that arrested at germinal vesicle breakdown (GVBD) (<0.01), and a significant decrease in the proportion of oocytes that successfully developed to the Metaphase II (MII) (<0.01), with an increase in spindle abnormal rate (<0.01) and a decrease in actin distribution at the plasma membrane (<0.05).Further studies showed that, compared with control group, the mitochondrial membrane potential was significantly decreased (<0.05), impairing mitochondrial function.At the same time, the rate of early apoptosis was obviously increased (<0.01), and the level of autophagy was also significantly increased (<0.01) in FB1-treated oocytes.Western blotting analysis showed that the expressions of pro-apoptotic protein BAX and autophagy protein LC3A/B II in FB1-treated oocytes were significantly up-regulated (<0.05), and the expression of anti-apoptotic protein BCL2 was significantly down-regulated (<0.05), indicating the occurrence of early apoptosis and autophagy.【Conclusion】FB1had obvious toxic effects on porcine oocyte maturationand embryo development after activation, resulting in meiotic cycle arrest, spindle structure disorder, actin distribution reduction and mitochondrial injury, and its toxic mechanism might be related to the induction of apoptosis and autophagy in oocytes.
porcine oocytes; fumonisin B1; cytoskeleton; apoptosis; autophagy
2021-01-29;
2021-06-17
国家自然科学基金(31972759,31572589)、南京农业大学2019年大学生创新创业训练专项计划(S20190021)、南京农业大学“课程思政”示范项目(KCSZ2020044)
李文慧,E-mail:1065167020@qq.com。通信作者剧世强,E-mail:jusq@njau.edu.cn
(责任编辑 林鉴非)

