查尔酮合成酶基因在葡萄抗灰霉病和霜霉病中的作用
郭泽西,孙大运,曲俊杰,潘凤英,刘露露,尹玲
查尔酮合成酶基因在葡萄抗灰霉病和霜霉病中的作用
郭泽西,孙大运,曲俊杰,潘凤英,刘露露,尹玲*
广西壮族自治区农业科学院广西作物遗传改良生物技术重点开放实验室,南宁 530007
【目的】克隆不同抗性葡萄品种中查尔酮合成酶(chalcone synthase)基因,明确该基因在葡萄灰霉病菌()和葡萄霜霉病菌()侵染下的表达模式,并对CHS1进行亚细胞定位和功能验证,为探究CHS1的广谱抗病作用机理提供依据。【方法】分别以毛葡萄()‘野酿二号’、欧亚种()‘无核白’和山葡萄()‘双红’叶片cDNA为模板,克隆,分析不同品种中CHS1的序列差异,并对CHS1蛋白的理化性质进行生物信息学分析;利用qRT-PCR检测不同葡萄品种受到灰霉病菌和霜霉病菌侵染后的表达模式;构建表达载体,利用农杆菌介导的瞬时表达技术,分别在烟草和‘无核白’组培苗叶片中进行亚细胞定位和抗病功能验证。【结果】在不同葡萄品种中高度保守,ORF全长均为1 182 bp,编码393个氨基酸,预测编码的蛋白分子量为42.92 kD,为稳定的亲水蛋白。受灰霉病菌侵染后,毛葡萄和欧亚种的表达模式变化类似,但灰霉病抗性品种‘野酿二号’中的表达水平整体显著偏高;受霜霉病菌侵染后,山葡萄和欧亚种表现出不同的表达模式变化,霜霉病抗性品种‘双红’中的表达量不断增加,而的表达量逐渐下降。亚细胞定位结果表明,CHS1蛋白在细胞膜质、细胞核中都有分布,但以细胞核定位为主。人工接种灰霉病菌和霜霉病菌后,与阴性对照相比,过表达VaCHS1的‘无核白’叶片具有更强的灰霉病和霜霉病抗性。【结论】抗性品种中查尔酮合成酶基因的表达量比感病品种高,过表达CHS1能够提高感病葡萄品种对灰霉病和霜霉病的抗性。
查尔酮合成酶;葡萄;灰霉病菌;霜霉病菌;抗病性
0 引言
【研究意义】葡萄是我国广泛种植的果树,其果实可以用来鲜食、酿酒、制干和制汁等,具有重大的经济价值。国家统计局统计数据显示,2019年我国葡萄种植面积达到72.62万公顷,产量为1 419.54万吨。灰霉病和霜霉病是危害葡萄生长比较严重的两种病害,会造成果实品质下降,严重减产,甚至绝收。生产上主要采用化学药剂防治灰霉病和霜霉病,普遍存在病原菌易产生抗药性,增加生产成本并造成一定的环境问题。因此,培育广谱抗病优质葡萄品种是葡萄育种的重点。将抗病品种中的查尔酮合成酶(chalcone synthase)基因转入感病品种,提高对灰霉菌和霜霉菌的抗性,了解在葡萄抗灰霉病和霜霉病中的作用机制,可为广谱抗病品种的培育提供理论依据。【前人研究进展】类黄酮(flavonoid)是一类低分子量多酚化合物的总称,在植物受到病原菌侵染时类黄酮合成途径被迅速激活,进而起到防御作用。类黄酮不仅在植物自身生理生化方面具有重要作用,例如种子的显色反应、逆境的抵抗[1]、抗病害[2]和信号传导[3]等,在临床上还具有防癌[4]、抗氧化[5]、抗疟疾和抗动脉硬化等功能。查尔酮合成酶(CHS)是类黄酮合成途径中的关键酶,也是限速酶。研究表明,在番茄[6]、亚麻[7]、小麦[8]、烟草[9]和苹果[10]中过表达能够增加对虫害和病原菌等环境胁迫的抗性,而在彩色棉中参与植株体内和纤维中花青素的合成与累积,在纤维色泽形成中起着关键作用[11]。【本研究切入点】前期本课题组通过对多个葡萄品种响应不同病原菌侵染的转录组数据分析,发现(XM_019224647.1)的表达量在不同抗性品种响应葡萄灰霉病菌()和葡萄霜霉病菌()的侵染过程中均存在显著差异,推测该基因可能与抗病相关;DAO等研究表明,植物在紫外线或病原菌等胁迫条件下会被诱导表达,从而导致类黄酮和异黄酮植物抗毒素的积累,并参与水杨酸防御途径[12-13]。因此笔者推测CHS在葡萄的抗病过程中也发挥重要作用。【拟解决的关键问题】从野生毛葡萄‘野酿二号’(cv.Yeniang-2)、欧洲葡萄‘无核白’(cv.Thompson Seedless)和山葡萄‘双红’(cv.Shuanghong)中克隆,分析其在不同品种中的序列差异和蛋白特征,并通过qRT-PCR检测该基因受灰霉病菌和霜霉病菌侵染后不同时间点的表达差异,通过叶片瞬时表达明确该基因的亚细胞定位和抗性功能,为培育广谱抗病的葡萄新品种提供新的思路和策略。
1 材料与方法
试验于2020年在广西作物遗传改良生物技术重点开放实验室完成。
1.1 材料与试剂
1.1.1 材料 野生毛葡萄‘野酿二号’由广西壮族自治区农业科学院组培苗公司提供;欧洲葡萄‘无核白’和山葡萄‘双红’来自广西壮族自治区农业科学院试验基地。葡萄灰霉病菌由北京市农林科学院植物保护研究所惠赠。葡萄霜霉病菌由广西作物遗传改良生物技术重点开放实验室葡萄分子设计育种团队分离保存。
本氏烟()和葡萄组培苗均在光照16 h、黑暗8 h,25℃生长条件下培养。
1.1.2 试剂 植物总RNA提取试剂盒Spectrum Plant Total RNA Kit购自西格玛奥德里奇(上海)贸易有限公司;反转录试剂盒PrimeScriptⅡ1st Strand cDNA Synthesis Kit购自Takara(大连)公司;高保真DNA聚合酶2×Phanta Max Master Mix、感受态细胞Fast-T1和克隆试剂盒5 min TA/Blunt-Zero Cloning Kit购自南京诺唯赞生物科技有限公司;胶回收试剂盒QIAquick Gel Extraction Kit和质粒小提试剂盒TIANprep Mini Plasmid Kit购自天根生化科技有限公司;荧光定量试剂盒LightCycle 480 SYBR GreenⅠMaster购自广州聚研生物科技有限公司。
1.2 方法
1.2.1的克隆 ‘野酿二号’‘无核白’和‘双红’叶片总RNA提取参照Spectrum Plant Total RNA Kit试剂盒说明书。参照TaKaRa公司的PrimeScriptⅡ 1st Strand cDNA Synthesis Kit的试剂盒说明书进行cDNA的合成。根据NCBI上的序列(登录号:XM_019224647.1)设计特异引物CHS1-F和CHS1-R,引物序列见表1。以cDNA为模板,利用2×Phanta Max Master Mix试剂盒进行扩增,反应条件:95℃预变性3 min;95℃ 15 s,54℃ 15 s,72℃ 45 s,30个循环;72℃延伸5 min。1%的琼脂糖凝胶电泳检测PCR产物,参照琼脂糖凝胶回收试剂盒说明书进行PCR产物回收。回收片段参照5 min TA/Blunt-Zero Cloning Kit试剂盒与T载体进行连接,37℃,连接5 min。将连接产物转化到Fast-T1化学感受态细胞。具体步骤参照Fast-T1的说明书。挑取白斑,PCR检测,检测的引物为CHS1-F和通用引物M13-F。质粒的提取步骤详见TIANprep Mini Plasmid Kit试剂盒说明书。将质粒送往上海生工公司测序。将测序的结果用软件Vector NTI Explorer进行序列的组装,碱基序列和氨基酸序列的比对使用DNAMAN软件,用蛋白质系统分析工具(http://web.expasy.org/protparam/)分析CHS1蛋白的理化参数。

表1 本试验所用引物序列
1.2.2 病原菌培养及接种方法 葡萄霜霉病菌的培养和接种:取不同葡萄品种一年生枝条上第2—4位健康的完全伸展开的幼嫩叶片,用无菌水清洗两次,滤纸吸干叶片表面水分,用打孔器打取直径为1或1.5 cm的叶盘,放入铺有两层湿润滤纸的培养皿中进行保湿。将实验室在‘赤霞’叶片上扩繁的葡萄霜霉病菌配置成浓度为2×105/mL的孢子囊悬浮液,用移液器接种到‘野酿二号’‘无核白’和‘双红’的叶盘上,每个叶盘上接种35 µL。在抗性表型观察试验中,每个品种接种12个叶盘。
葡萄灰霉菌病的培养和接种:在超净工作台上,将在PDA培养基上新活化的灰霉病菌作为接种试材。用灭过菌的打孔器在灰霉病菌菌落边缘打下直径0.5 cm菌块。如霜霉病菌接种步骤中准备的叶盘,叶盘中间用无菌牙签刺一个小孔,将灰霉病菌菌块倒扣在叶盘针刺处,使得菌丝与叶片接触。在相对湿度90%,22℃黑暗条件下培养3 d,观察发病症状。在抗性表型观察试验中,每个品种接种16个叶盘。
1.2.3的表达模式分析 取不同葡萄品种一年生枝条上第2—4位健康的幼嫩叶片,用超纯水清洗两次,滤纸吸干叶片表面水分,用打孔器打取直径为1 cm的叶盘,放入铺有两层湿润滤纸的培养皿中进行保湿。叶盘均分到5个培养皿中,每个皿的标记为0、6、12、24和48 h。每个品种选取长势一致的3棵植株作为3个生物学重复。按照1.2.2中的接种方法,分别进行霜霉病菌和灰霉病菌接种,并分别在0、6、12、24和48 h取样,迅速用液氮冷冻,保存于-80℃冰箱备用。
叶盘RNA提取和cDNA合成参照1.2.1。利用Primer 5.0软件设计荧光定量引物CHS1-qF/R,以为内参基因(引物信息见表1),使用ROCHE公司的LightCycle 480进行荧光定量PCR。每个生物学重复设置3个技术重复。荧光定量反应体系参照LightCycle 480 SYBR GreenⅠMaster说明书。采用2-ΔΔCt法计算不同时间点相对0 h的表达量变化。采用IBM SPSS Statistics计算各组别间的差异显著性。
1.2.4 VaCHS1的亚细胞定位 以‘双红’叶片cDNA为模板,使用含有Ⅰ和Ⅰ酶切位点的上下游引物CHS1-2F/R,利用2×Phanta Max Master Mix进行PCR扩增,同时使用Ⅰ和Ⅰ酶切pBI121- GFP载体;将目的基因和载体大片段回收纯化后进行连接,将连接产物转化到大肠杆菌DH5感受态细胞。通过PCR、酶切鉴定阳性克隆并进行测序;将构建成功、测序正确的重组载体质粒通过电转化法转入农杆菌GV3101,28℃培养2 d;参照尹玲[14]的瞬时转化方法注射烟草叶片;48 h后取标记的农杆菌注射的烟草叶片,于激光共聚焦显微镜C2-ER(Nikon,Japan)下观察GFP融合蛋白的绿色荧光位置,拍照记录。
1.2.5 VaCHS1瞬时转化至葡萄叶片 将pBWA(V) HS-VaCHS1GFP过表达载体转化到农杆菌GV3101。挑取单菌落接种到5 mL YEP培养基上,并加上2.5 µL的100 ng∙mL-1的卡那霉素,在28℃、200 r/min的摇床上培养2 d。2 d后,将旧培养基上的菌液吸取200 µL至20 mL新鲜YEP中生长。24 h后,将细菌培养物转移到50 mL离心管,室温下1 500×离心4 min,用渗透缓冲液(50 mmol∙L-1MES pH 5.6,2 mmol∙L-1Na3PO4,0.5%蔗糖(w/v)和100 μmol∙mL-1乙酰丁香酮)洗涤沉淀两次,并将细菌悬浮液稀释至OD600为0.2。在25℃、黑暗环境中生长1—2 h,注射前轻轻摇动离心管,使用不带针头的1 mL注射器注射菌液到‘无核白’叶片远轴端。渗透后,将叶片转移到光照16 h、黑暗8 h,温度为22℃的生长室生长。2 d后,分别用灰霉病菌和霜霉病菌鉴定瞬转后葡萄叶片的抗性,同时以pBWA(V)HS-GFP空载作为对照,接种方法与1.2.2中离体叶盘类似,但是整片叶子接种时注意避开叶片的主叶脉,同时接种点要与观察到GFP荧光的注射点尽量保持重合。每组鉴定选取5片叶子作为生物学重复。
2 结果
2.1 不同葡萄品种接种霜霉病菌和灰霉病菌的表型
通过室内离体叶盘法接种鉴定发现,‘野酿二号’‘无核白’和‘双红’3个葡萄品种对霜霉病的抗性存在较大差异,如图1所示,欧亚种‘无核白’接种5 d后,叶盘上可以观察到明显的白色霜霉,而山葡萄‘双红’和毛葡萄‘野酿二号’的叶盘表面未见任何发病症状。同样地,利用室内离体叶盘法对3个品种进行灰霉病抗性鉴定,结果表明,相同面积的灰霉病菌菌块接种相同大小的叶盘5 d后,‘无核白’表现出明显的发病症状,病斑直径显著大于‘双红’,而‘野酿二号’叶盘上只观察到接种前针刺的小孔。这表明,欧亚种‘无核白’对霜霉病菌和霜霉病菌均表现为感病,‘野酿二号’和‘双红’则对这两种病原菌均有较强的抗性。

图1 不同葡萄品种接种霜霉病菌和灰霉病菌后的表型
2.2 不同葡萄品种CHS的克隆和序列分析
以‘野酿二号’‘无核白’和‘双红’cDNA为模板,利用RT-PCR分别从3个品种中扩增出、和的编码区序列,全长均为1 182 bp,编码393个氨基酸。预测编码的CHS1蛋白的分子量为42.92 kD,理论等电点为6.10,包含20种氨基酸,正电荷的氨基酸(Arg+Lys)43个,负电荷的氨基酸(Asp+Glu)48个;不稳定性系数为34.59,属于稳定蛋白,且亲水性平均系数(GRAVY)为-0.064,为亲水蛋白。TMHMM在线网站分析表明该蛋白没有跨膜结构域,不属于跨膜蛋白。序列比对分析结果如图2所示,VvCHS1和VaCHS1的氨基酸序列完全一致,VqCHS1与VvCHS1、VaCHS1只在第61位存在1个氨基酸的差异,说明CHS1在不同品种中高度保守。

图2 VqCHS1、VvCHS1和VaCHS1的氨基酸序列比对
2.3 不同品种受到病原菌侵染后CHS1的表达模式分析
用打孔器在‘野酿二号’和‘无核白’的嫩叶上打取叶盘,直径0.5 cm灰霉病菌菌块进行侵染,并在侵染后0、6、12、24和48 h分别收集叶盘用于的荧光定量分析。结果如图3所示,与0h相比,灰霉病菌侵染6 h后,‘野酿二号’诱导上调表达,侵染后12—24 h,表达量比6 h有所下降,而48 h又急剧上升;感病品种‘无核白’的表达模式变化虽然与之类似,但整体表达量均低于抗灰霉病的‘野酿二号’。
用相同浓度的霜霉病菌孢子囊悬浮液接种‘双红’和‘无核白’的嫩叶叶盘,接种后0、6、12、24和48 h分别取样用于表达量分析。结果如图4所示,霜霉病菌侵染后,抗霜霉病的品种‘双红’中的的持续上调表达,在24 h时表达量达到最高,48 h时表达量略有下降;而感病品种‘无核白’的表达量持续下降,在48 h时略有回升。

柱上不同小写字母表示相对表达量在0.05水平上差异显著。图4同Different lowercase letters on the bars indicate significant difference in the relative expression at 0.05 level.The same as Fig.4
2.4 CHS1蛋白的亚细胞定位
为了验证VaCHS1的亚细胞定位,将含有pBI121- VaCHS1-GFP载体的农杆菌瞬时转化至烟草叶片表皮细胞中,表达pBI121-GFP的烟草叶片为阴性对照,观察融合蛋白的荧光位置。结果如图5所示,瞬时表达pBI121-GFP的细胞,绿色荧光分布在细胞膜、细胞核和细胞质,而瞬时表达pBI121-VaCHS1-GFP的细胞,绿色荧光主要分布在细胞核内,少量分布在细胞膜。
2.5 CHS1的抗病功能验证
为了验证CHS1在葡萄抗灰霉病和霜霉病中的功能,将pBWA(V)HS-GFP和pBWA(V)HS-VaCHS1- GFP分别瞬时转化感病品种‘无核白’组培苗叶片。2 d后,首先在紫外灯下观察蛋白的表达情况,如图6-A、6-B所示,观察到明显的绿色荧光,说明pBWA (V)HS-GFP和pBWA(V)HS-VaCHS1-GFP在‘无核白’上正常表达。然后用直径为0.5 cm的灰霉病菌菌块和浓度为2×105孢子囊/mL的霜霉病菌菌液分别侵染瞬时转化的叶片,5 d后观察发病情况。结果如图6-C、6-D所示,表达VaCHS1的‘无核白’叶片接种灰霉病菌后,发病面积和严重程度明显小于对照组,抗性显著增强,5个重复试验鉴定结果表现一致;如图6-E、6-F所示,对照组‘无核白’叶片接种点周围可以观察到明显的白色霜霉菌,而过表达VaCHS1的‘无核白’叶片表现出较强的霜霉病抗性,叶片表面几乎观察不到病菌生长,5片叶子重复表型一致。

图4 霜霉病菌侵染‘双红’和‘无核白’过程CHS1的表达变化
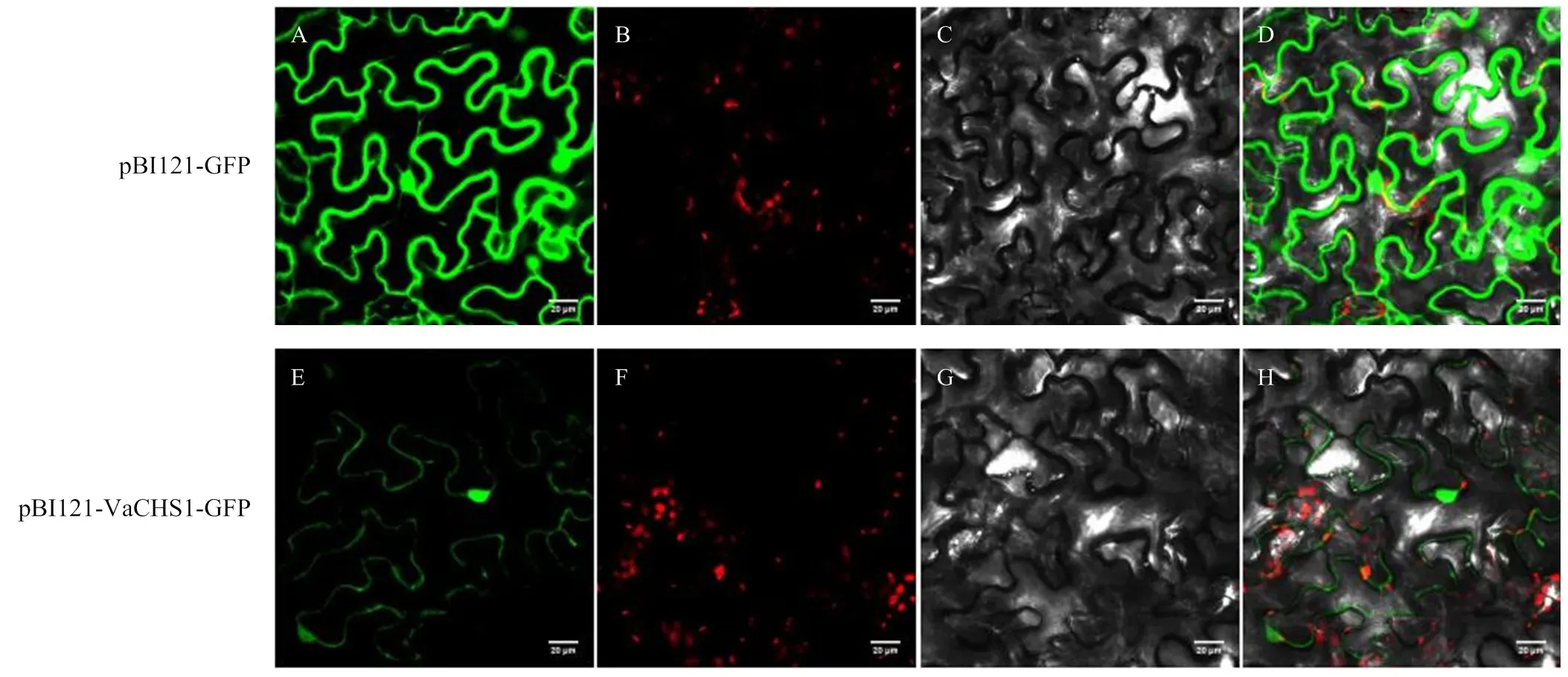
A、E:荧光蛋白通道Fluorescent protein channel;B、F:叶绿体荧光蛋白通道Chloroplast fluorescent protein channel;C、G:明场Bright field;D、H:荧光蛋白通道、叶绿体荧光蛋白通道和明场的叠加图Merged field
3 讨论
3.1 CHS基因结构与抗病性
类黄酮是植物重要的次生代谢产物,参与植物对逆境环境的抵抗[15]。CHS是类黄酮合成途径中的关键酶,也是限速酶[16]。查尔酮合成酶基因家族是个古老的基因家族,具有高度保守性[17]。目前为止,在盐肤木、金钱莲、桑树、海南龙血树和高粱等多种植物中都已克隆得到。本研究克隆到的、和3个基因的ORF均为1 182 bp,编码393个氨基酸,与显齿蛇葡萄[18]中克隆得到的和巨峰葡萄中克隆得到的[19]的ORF长度完全一致,说明在同一科/属的植物中具有高度保守性;而在草地早熟禾[17]和盐肤木[20]中克隆得到的和的ORF长度则为1 170和1 173 bp,说明不同物种间的存在一定差异。此外,上游的启动子包含一些特殊元件调控自身的表达,例如银杏启动子区存在紫外/蓝光响应单元、植物激素响应单元、真菌诱导元件、MYB结合位点、TATA-box和CAAT-box等多个顺式作用元件[21];龙血树的启动子区域中包含大量光应答元件、激素应答元件、MBY结合相关元件以及参与防御和应激反应的富含TC的重复元件[22];小麦启动子上的ABRE(脱落酸响应原件)和茉莉酸甲酯的响应原件被外界条件刺激(病原体侵染、创伤和低温胁迫)后会诱导表达[8]。本研究中抗霜霉病品种‘双红’的VaCHS1与感病品种‘无核白’的VvCHS1之间无氨基酸差异,推测抗病性差异可能与其基因上游的启动子序列差异有关。

A、B:GFP和VaCHS1-GFP荧光蛋白表达Expression of fluorescent protein of GFPandVaCHS1-GFP;C、E:灰霉病菌、霜霉病菌侵染表达GFP的‘无核白’叶片B.cinerea and P.viticola infect ‘Thompson seedless’ leaves expressing GFP;D、F:灰霉病菌、霜霉病菌侵染表达VaCHS1的‘无核白’叶片B.cinerea and P.viticola infect ‘Thompson seedless’ leaves expressingVaCHS1
3.2 CHS在各种胁迫下的表达变化
的表达受到多种外界环境刺激的控制,包括紫外线、病原菌、创伤和生物钟等各种生物和非生物胁迫[23]。研究表明,不同受到不同的刺激,其表达模式的变化也不尽相同。和在受到创伤时仅表现出轻微的上调表达,而则在创伤后8 h表达量增加5倍;与创伤处理相比,UV-C和霜霉病菌处理后,3个的转录物积累则均显著减少[24]。而在CIAFFI等[25]的研究中发现,在不同基因型的葡萄品种中,3种组成型表达量存在显著差异,但这种差异与葡萄对霜霉病的抗性并无显著相关性,接种霜霉病菌后,在抗性较强品种中,霜霉病菌接种导致从感染的早期阶段(16—24 hpi)开始,转录物积累稳定且显著减少。上述两项研究中,推测在抗性品种中表达水平的下降是由于与该基因具有相同催化底物的芪合酶表达量大幅提高,二者对底物的竞争性抑制导致的。对霜霉病有较强抵抗力的黄瓜品种‘Jing Chun NO.4’受到黄瓜霜霉病菌侵染后,在25 hpi到30 hpi时表达量增加了5倍以上,随后又迅速降低[26]。使用葡萄的寄主病原菌——葡萄霜霉病菌和非寄主病原菌——黄瓜霜霉病菌分别接种抗病葡萄‘Gloire’和感病葡萄‘Riesling’时,发现两种病菌都能诱导的表达,但感病葡萄‘Riesling’中的表达量低于抗病葡萄‘Gloire’,值得注意的是,抗病品种中有较弱的组成型表达而在感病品种中则没有[27]。本研究分别用灰霉病菌侵染‘野酿二号’和‘无核白’、霜霉病菌侵染‘双红’和‘无核白’,发现抗病品种‘野酿二号’‘双红’中和在受到病原菌侵染后都可以诱导上调表达,而感病品种‘无核白’中的表达量明显低于和,这与QIAO等[26]和KORTEKAMP[27]的研究结果一致,说明在抗病葡萄抵抗灰霉病菌和霜霉病菌侵染过程中发挥重要作用。
CHS可以通过催化形成不同的类黄酮化合物来提高植物的抗病能力,也可通过改变植保素[26]、黄酮素[23]、抗氧化酶SOD和POD[9]等的积累以及防御酶的活性来提高防御能力。在烟草中过表达或沉默,可以显著提高或减少烟草叶片中总黄酮、绿原酸、芸香苷、花青素等物质的含量[9]。抗枯萎病的棉花品种中表达量明显上调后,类黄酮的含量提高从而增加其对枯萎病的抗性[28]。本研究中在感病品种‘无核白’叶片中瞬时表达VaCHS1能够提高对灰霉病和霜霉病的抗病能力,但具体是通过何种途径诱导CHS的表达还有待进一步验证。
4 结论
从不同抗性的葡萄品种‘野酿二号’‘双红’‘无核白’中分别克隆了,该基因高度保守,主要定位于细胞核;虽然受灰霉病菌和霜霉病菌侵染后表达模式的变化不同,但抗性品种‘野酿二号’以及‘双红’中的整体表达水平均显著高于感病品种‘无核白’。过表达VaCHS1可以显著提高‘无核白’叶片对灰霉病和霜霉病的抗性,表明CHS1在葡萄抵御灰霉病和霜霉病的过程中发挥重要的作用。
[1] 王佳媛.海南龙血树查尔酮合酶基因()的克隆及其启动子功能分析[D].海口: 海南大学, 2014.
WANG J Y.Cloning of chalcone synthase gene fromand functional identification of its promoter[D].Haikou: Hainan University, 2014.(in Chinese)
[2] 王志彬.柑橘查尔酮合成酶基因遗传多样性及其功能研究[D].重庆: 西南大学, 2019.
WANG Z B.Genetic diversity and functional study of chalcone synthase gene in citrus[D].Chongqing: Southwest University, 2019.(in Chinese)
[3] ZHAO C Y, WANG F, LIAN Y H, XIAO H, ZHENG J K.Biosynthesis of citrus flavonoids and their health effects.Critical Reviews in Food Science and Nutrition, 2020, 60(4): 566-583.
[4] ZHANG Y, DOU H T, LI H J, HE Z F, WU H J.The citrus flavonoid nobiletin inhibits proliferation and induces apoptosis in human pancreatic cancer cells.Food Science and Biotechnology, 2014, 23(1): 225-229.
[5] TERASHIMA M, KAKUNO Y, KITANO N, MATSUOKA C, MURASE M, TOGO N, WATANABE R, MATSUMURA S.Antioxidant activity of flavonoids evaluated with myoglobin method.Plant Cell Reports, 2012, 31(2): 291-298.
[6] KROL P, IGIELSKI R, POLLMANN S, KEPCZYNSKA E.Priming of seeds with methyl jasmonate induced resistance to hemi-biotrophf.sp.in tomato12-oxo- phytodienoic acid, salicylic acid, and flavonol accumulation.Journal of Plant Physiology, 2015, 179: 122-132.
[7] ZUK M, DZIATO M, RICHTER D, DYMINSKA L, MATULA J, KOTECKI A, HANUZA J , SZOPA J.Chalcone synthase (CHS) gene suppression in flax leads to changes in wall synthesis and sensing gene, cell wall chemistry and stem morphology parameter.Frontiers in Plant Science, 2016, 7: 894.
[8] 薛保国, 谢丽华, 杨丽荣, 孙润红, 全鑫, 杨艳艳, 孙虎, 雷振生, 赵献林.小麦查尔酮合成酶基因及其启动子序列的克隆与分析.植物病理学报, 2017, 47(1): 50-60.
XUE B G, XIE L H, YANG L R, SUN R H, QUAN X, YANG Y Y, SUN H, LEI Z S, ZHAO X L.Cloning and functional analysis ofand its promoter in wheat.Acta Phytopathologica Sinica, 2017, 47(1): 50-60.(in Chinese)
[9] 陈帅.烟草类黄酮代谢途径中关键酶CHS基因与R2R3 MYB类转录抑制因子功能研究[D].成都: 四川农业大学, 2017.
CHEN S.Functional analysis of CHS genes and R2R3 MYB repressors related to flavonoid biosynthesis pathway in[D].Chengdu: Sichuan Agricultural University, 2017.(in Chinese)
[10] LU Y F, CHEN Q, BU Y F, LUO R, HAO S X, ZHANG J, TIAN J, YAO Y C.Flavonoid accumulation plays an important role in the rust resistance ofplant leaves.Frontiers in Plant Science, 2017, 8: 1286.
[11] 梁先利, 张丽清, 柯丽萍, 孙玉强.彩色棉查尔酮合成酶基因的克隆和功能分析.农业生物技术学报, 2019, 27(6): 993-1002.
LIANG X L, ZHANG L Q, KE L P, SUN Y Q.Cloning of chalcone synthase geneand its function analysis in coloured cotton ().Journal of Agricultural Biotechnology, 2019, 27(6): 993-1002.(in Chinese)
[12] DAO T T, LINTHORST H J M, VERPOORTE R.Chalcone synthase and its functions in plant resistance.Phytochemistry Reviews, 2011, 10(3): 397-412.
[13] LEI K J, ZHANG L, DU X Y, AN Y, CHANG G H, AN G Y.A chalcone synthase controls the verticillium disease resistance response in bothand cotton.European Journal of Plant Pathology, 2018, 152:769-781.
[14] 尹玲.葡萄霜霉病抗性基因结构域及霜霉菌效应分子功能研究[D].北京: 中国农业大学, 2015.
YIN L.Functional analysis of domains of grape downy mildew resistance geneand effectors of[D].Beijing: China Agricultural University, 2015.(in Chinese)
[15] BASKER V, VENKATESH R, RAMALINGAM S.Flavonoids (antioxidants systems) in higher plants and their response to stresses//Antioxidants and Antioxidant Enzymes in Higher Plants.Springer, Cham, 2018: 253-268.
[16] YU H N, WANG L, SUN B, GAO S, CHENG A X, LOU H X.Functional characterization of a chalcone synthase from the liverwort.Plant Cell Reports, 2015, 34(2): 233-245.
[17] 何春艳, 甘露, 闫蒙举, 张兰, 苏浩天, 尹淑霞.草地早熟禾查尔酮合成酶基因.中国草地学报, 2018, 40(4): 8-15.
HE C Y, GAN L, YAN M J, ZHANG L, SU H T, YIN S X.Cloning, functional and expression analysis of chalcone synthase geneKentucky bluegrass.Chinese Journal of Grassland, 2018, 40(4): 8-15.(in Chinese)
[18] 许明, 林世强, 倪冬昕, 伊恒杰, 刘江洪, 杨志坚, 郑金贵.藤茶查尔酮合成酶基因的克隆及功能鉴定.中国农业科学, 2020, 53(24): 5091-5103.
XU M, LIN S Q, NI D X, YIN H J, LIU J H, YANG Z J, ZHENG J G.Cloning and function characterization of chalcone synthase gene.Scientia Agricultura Sinica, 2020, 53(24): 5091-5103.(in Chinese)
[19] 周军, 陶建敏, 彭日荷, 熊爱生, 蔡斌, 徐锦涛, 金晓芬, 张斌, 高峰, 高建杰, 章镇, 姚泉洪.巨峰葡萄查尔酮合成酶基因4的克隆及表达特性的RT-PCR分析.南京农业大学学报, 2010, 33(2): 39-44.
ZHOU J, TAO J M, PENG R H, XIONG A S, CAI B, XU J T, JIN X F, ZHANG B, GAO F, GAO J J, ZHANG Z, YAO Q H.Cloning and expression analysis of4 of Kyoho grape by RT-PCR.Journal of Nanjing Agricultural University, 2010, 33(2): 39-44.(in Chinese)
[20] MA W L, WU Y, WU M, REN Z M, ZHONG Y.Cloning, characterization and expression of chalcone synthase from medicinal plant.Journal of Plant Biochemistry and Biotechnology, 2015, 24(1): 18-24.
[21] LI L L, CHENG H, YUAN H H, XU F, CHENG S Y, CAO F L.Functional characterization of thechalcone synthase gene promoter in transgenic tobacco.Genetics and Molecular Research, 2014, 13(2): 3446-3460.
[22] WANG J Y, DAI H F, LI H L, GUO D, MEI W L, PENG S Q.Molecular and functional characterization of the chalcone synthase gene () promoter in response to hormones.Plant Omics Journal, 2015, 8(5): 398-404.
[23] CHEN L J, GUO H M, LIN Y, CHENG H M.Chalcone synthase EaCHS1 fromfunctions in salt stress tolerance in tobacco.Plant Cell Reports, 2015, 34(5): 885-894.
[24] VANNOZZI A, DRY I B, FASOLI M, ZENONI S, LUCCHIN M.Genome-wide analysis of the grapevine stilbene synthase multigenic family: genomic organization and expression profiles upon biotic and abiotic stresses.BMC Plant Biology, 2012, 12: 130.
[25] CIAFFI M, PAOLACCI A R, PAOLACCI M, ALICANDRI E, BIGINI V, BADIANI M, MUGANU M.Transcriptional regulation of stilbene synthases in grapevine germplasm differentially susceptible to downy mildew.BMC Plant Biology, 2019, 19: 404.
[26] QIAO Y, MENG X J, JIN X X, DING G H.Genes expression of key enzymes in phenylpropanes metabolism pathway in cucumber with RT-PCR.Advanced Materials Research, 2013, 746: 53-57.
[27] KORTEKAMP A.Expression analysis of defence-related genes in grapevine leaves after inoculation with a host and a non-host pathogen.Plant Physiology and Biochemistry, 2006, 44(1): 58-67.
[28] 黄启秀.海岛棉类黄酮代谢途径中与枯萎病抗性相关基因的克隆及功能验证[D].乌鲁木齐: 新疆农业大学, 2017.
HUANG Q X.Cloning and functional verification of genes related to Fusarium wilt resistance in flavonoid metabolism pathway of island cotton (L.)[D].Urumqi: Xinjiang Agricultural University, 2017.(in Chinese)
The Role of Chalcone Synthase Gene in Grape Resistance to Gray Mold and Downy Mildew
GUO ZeXi, SUN DaYun, QU JunJie, PAN FengYing, LIU LuLu, YIN Ling*
Key Lab of Guangxi Crop Genetic Improvement and Biotechnology, Guangxi Academy of Agricultural Sciences, Nanning 530007
【Objective】The objective of this study is to clone the chalcone synthase geneand, verify the subcellular localization and function of CHS1, and to provide a basis for exploring the broad-spectrum resistance mechanism of CHS1.【Method】genes were cloned from the leaf cDNAs of‘Yeniang-2’,‘Thompson Seedless’ and‘Shuanghong’.The differences in the nucleic acid sequence and physicochemical properties of CHS1 protein were analyzed by bioinformatics.Expression patterns ofandinfection were also detected by qRT-PCR.The expression vector was constructed, and the transient expression technology mediated bywas used to verify the subcellular localization and disease resistance function in the leaves of tobacco and ‘Thompson Seedless’ tissue culture seedlings.【Result】Theis highly conserved among different grape varieties.The full length of ORF is 1 182 bp, which encodes 393 amino acids.The predicted molecular weight of the encoded protein is 42.92 kD, which is a stable hydrophilic protein.After being infected by, the expression patterns ofand1 were similar, but the expression level of‘Yejiang-2’ was significantly higher.After being infected by,andshowed different expression pattern changes.The expression level of‘Shuanghong’ continued to increase, while the expression level ofgradually decreased.The results of subcellular localization showed that CHS1 protein is distributed in the cytoplasm and nucleus, but it is mainly localized in the nucleus.Compared with the negative control, the ‘Thompson Seedless’ leaves overexpressing VaCHS1 showed stronger resistance to gray mold and downy mildewafter artificial inoculation.【Conclusion】The expression level ofCHS1 can increase the resistance of susceptible grape varieties to gray mold and downy mildew
chalcone synthase (CHS); grape;;; disease resistance
2021-09-23;
2021-12-14
国家自然科学基金(31860493)、广西重点研发计划(桂科AB21076001)、“广西八桂青年学者”专项、广西农科院基本科研业务专项(2021JM97,2018JZ18)
郭泽西,E-mail:1162410925@qq.com。通信作者尹玲,E-mail:779335723@qq.com
(责任编辑 岳梅)

