家蚕热休克蛋白HSP90相互作用蛋白的筛选与鉴定
龙艳碧,吴云飞,张倩,陈鹏,2,潘敏慧,2
家蚕热休克蛋白HSP90相互作用蛋白的筛选与鉴定
龙艳碧1,吴云飞1,张倩1,陈鹏1,2,潘敏慧1,2*
1西南大学家蚕基因组生物学国家重点实验室,重庆 400716;2西南大学农业农村部蚕桑生物学与遗传育种重点实验室,重庆 400716
【目的】HSP90是热休克蛋白家族的成员之一,在昆虫的抗逆性和变态发育中发挥重要作用,已有研究表明HSP90能够促进家蚕核型多角体病毒(nucleopolyhedrovirus,BmNPV)的增殖,但作用机制尚不清楚。本研究通过鉴定BmHSP90的相互作用蛋白,为其促进BmNPV增殖的作用机制解析提供参考。【方法】构建连接在pIZ/V5-His的BmHSP90HA真核过表达载体,在家蚕BmN-SWU1细胞中转染48 h后,感染BmNPV继续培养48 h后收集蛋白,保留总蛋白后将这些蛋白均分两管,进行免疫共沉淀,分别用抗HA抗体和IgG抗体钓取相互作用蛋白,对蛋白胶进行硝酸银染色后,获取差异条带并做质谱分析,将质谱结果与信息分析结合进行候选互作蛋白筛选,并克隆鉴定互作蛋白。通过免疫荧光验证HSP90与互作蛋白的共定位情况,并进一步采用免疫共沉淀试验确定其是否存在相互作用关系。【结果】硝酸银染色结果显示,试验组与对照组在90、70和60 kD附近处存在差异条带,并验证了90 kD处的差异条带为诱饵蛋白;将另外两条差异带进行质谱分析,共鉴定到7个候选相互作用蛋白,通过分析选择其中两个候选蛋白作后续研究,分别为Tubulin-specific chaperone E(Tbce)和Golgin subfamily A member 5(Golga5)。的最大开放阅读框长度为1 728 bp,编码576个氨基酸,的最大开放阅读框长度为1 854 bp,编码618个氨基酸;同源比对和系统进化树显示BmTbce的微管结合结构域(cytoskeleton-associated protein-glycine-rich,CAP-Gly)位于N端且在不同物种之间保守性较高,BmGolga5的跨膜区(transmembrane domain,TMD)位于C端,也较为保守;荧光共定位显示BmHSP90与BmTbce和BmGolga5在细胞质中发生共定位,并进一步通过免疫共沉淀证明BmHSP90HA和BmTbceFlag、BmHSP90HA和BmGolga5Flag具有相互作用关系。【结论】经过筛选与鉴定,在BmNPV感染家蚕细胞的过程中,与家蚕热休克蛋白HSP90发生相互作用的蛋白为BmTbce和BmGolga5。
家蚕;家蚕核型多角体病毒;HSP90;Tbce;Golga5
0 引言
【研究意义】1962年,Ritossa在制备果蝇唾液腺细胞染色体的过程中发现温度骤变后果蝇的染色体会出现膨胀现象,暗示局部转录活性增强,他将这个现象称之为热休克反应[1];1974年,Tissieres等通过蛋白凝胶电泳技术和放射自显影技术证实了热激处理后产生一组新的蛋白条带,并命名为热休克蛋白(heat shock protein,HSP)[2-3]。热休克蛋白的功能鉴定一直成为应激研究的重点,根据功能可将热休克蛋白分为7类,其中分子伴侣是主要类别[4],因分子量不同又将其分为5个主要且广泛保守的家族——HSP100、HSP90、HSP70、HSP60和小热休克蛋白(sHSP)[5-6]。HSP90作为热休克蛋白家族的一员,是一类极为丰富且高度保守的蛋白,被定义为细胞蛋白质稳态的中心调节剂,同时也是许多病毒蛋白合成不可或缺的成分[7-9]。有研究发现BmHSP90参与了家蚕核型多角体病毒(nucleopolyhedrovirus,BmNPV)侵染宿主的过程,但具体的作用机制仍然未知[10]。因此,鉴定BmHSP90相互作用蛋白对解析其在病毒与宿主间的作用机制具有重要意义。【前人研究进展】同热休克蛋白其他家族一样,HSP90与病毒有着复杂的关系,HSP90通过促进病毒颗粒进入细胞、细胞内转运、表达和病毒蛋白的稳定以及基因组复制,在复制周期的不同阶段参与病毒的复制[11]。HSP90作用的病毒涉及DNA病毒和RNA病毒两种[12],猿猴病毒40(simian virus 40,SV40)是一种小型双链环形DNA肿瘤病毒,可编码3种肿瘤抗原:大T、小T和17 KT,大T抗原肿瘤抑制基因p53和成视网膜细胞瘤(pRB)家族蛋白使宿主细胞从G1期过渡到S期,导致病毒发生增殖,HSP90能与未成熟形式的大T抗原缔合,有助于大T抗原形成功能成熟的结构,从而促进病毒DNA的复制[13]。同时,HSP90还通过氨基末端伴侣结构域和包含高酸性结构域的中间区域与RNA病毒——流感病毒RNA聚合酶的亚基之一PB2亚基相互作用,刺激RNA聚合酶活性促进其复制[14]。近来对严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)细胞进行的大规模转录组学分析表明,HSP90是与感染相关的蛋白质,HSP90的抑制减少了病毒复制和炎症反应的诱导[15],因此,HSP90在未来将可能成为抗病毒研究的靶点。HSP90的细胞功能多种多样,对其在昆虫领域作用的了解仍然有限。据报道,在棉铃虫()中,HSP90在受体上游参与了蜕皮激素信号途径介导的个体发育[16];HSP90突变体的果蝇繁殖力和寿命明显低于野生型果蝇,即使在稍微升高的温度下,HSP90突变体种群也会灭绝,而野生型种群却持续存在,表明HSP90是应激反应和信号传导的调节剂,有助于缓冲来自野生种群果蝇的有害变异,并且在热应激条件下其缓冲作用变得更加重要[17],说明HSP90在昆虫发育过程中参与细胞通讯和信号传递过程[18]。但在家蚕中通过RNA干扰沉默BmN细胞中的抑制BmNPV复制,反之的过表达上调了其增殖复制的水平[19]。说明BmHSP90能够在家蚕细胞中促进BmNPV的复制,但BmHSP90调控病毒增殖复制的具体机制仍不清楚。【本研究切入点】以家蚕对外界刺激作出快速有效应答的先天性免疫防御系统为切入点,以家蚕分子伴侣HSP90作为研究对象,在BmNPV入侵家蚕细胞后,鉴定与BmHSP90直接相互作用的蛋白,从而解析宿主BmHSP90使病毒复制增加的机理。【拟解决的关键问题】筛选并鉴定BmHSP90相互作用的蛋白,加强对BmNPV致病机理的了解并为病毒防控提供新的靶点,为家蚕抗病品种培育提供理论依据。
1 材料与方法
试验于2019—2020年在西南大学家蚕基因组生物学国家重点实验室完成。
1.1 供试材料与主要试剂
供试材料为本实验室建立的家蚕卵巢细胞系BmN-SWU1[20]。Taq扩增酶、SolutionⅠ连接酶和限制性内切酶(H I、I、I、II和I)购自TaKaRa公司;引物合成和测序均由北京六合华大基因科技股份有限公司完成;DNA凝胶回收试剂盒购自OMEGA公司;QIAGEN质粒提取试剂盒购自Promega公司;Trans1-T1 Phage Resistant化学感受态细胞和蛋白Marker购自全式金公司;PVDF膜、昆虫转染试剂购自Roche公司;HA、Flag标签单克隆抗体、Alexa Fluor 488/555标记山羊抗小鼠/兔IgG(H+L)、蛋白磁珠和ECL显色液购自Invitrogen公司;HRP标记山羊抗小鼠/兔抗体IgG(H+L)、小鼠IgG和预染Marker购自碧云天生物技术有限公司;抗荧光淬灭封片剂、DAPI染料购自Life Technologies公司。其他试剂均为国产或进口分析纯。
1.2 基因序列的生物信息学分析
、和的克隆引物在Premier 5.0软件设计,利用SMART网站(http://smart.embl-heidelberg.de/)在线预测BmTbce和BmGolga5的结构域,根据BmTbce和BmGolga5的序列在SilkDB 3.0(https://silkdb.bioinfotoolkits.net/)和NCBI(http://www.ncbi.nlm.nih.gov/)下载不同物种中的同源序列;然后使用ClustalX 1.83和GENEDOC 3.2做初步序列比对,再在https://espript.ibcp.fr/ESPript/cgi- bin/ESPript.cgi在线网站加工;系统发生树构建使用 MEGA 6.0 软件,在https://itol.embl.de/进行美化。
1.3 真核过表达载体构建
以pIZ/V5-His为空载,通过PCR、酶切和连接构建带有HA标签的BmHSP90和Flag标签的BmTbce与BmGolga5的质粒。所有质粒确保序列正确再进行后续试验,所用引物见表1。

表1 本研究所用引物
加粗表示限制性内切酶,下划线标记序列代表标签基因序列
Bold indicates restriction endonuclease, and underlined sequence represents tag gene sequence
1.4 免疫共沉淀(Co-IP)
首先提前准备好细胞密度在80%—90%的BmN- SWU1细胞,将待转质粒与转染试剂按1﹕2.5(m/v)的比例转染至细胞瓶中,即在新的EP管中先加500 µL的无抗培养基,再加入3 µg质粒,最后加7.5 µL的转染试剂,用100 µL的移液枪逐滴加入吹打混合液100下,静置30 min,预先在培养瓶中先加入2 mL的无抗培养基,再边摇晃培养瓶逐滴加入混合质粒;27℃培养48 h使细胞增殖,添加BmNPV感染48 h后,收集蛋白,先用1×PBST润洗培养瓶的细胞两次,加入500 µL含PMSF(1 mmol·L-1)的IP裂解液;将细胞瓶平放在冰盒上,放置摇床裂解30 min,吹下细胞,转移至新的1.5 mL的EP管中;离心10 min弃细胞碎片(4℃,12 000×);在两个新的1.5 mL EP管中加入protein A+G磁珠共50 µL,将离心管插入免疫磁条上,加入PBST清洗磁珠两次;然后再加入400 µL干净的PBST轻轻混匀后分别加入4 µL小鼠IgG抗体和标签抗体,旋转混匀20 min使磁珠与抗体结合;清洗磁珠后将得到的上清蛋白分别等量加入两个EP管中,混匀后旋转孵育;1.5 h后用枪头吸走液体,用PBS洗两次后加入80 µL IP裂解液和20 µL的5×上样缓冲液,沸水煮15 min后,将离心管放至磁力架中吸走蛋白溶液转移到新管中,置于-20℃保存。
1.5 硝酸银染色
根据配方制备12%的SDS-PAGE胶,将免疫共沉淀得到的样品和蛋白Marker点入孔中,用恒流进行分离,在浓缩胶的区域每块胶所用的电流为8 mA,待样品跑到分离胶区域时将每块胶的电流调整为16 mA,待蓝色染料刚好要跑出即可,将凝胶取出,放入干净的玻璃皿中,用双蒸水清洗胶块,重复两次,倒掉液体,倒入固定液固定,放于水平摇床上轻轻摇晃1 h;继续在摇床上用洗涤液进行清洗,每20 min换一次清洗液,清洗6次;加入适量增感液,增感90 s,时间要精确,注意避光;迅速倒掉增感液,加入双蒸水,立即放回水平摇床清洗20 s,时间严格控制,重复3次;加入硝酸银染色液,染色30 min,用锡箔纸将玻璃皿包着,严格避光;重复清洗的步骤,慢慢倒入显影液,以白纸为背景,仔细观察胶块的颜色,当条带亮度显影合适的时候立即加入终止液,终止显影;在扫描仪上扫描并保存图片,仔细观察并找出差异带,用干净的小刀切取差异条带,做好标记至-80℃保存,最后送至华大基因公司做质谱分析。
1.6 免疫荧光
先在24孔板铺上细胞爬片,将可以传代的细胞吹下,每个孔加入400 µL的细胞,待细胞全部贴壁后换液,6—9 h后待细胞状态稳定,再按上述转染方法将待共转的质粒转入孔中,27℃培养,48 h后开始做免疫荧光;吸尽孔里的培养基,加入PBST涮洗2次;加入350 µL 4%多聚甲醛固定15 min使细胞保持原有的状态;然后处理固定液,加入PBST后放至摇床上洗涤5 min,共3次;吸干洗涤的PBST后于每个孔中加入350 µL的0.1% TritonX-100打孔,室温下放置15 min;重复洗涤步骤;彻底吸干洗涤液,再向每个孔中加入500 µL的一抗稀释液(1﹕200),避光放置37℃培养箱培养1 h;回收一抗,加入PBST洗涤5 min,重复5次;向每个孔中加入500 µL的二抗和DAPI混合的稀释液(1﹕500),放置37℃培养箱培养40—50 min,注意要严格避光;在避光条件下继续重复洗涤,在干净的载玻片中间滴加2 µL的抗荧光猝灭剂,轻轻勾起爬片,细胞面朝下,铺在载玻片上,指甲油密封,随后用激光共聚焦显微镜观察结果。
1.7 Western blot
将免疫共沉淀钓取的样品进行SDS-PAGE电泳,将蛋白胶的上层浓缩胶切掉,下层胶待用,然后准备一张4×8格大小的聚偏二氟乙烯印迹膜(PVDF)和两个干净的玻璃皿,一个倒入甲醇,另一个加入双蒸水,做好标记,先把PVDF膜放进装有甲醇的玻璃皿中激活20 s,迅速挑起膜放进双蒸水中浸泡2 min;把滤纸、PVDF、蛋白胶和上层滤纸全部放到转膜液中,开始转膜,由下到上的顺序将转膜液中的上述4种物品轻轻叠放,每一层之间都不能有气泡;轻轻平放到转移槽中,转膜9 min;完成后用镊子挑起PVDF膜放入膜盒中。加入现配的封闭液,放入上下摇床摇1 h或4℃封闭过夜;之后加入一抗溶液(1﹕2 000稀释),室温下水平摇床孵育2 h,用TBST洗5 min,重复6次;加入二抗(1﹕4 000稀释),继续孵育50 min,重复洗涤,在光源较弱的环境配制显色液,混匀后在成像仪中放置一个干净的手套,按照胶块的大小滴加显色液,从一侧放入PVDF膜,再在上面滴加显色液;曝光,保存图片。
2 结果
2.1 免疫共沉淀钓取BmHSP90的相互作用候选蛋白
将转染了pIZ-BmHSP90HA质粒的细胞培养48 h后感染BmNPV,继续培养48 h收集蛋白,以HA抗体为诱饵、小鼠IgG为对照,免疫共沉淀结合银染试验找出差异条带。结果显示,与IgG组相比,IP组在大小为90、70和60 kD附近处各有一条差异条带,如图中箭头所示a、b和c(图1-A)。为了检测诱饵蛋白是否表达,将3条差异胶切下来,分开装入干净的1.5 mL EP管中,加入PBS研磨至胶块完全消失,电泳后进行免疫印迹,HA抗体作一抗孵育。结果显示在90 kD处观察到条带(图1-B),说明此处的差异带为诱饵蛋白BmHSP90。进行3次生物学重复后确定差异带,将其切下进行LC-MS/ MS质谱分析。
使用NCBI数据库以及家蚕数据库比对质谱分析得到的肽段,共找到7个潜在的相互作用蛋白(表2),通过分析在两个差异带中各选取了一个候选蛋白作为后续的研究对象,分别为BmTbce(XP_004923154)和BmGolga5(XP_012550337)。
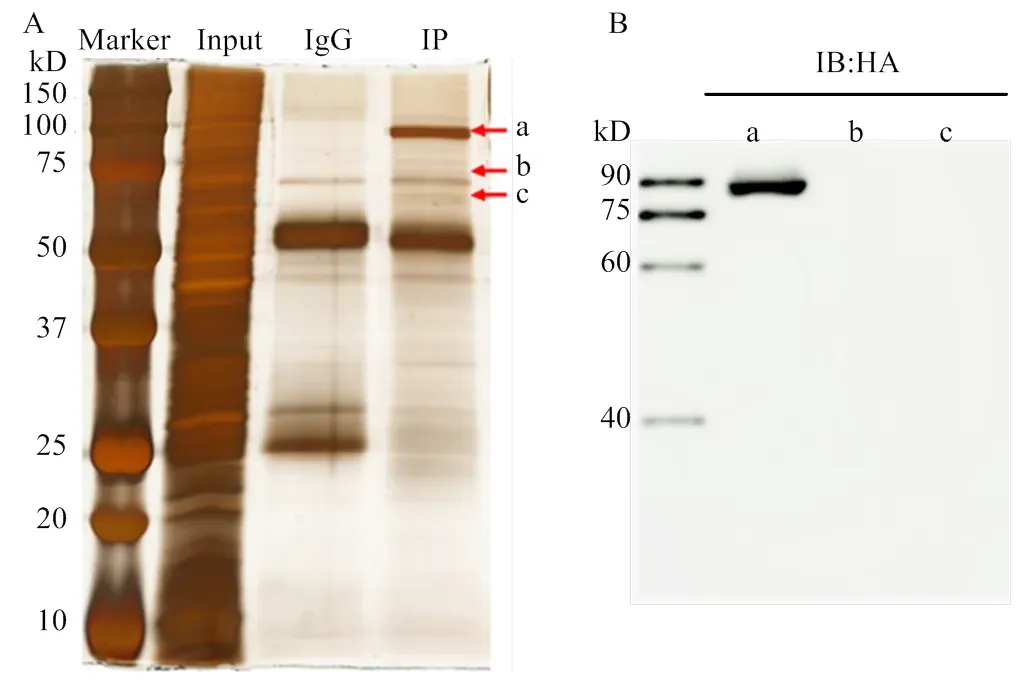
Input组表示总蛋白样品,IgG组表示对照组样品,IP组表示试验组样品,a、b、c表示试验组与对照组相比得出的差异带
2.2 BmTbce和BmGolga5的克隆鉴定
以家蚕cDNA为模板,用表1的引物克隆得到Gene ID为BGIBMGA000149的,的CDS全长1 728 bp,编码576个氨基酸,预测的蛋白分子量63.36 kD,等电点为6.27,对其结构域进行预测,分析发现BmTbce在59—125氨基酸处含有微管结合结构域(CAP-Gly)。为了进一步探究BmTbce的CAP-Gly结构域在生物进化过程中的保守性及位置,选取人()、黑腹果蝇()、斑马鱼()和非洲爪蟾()的CAP-Gly结构域处与BmTbce的同源氨基酸进行比对发现其结构域非常保守(图2);此外,通过构建系统进化树发现Tbce在脊椎动物和无脊椎动物的不同物种中有且仅有一个CAP-Gly结构域并且位于N端(图3);Gene ID为BGIBMGA010211的的CDS全长为1 854 bp,编码618个氨基酸,预测的蛋白分子量为67.98 kD,等电点为6.59,在581—603氨基酸处含有跨膜区(TMD),与其他物种的同源氨基酸进行比对发现其跨膜区比较保守(图4),系统进化树显示不同物种Golga5的跨膜区均位于C端(图5)。以上结果显示,Tbce和Golga5分别在不同物种中具有保守且专一的CAP-Gly结构域和跨膜区。

表2 BmHSP90免疫共沉淀候选蛋白

蓝色框区的氨基酸残基表示在所有比对物种中,有≥70%是一致的The amino acid residues in the blue box indicate that ≥70% of all the compared species are identical。斜纹夜蛾Spodoptera litura (XP_022828735.1);棉铃虫Helicoverpa armigera (XP_021199983.1);帝王蝶Danaus plexippus (OWR53855.1);金凤蝶Papilio machaon (KPJ17724.1);家蚕Bombyx mori (XP_004923154.1);黑腹果蝇Drosophila melanogaster (NP_610197.2);人Homo sapiens (NP_001072983.1 );非洲爪蟾Xenopus laevis (NP_001088530.1);斑马鱼Danio rerio (NP_001035078.2);芜菁叶蜂Athalia rosae (XP_012251255.1)
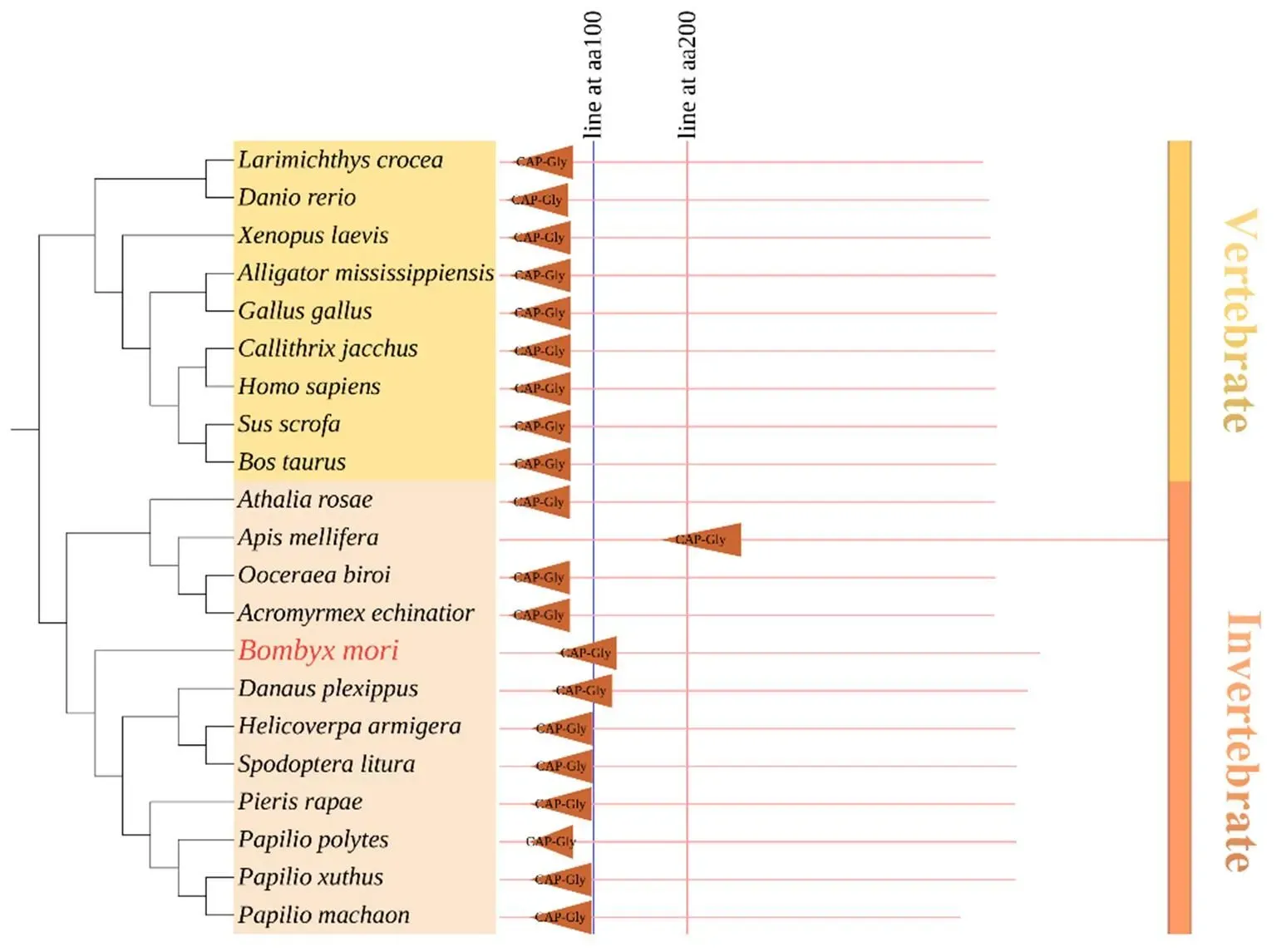
棕色三角形区表示所有比对物种中CAP-Gly结构域所在位置
2.3 BmHSP90与其潜在相互作用蛋白BmTbce和BmGolga5的亚细胞定位分析
为了分析BmHSP90与BmTbce和BmGolga5的定位情况,共转BmHSP90HA和BmTbceFlag、BmHSP90HA和BmGolga5Flag进细胞中进行共定位观察,如图6所示,免疫荧光使用DAPI染料标记细胞核并显示为蓝光,HA标签的荧光抗体选择绿光,Flag标签选择为红光,共定位显示BmHSP90与BmTbce和BmGolga5共定位于细胞质中,且BmGolga5部分呈点状分布。因此,推测BmHSP90与BmTbce和BmGolga5可能具有相互作用。
2.4 BmHSP90与其潜在相互作用蛋白BmTbce和BmGolga5的相互作用分析
为了进一步确定BmHSP90与BmTbce和BmGolga5是否存在相互作用,再次进行了上述转染试验,收集蛋白后进行正向验证,通过免疫共沉淀步骤分别用Flag抗体和小鼠IgG抗体沉淀BmTbceFlag和BmGolga5Flag,再用HA抗体通过Western blot检测BmHSP90HA,观察BmHSP90是否能被BmTbce和BmGolga5沉淀下来;同理进行反向验证时,IP组使用HA抗体和小鼠IgG抗体钓取蛋白,IB组再用Flag抗体杂交,检测BmHSP90是否可以钓取BmTbce和BmGolga5。正向和反向的验证结果显示,对应的目的蛋白都能被检测到(图7)。表明BmHSP90均与BmTbce和BmGolga5具有相互作用关系。
3 讨论
3.1 HSP90与Golga5和Tbce的协同作用对病毒蛋白侵染宿主的影响
Golga5(Golgin-84)在其N端497个残基包含一个卷曲螺旋结构域,在其C末端附近有一个跨膜结构域,定位在高尔基体上,是一种完整的膜蛋白[21]。在真核细胞中观察到Golga5在高尔基体堆叠侧缘的管网结构中含量丰富,Golga5在哺乳动物细胞高尔基体膜的组装和维持中起着关键作用,在大鼠肾(NRK)细胞中的瞬时表达有助于防止由蛋白转运抑制剂引发的高尔基体分解[22-23]。外壳蛋白复合物I(COPI)是一种异聚蛋白外壳,可介导高尔基体到内质网和高尔基体内转运的蛋白质的出芽[24],Golga5与保守的寡聚高尔基体(COG)复合物的相互作用可能参与了高尔基体内COPI囊泡的逆行[25]。在登革热病毒(dengue virus)侵染宿主细胞过程中,作为一种糖基化包膜蛋白,其需要在宿主细胞的内质网加工,敲低后,病毒蛋白的逆行运输会受到损害,从而影响登革热病毒蛋白折叠,导致病毒蛋白降解增加,阻碍了病毒粒子的产生[26-28];在HeLa细胞中HSP90敲低会导致高尔基体破碎,水疱性口炎病毒(VSVG)的顺行囊泡运输受损[29],由此可见HSP90对维持高尔基体的结构至关重要。本研究发现BmHSP90与BmGolga5发生相互作用,暗示Golga5对BmNPV蛋白在家蚕宿主细胞内的正确加工修饰和转运具有重要意义。

蓝色框区的氨基酸残基表示在所有比对物种中,有≥75%是一致的The amino acid residues in the blue box indicate that ≥75% of all the compared species are identical。家蚕Bombyx mori (XP_021207081.1);帝王蝶Danaus plexippus (XP_032522464.1);斜纹夜蛾Spodoptera litura (XP_022815171.1);玉带凤蝶Papilio polytes (XP_013139496.1);黑腹果蝇Drosophila melanogaster (NP_651250.2);埃及伊蚊Aedes aegypti (XP_021706120.1);人 Homo sapiens (AAD09753.1);非洲爪蟾Xenopus laevis (NP_001085841.1);斑马鱼Danio rerio (NP_998576.1);芜菁叶蜂Athalia rosae (XP_012252705.1)
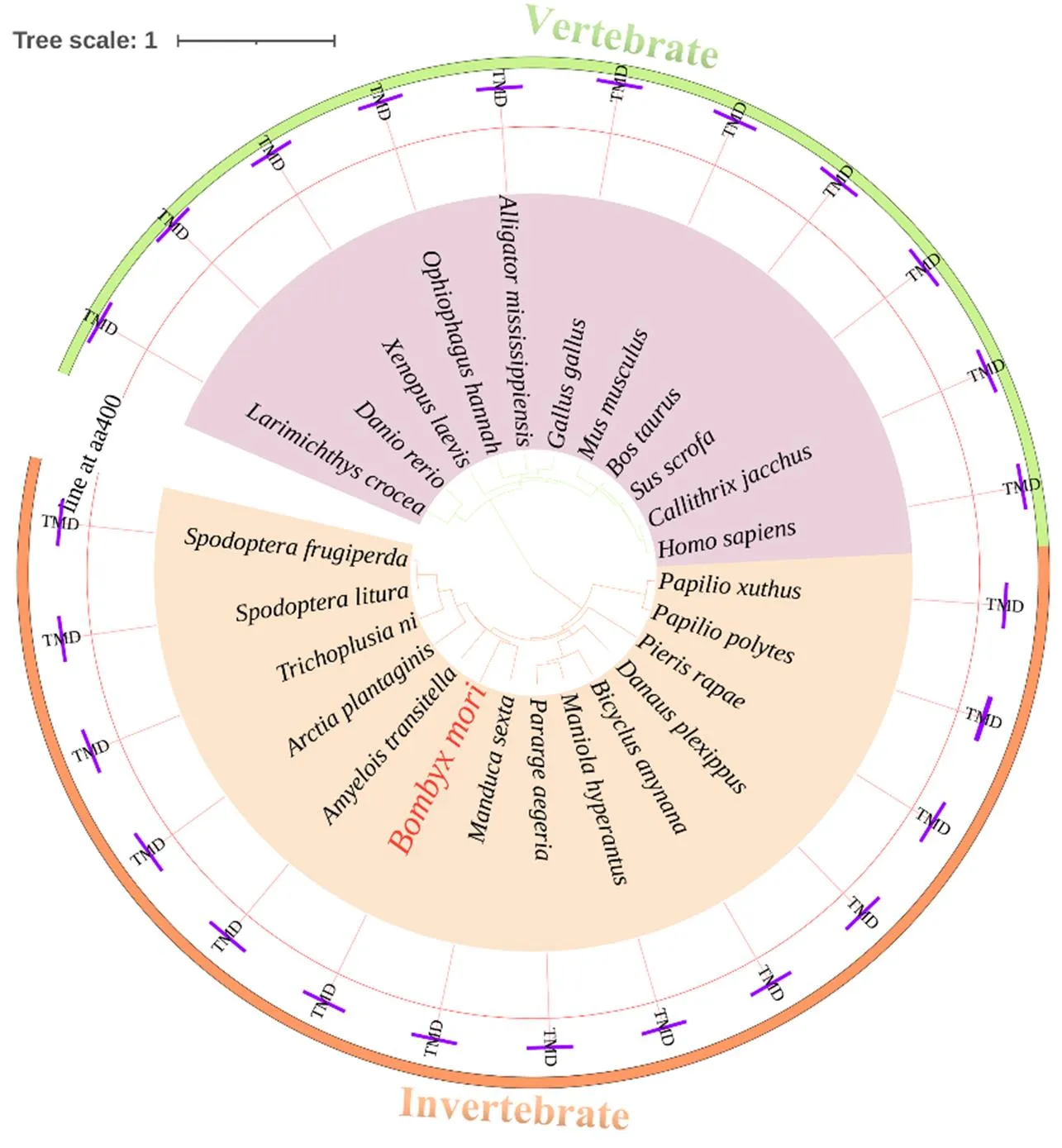
紫色直线表示所有比对物种中蛋白所含跨膜区位置

图6 荧光共定位分析 BmHSP90与BmTbce和BmGolga5的定位情况

图7 免疫共沉淀和Western blot验证BmHSP90与BmTbce和BmGolga5的相互作用
微管是细胞的主要组成部分之一,其在细胞分裂、细胞生长和运动、细胞内运输和维持细胞形状中发挥着关键作用[30]。微管蛋白分子伴侣E(Tbce)最初是从牛睾丸组织纯化出的一种大小为60 kD的蛋白,该蛋白通过调节微管蛋白异质二聚体的聚合而参与微管蛋白的正确折叠及折叠速率[31]。在果蝇神经肌肉中,过表达会导致大量的微管形成,而敲除后会导致微管的功能发生紊乱,进而影响了神经肌肉突触的功能[32];在果蝇中发现Tbce具有特殊的CAP-Gly基序,其负责在有丝分裂前期募集染色质周围的微管蛋白,对于纺锤体的正确组装至关重要[33]。微管因结构复杂而在无数的细胞功能中起到至关重要的作用,许多病毒已经进化出利用这些结构来帮助其复制的机制。已报道小鼠诺如病毒(mouse norovirus)在感染活细胞过程中利用微管将复制复合物从细胞外围向复制位点即邻近微管组织中心附近运输,微管网络的化学破坏使诺如病毒复制的位点分散在整个细胞中,并损害了病毒蛋白的产生[34]。感染性病毒感染通常受到细胞骨架的操控,如疱疹病毒(herpesvirus)和人类乳头瘤病毒(human papillomavirus)利用基于微管的逆行运输将其基因组传递到细胞核,随后在生命周期的裂解阶段,成熟的病毒颗粒易位到细胞质内的特定区域,导致二次感染[35-36];并且热休克反应诱导细胞多极微管的形成,从而进行多极分裂,HSP90能够促进子代BV产生所需的核肌动蛋白聚合从而参与杆状病毒BV繁殖[37-38]。
3.2 家蚕HSP90与Golga5和Tbce协同作用的意义
本研究通过银染试验筛选了HSP90在家蚕细胞受到BmNPV感染时发生相互作用的蛋白,并采用免疫荧光和免疫共沉淀技术验证了BmHSP90与BmTbce和BmGolga5具有相互作用关系,暗示着病毒与家蚕细胞相互作用的多样性与复杂性。因此,笔者推测在BmNPV侵染家蚕细胞时,BmHSP90募集分子伴侣BmTbce和BmGolga5,BmGolga5是高尔基体完整性必不可少的一部分,对COPI囊泡介导高尔基体向内质网方向的逆向运输具有重要意义,病毒第一次入侵时,病毒蛋白可能通过大量快速的逆向运输过程逃避宿主介导的免疫系统清除,从而成功感染宿主;而参与折叠微管蛋白的BmTbce有助于逃逸的病毒蛋白借助微管轨道被运输入核与病毒核酸进行组装,从而导致二次感染,促进病毒的增殖。但这些推测还需要进一步的研究验证。
4 结论
生物信息学分析显示Golga5在不同物种中均含有一个C端的跨膜结构域,BmTbce蛋白在N端含有CAP-Gly基序,进一步通过免疫荧光及免疫共沉淀验证了BmGolga5和BmTbce分别与BmHSP90共定位于细胞质并发生相互作用。
[1] Ritossa F.A new puffing pattern induced by temperature shock and DNP in.Experientia, 1962, 18: 571-573.
[2] Tissiéres A, Mitchell H K, Tracy U M.Protein synthesis in salivary glands of: Relation to chromosome puffs.Journal of Molecular Biology, 1974, 84(3): 389-398.
[3] Landais I, Pommet J M, Mita K, Nohata J, GimenezS, Fournier P, Devauchelle G, Duonor-Cerutti M, Ogliastro M.Characterization of the cDNA encoding the 90 kDa heat-shock protein in the Lepidopteraand.Gene, 2001, 271(2): 223-231.
[4] Richter K, Haslbeck M, Buchner J.The heat shock response:life on the verge of death.Molecular Cell, 2010, 40(2): 253-266.
[5] Mogk A, Bukau B.Role of sHsps in organizing cytosolic protein aggregation and disaggregation.Cell Stress and Chaperones, 2017, 22(4): 493-502.
[6] Bar-Lavan Y, Shemesh N, Ben-Zvi A.Chaperone families and interactions in metazoa.Essays in Biochemistry, 2016, 60(2): 237-253.
[7] Dalidowska I, Gazi O, Sulejczak D, Przybylski M, Bieganowski P.Heat shock protein 90 chaperones E1A early protein of adenovirus 5 and is essential for replication of the virus.International Journal of Molecular Sciences, 2021, 22(4): 2020.
[8] Zhang Y, Zhang Y A, Tu J.Hsp90 is required for snakehead vesiculovirus replication via stabilization the viral L protein.Journal of Virology, 2021, 95(16): e00594-21.
[9] Jing L, Buchner J.Structure, function and regulation of the Hsp90 machinery.Biomedical Journal, 2013, 36(3): 106-117.
[10] Wu P, Shang Q, Huang H, Zhang S, Zhong J, Hou Q, Guo X.Quantitative proteomics analysis provides insight into the biological role of Hsp90 in BmNPV infection in.Journal of Proteomics, 2019, 203: 103379.
[11] Tsou Y L, Lin Y W, Chang H W, Lin H Y, Shao H Y, Yu S L, Liu C C, Chitra E, Sia C, Chow Y H.Heat shock protein 90: role in enterovirus 71 entry and assembly and potential target for therapy.PLoS ONE, 2013, 8(10): e77133.
[12] Iyer K, Chand K, Mitra A, Trivedi J, Mitra D.Diversity in heat shock protein families: functional implications in virus infection with a comprehensive insight of their role in the HIV-1 life cycle.Cell Stress and Chaperones, 2021, 26(5): 743-768.
[13] Miyata Y, Yahara I.p53-independent association between SV40 large T antigen and the major cytosolic heat shock protein, HSP90.Oncogene, 2000, 19(11): 1477-1484.
[14] Momose F, Naito T, Yano K, Sugimoto S, Morikawa Y, Nagata K.Identification of Hsp90 as a stimulatory host factor involved in influenza virus RNA synthesis.The Journal of Biological Chemistry, 2002, 277(47): 45306-45314.
[15] Wyler E, Mosbauer K, Franke V, Diag A, Gottula L T, Arsie R, Klironomos F, Koppstein D, Honzke K, Ayoub S,.Transcriptomic profiling of SARS-CoV-2 infected human cell lines identifies HSP90 as target for COVID-19 therapy.iScience, 2021, 24(3): 102151.
[16] 张凤霞.棉铃虫Hsp90、胸腺素和丝氨酸蛋白酶抑制因子在发育中的表达模式与激素调控[D].济南: 山东大学, 2010.
Zhang F X.Expression patterns and hormonal regulation of Hsp90, thymosin and serine protease inhibitors in the development of[D].Ji’nan: Shandong University, 2010.(in Chinese)
[17] Chen B, Wagner A.Hsp90 is important for fecundity, longevity, and buffering of cryptic deleterious variation in wild fly populations.BMC Evolutionary Biology, 2012, 12: 25.
[18] McClellan A J, Xia Y, Deutschbauer A M, Davis R W, Gerstein M, Frydman J.Diverse cellular functions of the Hsp90 molecular chaperone uncovered using systems approaches.Cell, 2007, 131(1): 121-135.
[19] Shang Q, Wu P, Huang H L, Zhang S L, Tang X D, Guo X J.Inhibition of heat shock protein 90 suppressesnucleopolyhedrovirus replication in.Insect Molecular Biology, 2020, 29(2): 205-213.
[20] Pan M H, Cai X J, Liu M, Lv J, Tang H, Tan J, Lu C.Establishment and characterization of an ovarian cell line of the silkworm,.Tissue and Cell, 2010, 42(1): 42-46.
[21] Bascom R A, Srinivasan S, Nussbaum R L.Identification and characterization of golgin-84, a novel Golgi integral membrane protein with a cytoplasmic coiled-coil domain.The Journal of Biological Chemistry, 1999, 274(5): 2953-2962.
[22] Satoh A, Wang Y, Malsam J, Beard M B, WARREN G.Golgin-84 is a rab1 binding partner involved in Golgi structure.Traffic, 2003, 4(3): 153-161.
[23] Diao A, Rahman D, Pappin D J, Lucocq J, Lowe M.The coiled-coil membrane protein golgin-84 is a novel rab effector required for Golgi ribbon formation.The Journal of Cell Biology, 2003, 160(2): 201-212.
[24] Pinot M, Goud B, Manneville J B.Physical aspects of COPI vesicle formation.Molecular Membrane Biology, 2010, 27(8): 428-442.
[25] Sohda M, Misumi Y, Yamamoto A, Nakamura N, Ogata S, Sakisaka S, Hirose S, Ikehara Y, Oda K.Interaction of Golgin-84 with the COG complex mediates the intra-Golgi retrograde transport.Traffic, 2010, 11(12): 1552-1566.
[26] Tongmuang N, Yasamut U, Songprakhon P, Dechtawewat T, Malakar S, Noisakran S, Yenchitsomanus P T, Limjindaporn T.Coat protein complex I facilitates dengue virus production.Virus Research, 2018, 250: 13-20.
[27] Limjindaporn T, Wongwiwat W, Noisakran S, Srisawat C, Netsawang J, Puttikhunt C, Kasinrerk W, Avirutnan P, Thiemmeca S, Sriburi R, Sittisombut N, Malasit P, Yenchitsomanus P T.Interaction of dengue virus envelope protein with endoplasmic reticulum-resident chaperones facilitates dengue virus production.Biochemical and Biophysical Research Communications, 2009, 379(2): 196-200.
[28] Howe C, Garstka M, Al-Balushi M, Ghanem E, Antoniou A N, Fritzsche S, Jankevicius G, Kontouli N, Schneeweiss C, Williams A, Elliott T, Springer S.Calreticulin-dependent recycling in the early secretory pathway mediates optimal peptide loading of MHC class I molecules.The EMBO Journal, 2009, 28(23): 3730-3744.
[29] Wu Y, Ding Y, Zheng X, Liao K.The molecular chaperone Hsp90 maintains Golgi organization and vesicular trafficking by regulating microtubule stability.Journal of Molecular Cell Biology, 2020, 12(6): 448-461.
[30] 高囡囡, 鲍岚.微管蛋白的翻译后修饰及功能研究.生命科学, 2015, 27(3): 363-373.
Gao N N, Bao L.Post-translational modification and function of tubulin.Chinese Bulletin of Life Sciences, 2015, 27(3): 363-373.(in Chinese)
[31] Tian G, HUANG Y, Rommelaere H, Vandekerckhove J, Ampe C, Cowan N J.Pathway leading to correctly folded-tubulin.Cell, 1996, 86(2): 287-296.
[32] Jin S, Pan L, Liu Z, Wang Q, Xu Z, Zhang Y Q.tubulin-specific chaperone E functions at neuromuscular synapses and is required for microtubule network formation.Development, 2009, 136(9): 1571-1581.
[33] Metivier M, Gallaud E, Thomas A, Pascal A, Gagne J P, Poirier G G, Chretien D, Gibeaux R, Richard-Parpaillon L, Benaud C, Giet R.tubulin-specific chaperone E recruits tubulin around chromatin to promote mitotic spindle assembly.Current Biology, 2021, 31(4): 684-695.
[34] Hyde J L, Gillespie L K, Mackenzie J M.Mouse norovirus 1 utilizes the cytoskeleton network to establish localization of the replication complex proximal to the microtubule organizing center.Journal of Virology, 2012, 86(8): 4110-4122.
[35] DiGiuseppe S, Luszczek W, Keiffer T R, Bienkowska- Haba M, Guion L G, Sapp M J.Incoming human papillomavirus type 16 genome resides in a vesicular compartment throughout mitosis.Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(22): 6289-6294.
[36] Loftus M S, Verville N, Kedes D H.A conserved leucine zipper motif in gammaherpesvirus ORF52 is critical for distinct microtubule rearrangements.Journal of Virology, 2017, 91(17): e00304-17.
[37] Chen S, Liu M, Huang H, Li B, Zhao H, Feng X Q, Zhao H P.Heat stress-induced multiple multipolar divisions of human cancer cells.Cells, 2019, 8(8): 888.
[38] Li S, Wang Y, Hou D, Guan Z, Shen S, Peng K, Deng F, Chen X, Hu Z, Wang H, Wang M.Host factor heat-shock protein 90 contributes to baculovirus budded virus morphogenesis via facilitating nuclear actin polymerization.Virology, 2019, 535: 200-209.
Screening and identification of HSP90 interacting proteins insilkworm ()
LONG YanBi1, WU YunFei1, ZHANG Qian1, CHEN Peng1,2, PAN MinHui1,2*
1State Key Laboratory of Silkworm Genomic Biology, Southwest University, Chongqing 400716;2Key Laboratory of Sericulture Biology and Genetic Breeding, Ministry of Agriculture and Rural Affairs, Southwest University, Chongqing 400716
【Objective】HSP90 is a member of the heat shock protein family and plays an important role in insect resistance and metamorphosis.Studies have shown that HSP90 can promote the proliferation ofnucleopolyhedrovirus (BmNPV), but the mechanism of action is unclear.The objective of this study is to identify the interacting proteins of BmHSP90, and to provide a reference for the analysis of its mechanism of promoting BmNPV proliferation.【Method】The BmHSP90HAeukaryotic overexpression vector linked to pIZ/V5-His was constructed.After transfection in BmN-SWU1 cells for 48 h, BmNPV was infected and cultured for 48 h to collect the proteins.After the total protein was retained, the proteins were divided into two tubes and co-immunoprecipitation was performed.the interacting protein was caught with anti-HA antibody and IgG antibody, respectively, after staining the protein gel with silver nitrate, the different bands were obtained and mass spectrometry analysis was performed.the mass spectrometry results were combined with the information analysis to screen candidate interacting proteins, and then the interacting proteins were cloned and identified.The co-localization of HSP90 and the interacting protein was verified by immunofluorescence, and the co-immunoprecipitation experiment was further used to determine whether they had an interaction relationship.【Result】The results of silver nitrate staining showed that the experimental group and the control group had different bands near 90, 70 and 60 kD, and verified that the different bands at 90 kD were bait proteins.the other two different bands were analyzed by mass spectrometry, and a total of 7 candidate interacting proteins were identified.Two of the candidate proteins were selected for follow-up study through analysis, namely Tubulin-specific chaperone E (Tbce) and Golgin subfamily A member 5 (Golga5).The maximum open reading frame length of theis 1 728 bp, which encodes 576 amino acids, and the maximum open reading frame length of theis 1 854 bp, which encodes 618 amino acids.The homology alignment and phylogenetic tree showed that the microtubule binding domain of BmTbce (cytoskeleton-associated protein-glycine-rich, CAP-Gly) was located at the N-terminus and was highly conserved among different species.The transmembrane domain (TMD) of BmGolga5 was located at the C-terminus and was also conservative.The fluorescence co-localization showed that BmHSP90 co-localized with BmTbce and BmGolga5 in the cytoplasm, and it was further proved by co-immunoprecipitation that BmHSP90HAand BmTbceFlag, BmHSP90HAand BmGolga5Flaghad an interaction relationship.【Conclusion】After screening and identification, in the process of BmNPV infection ofcells, the proteins that interact with theheat shock protein HSP90 are BmTbce and BmGolga5.
; BmNPV; HSP90; Tbce; Golga5
2021-09-10;
2021-10-20
国家自然科学基金(31872427)、重庆市自然科学基金(cstc2020jscx-msxmX0045)、国家蚕桑产业技术体系(CARS-18)
龙艳碧,E-mail:1420183012@qq.com。通信作者潘敏慧,E-mail:pmh047@126.com
(责任编辑 岳梅)

