广泛靶向代谢组学解析桃蚜危害对桃树次生代谢产物的影响
闫乐乐,卜璐璐,牛良,曾文芳,鲁振华,崔国朝,苗玉乐,潘磊,王志强
广泛靶向代谢组学解析桃蚜危害对桃树次生代谢产物的影响
闫乐乐,卜璐璐,牛良,曾文芳,鲁振华,崔国朝,苗玉乐,潘磊*,王志强*
中国农业科学院郑州果树研究所,郑州 450009
【目的】阐明桃蚜()危害条件下桃树抗蚜和感蚜品种的代谢响应机制,并确定桃树响应桃蚜危害过程中起关键作用的次生代谢产物。【方法】采用抗蚜和感蚜桃树幼嫩新梢进行桃蚜危害处理,取接种3 d的桃树新梢进行次生代谢产物提取,并利用超高效液相色谱串联质谱(UPLC-MS/MS)对抗蚜品种(品系)‘96-5-1’(9651)和枣油桃(ZYT),感蚜品种中油13号(CN13)和中农金辉(ZNJH)进行广泛靶向代谢组分析,以|log2fold change|≥1,-value≤0.01作为筛选差异代谢物(differentially altered metabolite,DAM)的阈值。采用OPLS-DA模型的VIP值表示抗蚜和感蚜品种之间的差异。【结果】对桃蚜危害3 d后的处理取样,处理后的样品进行广泛靶向代谢组学分析,全部样品中共鉴定出528种代谢物。通过主成分分析(PCA)、层次聚类分析(HCA)和维恩图分析,发现感蚜品种中油13号被桃蚜危害后的差异代谢物总数为7种,有2种含量下降,5种含量上升;中农金辉被桃蚜危害后的差异代谢物总数为7种,有3种含量下降,4种含量上升。抗蚜品种‘96-5-1’被桃蚜危害后的差异代谢物总数为33种,有1种含量下降,32种含量上升;枣油桃被桃蚜危害后的差异代谢物总数为55种,有12种含量下降,43种含量上升。大多数差异代谢物来自两个抗蚜品种,并且抗蚜品种中差异代谢物的变化幅度比感蚜品种更大。经过分析获得的15种次生代谢产物(6种氨基酸及其衍生物、5种酚酸、3种核苷酸及其衍生物、1种有机酸)可能与寿星桃来源的桃蚜抗性相关。【结论】抗蚜品种在桃蚜危害后显著上调的次生代谢产物可能参与桃树对桃蚜的抗性反应过程,这些次生代谢产物(氨基酸及其衍生物、酚酸类物质、核苷酸及其衍生物和有机酸)的调控是桃树抵抗桃蚜危害的重要机制。
桃树;桃蚜;抗性;代谢组学;次生代谢产物;超高效液相色谱串联质谱
0 引言
【研究意义】桃蚜()是春季危害桃树最严重的害虫,通常以若虫、成虫群集于桃树新梢幼嫩叶片背面,通过刺吸式口器刺吸树体汁液,导致叶片卷曲。此外,桃蚜分泌的蜜露还会污染叶片,易诱发煤污病,影响树体正常生长及光合作用,进而影响桃果实的产量和品质,严重时还会导致桃树枯死[1]。目前,蚜虫防治主要依靠喷施农药,所需劳动力和经济成本较高,长期使用还会诱导桃蚜产生对农药的抗性,且有益昆虫也会受到负面影响[2]。发掘鉴定桃抗蚜资源并对其抗性机制进行研究,将有助于培育桃蚜抗性品种,并从根本上解决桃树蚜虫危害问题。研究桃树抗蚜品种在桃蚜取食过程中取食部位次生代谢产物的变化情况,是探索桃树桃蚜抗性机制形成的重要途径。【前人研究进展】目前,国内外已报道了多类桃属抗蚜资源。法国农业科学研究院(INRA)的研究人员先后报道了来源于桃砧木品种Rubira、垂枝花桃(weeping flower peach,WFP)和山桃P1908等为主的桃抗蚜资源[3-5],其中WFP和Rubira的桃蚜抗性为显性单基因调控,其抗性位点被命名为和[6-7]。国内中国农业科学院郑州果树研究所王力荣等[8]对桃属植物5个种419份资源进行了桃蚜抗性鉴定,并筛选出寿星桃、山桃和碧桃3类抗蚜资源。牛良等[9]对寿星桃类抗蚜材料‘粉寿星’来源的遗传群体抗性分析发现,‘粉寿星’对桃蚜的抗性为显性单基因控制,而后将该调控位点命名为[10]。张南南等[11]将寿星桃抗性调控位点定位到第1号染色体末端区域。Poëssel等[12]通过代谢组分析发现Rubira中的抗蚜性可能与酚类化合物二咖啡酰奎宁酸的积累相关。NIU等[10]对桃蚜危害前后桃树抗蚜品种的转录组分析发现,寿星桃类抗性品种在桃蚜危害之后,苯丙烷、类黄酮、芥子油苷、木脂素、生物碱和萜类等次生代谢产物合成路径基因的表达水平显著激活。众多研究表明,多类次生代谢产物在植物防御害虫危害过程中发挥关键作用,这些存在于植物中的次生代谢产物会对害虫起到阻止取食甚至导致死亡的作用[13-14]。Applebaum等[15]最早提出皂甙类化合物在植物害虫防御过程中的重要作用。目前,已有大量研究确认植物中的皂甙类物质如三萜类化合物对昆虫具有多种抗虫活性[16-17]。【本研究切入点】我国拥有丰富的抗蚜资源,但是对于抗蚜机制缺乏深入研究。虽然目前对桃抗蚜基因的定位已有相关报道,但是从代谢组学的角度全面解析的研究却鲜见报道。本研究通过广泛靶向代谢组技术,全面、快速地获取桃树抗蚜品种蚜虫危害后的代谢物信息,并系统分析代谢物差异水平和种类变化。【拟解决的关键问题】采用广泛靶向代谢组技术对桃蚜危害后的抗蚜品种进行研究,探明抗蚜和感蚜品种桃蚜取食前后的代谢物含量变化情况,阐释基于次生代谢产物的桃树抗蚜机制的形成过程,为桃树桃蚜防控提供理论依据。
1 材料与方法
1.1 材料
供试4个桃树品种(品系),包括抗蚜品种(品系)‘96-5-1’(9651)和枣油桃(ZYT),感蚜品种中油13号(CN13)和中农金辉(ZNJH),由中国农业科学院郑州果树研究所桃育种课题组育种圃保存。
试验材料处理于2020年春季4月份桃蚜易发生的季节进行,供试桃蚜采自育种圃感蚜品种自然生长的健康成虫。试验组进行桃蚜处理时,选择没有桃蚜危害症状和桃蚜分布的幼嫩桃树新梢,保证选取的试验材料无前期桃蚜危害,然后将15—20只桃蚜成虫用棉签轻轻放在待处理的新梢顶端,每个品种(品系)处理4株桃树,作为生物学重复。4—6 h内如发现蚜虫显著减少,则重新补接蚜虫。经过3 d,试验组和未经桃蚜危害的对照组取新梢顶端的3片嫩叶,3—5个新梢混为一个生物学样品,每组重复4次,采样后于-80℃下保存并在30 d内完成代谢组测试。
1.2 方法
1.2.1 样品预处理 将从各品种(品系)上收集的样品放置于冻干机(Scientz-100F)中真空冷冻干燥;用研磨仪(MM 400,Retsch)以30 Hz频率研磨1.5 min,将样品研磨成粉末;称取100 mg的样品粉末,溶于0.6 ml 70%甲醇提取液中;溶解的样品储存于4℃冰箱中过夜,其间涡旋6次以提高提取率;然后,样品在离心机中10 000×离心10 min,并吸取上清液。用0.22 μm微孔滤膜过滤样品,并储存在进样瓶中,以便用于超高效液相色谱串联质谱(UPLC-MS/MS)分析。
1.2.2 UPLC和MS/MS分析条件 UPLC采用的色谱柱为Agilent SB-C18 1.8 μm(2.1 mm×100 mm),采用的流动相分为两种,A相为超纯水(加入0.1%的甲酸),B相为乙腈。洗脱梯度:0—9 min,B相比例从5%升至95%;9—10 min,B相比例保持95%;10—11 min,B相比例从95%降至5%;并以5%保持至14 min;流速0.35 ml·min-1;期间柱温为40℃;进样量为4 µl。
质谱条件主要包括:电喷雾离子源(electrospray ionization,ESI)温度550℃,质谱电压5 500 V,帘气(curtain gas,CUR)30 psi,碰撞诱导电离(collision-activated dissociation,CAD)参数设置为高。在三重四级杆(triple quadrupole,QQQ)中,根据优化的去簇电压(declustering potential,DP)和碰撞能(collision energy,CE)进行扫描检测每个离子对[18]。
1.2.3 数据分析 利用多元统计分析方法,在OPLS- DA结果基础上,从获得的多变量分析OPLS-DA模型的变量重要性投影(variable importance in projection,VIP),筛选出不同样品间的差异代谢物(differentially altered metabolite,DAM)。然后结合单变量分析的-value值或差异倍数值(fold change,FC)进一步筛选出差异代谢物。本试验存在生物学重复,因此结合差异倍数值和OPLS-DA模型的VIP值筛选差异代谢物。筛选标准:选取FC≥2和FC<0.5的代谢物。如果对照组和试验组中的代谢物差异在2倍以上或0.5倍以下,则认为差异显著。VIP值表示对应代谢物之间的差异在模型中各组样品分类判别中的影响强度,一般认为VIP>1的代谢物具有显著性差异。在自建数据库MWDB(metware database)的基础上,根据二级谱信息进行代谢物定性。获得不同样品的代谢物质谱分析数据后,将所有物质质谱峰进行峰面积积分,并对其中不同样品中的同一代谢物质谱出峰进行积分校正[19]。
2 结果
2.1 桃蚜危害前后桃树新梢中的整体代谢成分分析
经过代谢组分析,4个桃品种(品系)中共鉴定出528种代谢物,按照这些代谢物的一级分类可以划分为11大类,具体种类及相应数目见表1。

表1 桃蚜危害前后桃新梢中检测到的528种代谢物质分类
2.2 桃蚜危害前后桃树新梢中代谢成分的主成分分析
为了解各组样品之间的代谢物差异和组内样品之间的变异度,对样品进行主成分分析(PCA)[20]。其中质控样品mix是各测试样品的一个混合样品。在PCA图中,PC1表示第一主成分,PC2表示第二主成分,百分比表示该主成分对数据集的解释率。从图1可看出UPLC-MS/MS分析所得原始数据在PC1、PC2两种主成分中得到良好地呈现。在图中,第一主成分的贡献率为23.47%,第二主成分的贡献率为14.55%,两种主成分贡献率之和为38.02%,代表两个主成分能够基本反映桃树新梢样品的主要特征信息。同组样品在图中聚集在一起,说明组内重复性好。感蚜品种中油13号和中农金辉处理前后样品分组在图中聚集在一起,说明感蚜品种在桃蚜危害处理前后的代谢成分差异变化较小;抗蚜品种枣油桃桃蚜处理前的样品和两个感蚜品种桃蚜处理前后样品分组在一起,‘96-5-1’桃蚜处理前的样品和两个感蚜品种桃蚜处理前后样品分组所处的位置也较近,说明抗蚜品种与感蚜品种桃蚜处理前样品的代谢成分差异很小,其中‘96-5-1’桃蚜处理前的样品没有与感蚜品种桃蚜处理前样品完全重叠,表明本试验中‘96-5-1’的对照样品可能存在部分蚜虫危害情况。而两个抗蚜品种‘96-5-1’和枣油桃在桃蚜危害处理后与抗蚜品种处理前和感蚜品种处理前后的分组分开明显、距离最远,说明它们之间代谢成分差异较大,蚜虫危害处理使抗蚜品种内的代谢物成分发生了显著的变化。质控样品mix也被一起分组,表明试验条件是稳定、可重复的(图1)。
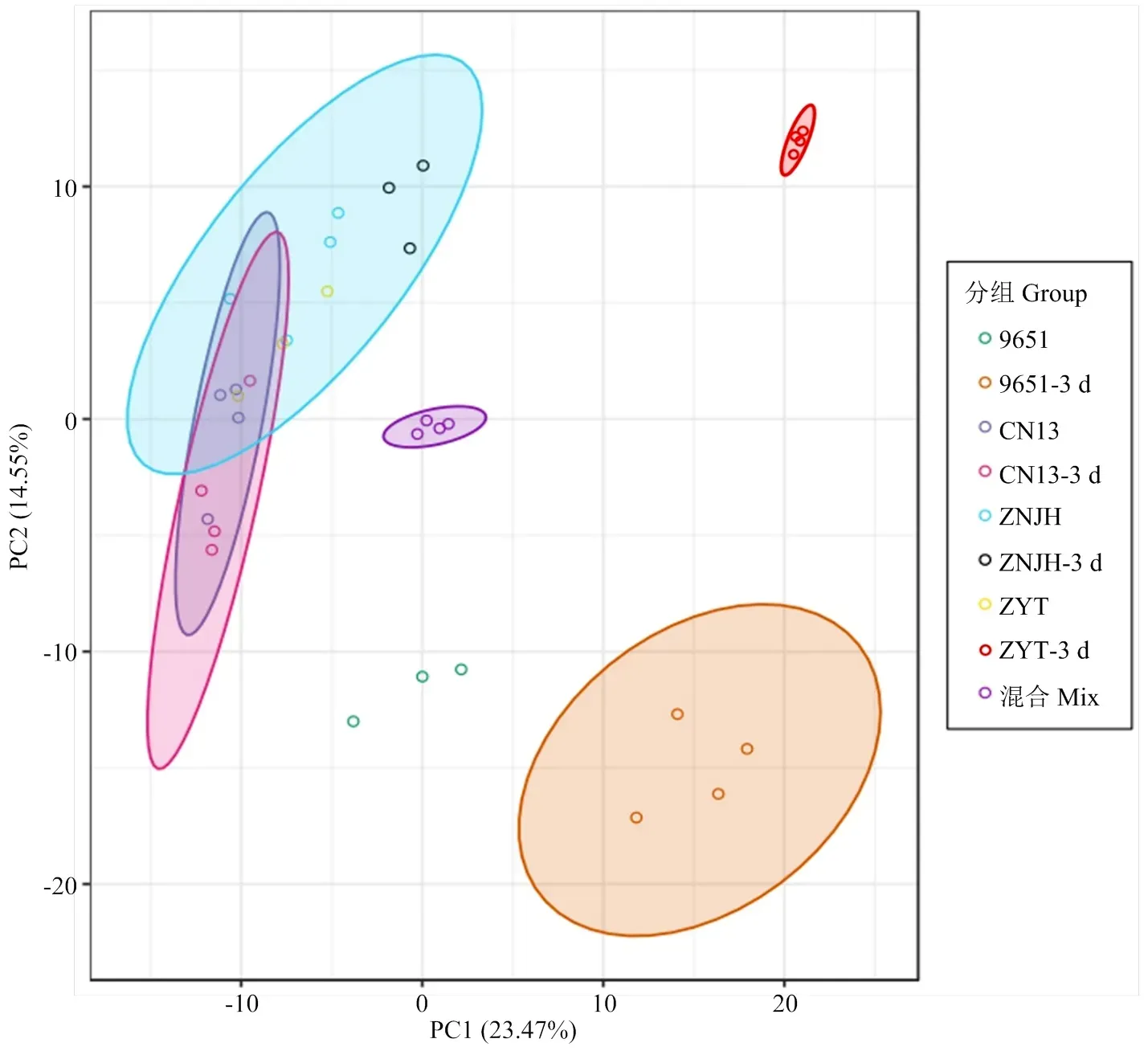
图中每个点代表一个样品,同一组的样品使用同一种颜色,每组4个生物学重复。重复性不好的样品,可以去掉一个样品点
2.3 桃蚜危害前后桃树新梢中代谢成分的层次聚类分析
为了进一步分析抗蚜和感蚜品种在桃蚜危害前后的代谢物变化情况,采用层次聚类分析(HCA)对蚜虫危害前后所有样品的整体代谢物变化进行可视化分析。整体而言,抗蚜品种‘96-5-1’和枣油桃蚜虫危害后的样品与‘96-5-1’取食前的样品聚在一起,说明这些样品中代谢物的表达模式一致性更高(图2),该结果与主成分分析(图1)得到的结果基本一致,即两个抗蚜品种‘96-5-1’和枣油桃在桃蚜危害处理后的样品与其他样品(两个感蚜品种处理前后的样品和抗蚜品种处理前的样品)是分开的,其中‘96-5-1’的对照样品可能存在部分蚜虫危害情况,因此与两个抗蚜品种蚜虫危害后的样品聚在一起(图2)。
2.4 桃蚜危害前后桃树新梢中差异代谢物分析
为了更加明确的展示不同品种对于桃蚜危害的代谢相应,比较了‘96-5-1’、枣油桃、中油13号和中农金辉在桃蚜危害3 d后各自差异代谢物的数目,抗蚜品种‘96-5-1’和枣油桃在桃蚜危害后差异代谢物的数目多于感蚜品种,且差异代谢物的含量均以上调为主,‘96-5-1’和枣油桃中上调代谢物占比分别为97.0%(32/33)和78.2%(43/55);说明抗蚜品种对于桃蚜危害的响应要强于感蚜品种,显现出明显的诱导性抗性特征(图3-A)。
采用维恩图分析4个桃品种在桃蚜危害后差异代谢物的异同,共有19种代谢物在抗蚜品种‘96-5-1’和枣油桃受蚜虫危害前后出现含量的变化,其中15种代谢产物含量的变化是在两个抗蚜品种中特异的,这15种代谢产物含量在两个感蚜品种中油13号和中农金辉蚜虫危害前后无差异,推测这15种代谢物与寿星桃来源的桃蚜抗性相关(图3-B)。
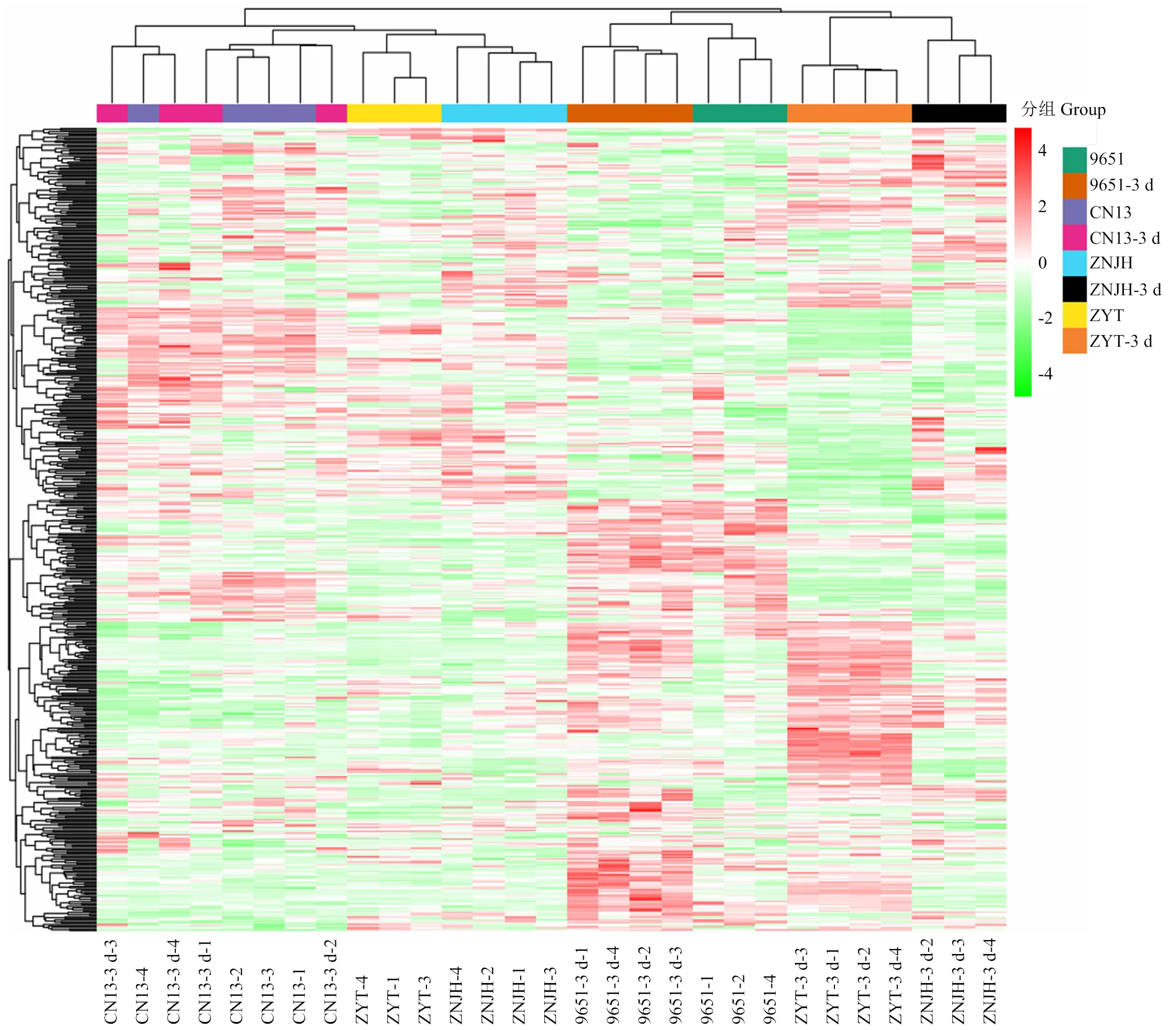
在总样品中检测到的次生代谢产物的热图。红色表示高丰度,绿色表示低丰度

A:柱状图Histogram;B:韦恩图Venn diagram
用正交偏最小二乘判别分析(orthogonal PLS- DA,OPLS-DA)模型筛选出蚜虫处理前后不同样品的差异代谢物并进行直观展示,感蚜品种中农金辉在桃蚜处理后,有521种代谢物含量变化不显著,4种代谢物含量上升,3种代谢物含量下降(图4-A);中油13号在桃蚜处理后,有521种代谢物含量变化不显著,5种代谢物含量上升,2种代谢物含量下降(图4-B)。抗蚜品种‘96-5-1’在桃蚜处理后,有495种代谢物含量变化不显著,32种代谢物含量上升,1种代谢物含量下降(图5-A);枣油桃在桃蚜处理后,有473种代谢物含量变化不显著,43种代谢物含量上升,12种代谢物含量下降(图5-B)。

一个点表示一种代谢物,绿点为下调差异表达代谢物,红点为上调差异表达代谢物,灰色部分为能检测到但含量变化不显著的代谢物。图5同
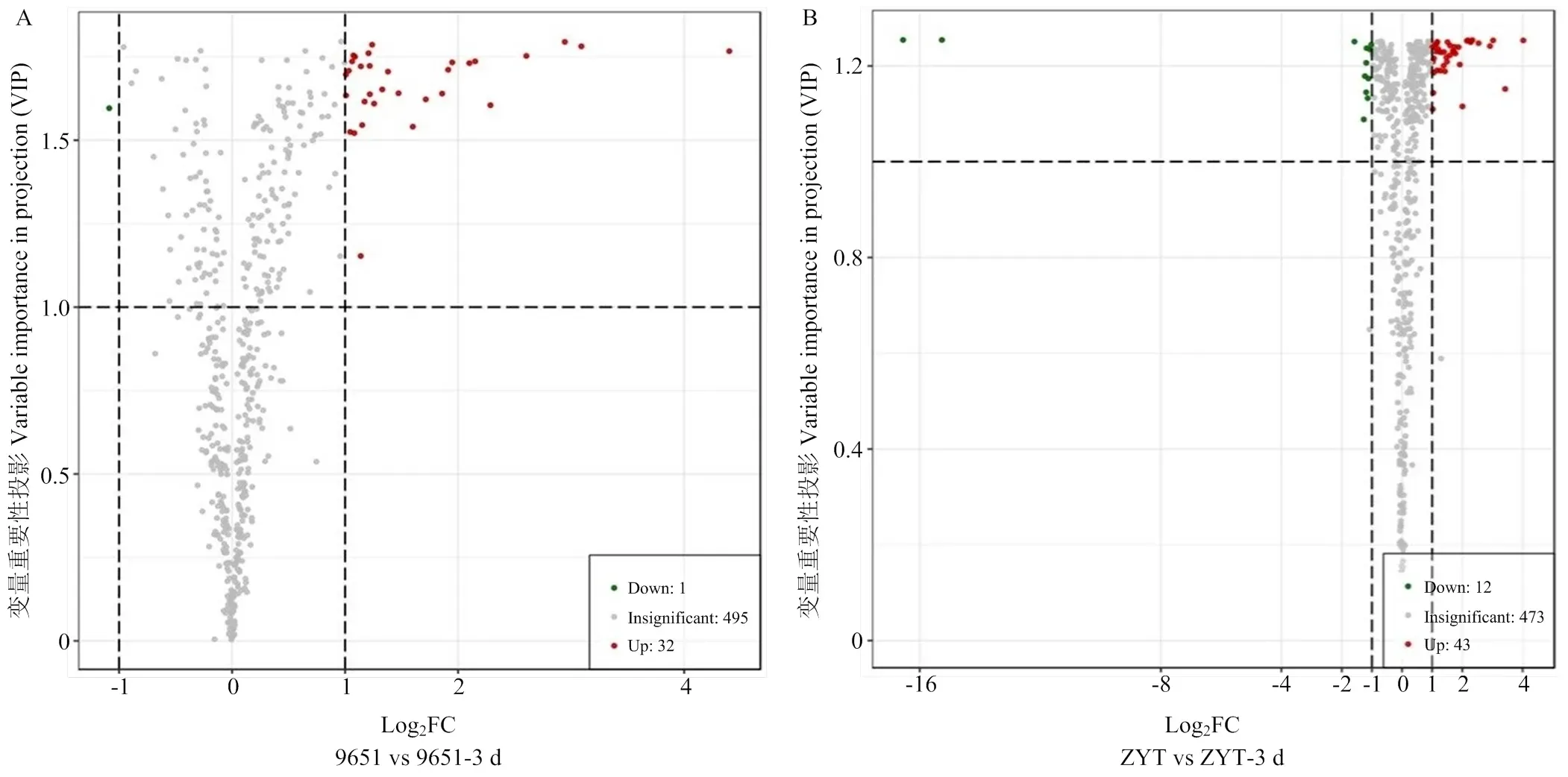
图5 抗蚜品种‘96-5-1’和枣油桃桃蚜危害前后差异代谢物火山图
通过图3-B的韦恩图分析可以看出,在所有检测到的差异代谢物中,有15种差异代谢物同时在抗蚜品种‘96-5-1’和枣油桃蚜虫危害后含量发生了变化,并且这15种差异代谢物在感蚜品种中油13号和中农金辉蚜虫危害后含量未发生明显变化,推测这些代谢物可能与寿星桃来源的桃蚜抗性相关。这15种差异代谢物包含6种氨基酸及其衍生物,5种酚酸类物质,3种核苷酸及其衍生物,1种有机酸(图6)。15种差异代谢物含量在感蚜品种蚜虫危害前后变化较小,而在抗蚜品种中含量变化明显(图6)。

图6 4个品种被蚜虫危害3 d后检测到的差异代谢物
3 讨论
3.1 桃蚜危害处理后抗蚜品种和感蚜品种的代谢物变化
昆虫取食植物后,植物首先利用形态学上的特殊结构进行物理防御,然后利用自身存在的或经诱导合成的代谢产物抵御昆虫取食。通常,按照防御物质出现的先后顺序将植物的抗性反应分为组成性抗性和诱导性抗性。组成性抗性是指植物在遭受昆虫危害前就存在的特性,而诱导性抗性是指植物在受到昆虫的取食、产卵、寄生等因素胁迫时才产生的一系列抗性反应[21-23]。诱导性抗性的植物在被昆虫取食后产生次生代谢产物防御昆虫[24]。研究表明,次生代谢产物与植物对昆虫的抗性紧密相关,其对昆虫的主要作用方式有拒食和毒杀[24]。本研究运用UPLC-MS/MS的方法,对抗蚜品种‘96-5-1’、枣油桃和感蚜品种中油13号、中农金辉桃蚜危害3 d处理的幼嫩叶梢中的代谢物进行分析,共检测出包括有黄酮类、酚酸类、脂质类、氨基酸及其衍生物类、有机酸、核苷酸及其衍生物类、生物碱类、木脂素和香豆素类、萜类、鞣质类等528种次生代谢产物。在桃蚜危害处理后,抗蚜品种‘96-5-1’和枣油桃中差异代谢物的数量和幅度显著大于感蚜品种中油13号和中农金辉,且抗蚜品种对于桃蚜危害的响应多以代谢物含量的上升为主(图3-A),表明来源于寿星桃的桃蚜抗性表现出明显的诱导性抗性特征。Pedersen等[25]比较不同苜蓿品种皂苷类化合物的浓度及植物体被蚜虫危害后的表型,发现苜蓿中的三萜皂苷具有抑制蚜虫发育的作用。本文利用广泛靶向代谢组学研究桃树对桃蚜危害的响应,发现某些特定次生代谢产物可能对寿星桃来源的桃蚜抗性具有重要作用,这与前期转录组研究得到的结论基本一致[10]。
3.2 桃蚜响应代谢物参与桃抗蚜过程的可能机制
通过UPLC-MS/MS对抗蚜和感蚜品种桃蚜危害前后代谢成分分析,筛选了15种差异代谢物,包含6种氨基酸及其衍生物,5种酚酸类物质,3种核苷酸及其衍生物和1种有机酸(图6),这些代谢物在感蚜品种蚜虫危害前后含量变化较小,而在抗蚜品种蚜虫危害前后代谢物含量明显提高,推测可能为寿星桃来源的桃蚜抗性相关代谢物成分。这4类代谢物参与植物免疫反应的可能路径主要有3类:(1)代谢物自身有抗菌或昆虫毒性活性,直接作为植物体内防御化合物存在。合成具有抗菌或毒性活性的天然产物是植物应对病原体和昆虫危害的防御措施[26]。酚酸类物质被昆虫取食后会产生毒性。例如东方斜纹夜蛾()幼虫的取食诱导辣椒中酚类化合物芦丁、香草醛和突触酸的产生,从而影响幼虫发育和成虫的反应[27]。(2)作为植物体内防御化合物的合成前体。例如硫代葡萄糖苷及其降解产物是植物中一类抗菌和抗虫物质[28-29],硫代葡萄糖苷分为脂肪族硫代葡萄糖苷、苯丙氨酸/酪氨酸衍生的苯系硫代葡萄糖苷和吲哚类硫代葡萄糖苷,这3类硫代葡萄糖苷均来源于不同的氨基酸前体[30]。咖啡因是一种典型的嘌呤生物碱,天然存在于咖啡、茶和可可等植物中,其化学本质是一类黄嘌呤生物碱,在植物体内以黄嘌呤类核酸为前体[31]。通常认为,植物体中的咖啡因也是一种防御化合物,例如烟草和菊花中过表达N-甲基转移酶基因后咖啡因含量增加,并增强植物体对昆虫和病菌的抗性[32]。(3)作为信号物质影响植物体抗性。例如氨基酸类物质在植物体免疫过程中作为信号物质存在,拟南芥中高丝氨酸或苏氨酸积累相关基因突变导致的氨基酸失衡,能够提高植物体对卵菌病原体的抗性,但对病原真菌或细菌抗性没有影响[33]。
4 结论
通过对桃蚜危害条件下抗蚜和感蚜品种次生代谢产物的综合比较,发现抗蚜品种中响应危害过程的代谢物为氨基酸及其衍生物、酚酸类物质、核苷酸及其衍生物和有机酸。在桃蚜危害后,抗蚜品种的植物体比感蚜品种的植物体检测到更多次生代谢产物成分的变化,并且这些变化以代谢物上调为主,这可能是寿星桃来源桃蚜抗性代谢物层面的产生机理。桃蚜危害后产生的酚酸类物质可能是作为植物体内的防御化合物,而氨基酸及其衍生物和核苷酸及其衍生物可能作为植物体内防御化合物的合成前体或抗性信号存在。
[1] 牛良.寿星桃抗蚜性鉴定及分子机制解析[D].武汉: 华中农业大学, 2019.
NIU L.Identification of resistance to green peach aphids of Shouxing peach and its molecular mechanism[D]. Wuhan: Huazhong Agricultural University, 2019.(in chinese)
[2] CUTLER G C, RAMANAIDU K, ASTATKIE T, ISMAN M B.Green peach aphid,(Hemiptera: Aphididae), reproduction during exposure to sublethal concentrations of imidacloprid and azadirachtin.Pest Management Science, 2009, 65(2): 205-209.
[3] MASSONIé G, MAISON P, MONET R, GRASSELLY C.Résistance au puceron vert du pêcher,Sulzer (Homoptera Aphididae) chez(L.) Batsch et d’autres espèces de.Agronomie, 1982, 2(1): 63-70.
[4] MONET R, MASSONIé G.Déterminisme génétique de la résistance au puceron vert () chez le pêcher.Résultats complémentaires.Agronomie, 1994, 14(3): 177-182.
[5] SAUGE M H, KERVELLA J, PASCAL T.Settling behaviour and reproductive potential of the green peach aphidon peach varieties and a related wild.Entomologia Experimentalis et Applicata, 1998, 89(3): 233-242.
[6] SAUGE M H, LACROZE J P, POëSSEL J L, PASCAL T, KERVELLA J.Induced resistance byin the peach cultivar ‘Rubira’.Entomologia Experimentalis et Applicata, 2002, 102(1): 29-37.
[7] SAUGE M H, MUS F, LACROZE J P, PASCAL T, KERVELLA J, POëSSEL J L.Genotypic variation in induced resistance and induced susceptibility in the peach -aphid system.Oikos, 2006, 113(2): 305-313.
[8] 王力荣, 朱更瑞, 方伟超, 左覃元, 韩立新.桃种质资源对桃蚜的抗性评价.果树学报, 2001, 18(3): 145-147.
Wang L R, ZHU G R, FANG W C, ZUO Q Y, HAN L X.Study on the resistance to peach aphid of peach germplasm.Journal of Fruit Science, 2001, 18(3): 145-147.(in chinese)
[9] 牛良, 鲁振华, 曾文芳, 崔国朝, 潘磊, 徐强, 李国怀, 王志强.‘粉寿星’对桃绿蚜抗性的遗传分析.果树学报, 2016, 33(5): 578-584.
NIU L, LU Z H, ZENG W F, CUI G C, PAN L, XU Q, LI G H, WANG Z Q.Inheritance analysis of resistance to green peach aphids (Sülzer) for peach cultivar ‘Fen Shouxing’ (var.).Journal of Fruit Science, 2016, 33(5): 578-584.(in chinese)
[10] NIU L, PAN L, ZENG W F, LU Z H, CUI G C, FAN M L, XU Q, WANG Z Q, LI G H.Dynamic transcriptomes of resistant and susceptible peach lines after infestation by green peach aphids (Sülzer) reveal defence responses controlled by thelocus.BMC Genomics, 2018, 19: 846.
[11] 张南南, 鲁振华, 崔国朝, 潘磊, 曾文芳, 牛良, 王志强.基于SNP标记桃抗蚜性状的基因定位.中国农业科学, 2017, 50(23): 4613-4621.
ZHANG N N, LU Z H, CUI G C, PAN L, ZENG W F, NIU L, WANG Z Q.Gene mapping of aphid-resistant for peach using SNP markers.Scientia Agricultura Sinica, 2017, 50(23): 4613-4621.(in chinese)
[12] POËSSEL J L, SAUGE M H, STAUDT M, DUFOUR C, DEBORDE C, RAHBÉ Y, JACKSON B, RENAUD C, MAUCOURT M, CORRE M N, EL-AOUNI H, LACROZE J P, MOING A.PR-proteins and induced resistance against pathogens and insects. Neuchâtel, Switzerland, 2011.
[13] NAWROT J, HARMATHA J.Phytochemical feeding deterrents for stored product insect pests.Phytochemistry Reviews, 2012, 11(4): 543-566.
[14] KANDA D, KAUR S, KOUL O.A comparative study of monoterpenoids and phenylpropanoids from essential oils against stored grain insects: acute toxins or feeding deterrents.Journal of Pest Science, 2017, 90: 531-545.
[15] APPLEBAUM S W, MARCO S, BIRK Y.Saponins as possible factors of resistance of legume seeds to the attack of insects.Journal of Agricultural and Food Chemistry, 1969, 17(3): 618-622.
[16] HUSSAIN M, DEBNATH B, QASIM M, BAMISILE B S, ISLAM W, HAMEED M S, WANG L, QIU D.Role of saponins in plant defense against specialist herbivores.Molecules, 2019, 24(11): 2067.
[17] DíAZ A, HERFINDAL L, RATHE B A, SLETTA K Y, Vedeler A, Haavik S,FOSSEN T.Cytotoxic saponins and other natural products from flowering tops ofL.Phytochemistry, 2019, 164: 67-77.
[18] CHEN W, GONG L, GUO Z, WANG W S, ZHANG H Y, LIU X Q, YU S B, XIONG L Z, LUO J.A novel integrated method for large-scale detection, identification, and quantification of widely targeted metabolites: application in the study of rice metabolomics.Molecular Plant, 2013, 6(6): 1769-1780.
[19] FRAGA C G, CLOWERS B H, MOORE R J, ZINK E M.Signature-discovery approach for sample matching of a nerve-agent precursor using liquid chromatography-mass spectrometry, XCMS, and chemometrics.Analytical Chemistry, 2010, 82(10): 4165-4173.
[20] CHEN Y H, ZHANG R P, SONG Y M, HE J M, SUN J H, BAI J F, AN Z L, DONG L J, ZHAN Q M, ABLIZ Z.RRLC-MS/MS-based metabonomics combined with in-depth analysis of metabolic correlation network: finding potential biomarkers for breast cancer.Analyst, 2009, 134(10): 2003-2011.
[21] CONRATH U, BECKERS G, Flors V, García-Agustín P, Jakab G, Mauch F, Newman M A, Pieterse C M J, Poinssot B, Pozo M J,.Priming: getting ready for battle.Molecular Plant-Microbe Interactions, 2006, 19(10): 1062-1071.
[22] BRUCE T J, PICKETT J A.Plant defence signalling induced by biotic attacks.Current Opinion in Plant Biology, 2007, 10(4): 387-392.
[23] TON J , D’ALESSANDRO M, JOURDIE V, JAKAB G, Karlen D, Held M, Mauch-Mani B, TURLINGS T.Priming by airborne signals boosts direct and indirect resistance in maize.The Plant Journal, 2007, 49(1): 16-26.
[24] 陈晓亚, 薛红卫.植物生理与分子生物学.4版.北京: 高等教育出版社, 2012: 716-734.
CHEN X Y, XUE H W.Plant Physiology and Molecular Biology.4th ed.Beijing: Higher Education Press, 2012: 716-734.(in chinese)
[25] PEDERSEN M W, BARNES D K, SORENSEN E L, GRIFFIN G D, NIELSON M W, HILL R R, FROSHEISER F I, SONODA R M, HANSON C H, HUNT O J,.Effects of low and high saponin selection in alfalfa on agronomic and pest resistance traits and the interrelationship of these traits.Crop Science, 1976, 16(2): 193-199.
[26] AHUJA I, KISSEN R, BONES A M.Phytoalexins in defense against pathogens.Trends in Plant Science, 2012, 17(2): 73-90.
[27] MOVVA V, PATHIPATI U R.Feeding-induced phenol production inL.influencesF.larval growth and physiology.Archives of Insect Biochemistry and Physiology, 2017, 95(1): e21387.
[28] BARTH C, JANDER G.myrosinases TGG1 and TGG2 have redundant function in glucosinolate breakdown and insect defense.The Plant Journal, 2006, 46: 549-562.
[29] BEDNAREK P, PISLEWSKA-BEDNAREK M, SVATOS A, SCHNEIDER B, DOUBSKY J, MANSUROVA M, HUMPHRY M, CONSONNI C, PANSTRUGA R, SANCHEZ-VALLET A, Molina A, Schulze-Lefert P.A glucosinolate metabolism pathway in living plant cells mediates broad-spectrum antifungal defense.Science, 2009, 323(5910): 101-106.
[30] SØNDERBY I E, GEU-FLORES F, HALKIER B A.Biosynthesis of glucosinolates – gene discovery and beyond.Trends in Plant Science, 2010, 15(5): 283-290.
[31] ASHIHARA H, CROZIER A.Caffeine: a well known but little mentioned compound in plant science.Trends in Plant Science, 2001, 6(9): 407-413.
[32] SANO H, KIM Y S, CHOI Y E.Like cures like: caffeine immunizes plants against biotic stresses.Advances in Botanical Research, 2013, 68: 273-300.
[33] VAN DAMME M, ZEILMAKER T, ELBERSE J, ANDEL A, DE SAIN-VAN DER VELDEN M, VAN DEN ACKERVEKEN G.Downy mildew resistance inby mutation of.The Plant Cell, 2009, 21(7): 2179-2189.
Widely targeted metabolomics analysis of the Effects offeeding onsecondary metabolites
YAN LeLe, BU LuLu, NIU Liang, ZENG WenFang, LU ZhenHua, CUI GuoChao, MIAO YuLe, PAN Lei*, WANG ZhiQiang*
Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009
【Objective】The objective of this study is to clarify the underlying biochemical mechanisms related to the resistance and susceptibility of peach towards, and to identify the key secondary metabolites of peach responding to theinfection.【Method】New shoots of resistant (‘96-5-1’ (9651), ZaoYouTao (ZYT)) and susceptible (Zhong You 13 (CN13), Zhong Nong Jin Hui (ZNJH)) peach trees were inoculated withfor 3 days and used for secondary metabolite extraction and UPLC-MS/MS analysis.Differentially altered metabolites (DAMs) were screened with |log2fold change|≥1,-value≤0.01 as threshold.The VIP value of the OPLS-DA model was used to perform differences between resistant and susceptible peach.【Result】To illustrate the biochemical mechanisms ofresistance in peach, aphid-resistant/aphid-susceptible peach varieties infested withfor 3 days.A total of 528 metabolites were identified in the treated samples through widely targeted metabolomics analysis.Using principal component analysis (PCA), hierarchical cluster analysis (HCA) and venn diagram analysis, it was found that 7 DAMs were identified from the susceptible variety CN13, and 2 of them were significantly decreased, 5 of them were significantly increased.7 DAMs were identified from the susceptible variety ZNJH, and 3 of them were significantly decreased, 4 of them were significantly increased.33 DAMs were identified from the resistant variety ‘96-5-1’, and 1 of them was significantly decreased, 32 of them were significantly increased.55 DAMs were identified from the resistant variety ZYT, and 12 of them were significantly decreased, 43 of them were significantly increased.The majority of the DAMs were identified from the two resistant varieties, and the overall magnitude of change was greater in the resistant varieties than that in the susceptible varieties.Finally, 15 secondary metabolites (6 amino acids and their derivatives, 5 phenolic acids, 3 nucleotides and their derivatives, and 1 organic acid) were considered to be involved inresistance of ‘Shou xing tao’.【Conclusion】The significantly up-regulated secondary metabolites obtained in-resistant peach varieties were mainly involved in the response tofeeding.The regulation of these secondary metabolites (amino acids and their derivatives, phenolic acids, nucleotides and their derivatives, organic acid) is the important mechanism of defense reaction to.
peach; green peach aphid (); resistance; metabolomics; secondary metabolite; UPLC-MS/MS
2021-08-13;
2021-09-17
国家自然科学基金(32071800,31701880)、中国农业科学院科技创新工程(CAAS-ASTIP-2021-ZFRI)、国家重点研发计划(2019YFD1000801)
闫乐乐,E-mail:275101462@qq.com。通信作者王志强,E-mail:wangzhiqiang@caas.cn。通信作者潘磊,E-mail:panlei@caas.cn
(责任编辑 岳梅)

