3.0T磁共振弥散加权序列对原发性肝癌TACE术后疗效评估
吴 杰,肖安岭(通信作者),李 卫,陈 雷,韩明锋,李秀勇
(1阜阳市第二人民医院MRI室 安徽 阜阳 236015)
(2阜阳市第二人民医院感染科 安徽 阜阳 236015)
(3阜阳市第二人民医院放射科 安徽 阜阳 236015)
(4阜阳市第二人民医院呼吸科 安徽 阜阳 236015)
(5阜阳市第二人民医院肾内科 安徽 阜阳 236015)
原发性肝癌是全球最常见恶性肿瘤,全球发病率排名第六,我国乙肝肝硬化患者比重较大,发病率居全球第三[1],其发病率和死亡率较高,肝癌的早期诊断和治疗可以明显降低患者死亡率,指导临床治疗,提高患者的生存率。近年来随着医学影像检查技术的飞速发展,尤其MRI扫描技术的迅猛发展新的检查技术和新序列的开展和应用,肝脏疾病的检出率不断提高,对延长患者的寿命,提高患者生活质量具有深远的价值和意义。MRI检查具有很高软组织分辨率,可以多方位、多参数、多序列成像,与其他影像检查方式比较,可以显著提高肝脏疾病的诊断率,是目前诊断肝脏疾病最有效的影像学检查方式。通过注射钆剂进行MRI动态增强扫描,能较清晰地反映病灶内部血供情况,有利于肝脏部分疾病的定性诊断。
对于肝癌的治疗主要采取手术切除的方式,肝癌介入手术主要用于手术难以切除或者中晚期肝癌患者的姑息治疗,用于改善患者的预后[2],提高患者生存质量。本文通过回顾性分析肝癌介入前后MRI信号和ADC值的变化情况,对介入效果进行评估,指导临床治疗。
1 资料与方法
1.1 一般资料
选取阜阳市第二人民医院2018年6月—2021年8月期间收治的40例经临床或者影像确诊的原发性肝癌患者为研究对象,所有患者均行经导管动脉栓塞化疗(transcatheter arterial chemoembolization,TACE),且术前均行3.0T MRI动态增强及DWI序列扫描。40例患者中男性34例(85.0%),女性6例(15.0%),年龄40~79岁,平均年龄(60.10±10.50)岁。
1.2 方法
采用盐酸利多卡因5 mL局部麻醉后采用Seldinger技术穿刺右侧股动脉,成功后置入5F动脉鞘,由鞘管引入5F RH导管及超滑导丝选择腹腔干行肝动脉DSA,见肝右静脉增粗,迂曲紊乱的肝实质期异常染色的肿瘤病灶,首先行4 mg雷替曲塞粉针+100 mL 0.9%氯化钠溶液进行化疗,然后在透视下注入6 mL碘油乳剂+10 mL罂粟乙碘油注射液+20 mL表柔比星粉针混匀进行栓塞治疗,术中经导管采用甲氧氯普胺10 mg及盐酸利多卡因5 mL进行止吐、镇痛处理。
术后检查采用西门子3.0T磁共振,扫描范围膈顶至肝脏下缘,行常规T1WI DIXON(同相位像、反相位像、纯水像和纯脂像)、T2WI压脂像、DWI横断位扫描,T2WI屏气的横断位T1VIBE多期动态增强扫描,造影剂采用江苏恒瑞生产的钆特酸葡胺,按0.1 mL/kg经肘静脉注射,速率为1.5~2.0 mL/s,扫描间隔为动脉期25 s、门脉60 s、延迟期180 s。将处理的原始数据导入磁共振后处理工作站,对介入治疗前后ADC值进行测量。
1.3 统计学方法
采用SPSS 20.0统计软件进行数据分析。计数资料以频数(n)、百分比(%)表示,行χ2检验;计量资料以均数±标准差(± s)表示,行t检验。P<0.05则差异有统计学意义。
2 结果
2.1 诊断符合率比较
40例检查患者经3.0T动态增强诊断残留活性病灶的符合率为97.5%(39/40),单纯的DWI序列诊断符合率为70.0%(28/40),两种检查方式之间的差异有统计学意义(χ2=11.114,P<0.05)。
2.2 ADC值比较
肿瘤残留组织ADC值为(1.08±0.12)×10-3mm2/s,肿瘤坏死组织的ADC值为(1.23±0.15)×10-3mm2/s,两者之间的差异有统计学意义(t=4.939,P<0.05)(图1)。
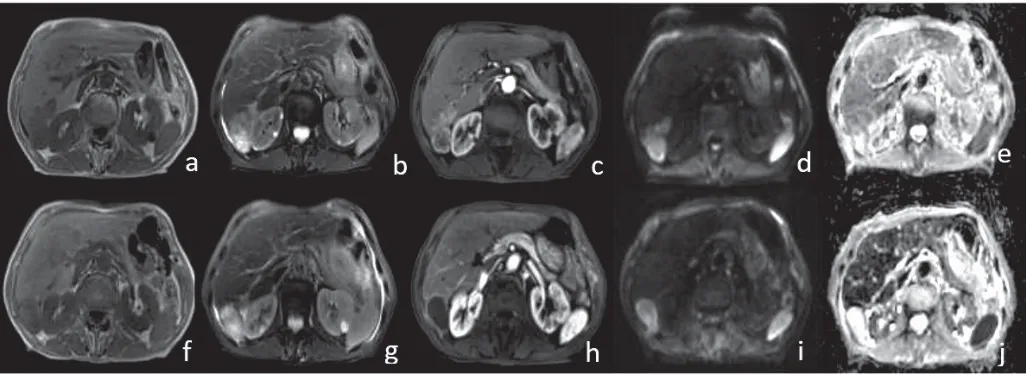
图1 病例影像图
3 讨论
肝癌的死亡率约占其他肿瘤死亡率的10%,及早地诊断和治疗是临床面临的实际问题。肝癌的发病率与乙肝有直接的关系,绝大部分肝癌患者都来自乙肝肝硬化,少数部分来源于布加氏综合征和酒精性肝硬化,还有极少数其他因素,我国是乙肝大国[3],也是肝硬化、肝癌的好发国家,早期肝癌患者通常无症状,发现时基本上已经是中晚期,病变进展快,临床治疗效果差,预后差,常见治疗方式有手术切除、介入治疗以及保守姑息治疗。手术切除通常用于较早期肝癌患者,这类患者预后较好,甚至可以达到临床的治愈;介入治疗通常用于错过了最佳手术的时期,减缓病情进展进行的选择性治疗,预后相对较差些,且部分病人术后容易复发;保守姑息治疗通常用于晚期肝癌患者,以最大限度提高病人生活质量而进行的治疗,预后最差。
肝癌TACE术后的活性评估对指导临床下一步治疗至关重要[4],由于碘油密度大,沉积在肿瘤部位呈高密度影,CT平扫无法明确肿瘤活性,CT增强扫描时高密度影造影剂与碘油共存,对判断TACE术后病灶活性存在很大干扰。常规的T1WI及T2WI也不能区分肿瘤TACE术后的活性区域,动态增强MRI扫描可以明确判断肿瘤术后的坏死区域,该区域边缘部分,由于早期炎性肉芽肿反应或晚期纤维成分,增强呈均匀线环样强化,可以与正常肝实质动脉期一过性灌注异常鉴别。本研究中有1例动态增强,动脉期病灶未见强化,术后活性部分未明确诊断,门脉及延迟期扫描呈持续结节状强化,考虑介入栓塞术后动脉被栓塞,门脉供血所致,本病例中DWI序列呈高信号,ADC图呈低信号,DWI序列有效弥补了动态增强扫描的不足。
不同的b值会产生不同的ADC值,理论上b值越大,ADC值越准确,但是随着b值的增大,图像的信噪比越差,成像质量越差,本研究根据实际应用的需要,b值采用800 s/mm2。理论上良性病变如肝囊肿、血管瘤等,自由水含量高,水分子活动活跃,扩散不受限;恶性病变比如肝癌、胆管细胞癌,自由水含量低,水分子活性受限,扩散也就受限,因此ADC值低于肝内良性病变[5],也可用于评估肝癌的活性区域。
肝脏原发性肿瘤TACE术后,肿瘤部位成分会发生变化,通常会发生碘油沉积、液化性坏死,凝固性坏死,可能还有残留肿瘤组织[6],病灶边缘会形成肉芽组织及水肿区域,碘油沉积通常T1WI,T2WI序列均呈低或稍高信号,DWI呈低信号,增强扫描不强化;液化性坏死通常T1WI呈低信号,T2WI呈高信号,DWI序列呈等或高信号,ADC图由于T2透过效应,呈现高信号,动态增强扫描不强化;凝固坏死通常T1WI呈高信号,T2WI呈等或者稍低信号,DWI呈低信号,内部合并少量水分时DWI可呈现亮信号,ADC图呈低信号,动态增强扫描不强化。TACE术后病灶内部合并出血时,DWI和ADC图可均呈低信号,这可能与暗化效应有关。活性病灶信号同肝癌呈T1WI稍低信号,T2WI稍高信号,DWI呈高信号,ADC图呈低信号,动态增强扫描呈明显的快进快出。介入术后病灶周围会出现水肿及肉芽组织增生,动态增强扫描呈均匀线环状强化,与残留活性病灶呈不均匀厚环状或结节状强化,鉴别较容易,但对于残留活性病灶厚环状或结节状强化不明显的,鉴别较困难,但是短期随访复查,病灶无变化,可明确诊断。本文研究中对肝癌TACE术后残留活性的判断,动态增强序列和单纯DWI序列具有显著差异(P<0.05),也说明依靠单纯的DWI序列对残留活性组织的评估[7],具有一定局限性,也存在一定的假阳性,但结合常规T1WI,T2WI序列可明显提高诊断的正确率。临床工作中,需要结合DWI序列和动态增强扫描序列才能对活性区域准确判断。由于昂贵的检查费用,并不是所有病人均愿意行MRI动态增强扫描,而且部分过敏体质、肝肾功能差、年龄偏大、体质弱小、不能屏气、耐药性差的患者等均不宜行MRI增强扫描,这时DWI序列结合常规T1WI,T2WI序列作为一个重要补充,具有重要意义。
本研究中男性肝癌发病率明显高于女性,据相关文献[8]报到一方面与性激素水平有关;另一方面与生活方式也有很大关系,这与本研究中的病例构成一致。ADC是表观弥散系数,代表水分子扩散情况[9],本研究中术前与术后ADC值差异有统计学意义(P<0.05),肿瘤细胞增殖速率快,单位体积内细胞密度大,水分子扩散明显受限。TACE可以使肿瘤细胞发生蛋白质变性、凝固性坏死、液化性坏死,局部水分子含量改变[10],从而使ADC值发生变化。
本研究中25例(62.5%)动脉期病灶边缘均匀线环状明显强化,DWI序列呈高信号,ADC图高于邻近正常肝组织,这可能与病灶周围炎性水肿,肉芽组织及新鲜血管增生有关,也可能与T2WI序列透过效应有一定的相关性,该征象通常早期出现,且持续时间较短。本研究中32例(80.0%)术后出现复发,复发率较高,这一方面可能与该组病例的病理分期较晚,存在周围微血管侵犯[11]有关,另一方面可能与发病部位特殊,TACE治疗存在一定局限性[12]有关。
对TACE术后活性的判断主要依靠影像学及实验室检查,对活性区域的判断,最佳的检查方式是动态MRI增强、DWI序列扫描及ADC值,但是对不能行MRI增强扫描的患者,单纯DWI和ADC值的测量,作为功能性MRI成像的补充,尤其是对ADC值的测量结合常规T1WI,T2WI序列,可以作为评估TACE术后活性组织的一种方法,对预后进行评估。

