糯米酒的液态发酵工艺优化
闫晓雪,伍时华,吴 军,龙秀锋,牛福星,易 弋
(1.广西科技大学 生物与化学工程学院,广西 柳州 545006;2.广西糖资源绿色加工重点实验室,广西 柳州 545006;3.广西科技大学教育评价与教师发展中心,广西 柳州 545006)
糯米酒是一种通过在底料中添加酒曲,利用其中糖化菌及酒化菌的代谢能力,在将糯米中的淀粉转化为单糖并发酵为酒精的同时,将其中的多糖、脂质、蛋白质等物质转化为低聚糖、小分子有机酸、氨基酸及肽类物质等对人体有益物质的一种酒[1-3]。由于其酒精度含量低,口感香甜醇美,营养丰富,具有促消化、提神醒脑、消暑、增进食欲和增进血液循环等功效而深受人们喜爱[4-6]。糯米酒的食用方法除了可以直接饮用之外,还可以作为食品调味品来增加香气、去腥除膻等[7-8],在美食界备受关注。
传统的糯米酒酿造方法是固态或半固态发酵[9-10]。但是该方法在对糯米原料蒸煮的环节中需要消耗大量的能量,导致制备成本过高。不仅如此,由于固态发酵本身的理化性质因素影响,造成糯米发酵过程黏度不断增大,局部温度升高,发酵菌体分布不均匀等。其结果便造成了原料利用率下降,产率低,耗时长等不利于工业化应用等影响。为此,在后续的研究中,利用液态发酵所固有的可调控,耗时短,原料利用率高等优势,进行糯米酒工业生产成为了主要研究方向[11-12]。
糯米酒的产率及酒的品质是工业化生产和应用的基础。糯米酒液态发酵过程中的最重要发酵工艺(包括酒曲接种量、发酵温度以及发酵时间)将一定程度上决定酒的产率,而酒的品质鉴定也多体现在发酵过程中乙醇、乙酸乙酯及乳酸的量。为此,本研究以糯米为原料,通过添加酒曲进行糯米酒的液态发酵。利用单因素及正交试验对糯米酒的液态发酵工艺进行优化,在此优化条件下进行5 L发酵罐的放大实验,对该糯米酒的质量指标及挥发性风味物质进行分析,为糯米酒的进一步产业化生产提供科学依据。
1 材料与方法
1.1 材料与试剂
糯米:市售;安琪多粮酒曲:市售;乙酸乙酯、乙醇(均为色谱纯):上海凛恩科技发展有限公司;L-乳酸(分析纯):上海麦克林试剂科技有限公司;α-淀粉酶(酶活1.8×105U/mL):沧州夏盛酶生物技术有限公司。
1.2 仪器与设备
LDZH-100KBS立式压力灭菌器:上海申安医疗器械厂;456GC气相色谱(gas chromatography,GC)仪:荷兰Scion Instruments公司;HITACHI高效液相色谱(high performance liquidchromatography,HPLC)仪:日本株式会社日立制作所;BIOSTATB25L发酵罐:德国Sartorius公司;ZXSD-R1430生化培养箱、ZWYR-C2402C恒温培养振荡器、ZHJH-C1112C超净工作台:上海智城分析仪器制造有限公司H2100R医用离心机:湖南湘仪实验室仪器开发有限公司;Therom TRACE1300 ISQQD气质联用(gas chromatography-mass spectrometry,GC-MS)仪:美国赛默飞世尔科技有限公司。
1.3 方法
1.3.1 糯米酒加工工艺流程及其操作要点
糯米打粉→加水调浆→加酶液化→灭菌→冷却→加酒曲→液态发酵→离心→糯米酒成品
操作要点:
糯米打粉:挑选颗粒饱满、无霉无蛀、淀粉含量高的糯米,机打成糯米粉,防潮保存备用。
加水调浆:糯米粉与水按照质量比1∶3搅拌均匀。
加酶液化:以10 U/g糯米粉添加α-淀粉酶,在95 ℃水浴中液化100 min,与碘液反应不呈现蓝色,结束液化。
灭菌:121 ℃高压蒸汽灭菌20 min。
添加酒曲:待温度冷却到室温,将酒曲加入冷却到室温的发酵培养基中,晃动瓶身,使其均匀。
液态发酵:发酵瓶采取透气膜加牛皮纸的方式进行封口包扎,放置摇床中,30 ℃、150 r/min条件下进行液态发酵,发酵结束经离心后得上清液,即为糯米酒成品。
1.3.2 糯米酒感官评价
参考相关糯米酒评定方法及感官评分标准[13-16],随机组合10人作为感官评价小组,通过多糯米酒产品的色泽、口感、气味和组织状态分别进行评测,统计结果取平均值。具体评分标准见表1。

表1 糯米酒感官评分标准Table 1 Sensory scoring standards of glutinous rice wine

续表
1.3.3 糯米酒液态发酵工艺优化
(1)单因素试验
分别对糯米酒液态发酵中的酒曲接种量(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)及发酵时间(4 d、5 d、6 d、7 d、8 d、9 d)3个因素进行单因素试验,重复3次,以发酵液中的乙醇、乙酸乙酯、乳酸及残总糖为评价指标,考察各因素对糯米酒液态发酵的品质影响。
(2)正交试验
在单因素试验基础上,选取显著影响试验结果的酒曲接种量(A)、发酵温度(B)、发酵时间(C)3个影响因素,进行3因素3水平L9(34)正交试验,对发酵液进行乙醇、乙酸乙酯、乳酸的积累量的测定,重复3次,参考文献中权重赋予方法[17-18],按照这些物质对米酒发酵的重要性,依次赋予权重0.8、0.1、0.1,根据公式(1-1)计算综合得分,对糯米酒液态发酵工艺进行进一步优化。正交试验因素与水平见表2。

表2 发酵工艺优化正交试验因素与水平Table 2 Factors and levels of orthogonal tests for fermentation process optimization
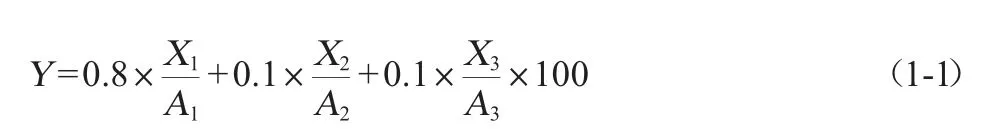
式中:Y为综合得分,分;X1为当前因素下乙醇积累量,g/L;A1为所有因素中最大乙醇积累量因素的乙醇积累量,g/L;X2为当前因素乙酸乙酯积累,mg/L;A2为所有因素中最大乙酸乙酯积累量因素的乙酸乙酯积累量,mg/L;X3为当前因素乳酸积累量,g/L;A3为所有因素中最大乳酸积累量因素的乳酸积累量,g/L。
1.3.4 糯米酒5 L罐液态发酵放大试验
根据正交优化结果进行糯米酒5 L罐液态发酵试验,发酵主要参数设置酒曲接种量2%、发酵温度30 ℃,发酵时间8 d,转速200 r/min,通气量80 mL/min。
1.3.5 分析检测
乙醇含量测定采用气相色谱法检测,其色谱条件:起始温度50 ℃,5 ℃/min升至80 ℃,保持5 min,再以20 ℃/min升至180 ℃。进样口温度180 ℃,检测器温度210 ℃,进样量0.5 μL,分流比20∶1[19]。
乙酸乙酯含量测定采用气相色谱法检测,其色谱条件如下:初始温度40 ℃,3 ℃/min升温至70 ℃,保持3 min,再以10 ℃/min升至180 ℃,保持2 min,进样口温度200 ℃,检测器温度230 ℃,进样量0.5 μL,分流比20∶1[20]。
残总糖、总酸、氨基酸态氮含量:按照国标GB/T13662—2018《黄酒》进行检测[21]。
乳酸含量测定采用高效液相色谱法检测,其色谱条件:磷酸二氢钠∶乙腈=99∶1(V/V)的混合溶液过滤后方可作为流动相使用,日立C18色谱柱(5 μm×250 mm×4.6 mm),柱温30 ℃,流速1 mL/min,进样量20 μL,二极管阵列检测器(diode-array detector,DAD),波长范围200~400 nm,监测波长210 nm,采集时间10 min。
挥发性风味化合物检测采用GC-MS法。样品前处理:取发酵结束的发酵液在12 000 r/min、4 ℃的条件下离心15 min,取上清液和二氯甲烷各30 mL置于摇床(100 r/min)萃取60 min,取下层溶液,再分别用20 mL、10 mL的二氯甲烷萃取2次后,合并有机相,收集下层溶液并减压浓缩至5 mL,4 ℃冷藏备用。气相色谱条件:程序升温:40 ℃保持5 min,以5 ℃/min升至180 ℃保持5 min,再以5 ℃/min升至240 ℃;进样口温度280 ℃;氦气(He)流速1 mL/min;进样量1 μL。质谱条件:离子源温度300 ℃;传输通道温度280 ℃;电离方式为电子电离(electronic ionization,EI)源,电子能量70 eV;质谱扫描范围40~600 amu[22]。
定性定量分析:采用将检测到化合物的质谱与美国国家标准技术研究所(national institute of standards and technology,NIST)14标准谱库比对进行定性,采用面积归一化法计算糯米酒中各挥发性成分的相对含量。
1.3.6 数据处理
采用Origin 9.0、SPSS19.0对试验数据进行绘图和统计分析。
2 结果与分析
2.1 发酵工艺优化单因素试验结果
2.1.1 酒曲接种量对糯米酒发酵的影响
酒曲接种量的不同可能造成发酵液中菌种达到稳定期的时间不同,造成菌种对底物的利用率、乙醇产率以及形成风味物质的含量不同,影响糯米酒品质。控制发酵温度30 ℃,转速为150 r/min,发酵时间为7 d,酒曲接种量分别为0.5%、1.0%、1.5%、2.0%、2.5%、3.0%的发酵条件下,进行乙醇、乙酸乙酯、乳酸和残总糖的测定,考察酒曲接种量对糯米酒液态发酵的影响,结果见图1。

图1 酒曲接种量对糯米酒液态发酵产物积累量和残总糖的影响Fig.1 Effect of Jiuqu inoculum on liquid fermentation products accumulation and total residual sugar of glutinous rice wine
由图1可知,随酒曲接种量在0.5%~3.0%范围内的增大,乙醇和乙酸乙酯的积累量均呈现先增加再降低趋势,乳酸的积累量呈现上升趋势,残总糖呈现下降趋势。在酒曲接种量为2.0%时,乙醇、乙酸乙酯积累量达到最大,分别为86.88 g/L、126.09 g/L,乳酸积累量为6.8 g/L,残总糖含量为5.25 g/L。乙酸乙酯是由乙醇和乙酸的相互作用下酯化反应生成[23]。这是因为接种量低时,菌种代谢繁殖速率降低,原料利用率较低,部分糖没有被消耗完全,间接导致乙醇积累量较低,残总糖含量较高;当接种量大时,微生物数量过多,相互之间形成竞争关系。微生物生长对葡萄糖消耗量增大,导致转化为乙醇的葡萄糖减少,间接导致乙醇积累量低,乙酸乙酯积累量较低。综和比较分析,确定最佳酒曲接种量为2.0%。
2.1.2 发酵温度对糯米酒发酵的影响
发酵温度的不同可能造成发酵液中菌种生长情况和发酵产物不同,影响菌种酶活和细胞结构,从而造成底物的利用率,乙醇产率及风味物质的含量不同,影响糯米酒风味。控制酒曲接种量2.0%,转速为150 r/min,发酵时间为7 d,发酵温度分别为26 ℃、28 ℃、30 ℃、32 ℃、34 ℃的发酵条件下,进行乙醇、乙酸乙酯、乳酸和残总糖的测定,考察发酵温度对糯米酒液态发酵的影响,结果见图2。
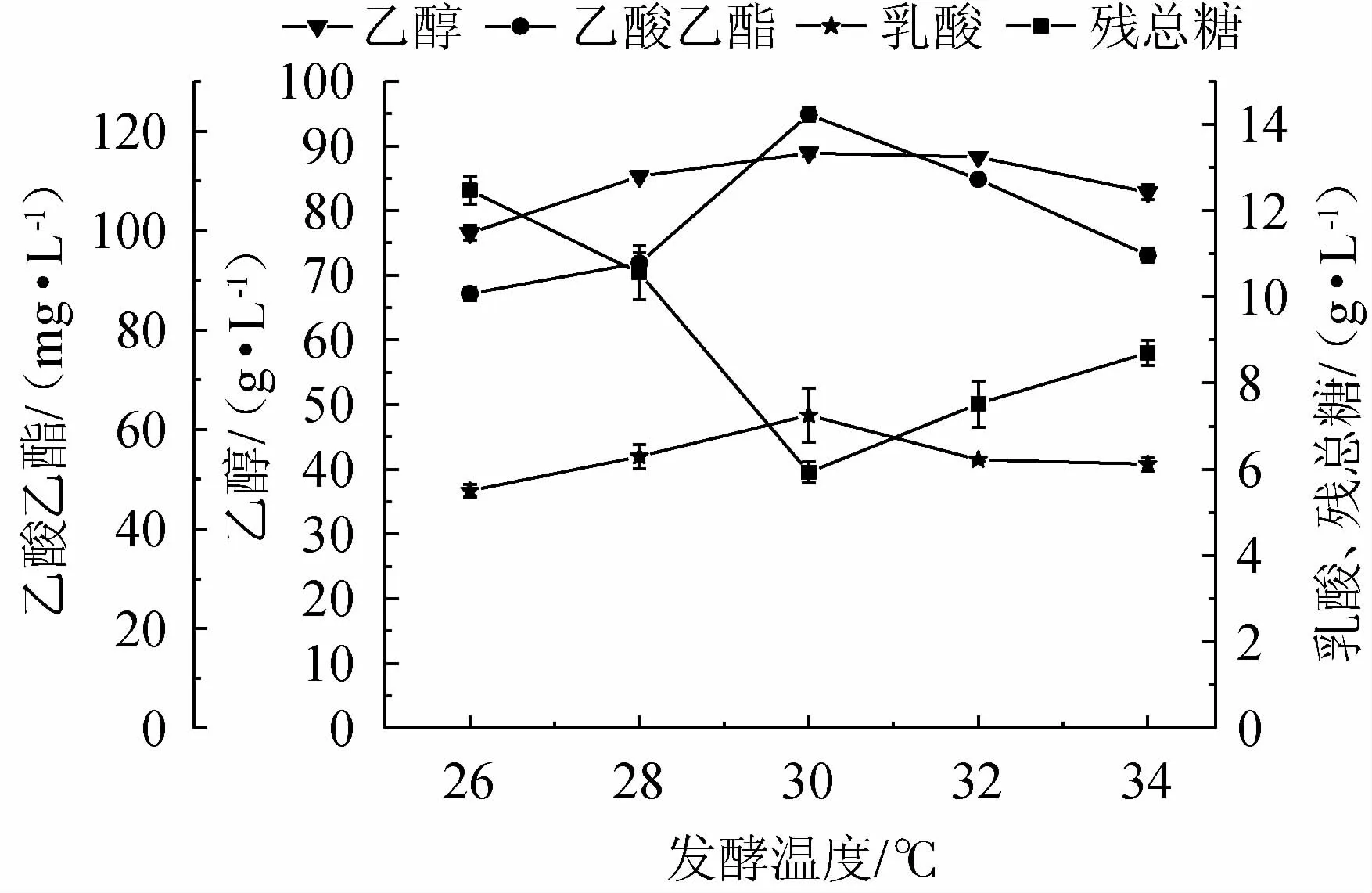
图2 发酵温度对糯米酒液态发酵产物积累量和残总糖的影响Fig.2 Effect of fermentation temperature on liquid fermentation products accumulation and total residual sugar of glutinous rice wine
由图2可知,随发酵温度在26~34 ℃内的升高,乙醇、乙酸乙酯、乳酸的积累量均呈现先增加后降低的趋势,残总糖的变化呈现先降低后增加的趋势。这是因为温度过低有可能会抑制酒曲中微生物的酶活,影响其生长导致发酵不完全,从而影响部分糖转化为乙醇,进而影响乙酸乙酯和乳酸的含量较低。当温度达到30 ℃时,乙醇、乙酸乙酯积累量达到最大,分别为88.53 g/L、123.36 g/L,乳酸积累量达到最大7.71 g/L,残总糖含量为6 g/L。但是当温度过高会使乙醇和乙酸乙酯挥发,并且会影响生物体内的蛋白质、脱氧核糖苷酸、核糖核酸及细胞膜结构,这些同样会抑制微生物的生长,导致乙醇,乙酸乙酯、乳酸含量的降低[24-25]。综合比较分析后,确定最佳发酵温度为30 ℃。
2.1.3 发酵时间对糯米酒主要成分积累量的影响
发酵时间的不同可能造成发酵液中菌体代谢产物的不同,从而造成底物的利用率,乙醇产率及风味物质的含量不同,影响糯米酒风味。控制发酵温度为30 ℃,接种量为2%,转速为150 r/min,发酵时间分别为4 d、5 d、6 d、7 d、8 d、9 d的发酵条件下,进行乙醇、乙酸乙酯、乳酸和残总糖的测定,考察发酵时间对糯米酒液态发酵的影响,结果见图3。
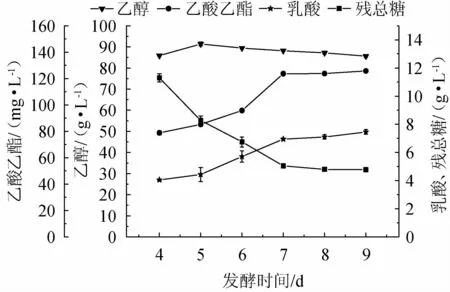
图3 发酵时间对糯米酒液态发酵产物积累量和残总糖的影响Fig.3 Effect of fermentation time on liquid fermentation products accumulation and total residual sugar of glutinous rice wine
由图3可知,随发酵时间在4~9 d内的增加,乙醇积累量呈现先增加后下降趋势,当发酵时间为5 d的乙醇积累量达到最大91 g/L;当发酵时间为7 d时,此时乙醇积累量88.37 g/L,乙酸乙酯积累量124.37 g/L,乳酸积累量6.89 g/L,残总糖含量为5 g/L。其原因可能是,当乙醇发酵完成时,随着发酵时间的延长,乙醇会挥发或转化为其他物质,如与酸类结合生成酯类物质,导致积累量下降[26],残总糖呈现下降趋势;乳酸积累量一直呈现上升趋势;乙酸乙酯的积累量呈现先上升后下降的趋势,但下降趋势不明显。综合比较分析后,确定最佳发酵时间为7 d。
2.2 发酵工艺优化正交试验
在单因素试验的基础上,以酒曲接种量(A)、发酵温度(B)、发酵时间(C)为影响因素,以综合评分为评价指标,进行L9(34)正交试验,试验设计与结果见表3,方差分析见表4。
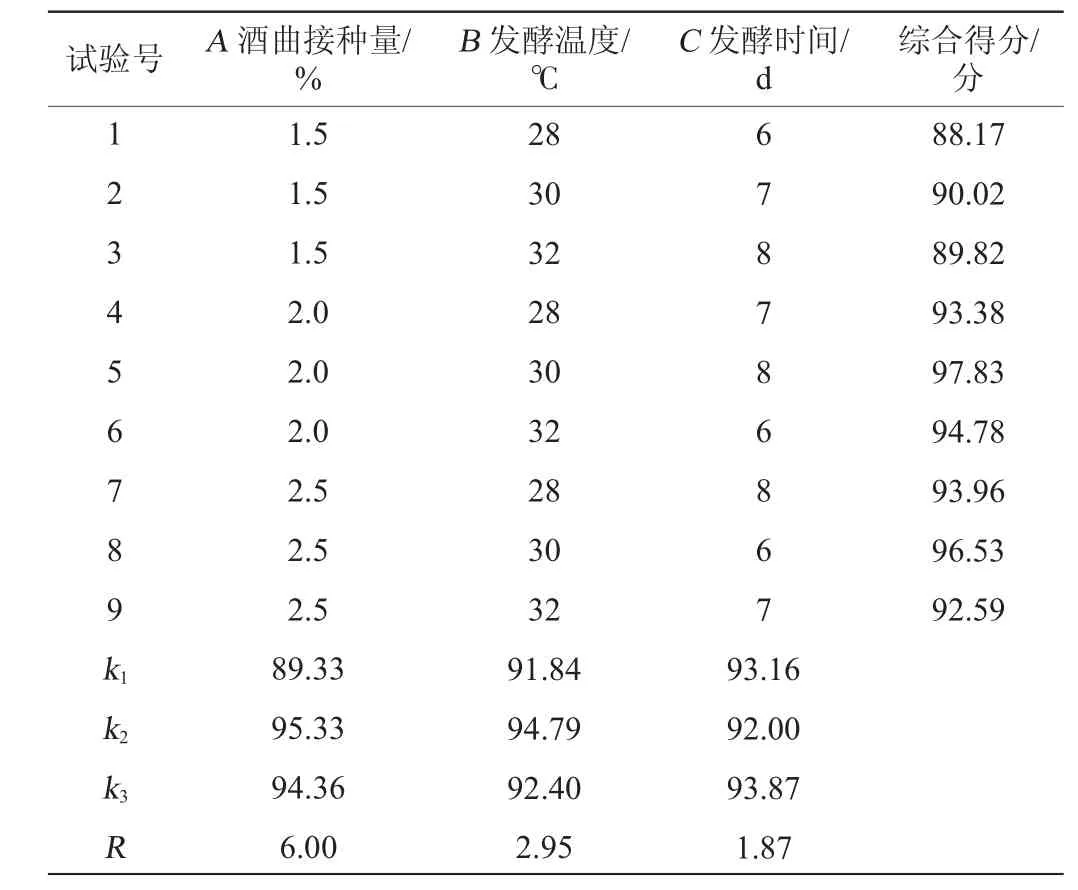
表3 发酵工艺优化正交试验结果与分析Table 3 Results and analysis of orthogonal tests for fermentation process optimization
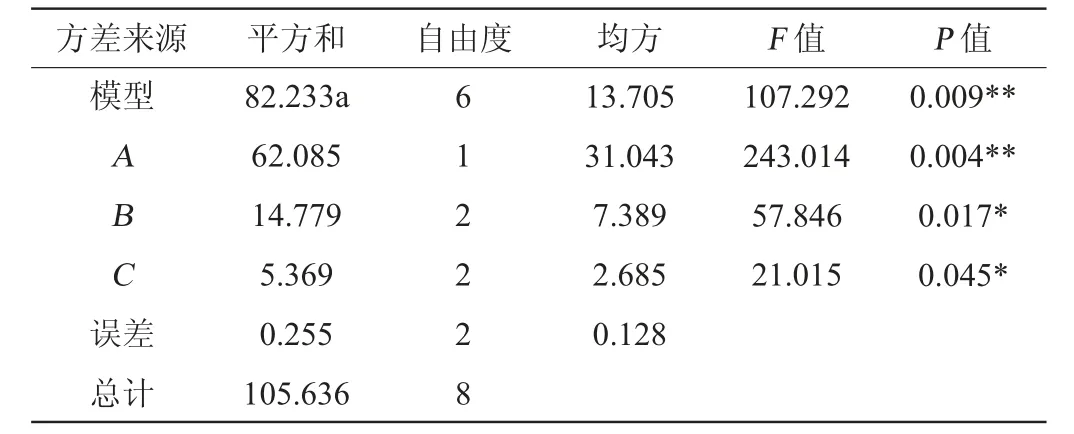
表4 正交试验结果方差分析Table 4 Variance analysis of orthogonal tests results
由表3可知,发酵工艺条件的主次顺序为酒曲接种量>发酵温度>发酵时间;得到最佳发酵工艺条件组合为A2B2C3,即酒曲接种量2%,发酵温度30 ℃,发酵时间8 d。在此优化工艺条件下,进行3次平行验证试验,得到糯米酒乙醇含量91.04 g/L,乙酸乙酯含量127.94 mg/L,乳酸含量7.4 g/L,综合得分为97.83分。
由表4可知,发酵温度和发酵时间对结果均有显著的影响(P<0.05),酒曲接种量对结果有极显著的影响(P<0.01)。因此,在糯米酒的液态发酵工艺中,酒曲接种量、发酵温度和发酵时间这三个因素都要考虑。
2.3 糯米酒5 L罐液态发酵试验结果
在前期针对三角瓶的发酵实验中,糯米酒形成过程中酒曲接种量、发酵温度及发酵时间已经得到了优化。在得出最佳条件后,对该条件进行5 L发酵罐实验,同时对糯米酒样品进行了酒精度、总糖、pH值、总酸、氨基酸态氮和乙酸乙酯的测定,结果见表5。
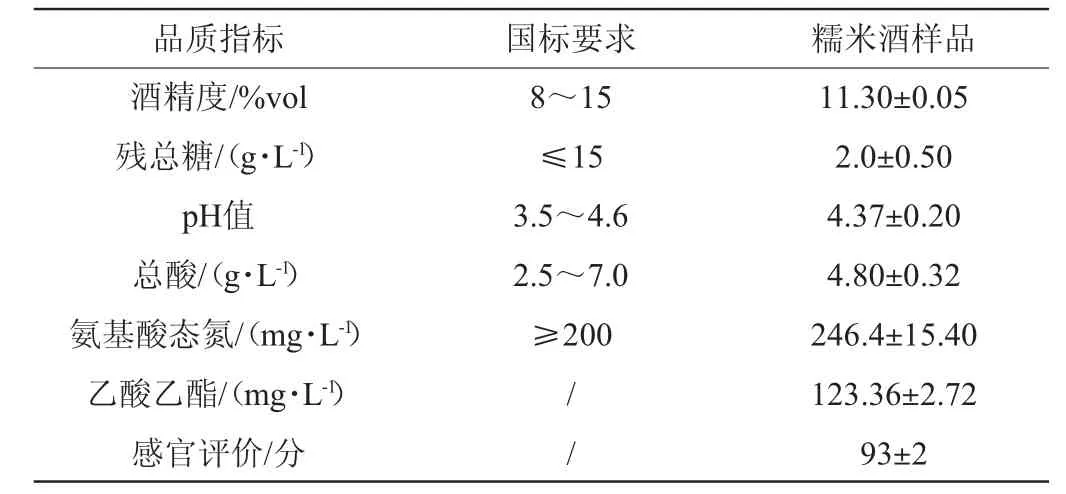
表5 液态发酵糯米酒质量指标测定结果Table 5 Determination results of quality indexes of glutinous rice wine by liquid fermentation
由表5可知,糯米酒样品的酒精度达到11.3%vol,总酸为4.80 g/L,pH值为4.37,残总糖为2 g/L,氨基酸态氮为246.4 mg/L,乙酸乙酯为123.36 mg/L,均符合国标GBT13662—2018《黄酒》中的标准。
2.4 糯米酒液态发酵风味物质分析
利用GC-MS对糯米酒的挥发性风味物质进行测定,其总离子流色谱图见图4,各挥发性风味物质测定结果见表6。

图4 糯米酒液态发酵风味物质GC-MS分析总离子流色谱图Fig.4 Total ion chromatogram of flavor compounds in liquid fermentation of glutinous rice wine analysis by GC-MS
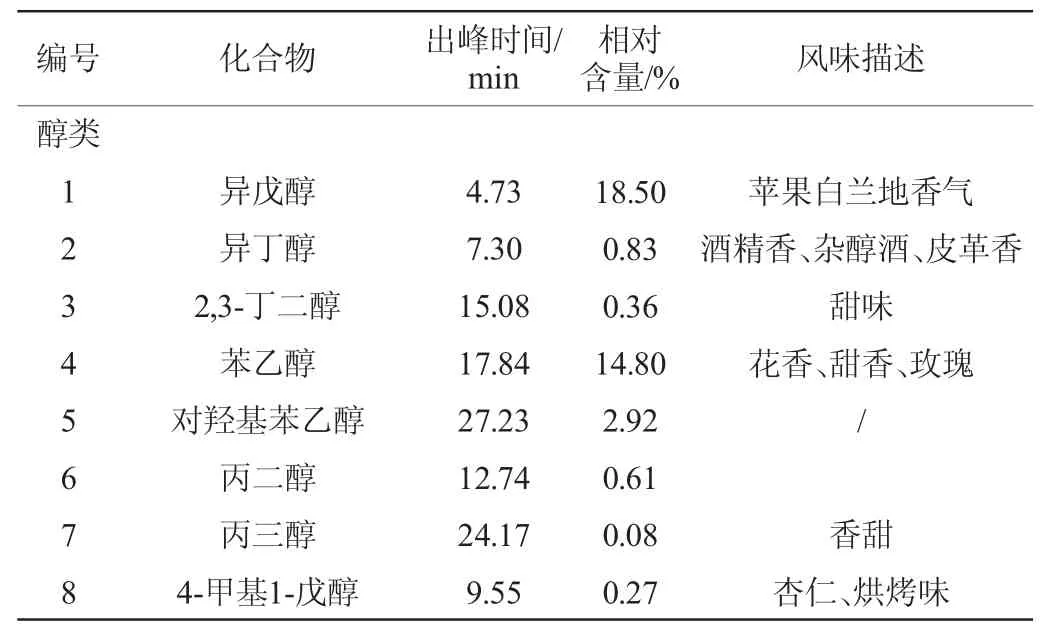
表6 糯米酒液态发酵挥发性风味物质GC-MS分析结果Table 6 Analysis results of volatile flavor compounds in liquid fermentation of glutinous wine analysis by GC-MS

续表
由图4及表6可知,糯米酒中共检测出挥发性风味化合物36种,其中醇类8种,酯类11种,酸类7种,酮类3种,其他类7种。醇类如异丁醇具有酒精香、杂醇酒、皮革香,2,3-丁二醇具有甜味,除此之外β-苯乙醇具有玫瑰、花香;4-甲基-1-戊醇具有杏仁、烘烤香等。酯类化合物一般都具有果香,如乙酸乙酯具有果香、葡萄、樱桃香;乙酸异戊酯具有香蕉香。挥发性酸类化合物主要为乙酸,与积累量最多的非挥发性的乳酸共同在酒体酸的滋味方面发挥着主要作用,同时还是乙酸酯类化合物的前体物。酮类化合物如2,3-丁二酮具有独特的黄油、甜奶油、焦糖香气;呋喃酮具有果香、焦香[27-30]。各种挥发性风味化合物之间相互作用,使酒香气趋于融合、协调,使糯米酒独具风格。
3 结论
糯米酒的发酵品质由发酵工艺所决定。本研究通过单因素试验以及正交试验分析,确定了糯米酒液态发酵的最佳工艺条件为酒曲接种量2.0%、发酵温度30 ℃,发酵时间8 d。在此最佳发酵工艺条件下,进行微通氧5 L罐液态发酵试验,酒精度、总酸、氨基酸态氮、乙酸乙酯的积累量分别为11.3%vol、4.8 g/L、246.4 mg/L、123.36 mg/L,残总糖为2 g/L,挥发性风味物质共检测出35种。综合所得结果分析,糯米酒液态发酵具有可行性,且操作简便,便于生产,为糯米酒液态发酵工业化生产提供理论研究依据。

