高效阴离子交换色谱法测定婴幼儿配方奶粉中酵母β-葡聚糖
罗 浩,吴俊发,吴芷欣,霍玟希,黄伟乾*,黄荣荣,何敏恒,
(1.广州检验检测认证集团有限公司,广东 广州 511400;2.国家加工食品质量检验中心(广东),广东 广州 511400)
酵母β-葡聚糖主要以β-(1,3)-糖苷键、β-(1,6)-糖苷键结合,是具有增强免疫活性、改善血脂、抗辐射、改善肠道功能等作用的活性多糖[1-3]。目前已作为新型食品配料用于婴儿配方食品、婴幼儿辅助食品及特殊医学用途配方食品中,使用量为0.21~0.67 g/kg;香菇、小麦和燕麦等食品中的β-葡聚糖也常作为保健品的主要功效成份,酵母β-葡聚糖应用广泛[4-8,10],研究婴幼儿配方食品中酵母β-葡聚糖定量分析方法非常重要。
目前报道的酵母β-葡聚糖前处理[11]方式主要有多步酶-碱法、酸水解法、酶解法、硫酸沉淀法等,而检测方法主要有分光光度法[12,13-14]、气相色谱法[15]、液相色谱法[16-19]、离子色谱法等。婴儿配方奶粉中的酵母β-葡聚糖,由于其水溶性差、添加量低,存在难定量的问题。离子色谱法[20-21]对功能性糖检测较有优势,检测限低,且离子色谱法检测酵母β-葡聚糖的报导较少。本研究采用离子交换色谱法,针对酵母β-葡聚糖的结构特点采用酶水解法,通过优化提取条件、色谱分离条件等,分离并酶解提取物,从而建立高效阴离子交换色谱-脉冲安培检测法[21-25]测定酵母β-葡聚糖含量的检测方法,以期为婴幼儿配方乳粉的安全保障提供技术支持。
1 材料与方法
1.1 材料与试剂
婴幼儿奶粉样品:市售;葡萄糖标准品(99.5%):德国Dr公司;冰乙酸、氢氧化钾、氢氧化钠、正磷酸、磷酸氢二钠(均为分析纯):广州化学试剂厂;无水乙酸钠(分析纯)、50%NaOH溶液(色谱纯)、中性蛋白酶(酶活力≥240 000 U/g)、碱性蛋白酶(酶活力≥80 000 U/g)、脂肪酶(酶活力≥50 000 U/g):美国Sigma公司;溶壁酶(酶活力≥10 U/mL)、β-(1,6)-葡聚糖酶(酶活力≥2 U/mg)、β-(1,3)-葡聚糖酶和葡萄糖苷酶混合酶(酶活力分别为≥100 U/mL和20 U/mL):爱尔兰Megazyme公司。
1.2 仪器与设备
ICS-6000离子色谱仪(配脉冲积分安培检测器,配Au电极):美国Thermo公司;Milli-Q去离子水发生器:美国Millipore公司;涡旋振荡器:德国IKA公司;恒温振荡水浴:优莱博公司;台式高速离心机:美国Sigma公司;S-210型pH计、MS204T分析天平:瑞士梅特勒公司。
1.3 方法
1.3.1 方法原理
婴幼儿配方奶粉经热水溶解,先使用混合蛋白酶(等体积比中性蛋白酶和碱性蛋白酶)和脂肪酶将样品中的蛋白质、脂肪酶解,经高速离心,保留沉淀物,沉淀物再经体积分数85%乙醇溶液洗去沉淀物中的单双糖,可得到样品中的酵母β-葡聚糖。酵母β-葡聚糖经葡聚糖酶酶解成葡萄糖,离子色谱检测,经外标法定量,经换算可得到酵母β-葡聚糖含量。
1.3.2 样品处理
(1)β-葡聚糖的提取
称取婴幼儿配方奶粉样品约5g(精确至0.001g)于50 mL离心管中,加入30 mL 70 ℃水充分溶解,加入500 μL碱性蛋白酶和中性蛋白酶混合液,以及500 μL脂肪酶,充分振荡后于约50 ℃水浴中酶解孵育2 h后冷却至室温。静置10 min后,置于10 000 r/min离心5 min,再利用滴管仔细吸除上层脂肪和中间酶解液,保留沉淀物,加入体积分数85%乙醇溶液5 mL,混匀,超声5 min,重复操作3次,可得到提取物。
(2)β-葡聚糖提取物的酶解
加入400 μL 2 mol/L冷的氢氧化钾溶液至提取物中,冰浴旋涡15 min,冰浴期间多次短时间旋涡至全部沉淀分散且无可见结块后,加入乙酸钠缓冲溶液至2 mL,再加入500 μL溶壁酶,将其置于50 ℃水浴锅中,酶解过夜(12 h以上),取出冷却至室温后定容至5 mL,得到酶解液。
移取100μL酶解液至10mL试管中,加入300μLβ-(1,6)-葡聚糖酶溶液,50 ℃酶解[26]60 min后,冷却至室温,再加入300 μL混合酶溶液,40 ℃酶解60 min后,冷却至室温,用纯水定容至5.0 mL,再经0.45 μm水相滤膜过滤测定。以不加试样,其他步骤同样品检测的全过程一致的为空白。
(3)酶解条件优化
分别考察蛋白质酶解温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)、蛋白质酶解时间(0.5 h、1.0 h、2.0 h、3.0 h、4.0 h)、溶壁酶添加量(200 μL、300 μL、400 μL、500 μL、600 μL、700 μL)对酶解率的影响。
1.3.3 酶解率的计算
酶解率是通过原样品中葡聚糖量扣减经酶解后产生葡萄糖折算成的葡聚糖的量与原样中葡聚糖的比值计算得出。酶解率的计算公式如下:
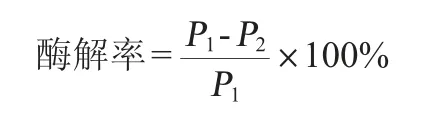
式中:P1为原样品中葡聚糖量,mg/100 g;P2为经酶解后产生葡萄糖折算成的葡聚糖的量,mg/100 g。
1.3.4 仪器条件
色谱柱:Thermo PA10阴离子交换柱(250 mm×4 mm,带预柱);检测器:脉冲积分安培检测器,Au电极;淋洗液:A为0.15 mol/L NaOH溶液,B为0.15 mol/L NaOH+0.5 mol/L乙酸钠混合溶液,C为超纯水;淋洗梯度程序:0~20.0 min 30%A+70%C,20.1~25.0 min 100%B,25.1~35.0 min 30%A+70%C;流速:1.00 mL/min;柱温30 ℃;进样量10 μL。
1.3.5β-葡聚糖含量的测定
将系列葡萄糖标准溶液按上述色谱条件上机测定,记录色谱图峰面积,以峰面积为纵坐标,以系列标准溶液的质量浓度为横坐标,绘制标准工作曲线。将试样溶液注入高效液相色谱仪中,记录峰面积,从标准工作曲线中查得试样溶液中葡萄糖的质量浓度。β-葡聚糖含量的计算公式如下:
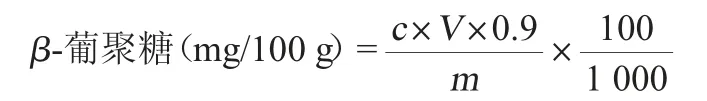
式中:c为待测液的质量浓度,mg/L;V为定容体积,mL;m为称样质量,g;0.9:葡萄糖换算成酵母β-葡聚糖的系数。
1.3.6 数据处理
离子色谱经自动进样分析,使用Thermo自带的仪器控制软件(Chromeleon 7.2)进行数据的采集和标准曲线绘制,外标法定量。
2 结果与分析
2.1 色谱柱的选择
常见的单、双糖pKa在12~14时,属于弱酸,因而在pH 12以上的淋洗液中基本上是以阴离子形式存在。目前常用的糖阴离子交换分离柱类型包括MA和PA两类,其中MA型柱填料为大孔型树脂,具有极高的柱容量,故适用于分析弱保留的糖醇类物质;而PA型无孔型树脂填料色谱柱中CarborPac PA 100和PA200更适合多糖分析,单糖分析效果较差。CarborPac PA 1和PA20分离时存在氧负峰的干扰,因此选择CarborPac PA 10用于本试验。
2.2 淋洗液浓度的选择
确定选用PA10进行目标物的分离,考虑选用适合的淋洗液分析目标物,分离效果较佳,本试验考察了不同淋洗液浓度(30 mmol/L、45 mmol/L、60 mmol/L)对分离效果的影响,结果见图1。由图1可知,三种淋洗液浓度条件下葡萄糖标准品均能很好分离,分别在4.9 min、11.6 min、19.4 min左右出峰,当淋洗液浓度在45 mmol/L时,样品的酶解产物出峰时间较适中且无明显干扰。目标峰出峰后可使用强淋洗液(乙酸钠-氢氧化钠混合溶液)冲洗色谱柱,以排除样品中杂质对下一样品的干扰。所以本实验选择淋洗液浓度为45 mmol/L。
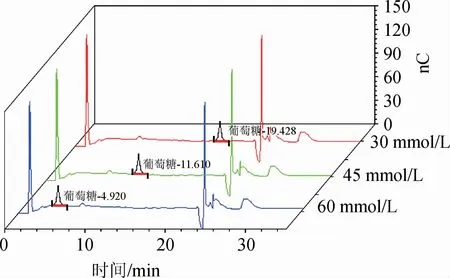
图1 不同淋洗液浓度条件下样品色图谱Fig.1 Chromatogram of samples under different concentration of eluent
2.3 不同酶解条件对酶解率的影响
2.3.1 蛋白质酶解温度对酶解率的影响
通过pH-state法研究蛋白酶在不同温度和时间的酶解度[12]。考察酶解过程中不同温度对样品中蛋白的酶解去除效果,结果见图2。由图2可知,酶解率随着酶解温度的升高呈先上升后下降的趋势,当温度达到50 ℃时,酶解效果最佳,继续升温对比发现,酶解效果反而成下降趋势。因此,选择最适蛋白质酶解温度为50 ℃。

图2 蛋白质酶解温度对酶解率的影响Fig.2 Effect of enzymatic hydrolysis temperature on enzymatic hydrolysis rate
2.3.2 蛋白质酶解时间对酶解率的影响
固定酶解温度为50 ℃,考察不同酶解时间对蛋白质酶解率的影响,结果见图3。
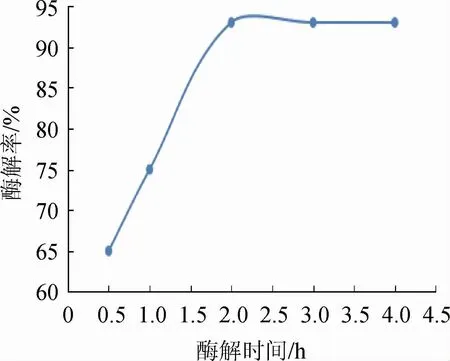
图3 蛋白质酶解时间对酶解率的影响Fig.3 Effect of enzymatic hydrolysis time on enzymatic hydrolysis rate
由图3可知,酶解率随着酶解时间的延长先升高,酶解时间>2.0 h之后,酶解效果基本无变化,故选择酶解时间为2.0 h。
2.3.3 溶壁酶添加量对酶解率的影响
固定酶解温度为50 ℃,酶解时间为2.0 h,考察溶壁酶(10 U/μL)添加量对酵母β-葡聚糖的酶解效果的影响,结果见图4。由图4可知,随着溶壁酶添加量的增加,酶解率逐渐提高;当添加量>500 μL之后,酶解率基本稳定。因此,选择溶壁酶添加量为500 μL。
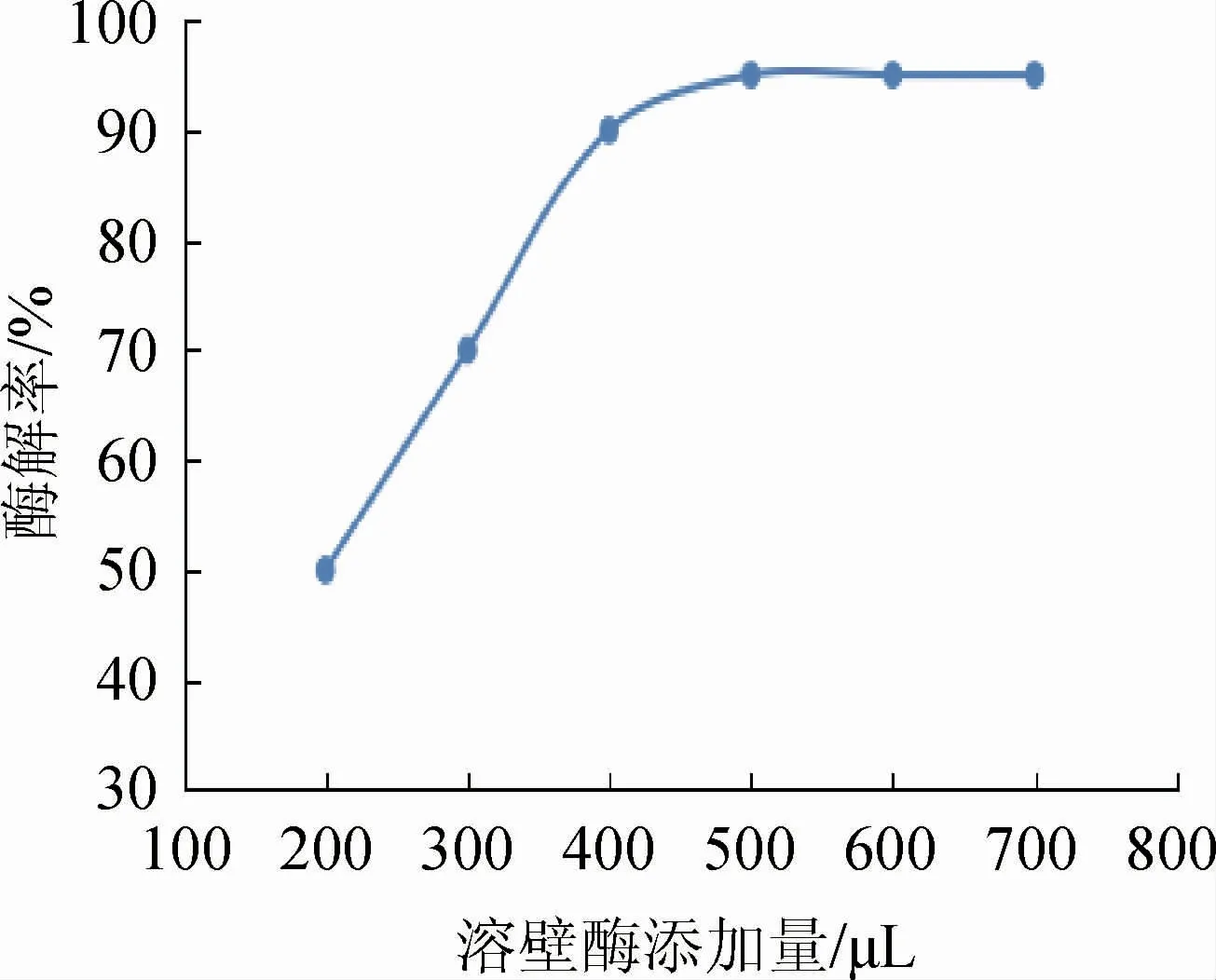
图4 溶壁酶使用量对酶解率的影响Fig.4 Effect of lysozyme addition on enzymatic hydrolysis rate
2.4 方法学验证
2.4.1 线性回归方程及相关系数
分别对系列浓度葡萄糖的标准溶液进行测定,以葡萄糖的色谱峰面积y对其质量浓度x(mg/L)进行线性回归,结果表明,葡萄糖在0.10~50.0 mg/L范围成线性良好(R2=0.999 5),标准曲线线性方程为y=1.088 1x-0.010 74。
2.4.2 方法检出限及定量限
以酶解产物葡萄糖的含量为参考,通过系列的换算,折算成酵母β-葡聚糖的含量。以葡萄糖的信噪比(S/N)3倍、10倍计算仪器检出限和定量限,结合前处理样品酶解过程的稀释倍数(以50倍计)以及葡萄糖换算成酵母β-葡聚糖的系数(以0.9计),可得酵母β-葡聚糖的方法检出限(limit of detection,LOD)和方法定量限(limit of quantitation,LOQ)。经测试,LOD为3.0 mg/100 g,LOQ为10.0 mg/100 g,本方法灵敏,可满足婴幼儿配方奶粉中酵母β-葡聚糖的定量分析要求。
2.4.3 加标回收率试验
选取阴性婴幼儿配方奶粉(本底值为:0 mg/100 g)添加3个浓度水平的酵母β-葡聚糖,按照本方法进行前处理和离子色谱检测,每个添加水平平行测定5次,计算平均回收率和相对标准偏差(relative standard deviation,RSD),测试结果见表1。由表1可知,酵母β-葡聚糖在10.0~50.0 mg/100 g加标水平下,平均回收率在96.9%~102.1%之间,日内相对标准偏差(relative standarddeviation,RSD)为1.04%~1.52%,表明该方法准确度良好,能够满足测定要求。

表1 方法加标回收率试验结果Table 1 Results of standard recovery tests of the method
2.4.4 精密度试验
选取一份加标样品,分别称取5份样品进行处理,测定5个平行样品中的酵母β-葡聚糖,计算相对标准偏差,结果见表2。结果表明,日间精密度试验结果RSD为2.43%(n=5),表明方法具有良好精密度,能满足GB/T 27417—2017《合格评定化学分析方法确认和验证指南》[27]的要求。

表2 方法精密度试验结果(n=5)Table 2 Results of precision tests of the method (n=5)
2.4.5 实际样品检测
应用建立的高效阴离子交换色谱-脉冲安培检测法测定婴幼儿配方奶粉中酵母β-葡聚糖含量,选取3份市售不同品牌婴幼儿配方奶粉样品进行平行测定5次,并与产品标签明示值进行比较,结果见表3。由表3可知,样品平行测定5次结果的相对标准偏差为1.19%~1.60%(n=5),测试结果分别为产品标签明示值的108.6%~112.9%、103.6%~106.8%、104.7%~107.9%,均落在产品标签明示值±15%的范围内,判断为可接受范围。
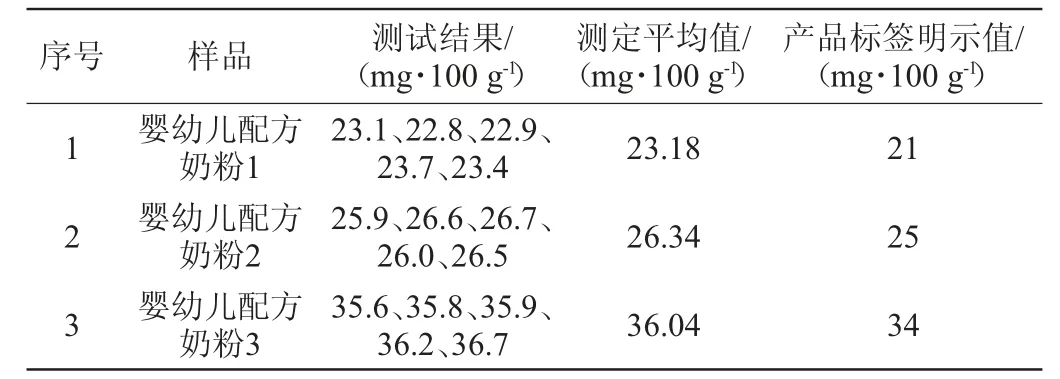
表3 实际样品测定结果Table 3 Determination results of actual samples
3 结论
本研究利用高效阴离子交换色谱-脉冲安培检测法,建立了适用于婴幼儿配方奶粉中添加酵母β-葡聚糖的含量的检测方法。结果表明,最优酶解条件为:酶解温度50 ℃、酶解时间2.0 h、溶壁酶添加量500 μL。在10.0~50.0 mg/100 g加标水平下,平均回收率在96.9%~102.1%之间;精密度试验结果的相对标准偏差为2.43%(n=5),该方法精密度良好,酵母β-葡聚糖的方法检出限为3.0 mg/100 g,定量限为10.0 mg/100 g,可用于婴幼儿配方奶粉中添加的酵母β-葡聚糖检测。

