龙脑樟乙酸乙酯部位的抗炎及抗肿瘤活性研究
曹明原,吴静,顾震,吴磊,彭建军
(1.江西省科学院 应用化学研究所,江西南昌 330096;2.江西农业大学 食品科学与工程学院,江西南昌 330000;3.江西樟乡天然冰片有限责任公司,江西吉安 343000)
龙脑樟(Cinnamomum camphora chvar. Borneol)为樟科(Lauraceae)樟属(Cinnamomum)的一种香樟树,1987年首次发现于江西省吉安市,目前主要在江西、湖南两地有所种植,资源较为稀缺[1-2]。龙脑樟因富含右旋龙脑(天然冰片),在中医典籍中被归于芳香开窍类药材,民间常将其用于醒目通窍、解郁散火、祛风解表、化湿和中[2]。龙脑樟中含有萜类、苯丙素类、挥发油类及黄酮类等化合物,具有抗炎、降血糖、抗菌、杀虫、抗肿瘤及抗氧化等药理活性[3-8]。目前对龙脑樟的研究多数集中在龙脑樟叶的化学成分、挥发油和天然冰片的提取[9-11],对龙脑樟的采后剩余部分(如龙脑樟枝)的研究较少,这不仅对龙脑樟资源造成了浪费,还降低了对龙脑樟资源的综合利用率。因此,本实验通过脂多糖(Lipopolysaccharid,LPS)刺激RAW264.7小鼠巨噬细胞建立体外炎症模型,以炎症介质NO的产生量为指标研究龙脑樟的抗炎活性,并通过MTT法研究龙脑樟对SH-SY5Y神经瘤细胞及HepG2肝癌细胞增殖的抑制作用,以期为进一步开发龙脑樟资源,提高龙脑樟资源的整体利用率提供理论基础及参考。
1 材料与方法
1.1 材料与试剂
DMEM高糖培养基(批号:AE29461773),美国HyClone实验室;NTC胎牛血清(批号:NTC-HK026),阿根廷Natocor工业;青链霉素(批号:G507FA0001)、0.4%台盼蓝染色液(批号:G616FA0001)、噻唑蓝(MTT)(批号:A600799-0005)、胰蛋白酶细胞消化液(批号:H617FA0003)、PBS缓冲液(批号:G429FA0001),上海生工生物工程股份有限公司;亚硝酸钠、盐酸萘乙二胺、磺胺、十二烷基硫酸钠,上海凛恩科技发展有限公司;脂多糖(LPS)、二甲基亚砜(DMSO),北京索莱宝科技有限公司;其余试剂均为分析纯,天津致远化学股份有限公司。
龙脑樟枝,由江西樟乡天然冰片有限责任公司提供,经江西省科学院应用化学研究所李雄辉研究员鉴定为龙脑樟枝,样本编号为PML202102;RAW264.7小鼠巨噬细胞、SH-SY5Y神经瘤细胞及HepG2肝癌细胞,由云南农业大学提供。
1.2 仪器与设备
Esco CellMate二氧化碳培养箱,新加坡Esco科技有限公司;尼康ECLIPSE Ts2倒置显微镜,日本NIKON公司;Tecan INFINITE 200PRO酶标仪,TECAN Austria有限责任公司;TD50002A电子天平,上海衡际科学仪器有限公司;Milli-Q超纯水器,密里博公司;RE52CS-1旋转蒸发器、B-260恒温水浴锅,上海亚荣生化仪器厂;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;DLSB-10L/10低温冷却液循环泵,巩义市予华仪器有限责任公司;KQ-500DB型数控超声波清洗器,昆山市超声仪器有限公司。
1.3 实验方法
1.3.1 样品的提取制备
将龙脑樟枝彻底干燥后粉碎,取粉碎后的龙脑樟枝2.4 kg,按15:1(kg:L)料液比加入80%的乙醇超声(400 W,30 min)重复提取2次,之后进行抽滤,旋转蒸发,减压浓缩后得到龙脑樟枝乙醇粗提物(Crude,242.42 g),将粗提物加入适量水混合后,用乙酸乙酯萃取,之后进行旋转蒸发、减压浓缩得到乙酸乙酯萃取部位浸膏。用活性炭对乙酸乙酯部位浸膏进行脱色处理,之后冷冻干燥,得到纯化后的乙酸乙酯部位样品(11.82 g)。取适量乙酸乙酯部位样品加入DMSO配制成100 mg/mL的母液,放于4 ℃冰箱便于后续实验。
1.3.2 细胞培养
将RAW264.7细胞接种在含有10%胎牛血清、1%青链霉素双抗的DMEM高糖培养基中,于37 ℃、5%CO2条件下培养。细胞生长至80%左右时,进行传代培养。SH-SY5Y细胞及HepG2细胞培养方式同上。
1.3.3 抗炎活性测定
(1)Griess法测定NO的释放量。以NaNO2为标准品,参考BEAK等[12]的方法绘制NO标准曲线。取对数生长期且生长状态良好的RAW264.7细胞,以5×105个/mL的浓度接种于96孔板中,每孔200 μL(四周边缘用等体积的PBS缓冲液填充),于37 ℃、5%CO2培养箱中培养24 h。然后弃去孔内旧培养液,设置空白组(只含培养液而无细胞,用于调零)、对照组、LPS模型组和药物组。空白组及对照组加入200 μL培养液(0.1% DMSO),LPS模型组加入200 μL含LPS培养液(0.1% DMSO),药物组先分别加入含不同浓度龙脑樟枝乙酸乙酯部位的培养液150 μL预处理2 h,再加入50 μL含LPS培养液,每组均设6个复孔,继续在培养箱中孵育24 h。之后每孔取上清液100 μL于96孔板中,加入100 μL配制好的Griess试剂,室温下反应10 min,在酶标仪540 nm处测定吸光值并代入NO标准曲线计算NO浓度。上述条件中所加药物终浓度分别为6.25 μg/mL、12.50 μg/mL、25.00 μg/mL、50.00 μg/mL 及 100.00 μg/mL,LPS终浓度为1 μg/mL。
(2)MTT法测定细胞存活率。参考YANG等[13]测定细胞存活率。接板条件及模型设置同1.3.3(1),加入LPS及药物孵育24 h后,吸出孔内培养液,再加入100 μL 1 mg/mL的MTT培养液培养4 h,最后加入MTT终止液继续培养16~20 h,于570 nm处测定其吸光度并按公式(1)计算存活率。
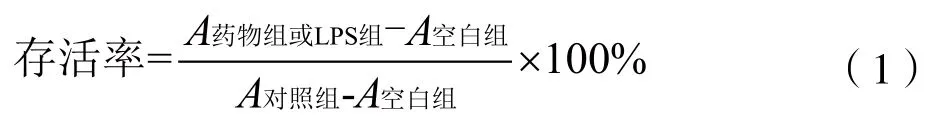
(3)抗肿瘤活性测定。设置空白组、对照组及药物组,药物组加入不同浓度药物孵育48 h后吸出孔内培养液,加入MTT并按1.3.3(2)所示的方法进行测定。
2 结果与分析
2.1 细胞毒性及NO释放量测定
LPS是革兰氏阴性细菌细胞壁的组成成分,可作用于宿主细胞细胞膜表面上的Toll样受体4刺激细胞产生炎症[14]。NO可调节炎症和宿主防御并参与到各种慢性疾病中,是一种重要的炎症介质,NO的释放量也是评价药物抗炎活性的一项重要指标[15]。龙脑樟枝抗炎活性的测定如图1(a)、图1(b)所示。在没有加入LPS时,对照组中的NO含量极低,仅有1.28 μmol/L,属于正常水平。经过1 μg/mL的LPS刺激后,炎症反应启动,NO含量显著升高(LPS组32.08 μmol/L),表明炎症模型构建成功。通过给予细胞不同浓度的药物处理,结果表明,浓度为6.25~100.00 μg/mL范围内的样品均显著降低了NO含量,表明龙脑樟枝乙酸乙酯部位有较好的抗炎活性。然而,细胞毒性实验表明,浓度为12.50~100.00 μg/mL范围内的样品都显著地降低了细胞的存活率,表明其对细胞都有不同程度的毒性作用。只有浓度为6.25 μg/mL时,样品对RAW264.7细胞无明显毒害作用且能够显著降低NO的含量,表明低剂量浓度的龙脑樟枝有较好的NO抑制作用,抗炎活性较强。
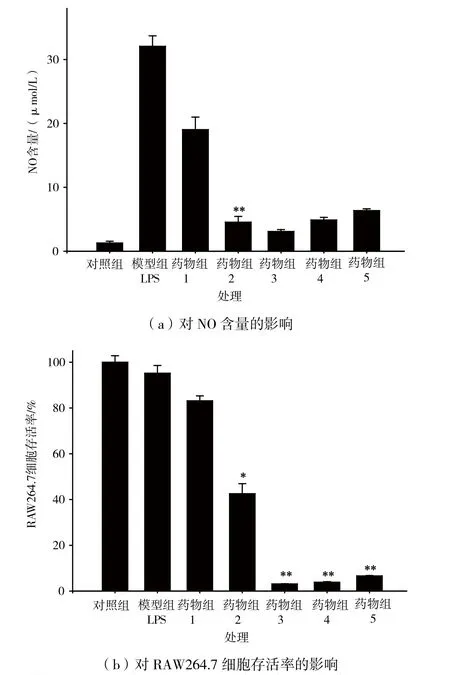
图1 龙脑樟枝乙酸乙酯部位抗炎活性的测定结果(±SD,n=6)
2.2 抗肿瘤活性测定
龙脑樟乙酸乙酯部位对SH-SY5Y神经瘤细胞及HepG2肝癌细胞增殖的抑制作用如图2(a)与图2(b)所示。6.25~25.00 μg/mL的样品对HepG2细胞及SH-SY5Y细胞的存活均无明显抑制作用,随着浓度增大为50.00~100.00 μg/mL时,龙脑樟枝均能极显著抑制HepG2细胞及SH-SY5Y细胞的增殖,表现出一定的剂量效应关系,且抑制率均在75%以上,表明龙脑樟枝对SH-SY5Y及HepG2细胞有潜在的抗肿瘤活性。
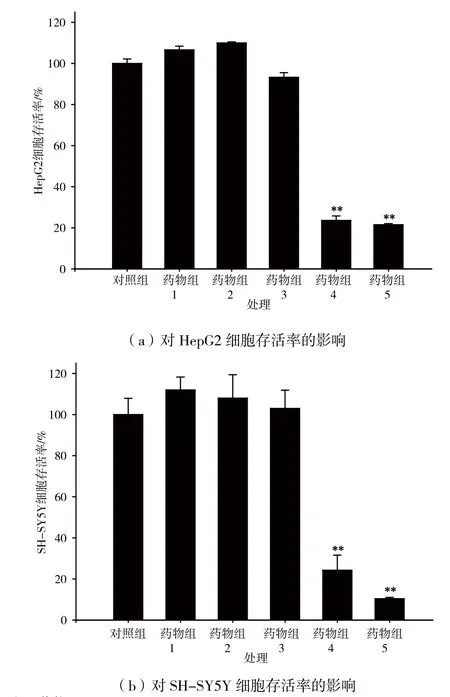
图2 龙脑樟枝乙酸乙酯部位抗肿瘤活性测定结果(±SD,n=6)
3 结论
结果表明,低剂量的龙脑樟枝乙酸乙酯部位可显著抑制炎症介质NO的释放,有一定的抗炎活性;中等剂量的样品对SH-SY5Y神经瘤细胞及HepG2肝癌细胞的增殖有显著的抑制作用,表明了龙脑樟枝的潜在抗肿瘤活性。研究为后续活性导向下的单体化合物分离提供了参考,也为提高龙脑樟资源的综合利用率提供了理论基础。目前关于其具体抗炎机制及抗肿瘤机理尚不清楚,可在后续的实验中深入研究。

