超细水合硅酸镁粉体的制备与表征
冯凌,崔帅
(盘锦职业技术学院,辽宁盘锦 124000)
水合硅酸镁是一种组成不定的具有链层状结构的轻质含水富镁硅酸盐,具有较大的比表面积,与海泡石结构相似。根据BREW和GLASSER的研究,以2∶1的镁硅比将硝酸镁溶液和水玻璃溶液混合制得的水合硅酸镁的结构与天然海泡石结构极为类似,但其实验直接将水合硅酸镁进行焙烧,粒子团聚严重[1]。廖润华等[2]人对天然海泡石进行酸化处理,但是其实验的原料为天然海泡石,细化程度不足致使酸活化时间长、活化效果不良。本文利用水玻璃与硝酸镁直接沉淀制胶后经过低温干燥,在水合硅酸镁粒子粒径很小的凝胶状态下对其直接进行高温酸活化,寻找一条比较温和的酸化条件下合成超细水合硅酸镁粉体的路线。
1 材料与方法
1.1 材料与仪器
DH-204型烘箱,天津中环实验电炉有限公司;SX2-4-10型马弗炉,天津中环实验电炉有限公司;CyberScan510型pH测试仪,EUCTECH;SHB-Ⅲ型循环水式多用真空泵,北京益利精细化学品公司;TDL-5型离心机,上海安亭科学仪器制造公司;SH5型加热磁力搅拌器,北京金北德工贸有限公司;ZRY-2P差热扫描分析仪,上海天平厂; Rigaku/max-2500VB型X射线衍射仪,日本Rigaku公司;S-250MK3-Cambridge扫描电子显微镜,英国剑桥大学仪器公司;ASAP 2020-Micromeritics比表面积及孔隙率分析仪,美国Micromeritics公司。
硅酸钠,化学纯模数为3.1~3.4,北京市精细化学品有限公司;硝酸镁,分析纯,北京市精细化学品有限公司;浓硫酸,分析纯,北京市精细化学品有限公司。
1.2 试验方法
配制一定浓度的Na2O·nSiO2溶液和Mg(NO3)2溶液,按照Si/Mg摩尔比2∶1,将两溶液以一定的滴加顺序混合,滴加速度控制在1.5滴/s左右,被滴液体利用转子搅拌;混合后即产生白色沉淀,将反应体系置于20 ℃空气中静置1 h;将产品以3 000 r/min的转速离心15 min,获得粘胶沉淀;配制质量浓度15%的硫酸溶液;将粘胶态硅酸镁放入已配好的15%的硫酸溶液,100 ℃煮12 h;将酸化处理的沉淀通过离心机离心后用去离子水洗10遍,干燥得酸活化后的水合硅酸镁;将部分样品450 ℃焙烧5 h。为了确定优化实验条件,实验中对是否酸化、是否焙烧、滴加顺序3个条件进行了垂直正交,同时固定原料的浓度和配比、干燥条件、滴加速度和搅拌速度。最后对原料浓度进行了改变,以确定实验中反应物浓度对产品的影响。工艺参数见表1。
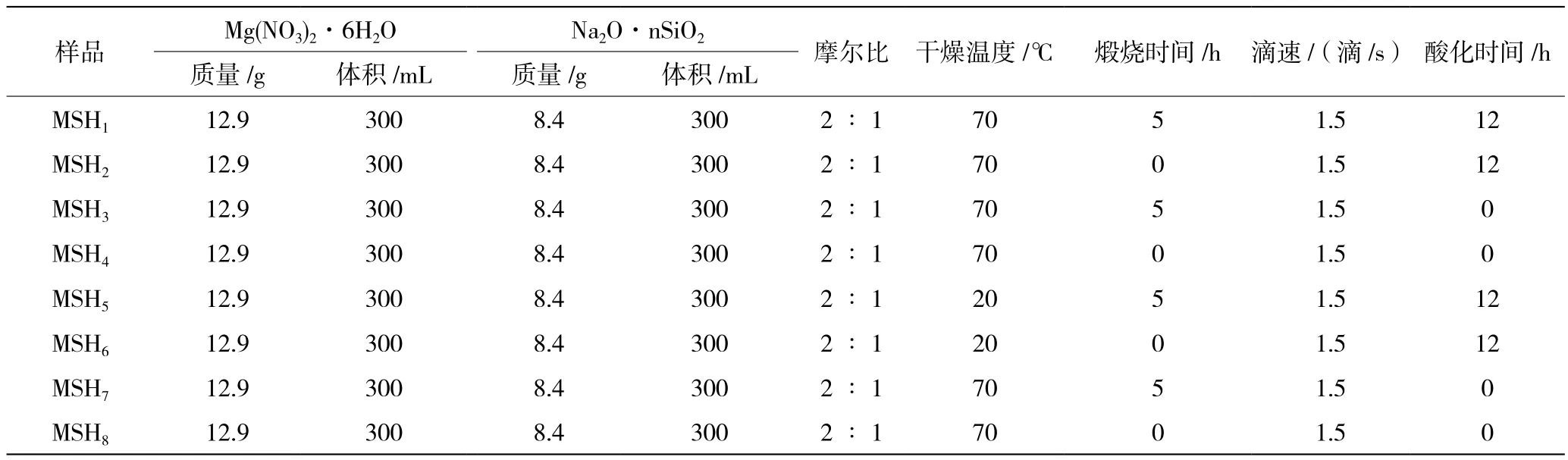
表1 水合硅酸镁的合成及酸化工艺参数
采用差热扫描分析仪进行综合热分析,固定升温速率为10 ℃/min,从室温程序升温到1 300 ℃,记录热重-差热分析(TG-DTA)曲线。采用X射线衍射仪对样品晶型结构进行分析,扫描角度5°~90°,CuKa辐射,管电压40 kV,管电流200 mA,λ=1.54056 Å。采用扫描电子显微镜观察样品的表面形貌,将固体样品粘在样品台上,真空喷金后观察。采用比表面积及孔隙率分析仪分析样品的比表面积及孔结构分布。
2 结果与分析
2.1 XRD表征
2.1.1 晶型分析
由于MSH3、MSH7、MSH8在实验过程中受到影响,并没有得到理想的结果,MSH1、MSH2、MSH4、MSH5和MSH6的XRD图谱如图1所示。由图1可知,5个样品的结晶度都很低,呈现非晶态结构。经硫酸处理样品弥散的衍射峰均出现在22.5°左右;未经硫酸处理的MSH4样品弥散的衍射峰则出现在26.5°左右。由文献报道可知[3],弥散的衍射峰出现在20°~40°为硅酸盐类的特征峰,5个样品的XRD弥散的衍射峰均出现在该范围内,表明各样品均为硅酸盐。

图1 MSH1、MSH2、MSH4、MSH5和MSH6的XRD图谱对比
2.1.2 焙烧对样品的影响
如图2、图3所示,MSH1在22.5°左右的峰更加尖锐,说明其结晶度更高,但是仍然属于非晶态结构;MSH6的结晶度增加很小;焙烧并没有破坏MgOSiO2-H2O体系的非晶结构;经过450 ℃焙烧5 h后两种滴加顺序生成的样品结晶度基本相同。
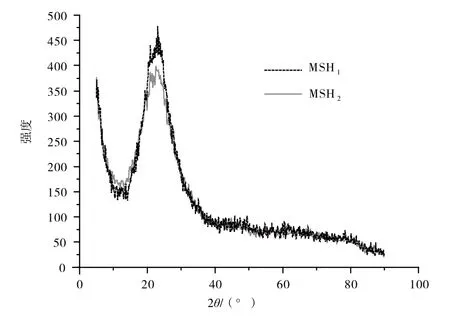
图2 MSH1和MSH2的XRD图谱对比

图3 MSH5和MSH6的XRD图谱对比
2.1.3 酸化对样品的影响
如图4所示,MSH2的结晶度更高。酸浓度越高、时间越长、温度越高,对MgO-SiO2-H2O体系的结构破坏越大。在脱镁率较低时,生成了新的内表面使比表面积增加;脱镁率较高时,严重破坏了海泡石的基本结构,比表面积降低[2]。经酸处理后,样品的孔隙率有所提高,这也就引起经硫酸处理的样品的峰值位置都相对于MSH4减小了4°左右。

图4 MSH2和MSH4的XRD图谱对比
2.2 DTA/TG表征
2.2.1 滴加顺序对样品的影响
由图5和图6可知,MSH8和MSH4在200 ℃之前有一个吸热谷,400 ℃之后到600 ℃左右有一个很宽的吸热谷,在850 ℃出现一个放热峰。而两者的TG曲线都有一个22%左右的失重台阶。推断在200 ℃之前的吸热谷是由于硅酸镁中脱去吸附水产生的,400~600 ℃的吸热是由于MgO-SiO2-H2O体系失去结构水产生的,860 ℃左右的尖头峰是SiO2和MgO结晶转变放热引起的。两样品的放热量明显不同,MSH4中镁的含量明显小于MSH8中镁的含量,由此推断,Na2O·nSiO2滴入Mg(NO3)2制备的产物含镁量较小。
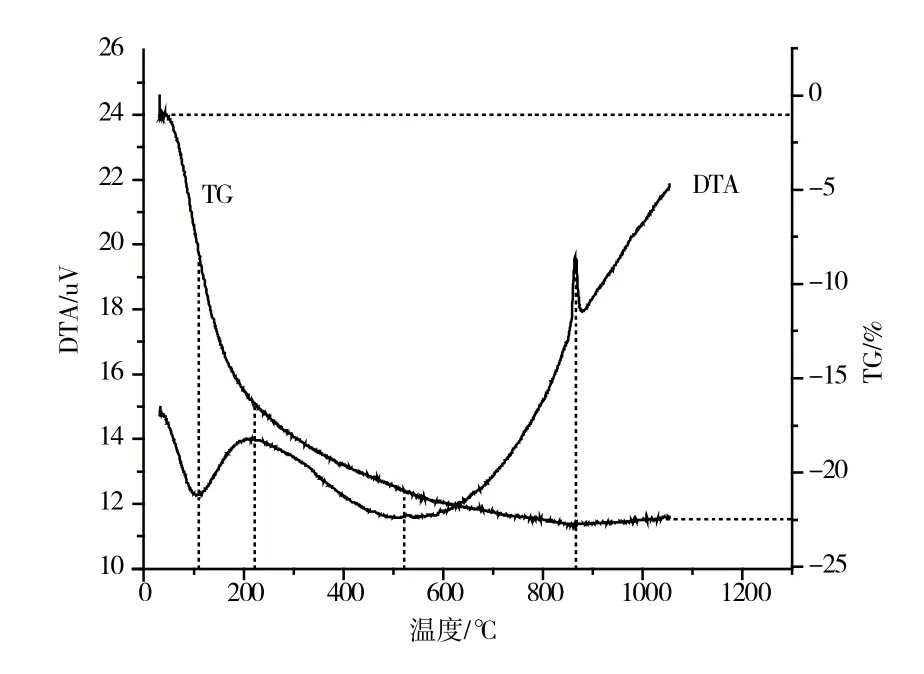
图5 MSH8的TG、DTA曲线

图6 MSH4的TG、DTA曲线
2.2.2 酸化对样品的影响
由图6、图7对比可知,MSH2在850 ℃没有明显的放热峰,且热失重有两个台阶,热失重和差热分析结果表明酸化处理过的样品几乎不含有镁,整体上是水合硅酸的特征曲线。由此可以解释图4中MSH2经过酸化后结晶度有所增加。

图7 MSH2的TG、DTA曲线
2.3 SEM表征
2.3.1 滴加顺序对样品的影响
如图8和图9所示,MSH1颗粒直径50~60 nm,MSH5颗粒直径20~30 nm,两者均呈类球形,粒子分散比较均匀,颗粒略微团聚。两者的制备方法中只有滴加顺序不同,表明要想获得高粒度的产物,滴加顺序优选Mg(NO3)2滴入Na2O·nSiO2。

图8 MSH1的SEM照片

图9 MSH5的SEM照片
2.3.2 焙烧对样品的影响
如图10所示,MSH6颗粒呈类球形,直径10~20 nm,粒子颗粒极其微小,团聚现象较MSH5有所缓解。MSH6和MSH5样品的孔结构都比较发达,孔径达到纳米级别的较多。根据硅酸镁的酸活化机理可知,酸活化是通过将Mg用氢替换下来而使其内部空间结构更加复杂[4],以至于造粒更加细,但是由于Na2O·nSiO2滴入Mg(NO3)2的产物的镁含量较低,因此酸化后得到的粒子相对比较大,可以解释SEM展现的MSH5的粒径小于MSH1的粒径。

图10 MSH6的SEM照片
2.4 BET表征
2.4.1 比表面积
MSH5、MSH6的BET比表面积分别为344.2510 m2/g和454.2572 m2/g。对应SEM表征可知,MSH5的粒子团聚现象较MSH6严重,致使MSH5的比表面积小于MSH6的比表面积。
2.4.2 孔结构分析
(1)从图11~图14可以看出,两样品在相对压力P/P0=0.1~0.3时吸附N2的体积有明显的增加,在P/P0=0.5~1.0时有一个同滞环,依据IUPAC规定这类等温线为典型的IV类介孔结构材料的气体吸附/脱附等温线[5]。脱附分支在相对分压为0.40~0.45发生突跃,说明其孔结构均是规则的三维孔结构。

图11 MSH5的吸附等温线

图12 MSH5的孔径与孔容关系

图13 MSH6的吸附等温线

图14 MSH6的孔径与孔容关系
3 结论
Na2O·nSiO2滴入Mg(NO3)2的产物镁含量比Mg(NO3)2滴入Na2O·nSiO2的产物镁含量低。随着酸活化处理的进行,硅酸镁粉体的镁含量不断下降,同时粒径也在下降,可以达到十几纳米,孔隙率不断提高,形成介孔材料。按照镁硅配比1∶2制备的硅酸镁初始镁含量越高的硅酸镁粉体经过酸化后所得的粉体粒径越小。酸活化会使硅酸镁粉体中的镁含量减小,酸浓度的增加或者酸化时间的增长使硅酸镁中镁含量不断下降,不利于形成硅酸镁。Mg(NO3)2滴入Na2O·nSiO2的产物比Na2O·nSiO2滴入Mg(NO3)2的产物的结晶度要高,但是两者都呈现非晶态结构,经过450 ℃焙烧后各个产物都仍然为非晶态物质。

