双重PCR检测海产品中携带trh毒力基因副溶血性弧菌的研究
刘月苹
(1.唐山职业技术学院,河北唐山 063004;2.沈阳农业大学 生物科学技术学院,辽宁沈阳 110866)
副溶血性弧菌(Vibrio parahaemolyticus,Vp)是引起人类肠胃炎的一种致病菌,常存在于人们食用的贝类产品及鱼类中,其主要致病机理是该菌可产生溶血毒素,包括耐热性溶血毒素(TDH)、耐热性溶血毒素相关的溶血毒素(TRH)及不耐热溶血毒素(TLH),其中TDH和TRH是副溶血性弧菌的主要致病因子。近几年来,副溶血性弧菌已超过沙门氏菌成为危害性最大的食源性病原菌,其引起的食源性致病案例更是呈明显上升趋势。因此,研究开发可快速检测致病性的副溶血性弧菌的方法至关重要。
传统检测方法大多要经过增菌、分离培养、生化鉴定和血清学反应等过程,操作时间长,步骤烦琐,检出率也较低。宋晶玲[1]利用神奈川试验与PCR检测183株O3:K6血清型副溶血性弧菌毒力基因时发现神奈川试验存在部分trh基因的漏检,而采用实时PCR(real-time PCR)、基因芯片与脉冲场电泳(PFGE)等方法检测副溶血性弧菌的技术含量高,使用设备价格昂贵[2]。
因此,本研究采用种特异性基因tlh和毒力基因trh为模板进行双重PCR扩增,在确定副溶血性弧菌种属的基础上进行trh毒力基因的检测,同时进行双重PCR的灵敏度及人工污染灵敏度的检测,初步建立了准确检测携带致病基因trh的副溶血性弧菌的双重PCR技术,并且提高了检测灵敏度和特异性,避免了神奈川试验假阳性的干扰,节约时间和材料成本。
1 材料与方法
1.1 材料
1.1.1 供试菌株
标准菌株:副溶血性弧菌标准菌株ATCC17802,沈阳农业大学微生物生化与分子生物学实验室保存。
试验菌株:微生物生化与分子生物学实验室保存的非副溶血性弧菌,包括李斯特氏菌、金黄色葡萄球菌、大肠杆菌、创伤弧菌、热带假丝酵母、伤寒沙门氏菌和芽孢杆菌。
1.1.2 试剂与仪器
Taq DNA聚合酶、dNTPs、10×Buffer和6×Loading Buffer,TAKARA公司;EB,Sigma公司;DL 2 000 marker,上海生工生物工程公司;琼脂糖,伯乐生命医学产品(上海)有限公司。
UV-10000型凝胶成像仪,骥辉分析仪器(上海)有限公司;T100型PCR仪,美国伯乐公司;721型紫外分光光度计,上海菁华科技仪器有限公司。
PCR引物根据文献设计,由TAKARA公司合成,如表1所示。

表1 tlh和trh基因的引物序列
反应体系:3.75 pmol/μL的tlh引物对各1 μL,3.75 pmol/μL的trh引物对各4 μL,2.5 μL的10×buffer( 含 Mg2+),2.0 μL 的 2.5 mmol/L 的 dNTP,4 μL的 DNA 模板,0.2 μL 的 Taq酶(5 U/μL),补水至反应体系25 μL。
反应条件:预变性94 ℃,5 min;变性94 ℃,1 min;退火 55 ℃,1 min;延伸 72 ℃,2 min;循环 29次;最后一个循环结束后,72 ℃延伸10 min。双重PCR扩增产物在1%琼脂糖凝胶电泳,经溴化乙锭染色,成像系统成像。
1.2 方法
1.2.1 菌株培养
取4 ℃保存的斜面菌种进行活化,挑取生长菌一环,接种到盛有50 mL培养基的三角瓶中37 ℃、160 r/min振荡培养过夜,所用培养基为胰胨肉汤。
1.2.2 模板DNA的提取
取0.6 mL对数期菌悬液与0.6 mL的2×TZ细胞裂解液混匀,使TZ工作浓度为2.0%的Triton X-100,2.5 mg/mL的叠氮化钠,0.1 mol/L的Tris-HCl缓冲溶液,pH 8.0。沸水浴10 min后冷却到室温,15 000 r/min离心10 min,取上清(含DNA)备用。
1.2.3 PCR体系优化及产物分析
在确定了反应体系为25 μL后,通过多次试验先确定了影响较小的因素:10×Buffer(含Mg2+),2.5 μL;2.5 mmol/L 的 dNTP,2.0 μL;Taq 酶 0.2 μL,DNA模板4 μL。对影响较大的引物浓度和退火温度进行调试,其中退火温度调试范围为在50.8~59.2 ℃;trh和tlh的引物浓度均为3.75 pmol/μL,由于之前做单重PCR检测时发现引物trh用量为4 μL时,PCR扩增条带亮度很亮,所以本试验采用trh引物用量为4 μL,tlh的引物用量范围为0.5~4.0 μL。PCR反应条件同1.1.2。
1.2.4 PCR反应特异性检测
采用TZ法分别提取副溶血性弧菌ATCC17802和7株非副溶血性弧菌的DNA,并利用优化的双重PCR体系进行DNA理论扩增反应与电泳检测分析。
1.2.5 验证双重PCR检测体系
活化试验室保存的利用传统方法从海产品中筛选出的副溶血性弧菌菌株,用双重PCR进行检测。
1.2.6 PCR灵敏度检测[3]
取对数期副溶血性弧菌悬液10 mL,12 000 r/min离心1 min,弃上清,用生理盐水在8 000 r/min,3 min条件下洗涤2次后,用生理盐水进行稀释,测定其600 nm吸光度值,通过标准曲线确定菌浓度为2.0×107CFU/mL,之后用生理盐水以10倍稀释法进行梯度稀释,分别取稀释菌液0.5 mL抽提DNA进行检测。
1.2.7 人工模拟样品检测
取菌浓度1.45×108CFU/mL的副溶血性弧菌0.5 mL,分别接入经检测无副溶血性弧菌的5 g碎牡蛎肉、碎虾肉、碎海鲇鱼肉及鱼鳃和鱼肠中,胰胨肉汤培养基,37 ℃、160 r/min增菌10 h,抽提DNA进行检测。
1.2.8 人工污染灵敏度检测
取经检测无副溶血性弧菌的黄花鱼肉5 g,无菌操作下剪碎,分别放入盛有45 mL胰胨肉汤培养液的9个三角瓶中,取经过生理盐水稀释,菌浓度为1.0×108CFU/mL副溶血性弧菌进行10倍梯度稀释,分别取0.5 mL稀释液放于三角瓶中,37 ℃、160 r/min培养10 h,从液面取0.5 mL增菌液进行DNA提取,双重PCR检测。
2 结果与分析
2.1 PCR体系优化及产物分析
影响PCR扩增反应的因素很多,其中两个重要参数就是退火温度和引物浓度[4]。首先利用PCR仪优化退火温度(图1),在最佳的退火温度下根据PCR扩增条带的亮暗调整引物浓度,以便使用较少的引物达到最佳的效果。

图1 退火温度优化
由图1可知,退火温度在50.8~59.2 ℃内,扩增片段为450 bp的条带亮度都很强,300 bp的条带亮度随着退火温度的降低亮度变强,而降低退火温度可以提高PCR扩增效率,因此选择55 ℃为最佳退火温度。
由图2可知,在固定trh引物用量、变化tlh引物用量的情况下,扩增片段300 bp的条带亮度都很弱,引物用量超过1.0 μL后亮度无法满足检测要求;而扩增片段为450 bp的条带亮度随用量的增加而增加。在3.75 pmol/μL的tlh引物对各1.0 μL,与3.75 pmol/μL的trh引物对各4 μL时,双重PCR条带亮度能够达到检测标准。

图2 引物浓度优化
2.2 特异性分析
采取TZ法对各种待测菌株进行DNA的抽提,之后分别加入两种引物进行双重PCR扩增(图3)。

图3 双重PCR的特异性检测结果
由图3可知,利用优化的双重PCR对两株副溶血性弧菌标准菌株ATCC17802的DNA进行扩增可获得大小为450 bp和300 bp的两条清晰的目的条带,而非副溶血性弧菌没有特异性条带产生。说明本试验建立的PCR检测体系具有极好的特异性和稳定性。
2.3 验证双重PCR检测体系
由图4可知,双重PCR方法与传统方法检测结果一致。5株经过细菌培养与生化鉴定为副溶血性弧菌的菌株进行双重PCR检测,所有菌株均扩增出tlh特异性条带,而有些副溶血性弧菌还扩增出trh毒力基因。说明tlh可作为PCR鉴定副溶血性弧菌的菌属特异性基因,该双重PCR方法能够准确地鉴定出携带trh毒力基因的副溶血性弧菌。

图4 双重PCR检测5株传统方法检测出的副溶血性弧菌
2.4 双重PCR灵敏度分析
浓度为2.0×108CFU/mL的副溶血性弧菌培养液以十倍稀释法稀释,进行PCR检测。扩增条带的亮度随着菌液浓度的减小而减弱;菌浓度为2.0×104CFU/mL时,450 bp和300 bp的目的片段都可扩增出来;菌浓度为2.0×103CFU/mL、2.0×102CFU/mL和2.0×10 CFU/mL时,只有条带亮度很弱的450 bp片段;浓度2.0 CFU/mL时双重PCR扩增条带均消失(图5)。实验结果表明,双重PCR对携带trh毒力基因的副溶血性弧菌的纯菌菌液灵敏度可达到2.0×104CFU/mL,此灵敏度可满足样本增菌后的检测要求。
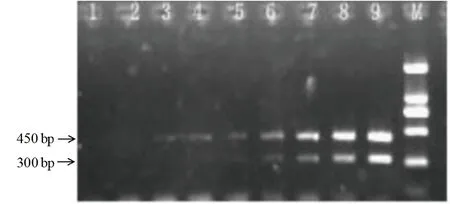
图5 双重PCR的灵敏度分析
2.5 人工污染样品检测
取浓度为1.45×108CFU/mL的副溶血性弧菌,接种于盛有5 g碎牡蛎肉、碎虾肉、碎鲇鱼肉及鱼鳃和鱼肠的三角瓶中,增菌10 h后进行双重PCR检测。结果4种样品都扩增出了特异性条带(图6),试验证明该双重PCR对海产品中存在的副溶血性弧菌有很好的特异性。同时发现,4种样品特异性扩增条带亮度不一样,碎鱼肉的扩增条带亮度最亮。可能是不同海产品营养成分不同,供细菌生长的环境也不相同,使含相同菌量的海产品在相同的增菌时间内获得的菌体数不同。

图6 海产品中双重PCR检测结果
2.6 人工污染灵敏度分析
不同菌浓度的副溶血性弧菌污染黄花鱼肉后,增菌10 h,双重PCR检测结果见图7。PCR条带亮度随着污染用菌浓度的减小而减弱,在1.0×103CFU/mL时,扩增出450 bp和300 bp的目的片段,而小于该菌浓度时,只有450 bp的目的片段且其亮度逐渐减弱至没有。因此,人工污染试验中检测携带trh毒力基因副溶血性弧菌的灵敏度为1.0×103CFU/mL,即黄花鱼肉中携带trh毒力基因的副溶血性弧菌含量为100 CFU/g时,增菌10 h该检验方法可检出。

图7 人工污染黄花鱼肉中双重PCR灵敏度分析
3 结论
目的基因的选择对于多重PCR检测技术的特异性尤为重要,关于副溶血性弧菌目的基因的选择,很多研究报道采用了不同的基因。强世龙等[5]与岳友宏等[2]采用tlh与tdh基因进行双重PCR检测,林佳琪等[6]采用tlh、tdh、tox R、trh基因进行四重PCR检测。tlh基因作为其种属鉴定基因是所有副溶血性弧菌都携带的,trh基因可用于其trh毒性的鉴定。除了trh基因外,副溶血性弧菌的溶血毒素还包括耐热性溶血毒素(TDH),也是副溶血性弧菌的主要致病因子,在临床腹泻患者分离的副溶血性弧菌菌株中90%以上携带tdh和(或)trh基因。但trh基因在其他弧菌中有交叉现象,与其他弧菌存在约93%~96%的同源性[7],同时在副溶血性弧菌神奈川试验为阴性时也含有致病基因trh[5],因此本试验采用trh基因与种特异性基因tlh设计引物进行双重PCR的扩增。
在双重PCR试验过程中,任何一个条件不符合,都很容易导致出现非特异性的产物或者扩增失败。退火温度是影响PCR反应特异性的重要因素之一,较低的退火温度会使PCR扩增产物浓度增高,增大引物与模板错配机会,出现非特异性扩增,造成涂抹带或者片状带。较高的退火温度,会使PCR扩增产物浓度降低,可能导致假阴性结果[4]。同时,引物浓度对双重PCR扩增也有较大的影响,PCR反应中,引物一般最适浓度为0.1~1.0 mol/L[8]。过低的引物浓度会导致PCR扩增无法完成30个循环,使扩增产物产量降低;过高的引物浓度会导致非特异性扩增,在电泳结果中出现杂带[4]。针对这些情况,本研究通过多次试验确定退火温度为55 ℃,tlh引物浓度为1.875~14.000 μmol/L,trh引物浓度为14.000 μmol/L,比一般的单重PCR所用引物浓度要低。试验中没有形成大量的引物二聚体,扩增效果极好,建立了稳定的双重PCR反应体系。
本研究人工污染灵敏度为1.0×103CFU/mL,与纯菌菌液灵敏度相比要高,分析原因可能是黄花鱼肉的主要成分蛋白大大促进副溶血性弧菌的生长。通过计算,此双重PCR检测污染黄花鱼肉样品检出限为100 CFU/g,比强世龙[5]报道的双重PCR检测模拟污染红螺样品检出限10 CFU/g要低一个数量级。

