人PD-L1蛋白的预测及分析
余科权 吴 敏
人程序性死亡配体1(programmed death-ligand 1,PD-L1)是程序性死亡分子受体1的配体,由CD274基因编码[1]。PD-L1具有抑制T细胞效应功能,可能在预防宿主细胞自身免疫和免疫介导的杀伤中发挥作用,近年来兴起的针对PD-L1的单克隆抗体的免疫治疗在晚期肿瘤方面取得了巨大的进展[2]。对于开发抗PD-L1抗体以干扰这个途径的小分子药物是非常值得期待并且具有应用前景的,但其发展受结构信息不足的阻碍[3]。本研究运用生物信息学的方法预测并分析PD-L1蛋白的结构,为其进一步的功能研究及相关药物研发提供一定的参考。
1 材料与方法
1.1 材料
从UniProt(http://www.uniprot.org/)网站上获取人的PD-L1蛋白的氨基酸序列(Q9NZQ7-1)。
1.2 方法
利用ProtParam在线工具http://web.expasy.org/protparam/预测人PD-L1蛋白的相关理化性质。利用ProtScale(http://web.expasy.org/protscale/)在线预测网站对人PD-L1蛋白的亲水性及疏水性进行预测及评估。利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)在线预测网站对人PD-L1蛋白跨膜区域进行预测及评估。利用SOPMA(https://npsa-prabi.ibcp.fr/)在线预测网站对人PD-L1蛋白二级结构进行预测及评估。利用Swiss-Model(https://swissmodel.expasy.org/)在线预测网站对人PD-L1蛋白三级结构进行预测及评估。利用STRING(http://string-db.org/)在线预测与人PD-L1蛋白相互作用的相关蛋白。利用(https://www.ebi.ac.uk/Tools/msa/clustalw2/)在线获取PD-L1蛋白的树文件,分析预测PD-L1蛋白的同源性。利用信号肽预测服务器(http://www.cbs.dtu.dk/services/SignalP/)分析预测PD-L1蛋白是否有信号肽。
2 结果
2.1 人PD-L1蛋白的理化性质预测和分析
ProtScale在线对人以及小鼠的PD-L1蛋白进行理化性质预测结果显示,人、小鼠的PD-L1蛋白在理化性质上非常接近,氨基酸个数均为290;相对分子质量接近,相差约485.8;原子数目接近,相差108;等电点均在7.35以下;人和小鼠的PD-L1蛋白不稳定系数均小于50;脂肪族系数相同;半衰期均达到30 h,总平均亲水性为负值。见表1。
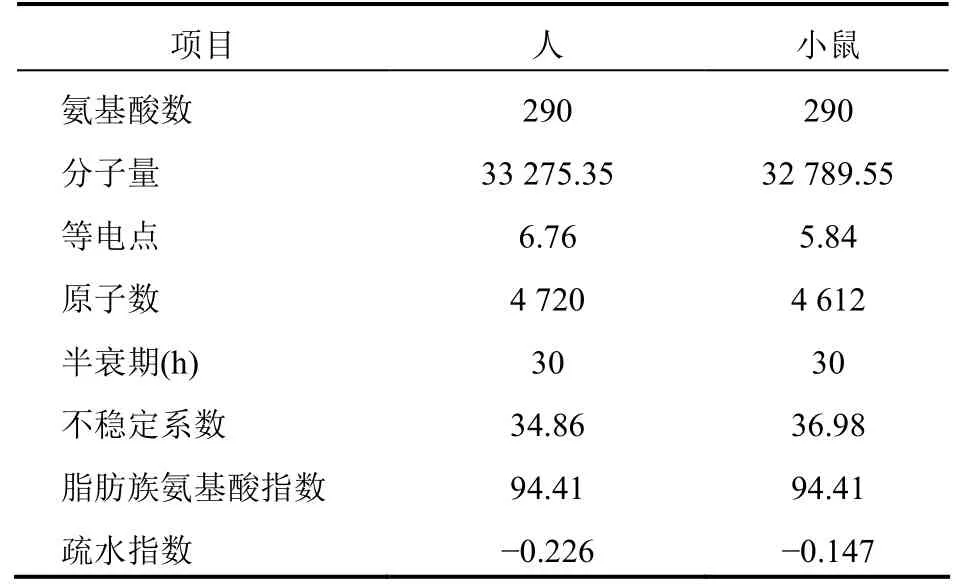
表1 人与小鼠PD-L1蛋白理化性质预测结果
2.2 人PD-L1蛋白亲水性、疏水性的预测与分析
ProtScale对PD-L1蛋白的预测结果显示,该蛋白质最强的疏水性位点是位于第54位的异亮氨酸(IL),分值为4.5;而最强的亲水性位点则是位于第85位氨基酸,分值为-4.5,为精氨酸(Arg),通过对PD-L1蛋白的整体观测可知,其亲水肽链数量多于疏水肽链。ProtParam对PD-L1蛋白的预测结果提示,疏水指数为-0.226。见图1。
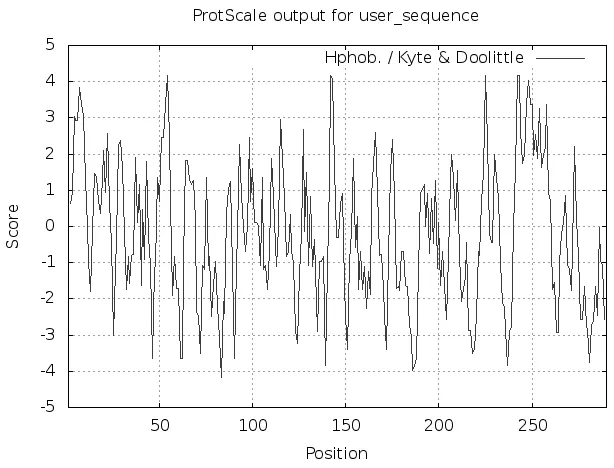
图1 人 PD-L1蛋白亲/疏水性分析
2.3 人PD-L1蛋白跨膜区域预测与分析
人PD-L1蛋白跨膜区域预测结果显示,人PD-L1蛋白具有跨膜区域,是跨膜蛋白(图2)。
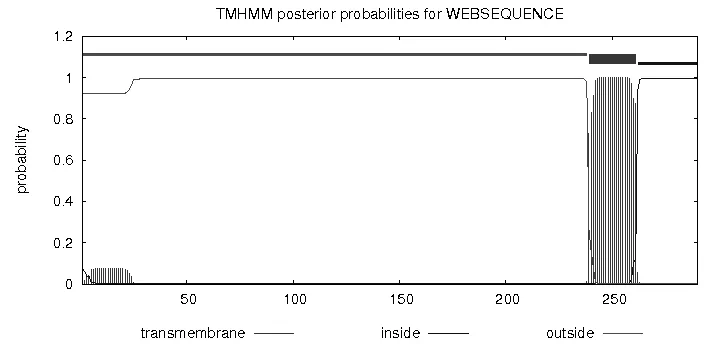
图2 人PD-L1蛋白跨膜区预测
2.4 人PD-L1蛋白二级结构的预测与分析
预测结果显示人PD-L1蛋白α螺旋结构占24.83%,延伸链占32.14%,β转角占8.62%,无规则卷曲占34.14%(图3)。具体数值见表2。
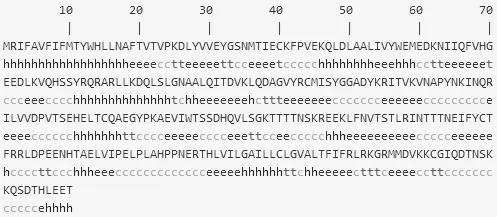
图3 人PD-L1蛋白二级结构预测

表2 人PD-L1蛋白二级结构预测结果
2.5 人PD-L1蛋白三级结构的预测与分析
通过将人PD-L1蛋白序列导入至Swiss-Model蛋白三级结构在线预测工具,获得了该蛋白三级结构的5种预测结果(图4)。通过对5种三级结构的波形图进行分析,本研究发现(A)与(B)的预测结果十分接近。通过Jpred4获取了A模型(3bis.1.A)及B模型(5ius.1.B)的拉曼图(图5),分析A预测模型(3bis.1.A)及B 预测模型(5ius.1.B)中蛋白质各氨基酸残基二面角ψ角和φ角的分布是否合理,结果显示预测的PD-L1蛋白三级结构模型的ψ角和φ角均位于黄色核心区域。
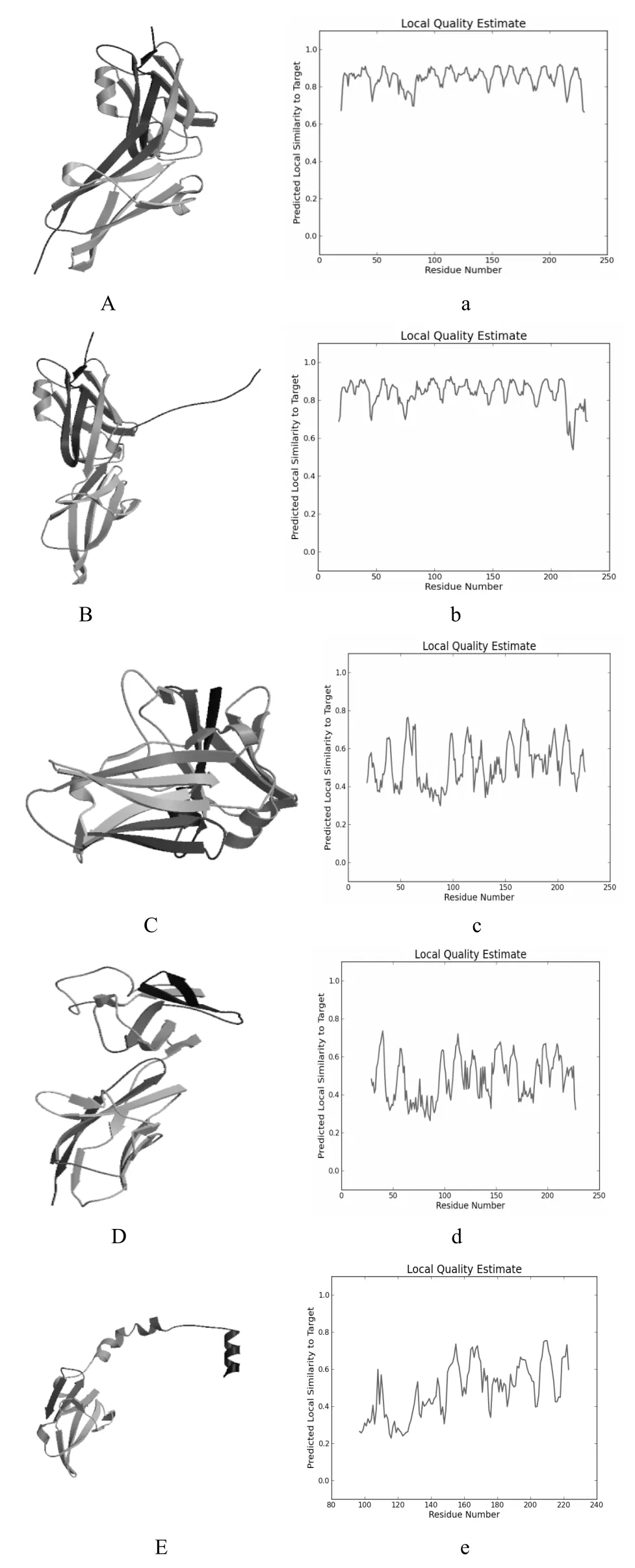
图4 人PD-L1蛋白三级结构预测
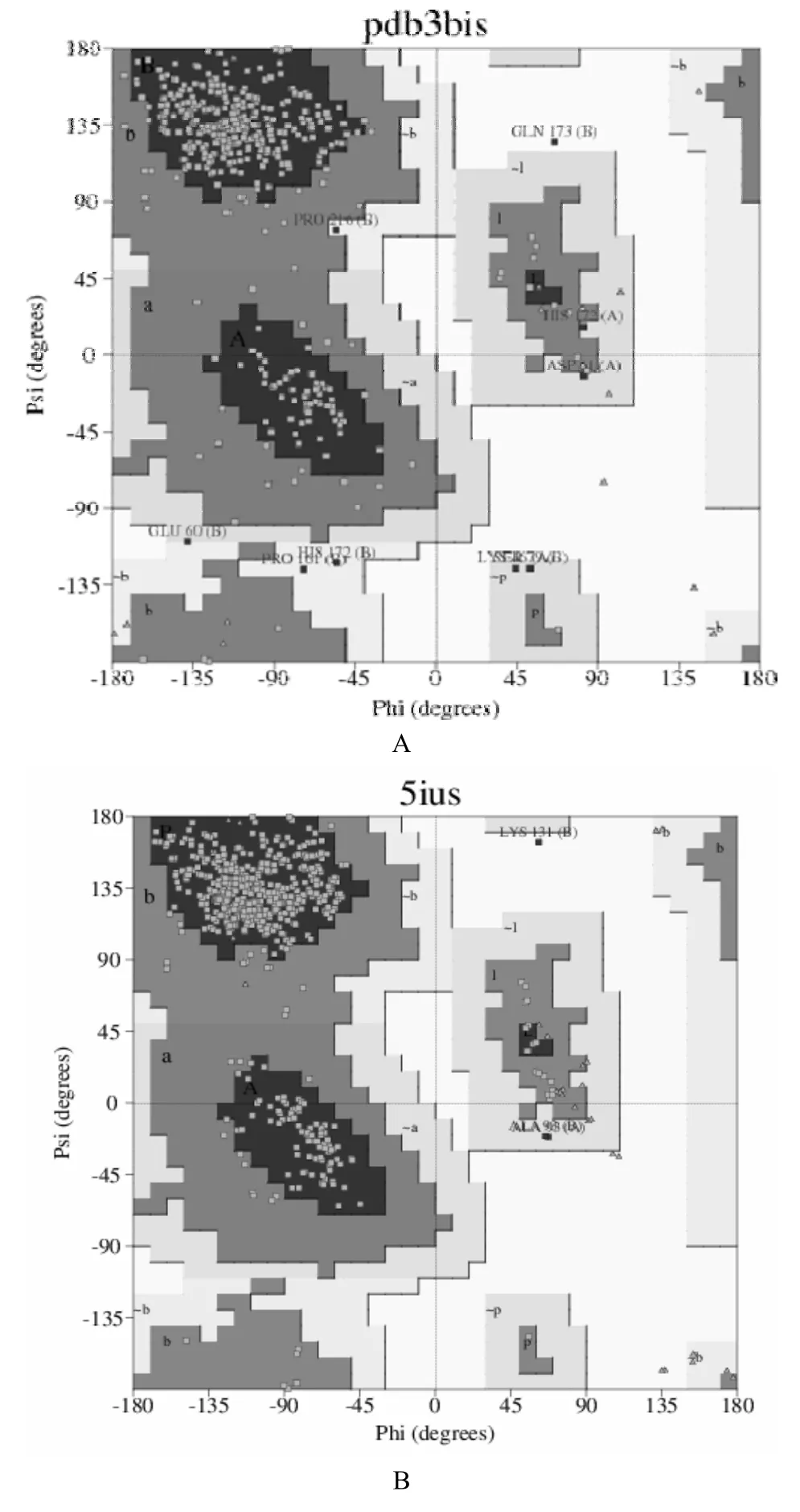
图5 人PD-L1蛋白预测三级结构模型拉曼图分析
2.6 人PD-L1蛋白的同源性预测与分析
NCBI的proten blast 在线网站获取PD-L1蛋白的树文件结果显示,物种间序列差异性较小,PD-L1蛋白具高度保守性。利用njplot将clutalx2输出的比对结果进行系统数可视化分析,结果显示人PD-L1蛋白的进化水平与黑猩猩等灵长类动物相同,与小鼠距离最远,数值为0.181。见图6。
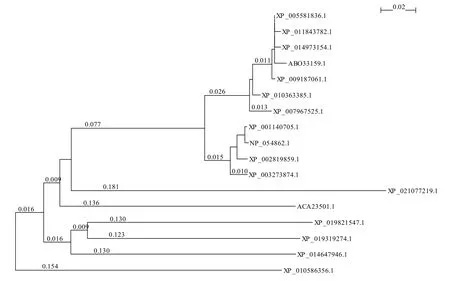
图6 不同物种间PD-L1蛋白进化树
2.7 人PD-L1蛋白相互作用的蛋白质预测与分析
STRING网站对11个可能相互作用的蛋白(图7),其评分为PDCD1LG2(0.998)、PDCD1(0.998)、CD274(0.998)、HLA-DRB1(0.993)、HLA-DRBA(0.993)、HLA-DRBA(0.991)、CD3G(0.991)、CD3E(0.980)、CD4(0.972)、LCK(0.906)、PTPN11(0.901)。
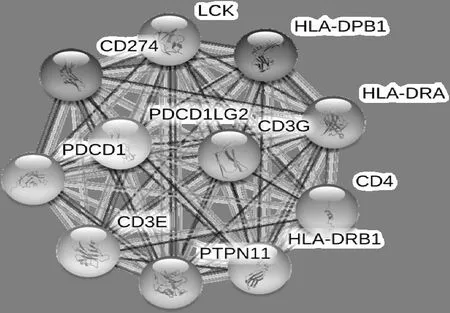
图7 与人PD-L1蛋白相互作用的蛋白质预测
2.8 人PD-L1蛋白信号肽及信号肽数据预测与分析
将人PD-L1蛋白氨基酸序列导入SignaP 4.1 Server,设置Cut-off参数为0.500,得出预测结果(图8),其中C、Y、S的最大值分别为0.846、0.875、0.963,位置分别在19位、19位、15位氨基酸上,S-mean、D值分别为0.912、0.895,该预测结果显示,人PD-L1蛋白具有蛋白信号肽序列,在18和19位上的切割位点。见表3。
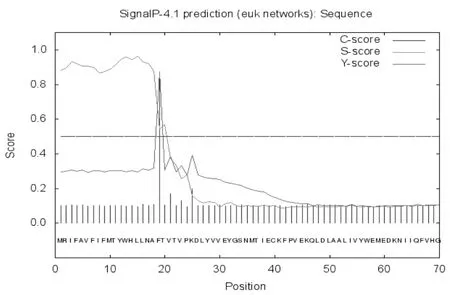
图8 人PD-L1蛋白信号肽序列预测
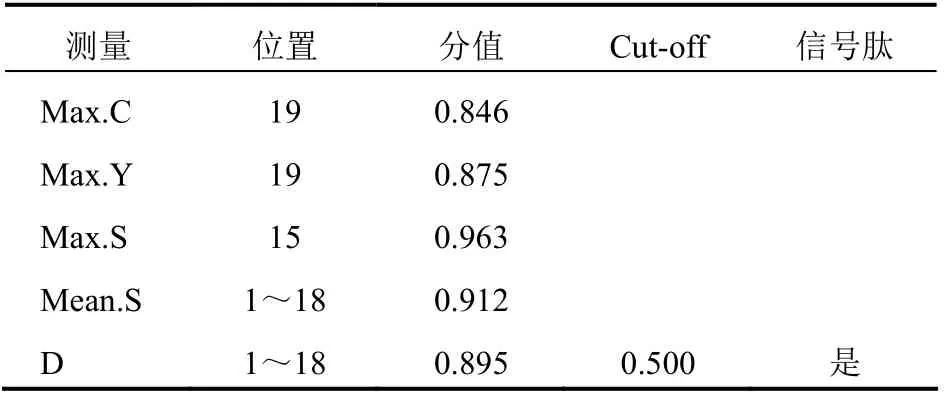
表3 人PD-L1蛋白信号肽序列预测
3 讨论
人PD-L1蛋白是程序性死亡分子受体1的配体,PD-L1蛋白不仅在淋巴细胞如单核细胞、DC细胞和T细胞上表达,而且也存在于非造血细胞上,如内皮细胞和上皮细胞[1,4]。通过干扰素调节因子-1(IRF-1),PD-L1受体可以被Ⅰ型和Ⅱ型干扰素(IFN)上调,其机制可能是通过Janus激酶/信号转导通路和转录激活因子(JAK/STAT)-依赖性物质通路,在肿瘤发生时更为明显[5-6]。在自身免疫性疾病的诱导期和效应期,PD-L1蛋白是自身反应性T细胞的关键负性调节因子,并以多种方式发挥其抑制功能[7-10]。PD-L2蛋白(B7-DC)是另一种PD-1的配体,在结构上与PD-L1蛋白相似,也具有抑制T细胞效应功能,本研究通过预测PD-L1蛋白的相互作用蛋白发现PDCD1LG2可能有类似作用。除了肿瘤细胞,肿瘤微环境中的肿瘤浸润淋巴细胞(TIL)以及巨噬细胞也表达PD-L1蛋白[2]。发生于恶性黑色素瘤患者前哨淋巴结中的微小转移灶,肿瘤细胞也可表达PD-L1蛋白,这可能成为将来复发和转移的源头[2,11]。在肿瘤细胞PD-L1蛋白表达的前提下,有TIL的患者预后较好,PD-L1蛋白高表达是机体抵抗肿瘤有效的免疫反应,与好的预后相关,PD-L1蛋白的表达与机体免疫功能相关。
本研究主要运用生物信息学的方法预测并分析了人PD-L1蛋白的基本结构及理化性质,结果表明,人PD-L1蛋白的同源性较强,在不同的物种之间进化高度保守,说明PD-L1蛋白可能在细胞的生命调控过程中具有重要作用。通过对PD-L1蛋白的结构分析可知,PD-L1蛋白是一种跨膜结构的稳定亲水蛋白,有信号肽序列,说明PD-L1蛋白可能在核糖体合成以后经过折叠,嵌入细胞膜,这与其可能影响细胞信号转导的特点相吻合。同时也与文献[4]报道的PD-L1蛋白是跨膜蛋白吻合。在细胞中,PD-L1蛋白作为PD-1的配体,与PD-1共同形成V形结构域,有助于与B7-1的结合,影响细胞的信号转导,从而抑制T细胞效应。这也应证了跨膜蛋白行使的功能与效应与功能区域密切相关。通过对PD-L1蛋白的二级结构的预测,推测在人PD-L1蛋白中,无规则卷曲是人PD-L1蛋白最多的二级结构原件而α-螺旋和延伸链散布于整个蛋白中。α-螺旋具有两性特点,即α-螺一侧为疏水的氨基酸,一侧为亲水的氨基酸。β折叠多由延伸链组成,这提示二级结构中相邻的氨基酸分子由于通过大量氢键的维系,使PD-L1蛋白具有良好的结构稳定性。三级结构预测了2种可能接近真实蛋白质的模型,说明了PD-L1蛋白结构的稳定。用单克隆抗体靶向抑制PD-L1蛋白免疫检查点最近在治疗恶性黑色素瘤、非小细胞肺癌和其他类型的癌症方面取得突破性进展,而针对PD-L1蛋白的高级结构的预测对于其结构的了解具有重要的意义[12-14]。Taube等[15]用免疫组织化学评估150例皮肤恶性黑色素瘤患者,早期患者的肿瘤细胞PD-L1蛋白高表达,可见PD-L1蛋白表达是肿瘤细胞早期适应机体的表现。提示了解PD-L1蛋白结构对于开发针对PD-L1蛋白的抗肿瘤药物及免疫治疗具有重要意义。通过对PD-L1蛋白的相互作用蛋白的预测与分析,找到了类似功能的蛋白质,提示该类似功能蛋白质均可能与PD-L1蛋白参与细胞信号转导,与PD-1构成复合物抑制T细胞效应的生物学功能相吻合。其中PDCD1LG2是程序性细胞死亡1配体2,与PD-L1蛋白属同一蛋白家族,参与共刺激信号,对于以不依赖PD-L1蛋白的方式的T细胞增殖和IFNG产生是必须的,也属于跨膜蛋白,其生物学功能与PD-L1蛋白类似,说明了PD-L1蛋白与肿瘤发生的密切关系,而PD-L1蛋白在肿瘤细胞高表达提示了机体抵抗肿瘤的免疫反应有效。人PD-L1蛋白的预测结果对于深入研究PD-L1蛋白对免疫细胞功能相关的生理过程的调控作用及开发新一代的针对抗PD-L1蛋白抗体的抗肿瘤药有一定的指导意义。
综上所述,人PD-L1蛋白是PD-1的关键配体蛋白,生物信息学预测其属跨膜蛋白,其对肿瘤的发生、发展以及免疫细胞的功能具有重要影响。

