肿瘤细胞中杆状病毒蛋白Ac34对CRM1出核通路的抑制作用研究*
李景琦,胡 雪,王 云,周 缘,刘锦龙,白慧敏
(1.内蒙古科技大学包头医学院基础医学与法医学院,内蒙古 包头 014040;2.中国科学院武汉病毒研究所)
正常细胞中,各种蛋白与因子呈现出核-质的平衡分布,并且这种平衡是主要依赖于CRM1介导的出核途径以及各种类型Importins介导的入核途径[1]。染色质区域维持蛋白1(The chromosome region maintenance 1 protein,CRM1),又名核输出蛋白1(Exportin-1,XPO1),是第一个发现且最为重要的Exportin,大部分蛋白的出核依赖于CRM1介导的出核途径。CRM1可以介导携带有NES序列的蛋白质从细胞核转运到细胞质,从而可以影响这些蛋白质被特定激活或抑制。但在肿瘤细胞中,CRM1异常表达,将编码有NES序列的肿瘤抑制因子,包括p53、p27、p21和p18在内的抑癌基因等过量地转运至细胞质使得它们无法在细胞核内发挥正常功能[2],从而使其功能丧失,失去了对肿瘤细胞的监管能力,促进肿瘤的恶性发展。在包括卵巢癌、宫颈癌、神经胶质瘤、成骨肉瘤、胰腺癌、骨髓瘤等多种肿瘤中,均发现CRM1的表达发生了上调,并且CRM1的含量也可以作为实体瘤和血液恶性肿瘤预后的重要指标[3]。由于CRM1对于真核细胞内物质转运以及肿瘤发生过程中的重要性,多种针对CRM1的抑制剂被开发用于科研甚至临床。开发新型、安全性高的CRM1抑制剂已经成为了炙手可热的新型抗肿瘤药物研发靶点。如鳞茎霉素B(Leptomycin B,LMB)[4]、新型的可逆的CRM1抑制剂CBS9106[5]、新型口服不可逆核出口抑制剂(selective inhibitors of nuclear transport,SINE)[6]等CRM1抑制剂已被广泛地开发和研究。
杆状病毒(Baculovirus)是专一性感染节肢动物的外被包膜的环状闭合双链DNA病毒,AcMNPV是杆状病毒科的代表物种,也是第一个完成基因组测序的杆状病毒。我们在前期研究中发现在昆虫细胞中AcMNPV可以通过其编码的Ac34使宿主胞质内的Arp2/3复合体在胞核中富集[7]。进一步分析发现,Ac34可以抑制细胞CRM1出核转运通路,从而使得携带有NES序列的Arp2/3复合体发生出核转运障碍,进而在胞核中滞留、聚集,从而协助病毒复制。为了探索Ac34是否可以在肿瘤细胞对CRM1出核转运通路发挥的抑制作用,本研究构建了荧光蛋白融合表达质粒,通过瞬时共转染的方式将Ac34和带有NES的荧光蛋白共转染至Hela细胞中,研究其在肿瘤细胞中对CRM1通路的作用,及其对肿瘤细胞增殖活性的影响,以探讨其作为一种新型抗肿瘤多肽药物的潜在可能性。
1 材料与方法
1.1实验材料
1.1.1菌株与细胞 DH5α菌株,Hela细胞,Huh7细胞,HepG2细胞。
1.1.2细菌培养基及细胞培养基 LB液体培养基、LB固体培养基、SOC培养基、DMEM培养基(美国GIBCO公司):DMEM基础培养基 + 10 %胎牛血清(GIBCO公司)+100 U/mL链霉素+100 U/mL青霉素。
1.1.3质粒 (1)pcDNA3.1(+)-EGFP:含有EGFP标签真核表达载体。(2)pcDNA3.1(+)-mC-3NES:含有mCherry标签融合3×NES真核表达质粒。(3)pcDNA3.1(+)-EGFP-AC34:含有EGFP标签的Ac34真核表达质粒。(4)PXJ40 - Flag-Ac34:含有Flag标签的Ac34真核表达质粒。
1.1.4引物 实验所用引物见表1。

表1 本实验所用的引物
1.1.5试剂与仪器 FastPFU高保真PCR酶,Taq DNA聚合酶、核酸Marker(Transgene公司)、转染试剂Lipofectamine 2000(Invitrogen公司)、普通化学试剂(国药集团化学试剂有限公司)、质粒小提试剂盒(OMEGA公司)、DNA胶回收试剂盒(AXYGEN公司)、细胞核染料Hoechst 33258(Invitrogen公司)、免疫荧光二抗:Alexa Fluor 425/188/561/640(Invitrogen公司)、WST-1细胞活力检测试剂盒(AXYGEN公司)、离心机(Eppendorf公司)、倒置显微镜(Olympus IX51)、激光共聚焦显微镜(Perkin Elmer Ultra VIEW Vox)。
1.2方法
1.2.1质粒构建 按照产品说明书介绍步骤,将目的片段扩增后凝胶回收,并酶切连接至pcDNA3.1(+)及PXJ40-Flag(实验室以前构建)载体上,
1.2.2细胞培养及转染 转染前一天在相应孔板中铺细胞,待铺细胞16~24 h,细胞生长至70 %~80 %可进行转染。将质粒加入250 μL Opti-MEM培养基中,涡旋混匀;将lipofectamine 2000加入250 μL Opti-MEM培养基中,轻柔混匀;静置5 min(lipofectamine 2000 μL∶质粒 ug=1.5 μL∶1 μg)。将质粒混合体系与脂质体混合体系等体积轻柔混匀,室温静置20 min。静置期间,将待转染细胞培养基上清更换为1 mL Opti-MEM清洗一遍,再加入1.5 mL的Opti-MEM,静置结束后,将脂质体-核酸混合物逐滴缓慢加入孔板内,轻柔晃匀,放入细胞培养箱。培养4~6 h进行换液,将Opti-MEM培养基更换为正常DMEM培养基,然后放入细胞培养箱继续培养。
1.2.3免疫荧光 将待收集细胞(chamber)从细胞培养箱中取出,将培养基吸掉,用PBS洗涤细胞3次,吸尽液体。用3.7 %的多聚甲醛(覆盖细胞即可)室温固定15~20 min,然后PBS洗3次。每个孔加入250 μL的1 % NGS + 0.5 % Triton-X,室温透化5 min,用PBS洗涤细胞3次,吸尽液体。每个孔加入150 μL的一抗,盖上封口膜,4 ℃冰箱中孵育16 h。移去一抗,用PBS洗3次。孵育二抗(自此开始注意避光操作),37 ℃ 1 h避光孵育。移去二抗,用PBS洗3次。加入hoechst 33258,室温静置等待5 min,用PBS洗3次。拆开chamber,每个孔的上方加入1滴荧光淬灭封片液,盖上盖玻片后,用指甲油封片,待风干后放到4 ℃冰箱保存。
1.2.4WST-1检测 把1 mL电子耦合试剂加入到WST-1粉末中(注意过程需要避光),完全溶解即成WST-1溶液,分装到新的1.5 mL EP管中,用锡箔纸包好,分装后-20 ℃,避光保存。将孔中的培养基吸尽,取500 μL培养基加入50 μL的WST-1,混合均匀后加入。吸光范围适宜时间1~2 h之间,从培养箱拿出孔板,用酶标仪测定。
2 结果
2.1EGFP-Ac34使mC-3NES在Hela细胞的细胞核中聚集 在前期研究中发现,杆状病毒AcMNPV在复制过程中会通过自身编码的Ac34蛋白抑制细胞CRM1出核转运通路,从而引起相关蛋白在核内集聚,最终包装形成核壳体。而前期的研究中,只在昆虫细胞中证明了Ac34可以抑制细胞CRM1出核转运通路,因此猜想Ac34有可能对肿瘤细胞具有抑制作用。我们想要进一步探索Ac34抑制细胞CRM1出核转运通路从而发挥抗肿瘤的效应,则需要验证Ac34是否在哺乳细胞中仍然可以抑制细胞CRM1出核转运通路。选择了已经报道的CRM1高表达的肿瘤细胞系人宫颈癌细胞系Hela,将表达质粒pCDNA3.1(+) - mC-3NES分别与pCDNA 3.1(+)-EGFP、pCDNA 3.1(+) - EGFP-Ac34共转入Hela细胞,还将pCDNA3.1(+) - mC-3NES转染入Hela细胞后加入CRM1抑制剂LMB,分别用EGFP和mCherry荧光蛋白进行免疫荧光实验,激光共聚焦分析其细胞定位。实验结果表明,当mC-3NES和EGFP共转入Hela细胞时,mC-3NES在细胞质分布,EGFP没有使mC-3NES在细胞核发生聚集;将mC-3NES转入Hela细胞后,再加入CRM1抑制剂LMB,mC-3NES在细胞核内发生了聚集;当mC-3NES与EGFP-AC34共转入Hela细胞后,mC-3NES在细胞核内发生了聚集,且具有统计学意义(P<0.001)。实验结果显示,EGFP不能使mC-3NES在细胞核内发生聚集,CRMI抑制剂LMB可以通过抑制CRM1的出核转运通路,使3NES无法转运至细胞质,而在细胞核内发生聚集,EGFP-Ac34同样可以使mC-3NES在细胞核内发生聚集,这也证明了在肿瘤细胞中,Ac34通过抑制CRM1出核转运通路,使3NES在细胞核内发生聚集。见图1。
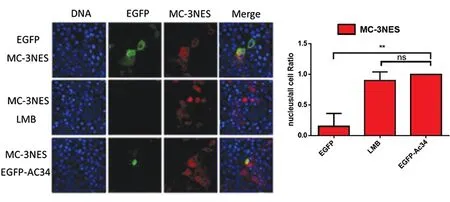
图1 EGFP-Ac34使mC-3NES在Hela细胞的细胞核中聚集
2.2Ac34对Hela细胞、Huh7细胞、HepG2细胞增殖活性的影响 我们选取多种已经报道的CRM1在其中高表达的肿瘤细胞系,如肝癌细胞系HepG2或Huh7、人宫颈癌细胞系Hela等,通过WST-1检测Ac34对细胞增殖活力的影响。在48孔板中接种Hela、Huh7、HepG2肿瘤细胞系,将PXJ40 - Flag-Ac34按浓度梯度(0、0.125、0.25、0.5、1 μg)转染至上述肿瘤细胞系,以及作为阴性对照的空载体PXJ40-Flag,每个样品设置三个复孔。48 h后通过WST-1试剂盒检测Ac34对这些肿瘤细胞系活力和增殖速度的影响,发现其没有统计学意义(P>0.05),提示Ac34对Hela、Huh7和HepG2细胞的活力和增殖速度没有影响。见图2。

图2 Ac34对肿瘤细胞增殖活性的影响
3 讨论
CRM1是真核细胞中主要的核输出蛋白,在每一个真核细胞中都有表达,是细胞生存所必需的。通过控制信号蛋白的亚细胞定位可以调控许多细胞通路,如大多数抑癌蛋白(Tumor Suppressor Protein,TSP)的基因在细胞核内可以发挥监控肿瘤的功能,而转入细胞质则会丧失监控肿瘤细胞的功能,因此通过改变抑癌蛋白的核质定位会推动许多癌症的转化。因为CRM1在许多癌症细胞中的表达异常增加,使许多TSP转运至细胞质而功能失活,可以通过抑制CRM1的核输出转运,使核质转运异常恢复动态平衡,从而抑制肿瘤的发展,因此CRM1成为了治疗肿瘤的靶点。
目前许多临床试验研究了抑制CRM1的药物对癌症患者的疗效,如CRM1抑制剂核出口化合物SINE的选择性抑制剂KPT-330。有研究表明KPT-330在晚期转移性实体肿瘤中具有临床有效性[8]。大多数抗肿瘤药物需要诱导细胞凋亡,如将p53、p73、BRCA 1、IκB、p21等瞬时激活。从本质上看,所有肿瘤中CRM1水平的升高促进了这些关键TSP的核输出转运,从而减轻了现有药物的抗肿瘤作用。通过抑制CRM1出核转运通路,如CRM1抑制剂SINE可以使TSP在细胞核保留并恢复其功能[9],抑制作用与现有的治疗方法有潜在的协同作用。因此,CRM1抑制剂有发展为抗肿瘤药物的潜力。
本研究显示了杆状病毒AcMNPV编码的Ac34在哺乳动物细胞中依然可以抑制CRM1介导的出核转运,且对细胞的增殖活性无影响。因此,Ac34有望发展为新型的小分子多肽抗肿瘤药物,通过抑制CRM1介导的出核转运通路,可以与现有的肿瘤治疗药物起协同作用,共同抑制肿瘤的发展。此外,本研究可加深对真核细胞核-质运输的认识,同时也为研发针对CRM1通路的抗肿瘤药物提供新的思路和理论基础。
4 结论
本研究发现Ac34在宫颈癌Hela细胞中能够抑制依赖CRM1的出核转运通路,阻止含有NES的目的蛋白出核。另一方面我们还研究发现Ac34对Hela细胞、Huh7细胞以及HepG2细胞的增殖活性无影响。因此,Ac34有发展为新型的小分子多肽抗肿瘤药物的潜力。
——一道江苏高考题的奥秘解读和拓展

