一株茶树根际细菌的鉴定与生防效果研究
朱咏珊,罗晓欣,梁浩然,陈正桐,刘成,曹凯,刘少群,周而勋,舒灿伟,郑鹏
一株茶树根际细菌的鉴定与生防效果研究
朱咏珊1,罗晓欣1,梁浩然4,陈正桐4,刘成3,曹凯3,刘少群2,周而勋1,舒灿伟1,郑鹏2*
1. 华南农业大学植物保护学院/广东省微生物信号与作物病害防控重点实验室/群体微生物研究中心,广东 广州 510642;2. 华南农业大学园艺学院,广东 广州 510642;3. 海峡两岸农业发展研究院,广东 珠海 519080;4. 华南农业大学农学院,广东 广州 510642
炭疽病是茶树的重要病害之一,对茶叶的生长和产量造成严重的危害。目前该病的防治主要依靠化学药剂,开发生物防治产品是推广茶树绿色防控技术主要措施之一。用生理生化特征分析和分子生物学技术鉴定一株茶树根际生防菌JT68,评估其对茶炭疽病菌的抑菌效果以及菌液对菌丝生长和孢子萌发的影响。用对扣法检测该菌株的挥发性有机物对茶炭疽菌的抑制效果,并鉴定有机物的成分。用离体叶片接种的方法测试了菌液对炭疽病的防效。鉴定结果表明,菌株JT68为解淀粉芽孢杆菌。JT68菌液对茶炭疽病菌的平板抑制率为80.94%,对孢子萌发抑制率为99.18%。其发酵液富含细胞壁降解酶,处理菌丝后使病菌菌丝萎缩变形和产生厚垣孢子。JT68菌株产生的挥发性有机物对茶炭疽菌的抑菌率为50.73%,GC-MS检测发现挥发物中主要含有酮类物质。离体接种结果表明,菌液稀释100倍、稀释10倍和原液对炭疽菌相对抑制率分别为72.66%、79.70%和83.20%。抑菌谱试验表明该菌株对稻瘟病、香蕉枯萎病、辣椒炭疽病菌、希金斯炭疽菌、大丽轮枝菌和齐整小核菌等6种植物病原菌抑菌率达到70.0%~93.2%。本研究鉴定的茶树根际解淀粉芽孢杆菌,具有优越的防治病害效果,目前已经投入生产,用于制备茶树专用叶面肥并推广应用,该产品的使用可以替代或减少化学农药的使用,实现茶树的绿色防控。
茶树炭疽菌;解淀粉芽孢杆菌;抑菌作用;生物防治
茶树()是世界上最重要的经济作物之一。2018年全球茶叶产量约570万t,其中,我国产量约280万t,占全球产量的近一半[1]。由炭疽菌(sp.)引起的茶炭疽病是一种严重的真菌性病害,广泛发生在世界上茶叶种植地区。发病早期,叶片边缘或顶端形成黑色圆斑,后期逐渐扩大病斑中心呈灰白色,可见分生孢子的小黑色点。炭疽菌的侵染导致叶片脱落,茶树活力减弱[2-3]。此外,该病还对茶叶的产量、品质和价值均有影响[2,4]。
胶孢炭疽菌()已被发现是引起茶炭疽病的病原种之一,而炭疽菌属真菌也被列为世界十大真菌病原物之一[2],能侵染包括园艺作物和林业等多种植物。随着茶叶种植面积的快速扩大,茶炭疽病普遍发生,笔者在潮州饶平茶叶种植区发现部分茶园发病率高达50%~60%。针对该病害目前主要使用化学杀菌剂,如吡唑醚菌酯、苯醚甲环唑和多菌灵等进行防治[5-6]。但是过量、长期使用化学农药不仅容易导致农药残留、病菌抗药性增强等问题,影响茶叶的销售和贸易[7],还会影响环境中的非靶标生物,破坏生态系统平衡,造成环境恶化。
生物防治法是利用其他生物对病虫害进行防控的方法,是一种环境友好的绿色防控技术[8]。为了减少茶叶产品中的农药残留和保护环境,采用生物杀菌剂控制茶炭疽病是茶叶绿色生产的重要措施之一。已有一些微生物被报道能够用于防治茶叶病害。茶叶叶际分离出的BMO-111对茶拟盘多毛孢菌()和外担子菌()具有显著的抑制效果,具有防治茶轮斑病和茶饼病的潜力[9];茶树根际分离的粘质沙雷氏菌()ETR17对9种茶树叶部和根部致病菌具有拮抗作用,ETR17能够产生几丁质酶、蛋白酶和纤维素,从而降解病原体的细胞壁[10];还有研究发现灰链霉菌()和哈氏赤霉()联合使用可有效控制茶树根腐病[11]。
本研究通过鉴定一株采自茶树根际的生防菌株并评估其对茶炭疽病的防治效果,旨在为生物防治产品的研发和产品化奠定基础。
1 材料与方法
1.1 供试材料
生防菌株:解淀粉芽孢杆菌(),从广东潮州古茶树根际土壤分离获得,编号JT68,菌株保藏于广东省微生物所菌株保藏中心。
供试病原菌:茶炭疽菌(),由湖南省农业科学院茶叶研究所提供。
茶树鲜叶:2019年2月于华南农业大学园艺学院茶园内采摘,茶树品种为金萱,取叶位置为芽下第4片叶。
主要试剂:丙酮、壬酮和癸酮(分析纯)均购自北京鼎国昌盛生物技术有限责任公司。
1.2 培养基配置
LB液体培养基:10 g蛋白胨,5 g酵母粉,10 g NaCl,补充蒸馏水至1 000 mL。
马铃薯葡萄糖琼脂培养基(Potato dextrose agar,PDA):马铃薯200 g煮沸,取过滤液,加入葡萄糖20 g、琼脂20 g,加热溶解后补充蒸馏水至1 000 mL。
上述培养基的pH值均为7.0,高压灭菌锅121℃灭菌20 min。配置培养基的试剂购于生工生物工程(上海)股份有限公司。
1.3 生防细菌的分离与筛选
1.3.1 细菌的活化和发酵
从–80℃冰箱取出已保存的菌株JT68。用涂布棒蘸取JT68菌液,涂布在LB平板上,于30℃培养过夜,获得单菌落。用灭菌牙签挑取1个单菌落接种到50 mL的LB液体培养基中,以200 r·min-1转速在30℃的摇床振荡培养48 h获得生防菌的菌液备用。
1.3.2 生防细菌的筛选
以茶炭疽菌作为指示菌,采用平板对峙培养法进行检测。本研究采用了3种不同的筛选方法。
两点对峙法:在距PDA平板外缘2 cm处各放置茶炭疽菌饼(直径6 mm)和风干滤纸片,两点在一条直线上,共5个重复。以滴加等量无菌水的滤纸片为空白对照。所有平板在28℃恒温箱中培养14 d。
点线对峙法:在距培养PDA平板外缘2 cm处放置茶炭疽菌饼,在另一端距外缘2 cm处蘸菌液划一条垂直直线,共3个重复。以等量无菌水划线为空白对照。所有平板在28℃恒温箱中培养14 d。
五点对峙法:在PDA平板中心放置茶炭疽菌饼(直径6 mm),取4片无菌滤纸片十字交叉放在菌饼四周,每张滤纸片距平板外缘2 cm。每个滤纸片滴上5 µL JT68菌悬液,在无菌超净台风干。以接种5 µL无菌水为对照,每个处理设置3个重复。在28℃下培养,3 d后观察抑菌效果,计算其抑菌带大小。
菌落净生长量=菌落直径-菌饼直径
相对抑菌率=[(对照组菌落净生长量-处理组菌落净生长量)/对照组菌落净生长量]×100%
1.4 生防细菌的鉴定
1.4.1 形态及生理生化鉴定
对待测菌株进行生理生化分析,包括菌落形状、菌体形状、细菌电镜扫描形状、革兰氏染色、生理生化特征测定。
1.4.2 16 S rDNA的PCR扩增
以JT68菌株DNA为模板,用细菌常用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TACGGYTACCTTGTTACGACTT-3')进行PCR扩增。PCR体系为:PCR预混液25 µL,上游引物2 µL,下游引物2 µL,DNA 1 µL,灭菌水补足至50 µL;PCR扩增反应程序为:98℃ 3 min;98℃ 10 s,55℃ 10 s,72℃ 15 s,35个循环;72℃ 2 min。扩增产物用1%的琼脂糖凝胶电泳检测,再送往擎科生物公司进行测序。
1.4.3 序列分析及构建系统发育树
将测序结果通过BLAST同源性比对,采用MEGA 5.0软件基于邻接法构建系统发育树。建树所用的序列为:解淀粉芽孢杆菌(NCBI登陆号:NR_117946),枯草芽孢杆菌(NCBI登陆号:NR_118972),暹罗芽孢杆菌(NCBI登陆号:NR_117274),死亡谷芽孢杆菌(NCBI登陆号:NR_075005),漠海威芽孢杆菌(NCBI登陆号:NR_116186),萎缩芽孢杆菌(NCBI登陆号:NR_118290)等12条序列。
1.5 细胞壁水解酶活性测定
将JT68菌液原液(2×108cfu·mL-1)按照1 000 r·min-1离心15 min后,获得上清液,稀释5倍,采用酶联免疫吸附剂法(Enzyme linked immunosorbent assay,ELISA)测定发酵液中的酶活。蛋白酶试剂盒(货号:SBJ-P270-48T)、纤维素酶试剂盒(货号:SBJ-P271-48T)和几丁质酶试剂盒(货号:SBJ-P1034-48T)均购自南京森贝伽生物科技有限公司,具体步骤参照产品说明书。
1.6 孢子萌发和菌丝生长的抑制作用
挑取3块直径为6 mm的茶树炭疽病菌饼于PDB液体培养基中,置于30℃摇床振荡培养5~7 d后用一层擦镜纸过滤备用。吸取JT68菌株菌液25 µL置于装有凹玻片的已灭菌的培养皿中,培养皿中垫湿润的滤纸。然后吸取等量的病原菌孢子悬液于凹玻片上,轻微振荡、摇匀。另以无菌水代替菌液作为空白对照。将摇匀的培养皿放置在21℃恒温培养箱中,黑暗处理24 h[12]。试验设3次重复。处理后取出凹玻片吸取混合液于血球计数板上,稀释至孢子浓度为每毫升1×106个时在显微镜下计数,统计分生孢子总数以及萌发的分生孢子数,计算分生孢子萌发率以及菌液对分生孢子萌发的抑制率。以孢子萌发的芽管超过孢子长度一半为萌发标准[13],按以下公式计算分生孢子平均萌发率和菌液对孢子萌发的抑制率:
萌发率=(已萌发的分生孢子数/分生孢子总数)×100%
抑制率=[(对照萌发率-药剂处理萌发率)/对照萌发率]×100%
在PDA平板上滴加50 µL均匀涂布JT68菌液,待半干时覆盖一层灭菌玻璃纸,排除气泡使之平整,培养基中间接种茶炭疽菌菌饼。空白组处理操作同上,但不涂菌液,放置于28℃恒温箱中培养5 d。试验设置3次重复。观察时撕下玻璃纸,剪取少量最外缘菌丝于显微镜下观察,以保证真实的菌丝状态。
1.7 挥发性有机物的抑菌效果和物质鉴定
在LB平板上滴加50 µL JT68菌液(2×108CFU·mL-1),涂布均匀,晾干待用。另在PDA平板中心接种一个茶炭疽病菌菌块。再将两个平板对扣,并用封口膜密封,以等量无菌水涂布LB平板为空白对照,设3组重复,放在28 ℃恒温箱培养1周,记录茶炭疽病菌菌落直径。计算相对抑制率:RI=(0-)/0×100%,其中RI为相对抑制,0为对照组菌落净生长量,为处理组菌落净生长量。
将JT68菌种接种于100 mL LB液体培养基中,在30℃ 200 r·min-1条件下恒温振荡培养48 h,得到菌液。瓶口不加塞,用三层灭菌锡箔纸封口并用橡筋扎紧,锡箔纸边缘用封口膜密封,以免发酵产生的挥发物漏出。以不加细菌的LB培养基为空白对照组。将菌液连瓶送至华南农业大学科技楼色谱分析室,采用顶空固相微萃取法对三角瓶内的顶空气体成分进行分析。将萃取头插入顶空瓶中40℃顶空吸附挥发性物质40 min后,立即插入GC-MS进样口,在240℃下解吸附5 min后,进行GC-MS分析。色谱条件:采用Agilent 19091S-433UI HP-5ms Ultra Inert色谱柱(30 m×250 µm×0.25 µm);色谱程序:初始温度50℃;以10℃·min-1升至200℃,保持5 min;以5℃·min-1升至220℃,保持10 min。质谱条件:电子轰击(EI)离子源,检测器电压350 V,离子源温度200℃,传输线温度250℃,电子能量70 eV,扫描质量范围35~350 m/z。试验设置重复3次。
1.8 纯品体外拮抗验证
在每个培养皿中放入直径1 cm的滤纸片,分别加入100 μL的2-丙酮、2-壬酮和2-癸酮,对照组盖子里加入100 μL灭菌水,另一个PDA培养基中央接种直径为6 mm的茶树炭疽病菌饼。将两个平板对扣并用封口膜密封,设3组重复,放至28℃恒温箱培养1周,记录茶炭疽病菌菌落直径并计算相对抑制率。
1.9 茶炭疽病室内抑菌效果测定
选取茶树芽尖下第4叶,保证长势一致无病害,叶片清洗干净,并晾干用75%的酒精浸泡约5 s,浸泡时间不可过长以免灼伤叶片,再用无菌水清洗3次,放至无菌超净台处晾干。取菌悬液原液(2×108cfu·mL-1)和10倍、100倍稀释液进行试验,每个样品处理3张叶片,设置5个重复。以无菌水为空白对照组。每组菌液分别按1∶1 000加入50%的曲拉通表面活性剂,有助于生防菌在叶片上充分展开,分布均匀。用无菌棉蘸取菌液均匀涂抹在叶片正反面,放入人工气候箱中培养一晚,培养条件为湿度95%、温度26℃。第2天进行接种,每片叶片叶脉左右两侧各对称接种2次,用接种针轻轻扎伤叶片(不刺破)。上方左右两个位置分别接种1个空白培养基和1个茶炭疽菌菌饼,下方左右位置分别接种1个炭疽菌饼和1个空白培养基。用湿润无菌脱脂棉花覆盖保湿。接种叶片平摊放入人工气候箱中培养,培养条件为湿度95%,温度26℃,12 h光暗交替。每天观察叶片症状,记录20 d生长情况,测量病斑直径,利用Photoshop软件计算面积,统计各处理组的相对抑制率:
相对抑制率=(对照组病斑面积-处理组病斑面积)/对照组病斑面积×100%
1.10 JT68抗菌谱检测
采用PDA培养基将稻瘟病菌()、香蕉枯萎病菌(f. sp.)、大丽轮枝菌()、齐整小核菌()、辣椒炭疽病菌()、希金斯炭疽菌()、瓜疫霉病菌()及立枯丝核菌(AG1-IA)8种供试病原真菌于25℃培养7 d,用直径为6 mm的打孔器在菌落边缘打取菌饼,分别接种至PDA平板中央,采用上述五点对峙法检测JT68抑菌谱。试验设置3个重复。抑菌率计算如前所述。
1.11 数据分析
试验数据采用SPSS 20.0软件进行统计分析,应用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 生防菌株的筛选
对峙培养的结果表明,采用五点对峙法、点线对峙法和两点对峙法的抑菌率分别为80.94%、74.46%和74.68%(图1),表明JT68菌株的菌液对茶炭疽病菌具有较高的抑菌效果。
2.2 JT68菌株的鉴定
2.2.1 JT68的形态鉴定
在LB固体培养基上,JT68菌株菌落呈白色圆形,边缘不规则,表面光滑、湿润、黏稠,不易挑起。革兰氏染色为阳性,菌体杆状,有芽孢,初步鉴定该菌株可能为解淀粉芽胞杆菌属sp.(图2)。
2.2.2 JT68的生理生化性质
经检测JT68能利用蔗糖、果糖、甘露醇和麦芽糖,接触酶反应、运动性测定、淀粉水解、V-P试验、硝酸盐还原、明胶液化等生理生化试验呈阳性,不能利用葡萄糖和乳糖,需氧,氧化酶反应、甲基红试验、硫化氢试验等呈阴性(表1)。根据细菌学鉴定手册判定该菌为芽孢杆菌属()。
2.2.3 JT68的分子生物学鉴定
JT68菌株的16 S rDNA基因PCR产物为一条约1 500 bp的片段,将测序结果进行BLAST同源性比对,结果显示JT68菌株的16 S rDNA基因长度为1 304 bp,将该序列提交到NCBI网站,登录号为MK928420。BLAST比对发现其与解淀粉芽孢杆菌()、枯草芽孢杆菌()、暹罗芽孢杆菌()、死亡谷芽孢杆菌()、漠海威芽孢杆菌()、萎缩芽孢杆菌()的16 S rDNA序列相似性高。选取12株同源性较高的不同物种的基因序列进行系统进化树构建(图3),结果表明JT68菌株与解淀粉芽孢杆菌()聚为一支,置信度高。
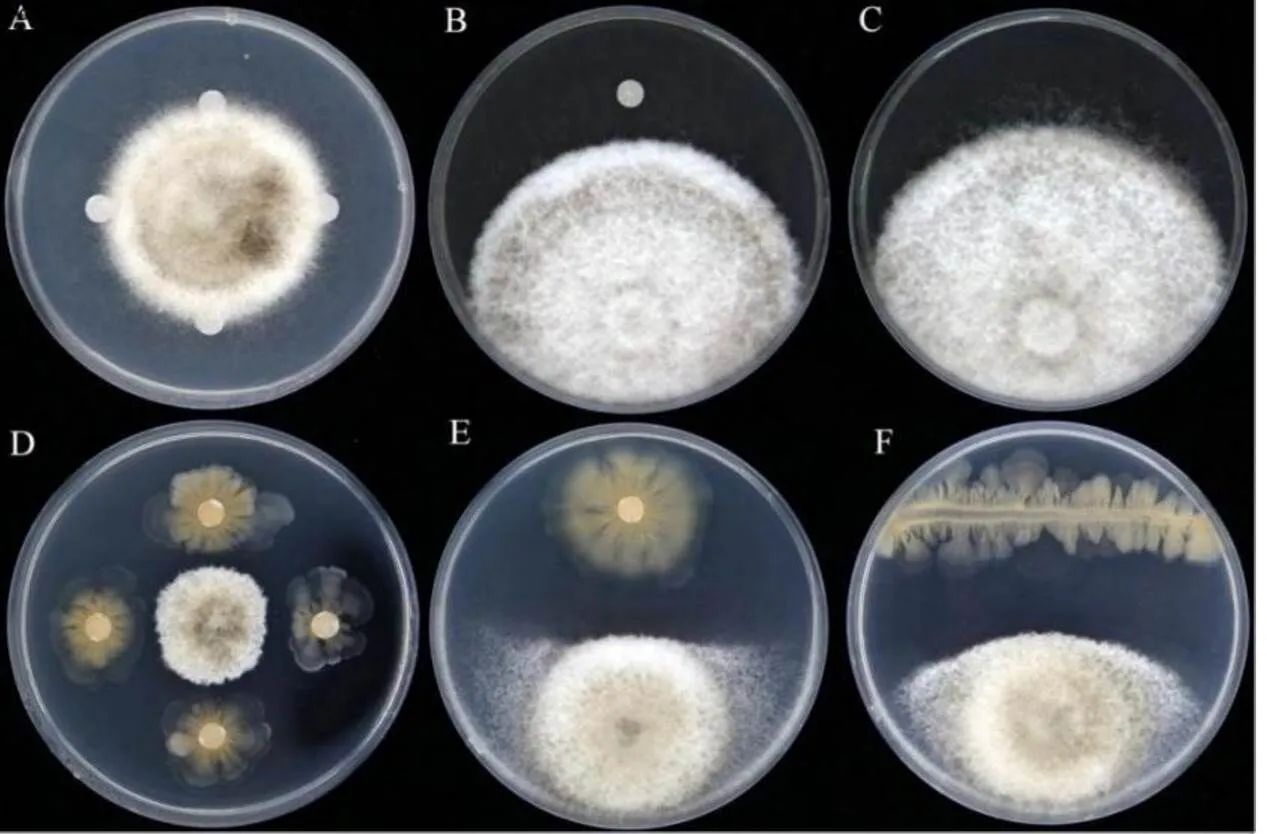
注:A、B、C为对照;D、E、F为JT68对茶炭疽菌的抑菌效果

图2 JT68的菌落图(A)、形态图(B)和革兰氏染色(C)

表1 JT68菌株的生理生化特性
注:+,阳性;-,阴性
Note: +, positive. -, negative
综合分子鉴定与生理生化鉴定结果,最终确定JT68菌株为解淀粉芽孢杆菌()。
2.3 JT68菌液中细胞壁水解酶活性
蛋白酶、纤维素酶及几丁质酶是真菌细胞壁的主要水解酶,通过检测发现JT68发酵液中它们的活性分别为591.6 mU·L-1、127.65 U·L-1和190.85 U·L-1(图4)。
2.4 JT68对茶树炭疽病菌孢子和菌丝的影响
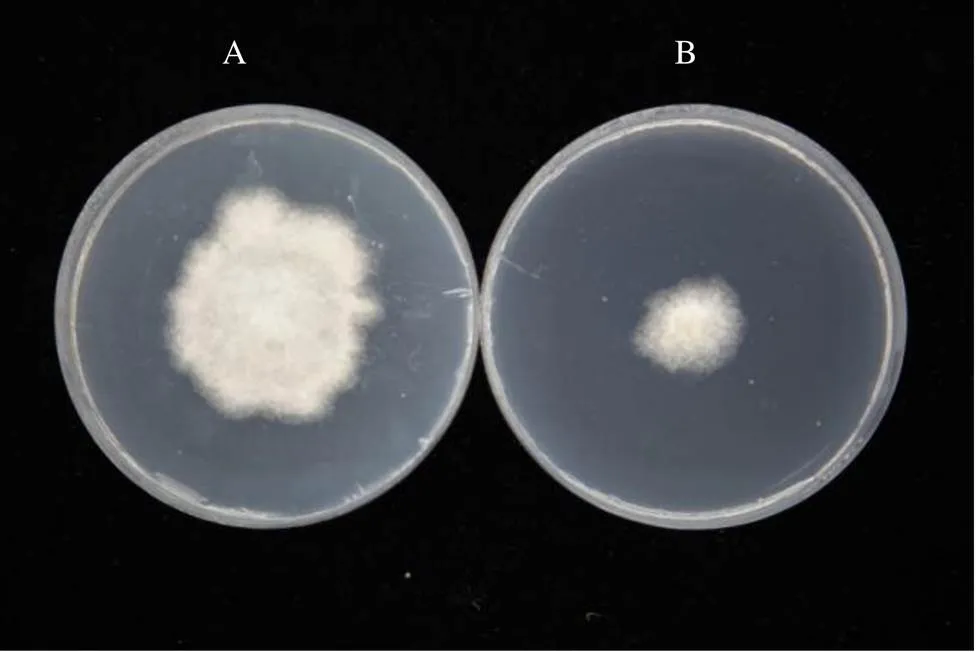
JT68菌液能显著抑制分生孢子的萌发。光学显微镜观察发现,对照组的茶炭疽菌孢子萌发率为61.1%(图5-A)。用JT68菌液处理后的孢子萌发率极低,在视野中仅能找到几个萌发孢子,萌发率近为1%(图5-B),说明JT68菌液可以完全抑制茶炭疽病菌的萌发。菌丝处理的结果发现,对照组菌丝宽度为8.0~9.0 µm,处理组菌丝形态发生了显著的变化,菌丝萎缩变细且在隔膜处膨大,菌丝宽度仅有4.0~5.0 µm(图5-C)。还可见胞质外泄,菌丝中心或顶端形成隔膜且菌丝近末端膨大形成厚垣孢子(图5-D),并随着培养时间增长厚垣孢子数逐渐增多。
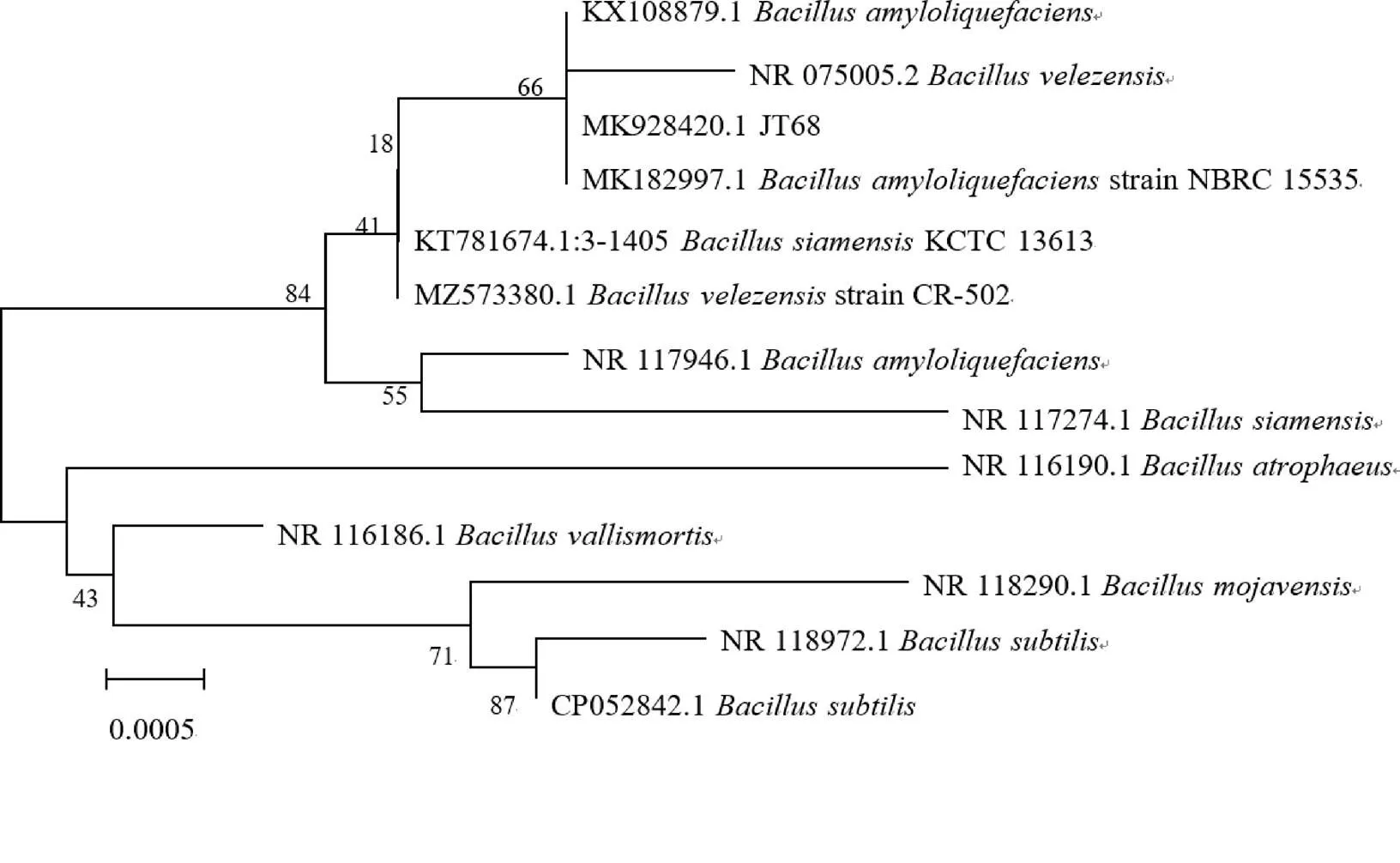
图3 菌株JT68的系统发育树

注:A:蛋白酶;B:纤维素酶;C:几丁质酶
2.5 JT68菌株挥发性有机物对菌丝的抑制效果和鉴定
通过对扣试验发现,JT68菌液产生的挥发性物质对茶炭疽病菌抑制率为50.73%(图6)。采用气相色谱-质谱联用技术对JT68发酵过程中的挥发性物质进行分析,从30℃条件下发酵2 d的JT68菌液中鉴定出6种主要的挥发性有机化合物,均与NIST谱库中检测到的物质具有较高的相似指数(SI)≥80%。这些化合物主要包括烷烃和酮类(表2),其中2-庚酮、2-壬酮和2-癸酮的含量最多,分别为24.176 8%、7.698 5%和1.344 7%。

注:A:以无菌水为空白对照中茶炭疽菌孢子正常萌发;B:JT68菌液处理后对茶炭疽菌的影响;C:PDA平板上正常生长的茶炭疽菌菌丝形态;D:JT68菌液处理后PDA平板上茶炭疽菌的菌丝形态
2.6 有机物纯品对菌丝的抑制效果
对JT68菌液挥发性有机物测定中含量最高的2-庚酮、2-壬酮和2-癸酮的抑菌效果进行测定。对扣试验结果表明,3种有机物纯品对炭疽菌均有显著的抑菌效果,抑菌率均达80%以上(表3)。
2.7 JT68菌液对茶叶炭疽病的抑制作用
离体接种试验表明,空白对照组的茶叶发病较快,接种3 d后叶片出现深棕色病斑,发病率为100%,20 d后病斑面积为2.06 cm2。JT68发酵原液处理组显著抑制病斑发展,叶片病斑面积明显减小,20 d后病斑面积为0.35~0.56 cm2且随着生防菌液浓度的增加而减小;菌液稀释100倍、稀释10倍和原液的条件下对茶炭疽病的相对抑制率分别为72.66%、79.70%和83.20%(表4、图7),表明该菌株菌液对茶炭疽病的防治效果很好。
2.8 JT68对不同病原真菌的广谱抑菌作用
五点对峙法检测结果显示,菌株JT68可以完全抑制稻瘟病菌、大丽轮枝菌、齐整小核菌的菌丝生长,抑菌率达100%。对希金斯炭疽菌、香蕉枯萎病菌、辣椒炭疽病菌的抑菌率分别为93.2%、70.3%和79.7%(图8、表5)。但对瓜疫霉病菌及立枯丝核菌没有抑菌作用。
注:A:空白对照;
B:JT68挥发性有机物处理
Note: A: Blank control.
B:treated with VOCs of JT68
图6 JT68菌株挥发性有机物对茶炭疽菌的抑制作用
Fig. 6 Inhibitory activity of VOCs from bacteria strain JT68 to

表2 JT68菌株挥发性有机物成分鉴定结果
注:只列出了相似指数≥80%的成分,微量成分也在JT68挥发物中检测到但未列在表中
Notes: Only components with similarity index≥80% were listed, and micro constituents were also detected in JT68 volatiles but not listed in the table

表3 3种有机物纯品的抑菌效果
注:表中数据为平均值±标准差
Note: The data are mean±SD

表4 茶炭疽菌活体接种病斑面积和抑制率
注:表中数据为平均值±标准差,同行数据后不同小写字母表示差异显著(<0.05)
Note: The data are mean±SD. Lowercase letters in the same row mean significant difference (<0.05)

注:A为清水对照组,B为生防菌液稀释100倍,C为生防菌液稀释10倍,D为生防菌液原液。黑色箭头表示接种病原菌,白色箭头表示接种水琼脂
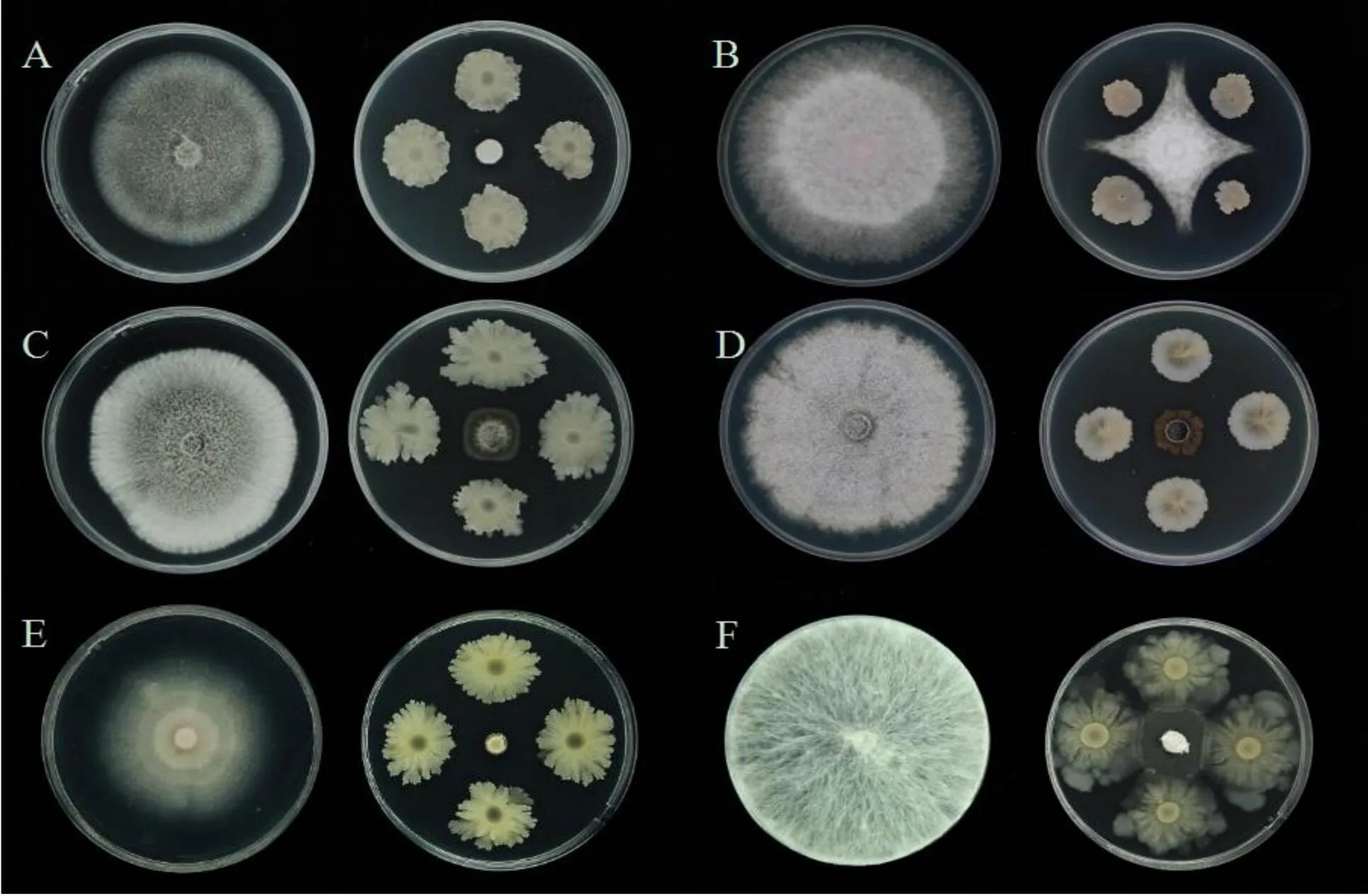
注:A为稻瘟病菌,B为香蕉枯萎病菌,C为辣椒炭疽病菌,D为希金斯炭疽菌,E为大丽轮枝菌,F为齐整小核菌

表5 JT68菌对其他病原真菌的抑菌率
3 讨论
随着人们生活水平的提高,饮食安全受到广泛关注。茶原产于中国,是世界上最受欢迎的饮料之一。茶叶产品中的化学残留物严重影响人们健康,生物防治方法可以减少化学农药的使用[14-16]。生物防治的目的是应用生物体或其活性成分来实现病害的防控。茶叶产品直接从茶叶和茶芽中提取,因而植物病害生物防治在有机茶生产的病害控制中至关重要[17]。在本研究中,从茶树根际土壤中筛选获得一株具有生防潜力的菌株并进行鉴定,评估其对茶炭疽病的防效。
目前,解淀粉芽孢杆菌因其优越的生防潜力和在恶劣环境条件下的高稳定性而广泛应用在生物防治产品。解淀粉芽孢杆菌的抑菌作用主要作用方式包括抗菌化合物的产生、生物膜的空间竞争、植物激素的产生、细胞外细胞壁降解酶分泌和诱导植株抗性[18-22]。本研究中,菌株JT68可以合成抗菌化合物,从而抑制炭疽病菌菌丝生长和孢子萌发,对茶炭疽病菌的抑菌率达80%左右。其菌液还可以完全抑制稻瘟病菌、大丽轮枝菌和齐整小核菌菌丝的生长,且对希金斯炭疽菌、香蕉枯萎病菌、辣椒炭疽病菌的抑菌率达到70.3%~93.2%,表明该菌株产生的抑菌物质抑菌谱广、抑菌效果好。
由于病原菌分生孢子萌发和菌丝的生长发育在病原入侵寄主植物中起着关键作用,研究发现JT68菌液几乎完全抑制了茶炭疽菌分生孢子的萌发,菌丝发育变态且在菌丝中心形成厚垣孢子,在植物叶片或果实采后炭疽病防治中具有巨大的生防潜力。从JT68发酵液中检测出3种重要的细胞壁降解酶的酶活性,其中包括蛋白酶、纤维素酶和几丁质酶,发酵液中酶活性为591.6 mU·L-1、127.65 U·L-1和190.85 U·L-1。众所周知,生防细菌可以分泌细胞壁降解酶来降解真菌细胞壁,导致真菌病原体竞争活性下降[23]。真菌细胞壁由几丁质、葡萄糖、多糖和粘多糖、蜡和色素组成[24]。蛋白酶与细胞壁的外蛋白层结合,打开蛋白质结构,暴露内葡聚糖层和几丁质微原纤维。纤维素酶将纤维素分子分解为单糖,如葡萄糖或其他低聚糖。几丁质酶溶解并消化几丁质及其衍生物,形成乙酰葡萄糖胺,分解真菌的细胞结构[25]。由于JT68使病原真菌缺乏营养物质,菌丝受其他生理和环境胁迫的影响,形成了厚垣孢子[26]。JT68分泌的细胞壁降解酶可能会导致细胞质渗漏。另外,JT68的代谢物可能导致菌丝死亡,破坏菌丝质膜,最终导致细胞内液体蒸发,随后导致菌丝萎缩[27-28]。
植物根部微生物产生的挥发性有机物具有抑制植物病原真菌的生长作用和植物促生作用[29],利用根际挥发物或根际细菌作为生物防治剂具有重要的农业应用前景。据报道,解淀粉芽孢杆菌TJ产生的挥发性有机物对苹果腐烂病菌有强烈的抑制效果,4-乙基苯酚、2-乙基环己酮和反-2-壬烯醛为主要的抑菌有效成分[30]。Gotor-Vila等[31]发现,解淀粉芽孢杆菌CPA-8产生具有抑菌作用的挥发性有机物中的主要有效成分为噻吩,能有效防控樱桃果腐病。赵月菊等[32]发现2-壬酮抑制黄曲霉的生长、孢子的萌发、菌丝形成和毒素产生。本研究中JT68能产生具有抑菌作用的挥发性有机物,对茶炭疽病菌抑制率为50.73%,GC-MS检测发现有效成分主要为庚酮、壬酮等酮类物质,且有研究表明酮类化合物的抗真菌活性与酮类化合物中的碳原子数呈负相关[33],这为熏蒸型生物农药提供了理论基础。
随着国家对农业的支持,微生物肥料在农业中的应用越来越受到重视。JT68菌株对炭疽菌具有巨大的生物防治潜能,有助于进一步加强炭疽菌综合防治,减少化学杀菌剂的使用。在今后的研究中,可以对该菌产生的抑菌物质进行结构和功能鉴定,开发成一种新型抗生素。目前该菌株已由海峡两岸农业科技股份有限公司投产,用于制备微生物肥料,作为茶树的专用叶面肥,在贵州、广东等省份的茶区推广近2 000 hm2,极大提高了茶树的防病能力,并对茶树的提质增效发挥重要作用。
[1] Ponmurugan P, Baby U I, Rajkumar R. Growth, photosynthetic and biochemical responses of tea cultivars infected with various diseases [J]. Photosynthetica, 2007, 45(1): 143-146.
[2] Wang Y C, Hao X Y, Wang L, et al. Diversespecies cause anthracnose of tea plants ((L.) O. Kuntze) in China [J]. Scientific Reports, 2016, 6(1): 35287. doi: 10.1038/srep35287.
[3] 唐美君. 茶炭疽病的识别与防治[J]. 中国茶叶, 2019, 41(4): 6-8.
Tang M J. Identification and control of tea anthrax [J]. China Tea, 2019, 41(4): 6-8.
[4] Wang Y C, Qian W J, Li N N, et al. Metabolic changes of caffeine in tea plant ((L.) O. Kuntze) as defense response to[J]. Journal of Agricultural and Food Chemistry, 2016, 64(35): 6685-6693.
[5] 吴庆丽, 秦刚, 李慧, 等. 助剂激健与杀菌剂混用对3种茶树病害的防效[J]. 中国植保导刊, 2020, 40(8): 69-71.
Wu Q L, Qin G, Li H, et al. The effect of the mixture of adjuvant Jijian' and fungicides against three diseases on tea [J]. China Plant Protection, 2020, 40(8): 69-71.
[6] 郭迟鸣, 林文珍, 汪文华, 等. 不同生物药剂对茶炭疽病菌和茶轮斑病菌的室内毒力测定[J]. 现代农业科技, 2020(12): 116-117.
Guo C M, Lin W Z, Wang W H, et al. Toxicity Measurement of Different Biological Reagents onand[J]. Modern Agricultural Science and Technology, 2020(12): 116-117.
[7] 向晓龙, 杨文, 刘惠芳, 等. 香茅醇不同旋光异构体对抑制茶炭疽病病菌活性的比较及其协同作用[J]. 茶叶科学, 2019, 39(4): 425-430.
Xiang X L, Yang W, Liu H F, et al. Fungicidal activity comparison and synergetic effect of citronellol optical isomers against[J]. Journal of Tea Science, 2019, 39(4): 425-430.
[8] 刘昌霖. 攸县油茶炭疽病病原菌的分离鉴定与其寄主的互作分析[D]. 长沙: 中南林业科技大学, 2020.
Liu C L. Isolation and identification of anthracnose pathogen fromH.H.Hu and analysis of its host interaction [D]. Changsha: Central South University of Forestry & Technology, 2020.
[9] Sowndhararajan K, Marimuthu S, Manian S. Biocontrol potential of phylloplane bacteriumBMO-111 against blister blight disease of tea [J]. Journal of Applied Microbiology, 2013, 114(1): 209-218.
[10] Dhar P G, Mangar P, Saha A, et al. Evaluation of the biocontrol efficacy of astrain indigenous to tea rhizosphere for the management of root rot disease in tea [J]. Plos One, 2018, 13(2): e191761doi: 10.1371/journal.pone.0191761.
[11] Viswanatham E, Kolandasamy M, Ponnusa P, et al. Evaluation ofspp. for effective management ofcausing red root-rot disease in tea plants [J]. Biological Control, 2015, 89: 75-83.
[12] 宋培玲, 燕孟娇, 张键, 等. 不同杀菌剂对油菜黑胫病菌分生孢子萌发及菌丝生长的抑制作用[J]. 北方农业学报, 2018, 46(3): 70-75.
Song P L, Yan M J, Zhang J, et al. Inhibition of different fungicides on conidia germination and mycelial growth of[J]. Journal of Northern Agriculture, 2018, 46(3): 70-75.
[13] 古丽皮艳, 韩青梅, 王兰, 等. 不同杀菌剂对玉米弯孢叶斑病菌的毒力测定[J]. 西北农林科技大学学报(自然科学版), 2005, 33(s1): 49-52.
Gulipiya, Han Q M, Wang L, et al. Determination of different fungicidesʾ effect on[J]. Journal of Northwest A&F University(Natural Science Edition), 2005, 33(s1): 49-52.
[14] Wang J, Cheung W, Leung D. Determination of pesticide residue transfer rates (percent) from dried tea leaves to brewed tea [J]. Journal of Agricultural and Food Chemistry, 2014, 62(4): 966-983.
[15] Cao Y L, Tang H, Chen D Z, et al. A novel method based on MSPD for simultaneous determination of 16 pesticide residues in tea by LC-MS/MS [J]. Journal of Chromatography B, 2015, 998/999: 72-79.
[16] Zhang X Z, Cui X, Wang X R, et al. Residue dissipation, transfer and safety evaluation of picoxystrobin during tea growing and brewing [J]. Journal of the Science of Food and Agriculture, 2020, 101(1): 194-204.
[17] Nobutaka S. Biological control of fungal plant diseases using antagonistic bacteria [J]. Journal of General Plant Pathology, 2008, 74(6): 459-460.
[18] Choudhary D K, Johri B N. Interactions ofspp. and plants: with special reference to induced systemic resistance (ISR) [J]. Microbiol Res, 2009, 164(5): 493-513.
[19] Qin Y X, Han Y Z, Yu Y Q, et al. Complete genome sequence ofL-S60, a plant growth-promoting and antifungal bacterium [J]. J Biotechnol, 2015, 212: 67-68.
[20] Gowtham H G, Murali M, Singh S B, et al. Plant growth promoting rhizobacteria-improves plant growth and induces resistance in chilli against anthracnose disease [J]. Biological Control, 2018, 126: 209-217.
[21] 梁丽琼, 黄少莉, 邵杭, 等. 水稻基腐病菌拮抗菌解淀粉芽孢杆菌E3菌株的鉴定及抑菌活性[J]. 华南农业大学学报, 2021, 42(4): 51-62.
Liang L Q, Huang S L, Shao H, et al. Identification of an antagonistic strainE3 againstand its antimicrobial activity [J]. Journal of South China Agricultural University, 2021, 42(4): 51-62.
[22] 陆景倩, 郎剑锋, 杨秋侠, 等. 解淀粉芽孢杆菌对植物土传病害的作用机制[J]. 湖北农业科学, 2021, 60(12): 5-10.
Lu J Q, Lang J F, Yang Q X, et al. Mechanism of Bacillus amyloliquefaciens on plant soil-borne disease [J]. Hubei Agricultural Sciences, 2021, 60(12): 5-10.
[23] Sietske A, Diderichsen B. On the safety ofand: a review [J]. Appl Microbiol Biotechnol, 1991, 36(1): 1-4.
[24] David J A. Fungal cell wall chitinases and glucanases [J]. Microbiology, 2004, 150(7): 2029-2035.
[25] Anupama S, Razia S, Jong-chan C, et al.C25 which is rich in cell wall degrading enzymes efficiently controls lettuce drop caused by[J]. European Journal of Plant Pathology, 2015, 142(3): 577-589.
[26] Harish S, Manjula K, Podile A R.is resistant to the mycolytic activity of a biocontrol strain ofAF 1 [J]. FEMS Microbiology Ecology, 1998, 25(4): 385-390.
[27] Li Y, Guo Q, Wei X, et al. Biocontrol effects ofagainst monkshood (.) root diseases caused byandspp. [J]. Journal of Applied Microbiology, 2019, 127(5): 1532-1545.
[28] 宋利沙, 蒋妮, 张占江, 等. 草珊瑚炭疽病拮抗细菌的鉴定及其抑菌机理[J]. 微生物学通报, 2020, 47(10): 3266-3276.
Song L S, Jiang N, Zhang Z J, et al. Identification of antagonistic bacteria against anthracnose of[J]. Microbiology China, 2020, 47(10): 3266-3276.
[29] 李艳玲, 宋阿琳, 卢玉秋, 等. 不同土壤玉米根际挥发性有机物组成和微生物群落特征[J]. 植物营养与肥料学报, 2019, 25(10): 1633-1645.
Li Y L, Song A L, Lu Y Q, et al. Volatile organic compound compositions and microbial community properties in maize rhizosphere among different soils [J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(10): 1633-1645.
[30] 李娟. 解淀粉芽孢杆菌TJ抑菌物质的研究[D]. 天津: 天津农学院, 2015.
Li J. Study on the antifungal substance of[D]. Tianjin: Tianjin Agricultural University, 2015.
[31] Gotor-Vila A, Teixidó N, Di Francesco A, et al. Antifungal effect of volatile organic compounds produced byCPA-8 against fruit pathogen decays of cherry [J]. Food Microbiology, 2017, 64: 219-225.
[32] 赵月菊, 刘阳, 王瑶, 等, 2-壬醇在抑制禾谷镰刀菌中的应用: CN201610217256.7[P]. 2017-10-20 [2021-09-03].
Zhao Y J, Liu Y, Wang Y, et al, Application of 2-nonanol in the inhibition of: CN201610217256.7 [P]. 2017-10-20 [2021-09-03].
[33] Yuan J, Raza W, Shen Q R, et al. Antifungal activity ofNJN-6 volatile compounds againstf. sp.[J]. Applied and Environmental Microbiology, 2012, 78(16): 5942-5944.
Identification of a Tea Rhizosphere Bacterium and its Biocontrol of Tea Anthracnose Disease
ZHU Yongshan1, LUO Xiaoxin1, LIANG Haoran4, CHEN Zhengtong4, LIU Cheng3, CAO Kai3, LIU Shaoqun2, ZHOU Erxun1, SHU Canwei1, ZHENG Peng2*
1. College of Agriculture, South China Agricultural University/Guangdong Province Key Laboratory of Microbial Signals and Disease Control/Integrative Microbiology Research Center, Guangzhou 510642, China; 2. College of Horticulture, South China Agricultural University, Guangzhou 510642, China; 3. Cross-strait Agricultural Development Research Institute, Zhuhai 519080, China; 4. College of Agriculture, South China Agricultural University, Guangzhou 510642, China
Tea anthracnose () is one of the most important fungal diseases ofworldwide, which causes serious damage to tea growth and production. The control of tea anthracnose is mainly dependent on chemical fungicides. To promote green prevention and control in tea plantation, development of biocontrol agents is critically important. A bacterium named JT68 isolated from tea rhizosphere was identified based on physiological and biochemical analysis and PCR. The inhibition effects of fermented broth JT68 on confrontation culture, mycelia growth and spores germination were determined. The effect of volatile organic compounds (VOCs) of JT68 was tested and the components were identified by GC-MS. The control effect of JT68 was determined using detached leaf method. The results of this study shows that the strain JT68 was identified as. Plate confrontation shows that the inhibition rate of fermentation broth of JT68 againstwas 80.94%. Co-culture shows that the inhibition rate of spore germination ofwas 99.18%, and the mycelia of pathogen shrank and formed chlamydospores. The VOCs of JT68 could inhibit 50.73% mycelia growth of. Ketones such as 2-Nonanone and 2-Undecanone were revealed as major components in VOC through GC-MS analysis. Leaf detached inoculation shows that the relative inhibition rates of the original fermentation broth, 10-fold, and 100-fold dilutions were 83.20%, 79.70% and 72.66%, respectively. Furthermore, our study found that JT68 strongly inhibited the growth of,,,,andwith the inhibition rates of 70.0%- 93.2%. Our study provided a biocontrol agentfrom tea rhizosphere, which showed superior biocontrol effect against. This strain had been applied to develop biofertilizer and widely used in the field, which would reduce the use of chemical fungicide and implement prevention and control in tea plantation.
tea anthracnose,, inhibition effect, biological control
S571.1
A
1000-369X(2022)01-087-14
2021-09-03
2021-10-30
广东省自然科学基金(2021A1515012091)、广州市科技计划(202102020290)、广东省重点领域研发计划(2019B020218009)
朱咏珊,女,本科生,主要从事生物防治研究,13533617512@163.com。*通信作者:zhengp@scau.edu.cn
(责任编辑:赵锋)

