福建野生茶树资源嘌呤生物碱构成评价及特异资源筛选
陈潇敏,赵峰,王淑燕,邵淑贤,吴文晞,林钦,王鹏杰,叶乃兴*
福建野生茶树资源嘌呤生物碱构成评价及特异资源筛选
陈潇敏1,赵峰2*,王淑燕1,邵淑贤1,吴文晞3,林钦4,王鹏杰1,叶乃兴1*
1. 福建农林大学园艺学院/茶学福建省高校重点实验室,福建 福州 350002;2. 福建中医药大学药学院,福建 福州 350122;3. 福建恒正检测技术有限公司,福建 福州 350100;4. 福建省产品质量检验研究院,福建 福州 350014
以43份福建野生茶树种质资源为供试材料,通过超高效液相色谱串联质谱(UHPLC-MS/MS)测定其嘌呤生物碱构成,并经描述统计分析及聚类分析后,系统地分析了其特征属性。结果显示,参试资源样的嘌呤生物碱构成差异明显,大致可划归4个具体类群:类群Ⅰ嘌呤生物碱总量及构成接近于常见茶树品种;类群Ⅱ嘌呤生物碱较高,且主要由咖啡碱构成,仅含少量苦茶碱和可可碱;类群Ⅲ嘌呤生物碱较高,且苦茶碱与咖啡碱含量相当,仅含少量可可碱;类群Ⅳ嘌呤生物碱高,且构成以苦茶碱为主,咖啡碱和可可碱都较低。经综合评价后,从中筛得嘌呤生物碱构成较特异资源14份,包括高嘌呤生物碱(>60 mg·g-1)5份,高咖啡碱(>50 mg·g-1)7份,高苦茶碱(>30 mg·g-1)7份。本研究可为茶树的种质资源保护、创新、品种选育及生产利用提供更多种质资源信息和科学依据。
茶树;种质资源;嘌呤生物碱;苦茶碱;液质联用
茶叶中富含嘌呤生物碱,目前,在茶叶中已发现的含嘌呤生物碱的组分有咖啡碱(Caffeine)、可可碱(Theobromine)、茶碱(Theophylline)和苦茶碱(Theacrine);其中,最为常见且含量较高的是咖啡碱[1-2]。从化学结构上看,它们都属于“黄嘌呤甲基化衍生物”,会通过竞争性抑制磷酸二酯酶,引起环磷腺苷增多和肾上腺素的释放,进而使中枢神经系统兴奋、支气管平滑肌舒张和利尿。但是,它们各自的生物效应的强弱存在一定的差异,例如:兴奋神经作用由强至弱依次为咖啡碱、可可碱、茶碱、苦茶碱;而松弛肌肉的利尿作用强弱顺序却恰好相反[3]。近年,在我国广东乳源[4]、江西聂都[5]、福建蕉城[6]、贵州普安[7]等地发现了一系列因富含苦茶碱而滋味极苦的茶树种质资源。相关研究显示,苦茶碱除了滋味苦外,还具有抗抑郁、镇静催眠和调节脂质代谢等其他药理作用[8-9]。
福建地处亚热带季风气候区,茶树栽培历史悠久,茶树种质资源丰富。俞永明等[10]和詹梓金等[11]曾对福建野生茶树资源的植被类型、自然分布规律以及形态学特征开展了较为系统的调查研究,并在安溪、尤溪、宁德等地发现了特异性野生茶树资源。野生茶树因生长环境独特,保持了原有演化特征,其茶树叶片的形态特征或生化成分构成也常异于栽培品种[12-14],开发潜力大,但目前尚未见从嘌呤生物碱构成角度对其进行研究的报道。
本课题组在茶树种质资源的调查研究中,收集了福建云霄、大田、漳平等产区滋味苦涩的特殊野生茶树资源。对其苦味成因的现有研究显示,富含嘌呤生物碱、儿茶素、花青素、苦味氨基酸以及茶皂素形成的复合物等,都有可能造成茶叶滋味苦涩[15-16]。本研究从嘌呤生物碱构成的角度,对这些滋味苦涩的福建野生茶树进行剖析,旨在为此类野生茶资源的开发利用提供参考。
1 材料与方法
1.1 供试材料
以富含苦茶碱的“凤凰苦茶”作为分析方法优化的材料。其余资源样品分别来源于福建省的云霄、大田、尤溪、蕉城、诏安、漳平和安溪等7个产区,共43份茶树种质资源;2021年3月中旬至4月中旬,采摘春季第一轮茶树新梢的一芽二叶,芽叶色泽基本为绿色,未见黄化、白化和红紫色芽叶。样品信息如表1所示。按照《茶树种质资源描述规范和数据标准》[17]进行采样和固样,采用120℃热风固样,样品粉碎过100目筛后待测。
1.2 嘌呤生物碱测定
1.2.1 仪器与设备
Nexera X2 LC-30A超高效液相色谱仪(Shimadzu公司,日本),串联Sciex 4500 Q-Trap质谱仪(Sciex公司,美国);C18反相色谱柱(2.1 mm×100 mm,2.6 µm)(广州菲罗门公司);AB204-N分析天平(梅特勒公司,美国);超纯水系统(上海和泰仪器有限公司);KQ-800E型超声波清洗器(昆山市超声仪器有限公司);MS3 basic涡旋振荡仪[艾卡(广州)仪器有限公司]。
1.2.2 试剂
色谱纯甲醇购自安谱实验科技股份有限公司,色谱纯乙腈购自上海默克化工技术有限公司,色谱纯甲酸购自国药集团化学试剂有限公司。咖啡碱(CAF,1.0 mg·mL-1标准储备液)、可可碱(TB,纯度≥99.9%)、苦茶碱(TC,纯度≥99%)和茶碱(TP,纯度≥98%)标准品均购自源叶生物科技有限公司。

表1 43份供试茶树种质资源样品信息
1.2.3 标准曲线
分别称取可可碱、苦茶碱、茶碱标准品0.010 g,以50%甲醇溶解后定容至10 mL,得1.0 mg·mL-1标准储备液;咖啡碱为1.0 mg·mL-1安瓿瓶标准储备液。分别取上述4种标准储备液1.00 mL于100 mL容量瓶,以50%(/)甲醇水定容,得10 µg·mL-1混合标准溶液,再次逐级稀释,制备浓度为0.05、0.1、0.15、0.2、0.3、0.4、0.5、1.0、2.0 mg·mL-1的工作曲线。
1.2.4 浸提溶剂优化
以“凤凰苦茶”为试验样品进行方法优化,比较纯水、50%甲醇、70%甲醇、100%甲醇、50%乙醇、70%乙醇和95%乙醇等7种溶剂的浸提效率。具体操作如下,分别称取0.200 g样品,加入25 mL溶剂,涡旋振荡后超声提取30 min,冷却后定容至25 mL,4℃,10 000 r·min-1离心5 min,上清液过0.22 µm有机相微孔滤膜,分别稀释10倍(用于可可碱和茶碱测定)和1 000倍(用于咖啡碱和苦茶碱测定)。
1.2.5 超声提取时间优化
以1.2.4章节优化选择的溶剂,对“凤凰苦茶”进行超声辅助提取(10、20、30 min和45 min)后,按照1.2.4章节的方法处理后测定。
1.2.6 色谱条件
流动相A为0.1%甲酸-水溶液(/),流动相B为乙腈;流速为0.30 mL·min-1;柱温为40℃;进样量为5.0 µL。梯度洗脱条件:0~0.2 min,10% B;0.2~2.5 min,10%~90% B;2.5~4.0 min,90% B;4.0~4.2 min,90%~10% B;4.2~6.0 min,10% B。
1.2.7 质谱条件
质谱条件包括确定各目标物质母离子、子离子、去簇电压、碰撞能量。分别取0.10 μg·mL-1单标工作液,电喷雾源(ESI),正离子模式,气帘气(N2)压力30 psi,电喷雾电压4 500 V,辅助气(N2)温度550℃,喷雾气(N2)压力55 psi,辅助加热气(N2)压力55 psi,质谱注射进样,通过母离子扫描,调节碰撞能量,稳定性好、信号强度高的碎片离子如表2所示,4种嘌呤生物碱的质谱图见图1。
1.2.8 方法学评价
方法的稳定性通过日内重现性和日间重现性进行评价。
日内重现性:称取茶样制备后,同日内连续进样3次,计算相对标准偏差(RSD)。日间重现性:称取茶样制备后,每日测定1次,连续测定5 d,计算RSD。
方法的准确度通过加标回收率试验进行评价。
加标回收率:在供试茶样中分别按低、中、高浓度添加混合标准溶液,3次重复,计算加标回收率和RSD。
1.3 数据分析
每份野生茶树资源均采集3个批次,每个方法条件优化样品均进行3次重复,最终结果以“平均值±标准偏差”表示;使用Origin 2018(美国,OriginLab公司)制作折线图和散点图、Prism 8.0(美国,Graphpad公司)制作柱状图;采用SPSS 19.0(美国,IBM公司)软件对数据进行方差分析、差异显著性检验(<0.05)、描述统计分析及聚类分析。

表2 4种嘌呤生物碱的色谱保留时间和质谱参数
注:a 代表定量子离子,其余为定性子离子
Note: a represents ion pair selected for MRM quantity
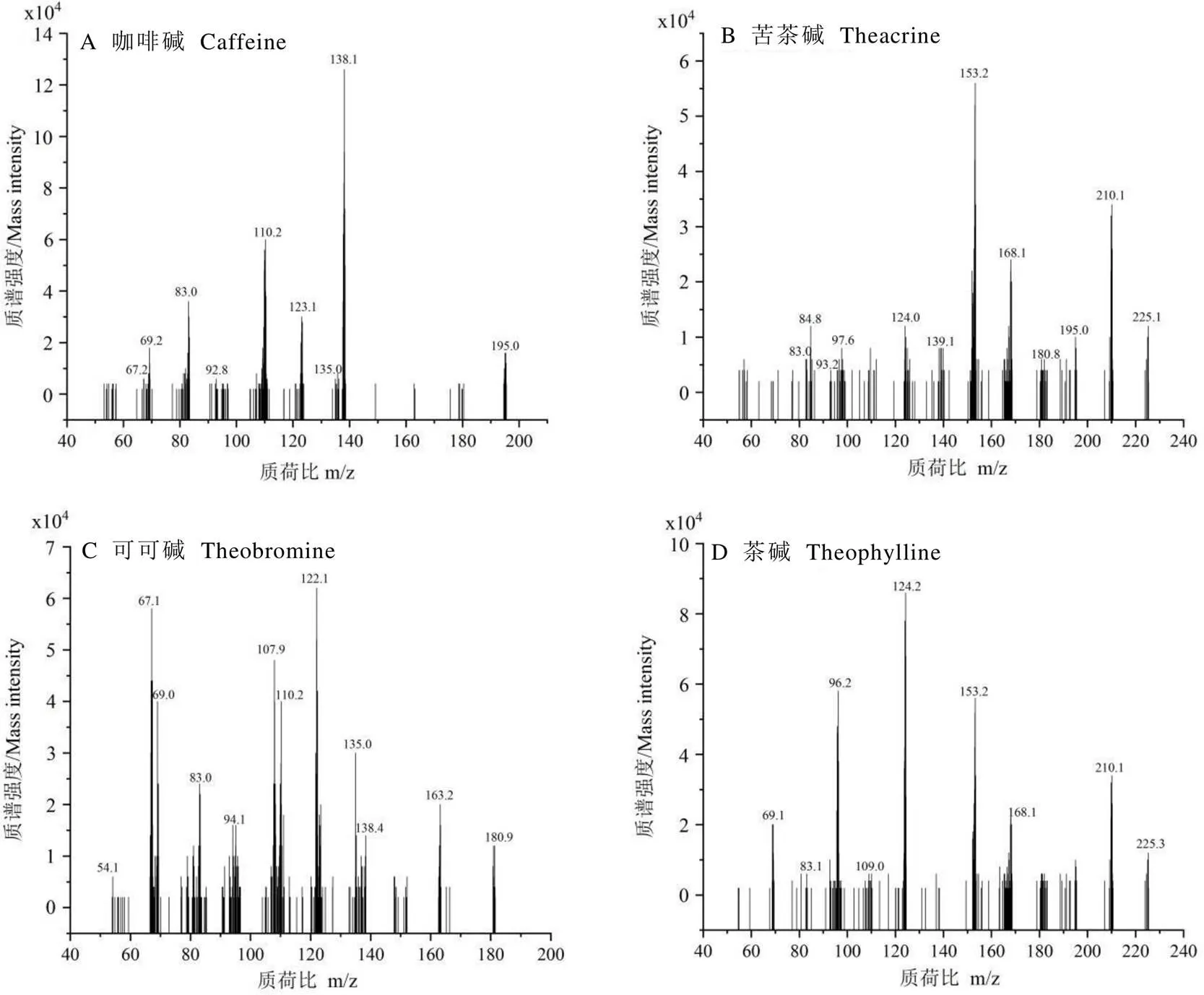
图1 4种嘌呤生物碱质谱图
2 结果与分析
2.1 茶叶嘌呤生物碱测定方法优化
2.1.1 提取溶剂筛选
如图2所示,分别比较水、50%甲醇、70%甲醇、100%甲醇、50%乙醇、70%乙醇和95%乙醇等7种溶剂。50%甲醇、70%甲醇、100%甲醇、50%乙醇、70%乙醇等5种溶剂咖啡碱的提取量较高,提取量显著高于水和95%乙醇(<0.05);50%甲醇、70%甲醇、100%甲醇、70%乙醇等4种溶剂苦茶碱的提取量较高,显著高于水、50%乙醇和95%乙醇的提取量(<0.05);采用100%甲醇作溶剂时可可碱的提取量最高,显著高于其他溶剂的提取量(<0.05)。综上可见,100%甲醇对咖啡碱、苦茶碱和可可碱的提取效率均较高,因此选择100%甲醇作为最终提取溶剂。
2.1.2 超声提取时间
100%甲醇超声提取10、20、30、45 min后,结果如图3所示。
随着提取时间的增加,咖啡碱和苦茶碱的提取量基本呈现逐步增加,至30 min达最高后,开始下降;而可可碱则主要在20 min时略有降低;综合各组分提取结果,选择30 min为最终浸提时间。
2.1.3 标准曲线及方法学评价
表3所示为各嘌呤生物碱的标准曲线及线性范围等相关信息,在试验涉及的浓度范围内,曲线的线性相关性均超过0.99;检出限区间为0.066~1.630 µg·L-1;定量限区间0.219~5.435 µg·L-1。该结果能够满足测试要求。测试结果精密度和准确度的评价结果如表4所示。可知,除茶碱因未检出无法进行评价外,其余目标组分的日内重现性≤3.86%,日间重现性≤4.5%;全部4个目标组分在各加标水平下的回收率达91.03%~100.7%,相对标准偏差≤7.42%。可见,试验结果能够满足测试要求。
2.2 福建野生茶树资源嘌呤生物碱构成分析
2.2.1 嘌呤生物碱种类及含量
普通茶树品种的嘌呤生物碱总量约占干物质的2%~5%,构成上以咖啡碱占比最大(2%~4%),可可碱次之(0.05%),茶碱往往较低(0.002%)[1]。苦茶碱是一种较特殊的嘌呤生物碱,多发现于特异性茶树种质资源中,普通品种中基本不含。

注:图中不同小写字母表示不同提取溶剂间差异显著(P<0.05)

注:图中不同小写字母表示不同提取时间间差异显著(P<0.05)

表3 嘌呤生物碱的标准曲线、相关系数、线性范围、检出限和定量限
注:以3倍信噪比计算检出限(LOD),以10倍信噪比计算定量限(LOQ)
Note: LOD was calculated by 3 times signal-to-noise ratio, LOQ was calculated by 10 times signal-to-noise ratio
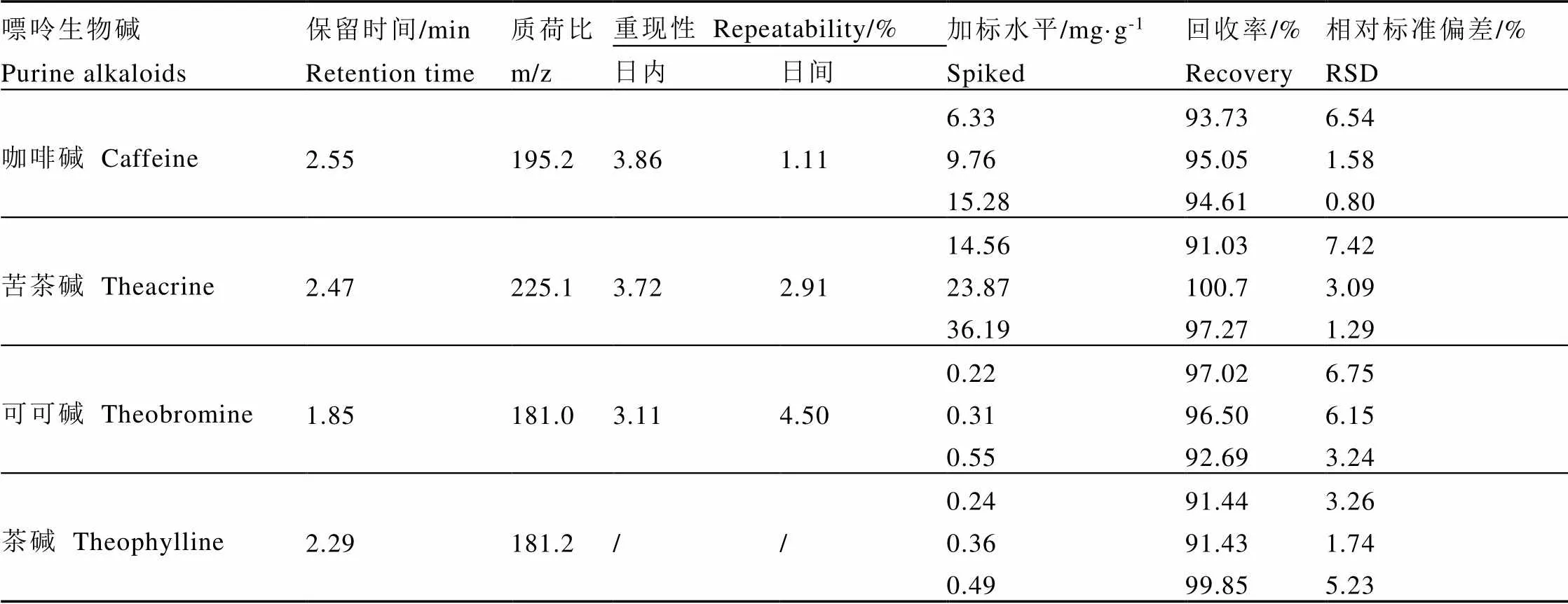
表4 嘌呤生物碱测试方法的精密度和准确度
表5所示为本研究中43份福建野生茶树资源的嘌呤生物碱的描述统计分析结果,可知,全部参试样品均含咖啡碱和可可碱,且均未检出茶碱。其中,27份含苦茶碱;咖啡碱、可可碱和苦茶碱含量差异较大。总嘌呤生物碱含量较高的野生茶树资源依次为:ZP11、YX03、DT03、ZP01、ZP10。
2.2.2 系统聚类分析
以Ward法对43份福建野生茶的嘌呤生物碱构成进行系统聚类分析,如图4所示,当距离取5时,上述资源可被归为4个类群,按照类群对其嘌呤生物碱进行描述统计分析(表6)。
第Ⅰ类群共20份茶树种质资源,其嘌呤生物碱总量及构成接近于常见品种茶树。该类群的嘌呤生物碱总量均值为43.55 mg·g-1,其中,咖啡碱、苦茶碱、可可碱分别为22.60~48.43、0~13.09、0.51~5.60 mg·g-1。涉及的种质资源包括诏安(9份)、漳平(4份)、尤溪(3份)、云霄(3份)和安溪(1份)。
第Ⅱ类群共7份茶树种质资源,其主要特征是嘌呤生物碱较高,且主要由咖啡碱构成,仅含少量苦茶碱和可可碱。该类群的咖啡碱含量均值为55.09 mg·g-1,其中咖啡碱最高的DT03含量达68.71 mg·g-1。
第Ⅲ类群共7份茶树种质资源,其主要特征是嘌呤生物碱较高,且苦茶碱与咖啡碱含量相当,仅含少量可可碱。该类群的苦茶碱含量均值为26.29 mg·g-1,咖啡碱含量均值为31.89~45.14 mg·g-1主要来源包括云霄(2份)、大田(2份)、漳平(3份)。
第Ⅳ类群包含9份资源样,其主要特征嘌呤生物碱高,且构成以苦茶碱为主,咖啡碱和可可碱都较低。咖啡碱平均含量为13.78 mg·g-1,苦茶碱平均含量为28.69 mg·g-1,JC01、JC02含有极低的咖啡碱,分别为0.52、4.01 mg·g-1,而它们的苦茶碱含量均高于20 mg·g-1,分别为22.77、23.12 mg·g-1。DT05为本研究中苦茶碱含量最高的种质资源,为41.22 mg·g-1,而咖啡碱含量仅为16.18 mg·g-1。
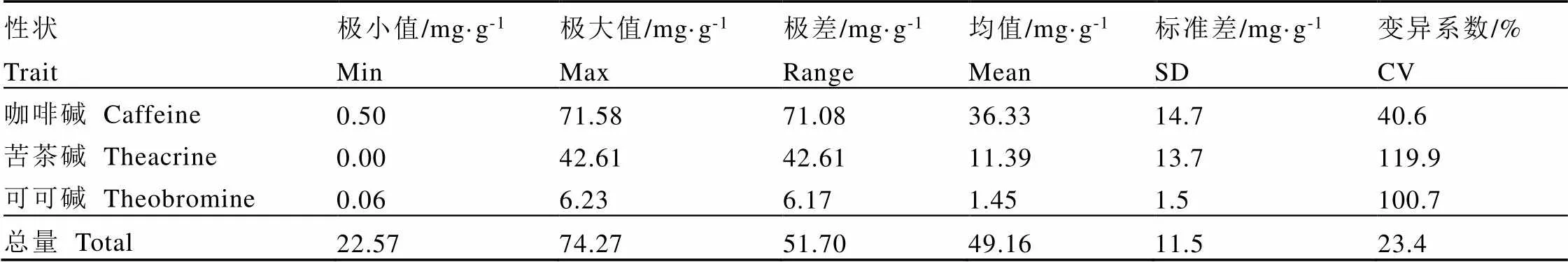
表5 福建野生茶树资源嘌呤生物碱含量的描述统计分析

图4 43份福建野生茶树资源嘌呤生物碱含量聚类图
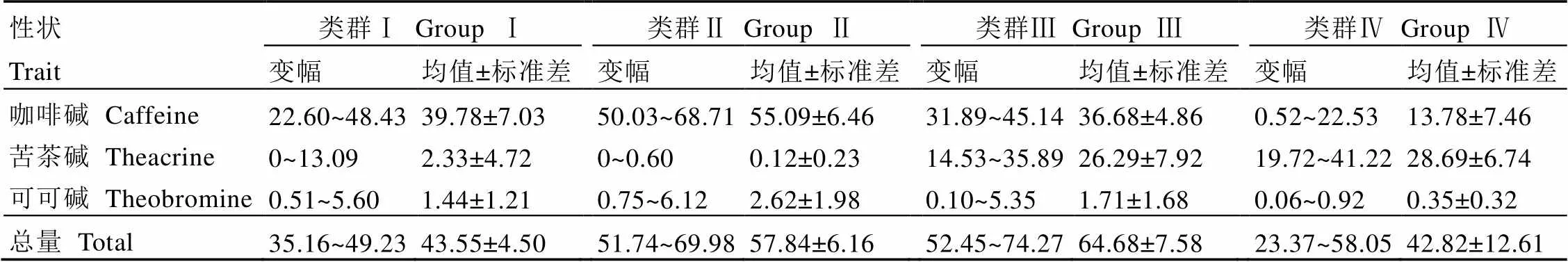
表6 43份福建野生茶树资源各类群嘌呤生物碱含量特征表
从产区角度观察其所属的群类后,发现来自诏安的10份资源中,9份属于第Ⅰ类群;蕉城的3份资源均属于第Ⅳ类群。而漳平的10份资源在4个类群中均有分布;其次为云霄和大田,各自6份资源,在3个类群中均有分布;尤溪的6份资源主要分布于两个类群(第Ⅰ类群和第Ⅱ类群)。
2.2.3 特异性福建野生茶树资源筛选
在聚类分析的基础上,按照嘌呤生物碱总量大于60 mg·g-1、咖啡碱大于50 mg·g-1和苦茶碱大于30 mg·g-1等3个标准,从43份福建野生茶树种质资源中获得了嘌呤生物碱构成特异的资源14份,具体如表7所示。
3 讨论
3.1 与现有其他方法的比较
图5为标准溶液(浓度为500 μg·mL-1的混合标准品)及典型样品测定的总离子流图,因4种嘌呤碱的化学结构相近,所以它们在色谱上的保留时间也较接近。当使用二极管阵列检测器进行测定时,需要耗费大量的时间对色谱分离条件进行优化,以达到基线分离,进而避免由于峰叠加而导致定量结果偏差[18-25],其余现有方法的分离耗时如表8所示,最长甚至需要耗时65 min。
通过比较还可以看出,本研究构建的UHPLC-MS/MS方法在嘌呤碱的种类、检出限、定量限和线性范围区间上均优于其他文献方法。特别是由于应用了质谱检测器,实现了在目标物未完全实现基线分离的条件下,进行准确的定性和定量。根据方法学评估结果(表3和表4),在试验的浓度范围内,各目标物质的线性相关和回收率等均良好。相较于二极管阵列检测器,质谱对于化合物的定性具有无可比拟的优势,且在检出限上也具备了突出的优势(表8),加之本方法使用了超高效液相色谱,使得分析的时间被进一步压缩至6 min,特别适用于高通量资源样品的嘌呤生物碱组分测定。
3.2 福建野生茶树资源嘌呤生物碱构成
在本研究中,系统聚类根据43份野生茶树资源的嘌呤生物碱构成特征,将其划分为4个类群,从各类的构成特点上分析,第Ⅰ类群资源的生物碱总量30~50 mg·g-1,基本与普通品种茶树相似;第Ⅱ类群和第Ⅲ类群为高咖啡碱、高苦茶碱种质资源,从测定结果上看,福建资源群体的苦茶碱含量明显高于广东(除乳源群体外)、江西和贵州[4-5,7,20];第Ⅳ类群,属于高苦茶碱低咖啡碱资源,此类群资源可作为筛选低咖啡碱茶树的天然材料。
近年来,随着对苦茶碱保健功效关注度的增加,其相关天然茶树资源的发掘也日益受到重视[26-28],参试的43份野生茶树资源中,有27份含有苦茶碱,特别是大田采集的6份样中均含有苦茶碱,且含量较高,特别突出的DT05,其苦茶碱含量甚至超过了40 mg·g-1。
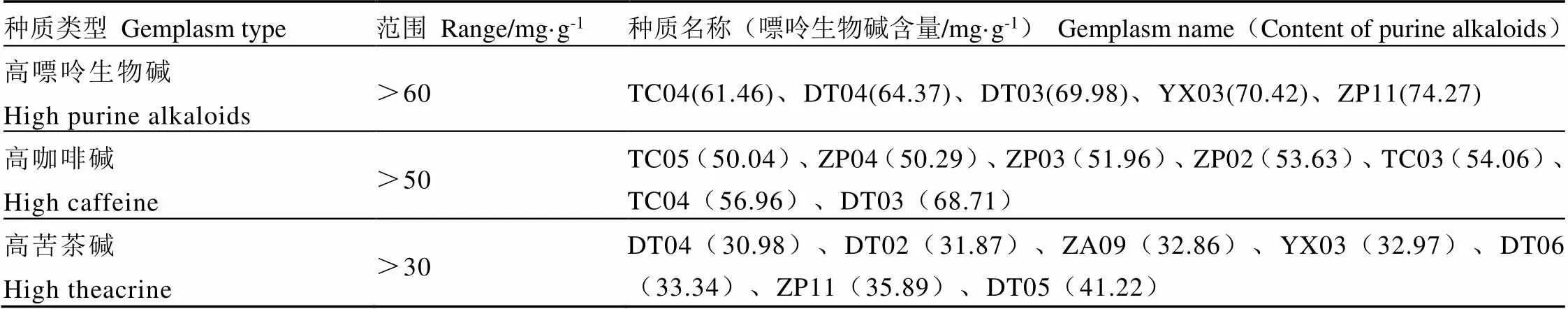
表7 嘌呤生物碱含量特异的种质资源
注:括号内数据为各资源对应的生化成分含量
Note: The data in brackets are the content of biochemical components corresponding to each resource

注:峰号1、2、3、4分别对应的组分为可可碱(TB)、茶碱(TP)、苦茶碱(TC)和咖啡碱(CAF)
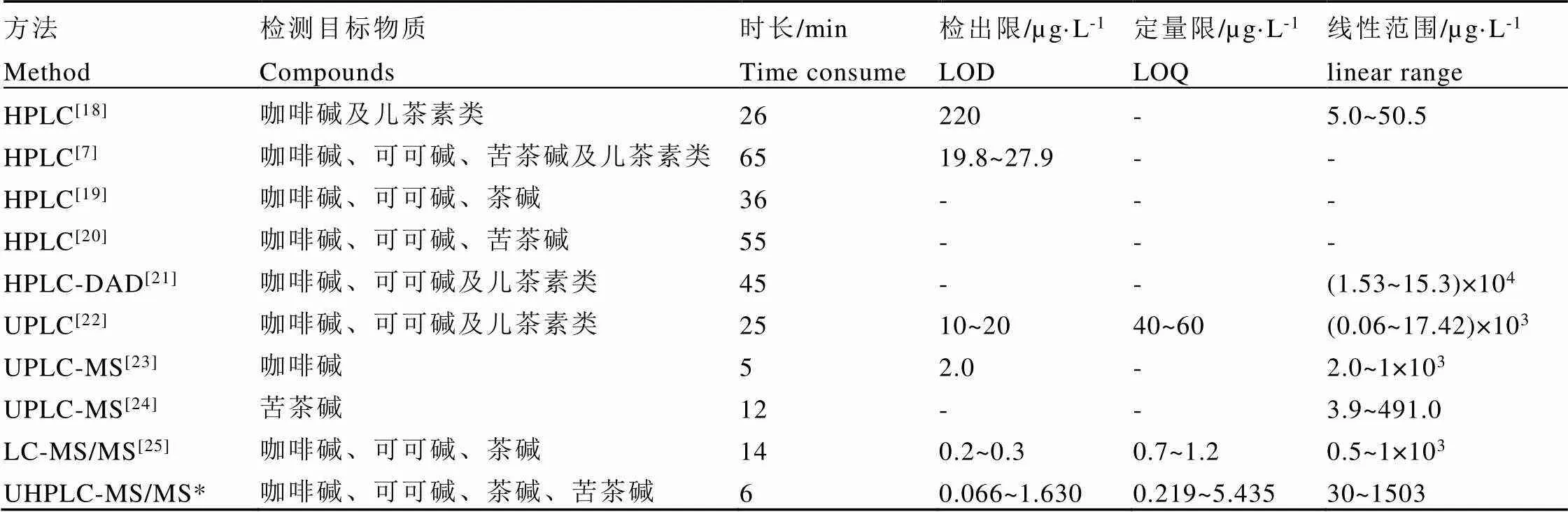
表8 茶叶中嘌呤生物碱检测方法
注:*为本研究构建方法,其他为文献方法
Note: * refer to our current method, the others were methods form references
福建野生茶树种质资源丰富,对其嘌呤生物碱组分构成的系统性评估,将为特异性茶树资源的开发利用提供依据。最终,从参试的野生茶树资源中,筛得5份高嘌呤生物碱资源(含量大于60 mg·g-1),7份高咖啡碱资源(含量大于50 mg·g-1),7份高苦茶碱资源(含量大于30 mg·g-1)。
[1] 叶乃兴. 茶学概论[M]. 2版. 北京: 中国农业出版社, 2021: 153.
Ye N X. Overview of tea science [M]. 2nd ed. Beijing: China Agriculture Press, 2021: 153.
[2] 王伟伟, 张建勇, 王蔚, 等. 茶叶中咖啡碱的开发利用[J].中国茶叶, 2021, 43(5): 11-15.
Wang W W, Zhang J Y, Wang W, et al. Development and utilization of caffeine in tea [J]. China Tea, 2021, 43(5): 11-15.
[3] 叶创兴, 林永成, 苏建业, 等. 苦茶varChang et Wang的嘌呤生物碱[J]. 中山大学学报(自然科学版), 1999(5): 82-86.
Ye C X, Lin Y C, Su J Y, et al. Purine alkaloids fromvarChang et Wang [J]. Journal of Sun Yat-sen University (Natural Science Edition), 1999(5): 82-86.
[4] 金基强, 周晨阳, 马春雷, 等. 我国代表性茶树种质嘌呤生物碱的鉴定[J]. 植物遗传资源学报, 2014, 15(2): 279-285.
Jin J Q, Zhou C Y, Ma C L, et al. Identification on purine alkaloids of representative tea germplasms in China [J]. Journal of Plant Genetic Resources, 2014, 15(2): 279-285.
[5] Wang S L, Chen J D, Ma J Q, et al. Novel insight into theacrine metabolism revealed by transcriptome analysis in bitter tea (Kucha,) [J]. Scientific Reports, 2020, 10(1): 1-11.
[6] 陈潇敏, 王鹏杰, 王淑燕, 等. 基于转录组的蕉城苦茶苦茶碱合成相关基因的挖掘[J/OL]. 应用与环境生物学报: 1-12 [2021-03-24]. https://doi.org/10.19675/j.cnki.1006-687x.2020.05041.
Chen X M, Wang P J, Wang S Y, et al. Excavation of genes involved in theacrine biosynthesis of Jiaochengkucha based on [J/OL]. Journal of Applied and Environmental Biology: 1-12 [2021-03-24]. https://doi.org/10.19675/j.cnki.1006-687 x.2020.05041.
[7] Li Y F, Ouyang S H, Chang Y Q, et al. A comparative analysis of chemical compositions invar.a novel Chinese tea, by HPLC and UFLC-Q-TOF-MS/MS [J]. Food Chemistry, 2017, 216: 282-288.
[8] Ouyang S H, Zhai Y J, Wu Y P, et al. Theacrine, a potent antidepressant purine alkaloid from a special Chinese tea, promotes adult hippocampal neurogenesis in stressed mice [J]. Journal of Agricultural and Food Chemistry, 2021, 69: 7016-7027.
[9] 秦丹丹, 王秋霜, 李红建, 等. 苦茶及其特异成分苦茶碱研究进展[J/OL]. 食品科学:1-10 [2021-03-24]. http://kns.cnki.net/kcms/detail/11.2206.TS.20201110.0910.002.
Qin D D, Wang Q S, Li H J, et al. Research progresses on(Chang et Wang) Chang and theacrine [J/OL]. Food Science: 1-10 [2021-03-24]. http://kns.cnki.net/kcms/detail/11.2206.TS.20201110.0910.002.
[10] 俞永明, 胡海波, 孙松祥. 福建安溪的“苦茶”[J]. 茶叶, 1958, 2(1): 19-21.
Yu Y M, Hu H B, Sun S X. Bitter tea in Anxi, Fujian [J]. Tea, 1958, 2(1): 19-21.
[11] 詹梓金, 林茂锋. 福建野生茶资源的地理分布与生态型[J]. 福建农学院学报, 1991, 20(4): 427-433.
Zhan Z J, Lin M F. Geographical distribution and ecotype of wild tea resources in Fujian [J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 1991, 20(4): 427-433.
[12] 叶乃兴, 杨如兴, 郭吉春, 等. 福建茶树遗传资源的多样性和品种创新[J]. 福建农林大学学报(自然科学版), 2004(2): 174-177.
Ye N X, Yang R X, Guo J C, et al. Diversity and variety innovation of tea tree genetic resources in Fujian [J]. Agriculture and Forestry University (Natural Science Edition), 2004(2): 174-177.
[13] 杨如兴, 陈芝芝, 张磊, 等. 福建野生茶树种质资源保护与利用[J]. 茶叶学报, 2017, 58(3): 96-101.
Yang R X, Chen Z Z, Zhang L, et al. Conservation and utilization of wild tea germplasm in Fujian [J]. Acta Tea Sinica, 2017, 58(3): 96-101.
[14] 杨江帆, 屠幼英, 叶乃兴. 中国乌龙茶种质资源利用与产业经济研究[M]. 北京: 中国农业出版社, 2020.
Yang J F, Tu Y Y, Ye N X. Study on the utilization and industrial economy of oolong tea germplasm resources in China [M]. Beijing: China Agriculture Press, 2020.
[15] 唐琴, 孙威江, 陈志丹, 等. 尤溪苦茶资源苦涩味物质测定与分析[J]. 食品科学, 2019, 40(18): 242-247.
Tang Q, Sun W J, Chen Z D, et al. Determination and analysis of bitter and astringent substances in Youxi bitter tea resources [J]. Food Science, 2019, 40(18): 242-247.
[16] 代丽凤, 罗理勇, 罗江琼, 等. 植物苦味物质概况及其在食品工业的应用[J]. 中国食品学报, 2020, 20(11): 305-318.
Dai L F, Luo L Y, Luo J Q, et al. Overview of bitter substances in plants and their application in food industry [J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(11): 305-318.
[17] 陈亮, 杨亚军, 虞富莲, 等. 茶树种质资源描述规范和数据标准[M]. 北京: 中国标准出版社, 2008.
Chen L, Yang Y J, Yu F L, et al. Description specification and data standard of tea germplasm resources [M]. Beijing: China Standards Press, 2008.
[18] 杨金川, 白雪梅. HPLC法同时测定茶叶中儿茶素类和咖啡因的含量[J]. 贵州农业科学, 2020, 48(2): 99-102.
Yang J C, Bai X M. Simultaneous determination of catechins and caffeine in tea by HPLC [J]. Guizhou Agricultural Sciences, 2020, 48(2): 99-102.
[19] 刘志彬, 张是宁, 张雯, 等. 高效液相色谱法分析武夷岩茶中的生物碱含量[J]. 食品与机械, 2016, 32(10): 27-29, 43.
Liu Z B, Zhang S Y, Zhang W, et al. The analysis of alkaloid content in Wuyi Rock Tea with high-performance liquid chromatography [J]. Food and Machinery, 2016, 32(10): 27-29, 43.
[20] 李红建, 秦丹丹, 姜晓辉, 等. 广东苦茶资源嘌呤生物碱含量分析与评价[J]. 茶叶科学, 2021, 41(1): 71-79.
Li H J, Qin D D, Jiang X H, et al. Analysis and evaluation of purine alkaloid content in Guangdong bitter tea resources [J]. Journal of Tea Science, 2021, 41(1): 71-79.
[21] Tan J F, Engelhardt U, Lin Z, et al. Flavonoids, phenolic acids, alkaloids and theanine in different types of authentic Chinese white tea samples [J]. Journal of Food Composition and Analysis, 2017, 57: 8-15.
[22] Jiang H, Yu F, Qin L, et al. Dynamic change in amino acids, catechins, alkaloids, and gallic acid in six types of tea processed from the same batch of fresh tea (L.) leaves [J]. Journal of Food Composition and Analysis, 2019, 77: 28-38.
[23] 秦园, 王惠芳, 吴建兵, 等. 超高效液相串联质谱检测茶叶及茶饮料中咖啡碱含量[J]. 食品工业科技, 2019, 40(10): 286-289, 301.
Qin Y, Wang H F, Wu J B, et al. Determination of caffeine content in tea and tea beverage by ultra performance liquid chromatography tandem mass spectrometry [J]. Science and Technology of Food Industry, 2019, 40(10): 286-289, 301.
[24] Jin J Q, Jiang C K, Yao M Z, et al. Baiyacha, a wild tea plant naturally occurring high contents of theacrine and 3″-methyl-epigallocatechin gallate from Fujian, China [J]. Scientific Reports, 2020, 10(1): 1-9.
[25] Jeszka-Skowron M, Zgoła-Grześkowiak A, Frankowski R.a promising herbal tea rich in bioactive compounds: LC-MS/MS determination of catechins, flavonols, phenolic acids and alkaloids–A comparison with, Rooibos and Hoan Ngoc herbal tea [J]. Journal of Food Composition Analysis, 2018, 74: 71-81.
[26] Qin D D, Wang Q S, Li H J, et al. Identification of key metabolites based on non-targeted metabolomics and chemometrics analyses provides insights into bitterness in Kucha [(Chang et Wang) Chang] [J]. Food Research International, 2020, 138:109789. doi: 10.1016/j.foodres.2020.109789.
[27] Zhang Y H, Li Y F, Wang Y J, et al. Identification and characterization of9-methyltransferase involved in converting caffeine into non-stimulatory theacrine in tea [J]. Nature Communications, 2020, 11(1): 1-8.
[28] Li H J, Fang K X, Qin D D, et al. Comparative transcriptome analysis reveals putative genes responsible for high theacrine content in Kucha ((Chang et Wang) Chang) [J]. Tropical Plant Biology, 2021, 14: 82-92.
Purine Alkaloid Evaluation and Excellent Resources Screening of Fujian Wild Tea
CHEN Xiaomin1, ZHAO Feng2*, WANG Shuyan1, SHAO Shuxian1, WU Wenxi3, LIN Qin4, WANG Pengjie1, YE Naixing1*
1. College of Horticulture, Fujian Agriculture and Forestry University/Key Laboratory of Tea Science in Universities of Fujian province, Fuzhou 350002, China; 2. School of Pharmacy, Fujian University of Traditional Chinese Medicine, Fuzhou 350122, China; 3. Hengzheng Testing Technology Company, Fuzhou 350100, China; 4. Fujian Institute of Product Quality Inspection, Fuzhou 350014, China
A total of forty-three wild tea resources in Fujian Province were applied in the research and the contents ofpurine alkaloids were determined by ultra high performance liquid chromatography-tandem mass spectrometry (UHPLC-MS/MS). The descriptive statistical analysis and cluster analysis were carried out to systematically analyze and explore the composition characteristics of purine alkaloids in Fujian wild tea resources. The results show that large variations in the purine alkaloids were identified in tea resources, which could be divided into four specific groups: group Ⅰ with similar contents of purine alkaloids as those in normal tea cultivars, group Ⅱwith higher purine alkaloids especially high caffeine content and low theophylline and theobromine, group Ⅲwith higher purine alkaloids especially high bitter theophylline and theophylline contents, group Ⅳ with high purine alkaloids especially bitter theophylline. After comprehensive evaluation, 14 tea resources with specific purine alkaloid composition were identified, including five germplasm resources with high purine alkaloids (>60 mg·g-1), seven germplasm resources with high caffeine (>50 mg·g-1) and seven germplasm resources with high bitter theophylline (>30 mg·g-1). Through this study, it provided more information and a scientific basis for the protection, innovation, breeding, production and utilization of tea germplasm resources.
tea plant, germplasm resources, purine alkaloid, theacrine, liquid chromatography-mass spectrometry
S571.1;Q946.91+2
A
1000-369X(2022)01-018-11
2021-06-02
2021-10-09
茶学福建省高校重点实验室开放课题(KLTS2018002)、福建中医药大学引进人才科研启动项目(2801/701190097)、福建农林大学优秀硕士学位论文资助基金(1122YS01003)
陈潇敏,女,硕士研究生,主要从事茶树栽培育种方面的研究。*通信作者:zhaofeng0591@fjtcm.edu.cn;ynxtea@126.com
(责任编辑:赵锋)

