不同仓储期普洱茶(生茶)中酚类成分差异及其对体外抗氧化能力的影响
马冰凇,王佳菜,徐成成,任小盈,马存强,3*,周斌星*
不同仓储期普洱茶(生茶)中酚类成分差异及其对体外抗氧化能力的影响
马冰凇1,王佳菜1,徐成成1,任小盈2,马存强1,3*,周斌星1*
1. 云南农业大学龙润普洱茶学院,云南 昆明 650201;2. 聊城高级财经职业学校,山东 聊城 252000;3. 华中农业大学园艺林学学院,湖北 武汉 430073
为探究普洱茶仓储陈化过程中酚类物质等品质成分变化及其对抗氧化能力的影响,采用高效液相色谱(HPLC)等方法对6个系列3个不同仓储期共18款普洱茶(生茶)中的17种酚类化合物、3种嘌呤碱等品质成分进行定量检测。并对普洱茶(生茶)的铁离子还原/抗氧化能力、DPPH自由基清除能力、ABTS自由基清除能力、羟基自由基清除能力和超氧阴离子自由基清除能力等体外抗氧化能力进行了测定。采用主成分分析(PCA)和正交偏最小二乘法-判别分析(OPLS-DA)等多元统计学分析方法,结合感官审评结果可基本实现仓储陈化过程中普洱茶(生茶)新茶和老茶的判别。单因素方差分析发现,普洱茶仓储陈化过程中7种儿茶素含量极显著(<0.01)降低,而鞣花酸、槲皮素、木犀草素和山奈酚等黄酮类化合物含量极显著(<0.01)增加。与普洱茶(生茶)陈茶和老茶相比,普洱茶(生茶)新茶的铁离子还原/抗氧化能力、DPPH自由基清除能力和ABTS自由基清除能力最高,而超氧阴离子自由基清除能力最低。双变量相关性分析揭示儿茶素(C)、没食子儿茶素(GC)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)和表没食子儿茶素没食子酸酯(EGCG)等儿茶素类物质是影响普洱茶(生茶)仓储陈化过程中铁离子还原/抗氧化能力、DPPH自由基清除能力和ABTS自由基清除能力的主要酚类成分。
普洱茶(生茶);仓储陈化;抗氧化;儿茶素
普洱茶是以云南大叶种(var.)晒青绿茶为原料,采用特定加工工艺制成的地理标志性产品。按其加工工艺和品质特征可分为普洱茶(生茶)和普洱茶(熟茶)[1]。在普洱茶仓储陈化过程中,受到仓储环境及其分布的微生物群落等因素影响,在微生物、酶、湿热、氧化等综合作用下,普洱茶中的酚类、氨基酸、可溶性糖等品质成分发生深刻变化[2-4]。现已在普洱茶仓储陈化过程中检出多种细菌、放线菌和真菌菌群[5-6]。特别是和等曲霉属真菌,对普洱茶仓储陈化和渥堆发酵中的酚类成分代谢均有一定影响[4,7]。
Zhou等[8]采用高效液相色谱(High performance liquid chromatography,HPLC)等方法对连续0~10 a陈化期内普洱茶(生茶)中的酚类、嘌呤碱、游离氨基酸等品质成分进行检测分析,揭示了普洱茶(生茶)仓储陈化过程中品质成分的阶段性变化,并将仓储陈化中的普洱茶分为新茶(2 a内)、陈茶(3~7 a)和老茶(8 a以上)。前人研究显示,茶叶中儿茶素类、黄酮类、酚酸类等酚类成分含量与抗氧化能力存在显著正相关(<0.05)[9-11]。(-)-表没食子儿茶素没食子酸酯(Epigallocatechingallate,EGCG)被认为是茶叶中主要抗氧化成分之一[11]。然而,普洱茶(生茶)仓储陈化过程中酚类成分变化对其抗氧化能力的影响尚不明确。
本研究采用HPLC等方法对6个系列3个不同仓储期共18款普洱茶(生茶)中的17种酚类化合物和3种嘌呤碱等活性成分,以及茶多酚总量、可溶性糖、游离氨基酸、总黄酮等品质成分进行定量检测;分析检测普洱茶(生茶)的铁离子还原/抗氧化能力、DPPH自由基清除能力、ABTS自由基清除能力、羟基自由基清除能力和超氧阴离子自由基清除能力等体外抗氧化能力;采用相关性分析方法探究普洱茶(生茶)仓储陈化过程中酚类等品质成分变化对其抗氧化能力的影响。本研究旨在揭示普洱茶(生茶)新茶、陈茶和老茶的酚类成分、抗氧化能力差异和品质特征,为仓储陈化中普洱茶(生茶)的分类研究提供科学依据。
1 材料和方法
1.1 材料
6个系列3个不同仓储期的18款普洱茶(生茶)样品信息见表1。参照Zhou等[8]的研究结果,根据仓储陈化期长短,将同一系列的普洱茶(生茶)分为新茶、陈茶和老茶。2019年至2020年加工生产的仓储陈化期在2 a内的普洱茶(生茶)为新茶,共6款,编号分别为DZ-X1、LC-X2、FP-X3、YW-X4、MZ-X5和SY-X6;2013年至2017年加工生产的仓储期为3~7 a的普洱茶(生茶)为陈茶,共6款,编号分别为DZ-C1、LC-C2、FP-C3、YW-C4、MZ-C5和SY-C6;2006年至2011年加工生产的仓储陈化期在8 a以上的普洱茶(生茶)为老茶,共6款,编号分别为DZ-L1、LC-L2、FP-L3、YW-L4、MZ-L5和SY-L6。茶叶样品收集完成后,自封袋密封,–20℃环境下保存。在相同条件下,进行茶样的研磨、浸提、检测等操作。
(+)-儿茶素(Catechin,C)、(+)-没食子儿茶素(Gallocatechin,GC)、(-)-表儿茶素(Epicatechin,EC)、(-)-表没食子儿茶素(Epigallocatechin,EGC)、(-)-儿茶素没食子酸酯(Catechin galllate,CG)、(-)-表儿茶素没食子酸酯(Epicatechin gallate,ECG)、(-)-没食子儿茶素没食子酸酯(Gallocatechin gallate,GCG)、EGCG、没食子酸、鞣花酸、水解单宁(1,4,6-三--没食子酰基---葡萄糖,1,4,6-tri--galloyl---glucose,GG)等酚类化合物标准品(纯度≥98%),槲皮素、山奈酚、杨梅素、芦丁、花旗松素、木犀草素等6个黄酮类化合物标准品(纯度≥98%),购自成都曼斯特生物科技有限公司;咖啡碱、可可碱、茶碱等3个嘌呤碱标准品(纯度≥98%)以及2,4,6-三(2-吡啶基)-1,3,5-三嗪(TPTZ)、1,1-二苯基-2-苦基肼(DPPH)、2,2'-二氮-双(3-乙基苯并噻唑-6-磺酸)(ABTS)、奎诺二甲基丙烯酸酯(Trolox)等试剂,购自美国Sigma-Aldrich公司;LC-MS级甲醇、乙腈,购自美国Thermo Fisher公司。
Heraeus Fresco17高速离心机(美国Thermo Fisher公司);JXFSTPRP-24研磨仪(上海净信实业发展有限公司);SCQ-Y300A超声波恒温水浴(上海声彦超声波仪器公司);TU-1901紫外-可见分光光度计(北京普析通用仪器有限责任公司);Multiskan FC型酶标仪(美国Thermo Scientific公司);1200型HPLC仪(美国Agilent公司)。
1.2 试验方法
1.2.1 主要品质成分分析
参照GB 5009.3—2016进行茶叶中水分的测定。参照GB/T 8313—2018,以没食子酸为参照,采用765 nm波长下的福林酚比色法测定普洱茶(生茶)中的茶多酚含量。以蔗糖为参照,采用蒽醌试剂在620 nm波长下进行普洱茶(生茶)中可溶性糖总量的测定[12]。游离氨基酸总量测定采用茚三酮比色法,以亮氨酸为标准氨基酸溶液在570 nm波长下测定[13]。总黄酮含量以芦丁为参照,采用415 nm波长下的三氯化铝比色法进行测定[14]。
1.2.2 茶汤浸提
18款普洱茶(生茶)茶样经研磨仪研磨,40目筛网筛分后,–20℃保存备用。称取1.0 g茶叶研磨样品,加入40 mL甲醇和4 mL盐酸于圆底烧瓶85℃回流浸提90 min,冷却过滤后,通过甲醇定容至50 mL[15]。0.45 μm尼龙滤膜过滤后用于HPLC检测。
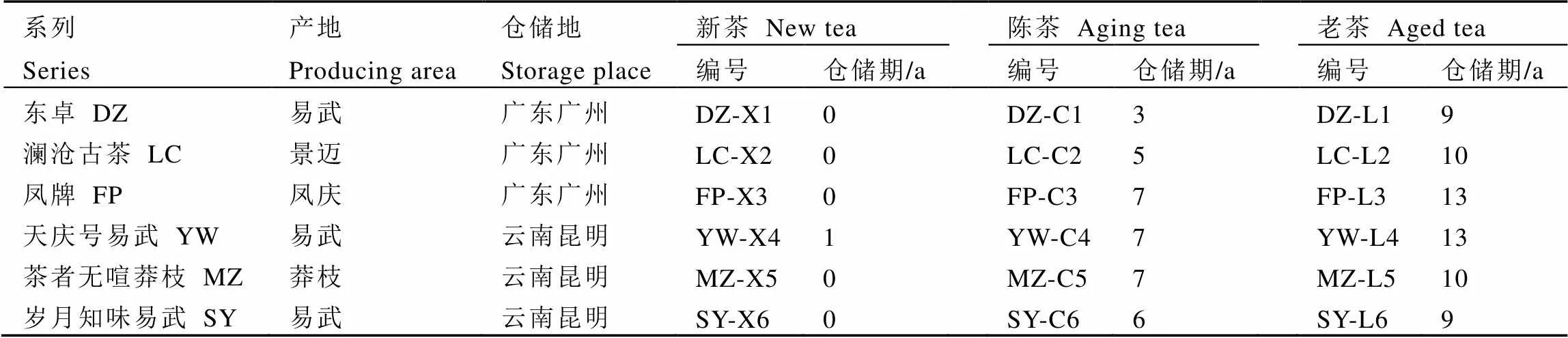
表1 18款普洱茶(生茶)信息表
注:同一系列为同一公司采用统一配方、产地晒青绿茶加工而成的不同仓储期的普洱茶(生茶)
Note: Puer raw teas of the same series were provided by the same tea company with the sun-dried green tea-leaves of uniform formula/production place
1.2.3 酚类化合物和嘌呤碱的HPLC定量检测
采用Agilent 1200型HPLC仪连接Agilent Poroshell 120 EC-C18色谱柱(100 mm×4.6 mm,2.7 μm)和Agilent C18保护柱(10 mm×4.6 mm,5 μm)对18个普洱茶(生茶)样品中的8种儿茶素、6种黄酮类、2种酚酸、水解单宁、3种嘌呤碱等活性成分进行定量检测[15-16]。流动相A为0.261%磷酸、5%乙腈,流动相B为80%甲醇;洗脱梯度程序:0 min,A相为90%,B相为10%;10 min,A相线性减少至55%,B相线性增加至45%;22 min,A相线性减少至35%,B相线性增加至65%;25.9 min,A相线性减少至0%,B相线性增加至100%;29 min,A相保持为0%,B相保持为100%;30 min,A相线性增加至90%,B相线性减少至10%;36 min,A相保持为90%,B相保持为10%。流速为0.8 mL·min-1[16]。柱温为30℃;0~20 min检测波长为280 nm;20~36 min检测波长为360 nm;进样体积为2 μL[16]。采用内标法协助普洱茶(生茶)中生物活性成分的识别,采用标准曲线完成普洱茶(生茶)中酚类化合物和嘌呤碱含量的定量分析。
1.2.4体外抗氧化能力测定
铁离子还原/抗氧化能力测定:0.05 g普洱茶(生茶)样品与1 mL 80%乙醇混合。在60℃,200~300 W条件下,超声波提取30 min后,12 000 r·min-1离心10 min,取上清液。以抗氧化剂Trolox为参照,在590 nm波长下采用微板法,通过标准曲线:1=0.097 21+0.004 2(2=0.999 7)进行铁离子还原/抗氧化能力的测定(1为Trolox物质的量,nmol;1为OD590)。
DPPH自由基清除能力测定:0.05 g普洱茶(生茶)样品与1 mL 80%甲醇提取液混合,冰浴匀浆后,12 000 r·min-1离心10 min,取上清液。以抗氧化剂Trolox为参照,采用517 nm波长下的微板法,通过标准曲线2=2.848 62+0.708 4(2=0.999 1)进行DPPH自由基清除能力的测定(2为Trolox的浓度,μg·mL-1;2为DPPH自由基清除率,%)。
ABTS自由基清除能力测定:0.05 g普洱茶(生茶)样品与1 mL 80%甲醇提取液混合,冰浴匀浆后,12 000 r·min-1离心10 min,取上清液。以抗氧化剂Trolox为参照,采用734 nm波长下的微板法,通过标准曲线3=0.504 23-1.421 3(2=0.997 1)进行ABTS自由基清除能力的检测(3为Trolox的浓度,μg·mL-1;3为ABTS自由基清除率,%)。
羟自由基清除能力测定:取0.1 g普洱茶(生茶)样品与1 mL蒸馏水混合,进行冰浴匀浆。12 000 r·min-1离心10 min后,取上清液。采用微板法在510 nm下的吸光度,按照如下公式进行羟自由基清除能力的测定:羟自由基清除率=[空白-(测定-对照)]÷空白×100%。
超氧阴离子自由基清除能力测定:取0.1 g普洱茶(生茶)样品与1 mL提取液混合,进行冰浴匀浆。12 000 r·min-1离心10 min后,采用微板法在570 nm波长下对普洱茶(生茶)样上清液的超氧阴离子自由基清除能力进行测定。计算公式如下:超氧阴离子清除率=(对照-测定)÷(对照-空白)×100%。
1.2.5 感官审评方法
参照GB/T 18797—2012、GB/T 23776—2018和GB/T 14487—2017对18款普洱茶(生茶)紧压茶进行感官审评,依次评判茶叶的外形、汤色、香气、滋味和叶底,分析总结新茶、陈茶、老茶等3组不同仓储期普洱茶(生茶)的品质特征。
1.3 数据处理与分析
2 结果分析
2.1 仓储陈化中普洱茶(生茶)的分组比较
如图1所示,在18款普洱茶(生茶)中均能检出8种儿茶素、2种酚酸、水解单宁、4种黄酮类(芦丁、花旗松素、杨梅素和木犀草素)以及2种嘌呤碱(咖啡碱和可可碱)。由于茶碱和山奈酚含量较低,受检测技术条件限制,在部分茶样中未能检出。此外,受茶树品种、加工工艺、仓储陈化时间等因素的影响,不同普洱茶(生茶)中槲皮素含量存在较大差异,在部分茶样中未能检出,而某些茶样中槲皮素含量高达0.43 mg·g-1。基于20种活性成分和4种主要品质成分的PCA(图2-A)和OPLS-DA(图2-B)均能用于不同仓储期普洱茶(生茶)分组的判别分析。在PCA中,PC1和PC2分别解释了总方差的35.2%和15.7%,将仓储陈化中的普洱茶(生茶)基本分为新茶、陈茶和老茶3组;由于原料以及仓储环境的差异,部分陈茶茶样与新茶或老茶有所重叠(图2-A)。OPLS-DA显示,普洱茶(生茶)陈茶在品质成分上更接近于普洱茶(生茶)老茶,与普洱茶(生茶)新茶存在显著差异。OPLS-DA(2=0.690,2=0.549,<0.001)模型能较好地应用于仓储陈化中普洱茶(生茶)分组的判别分析。
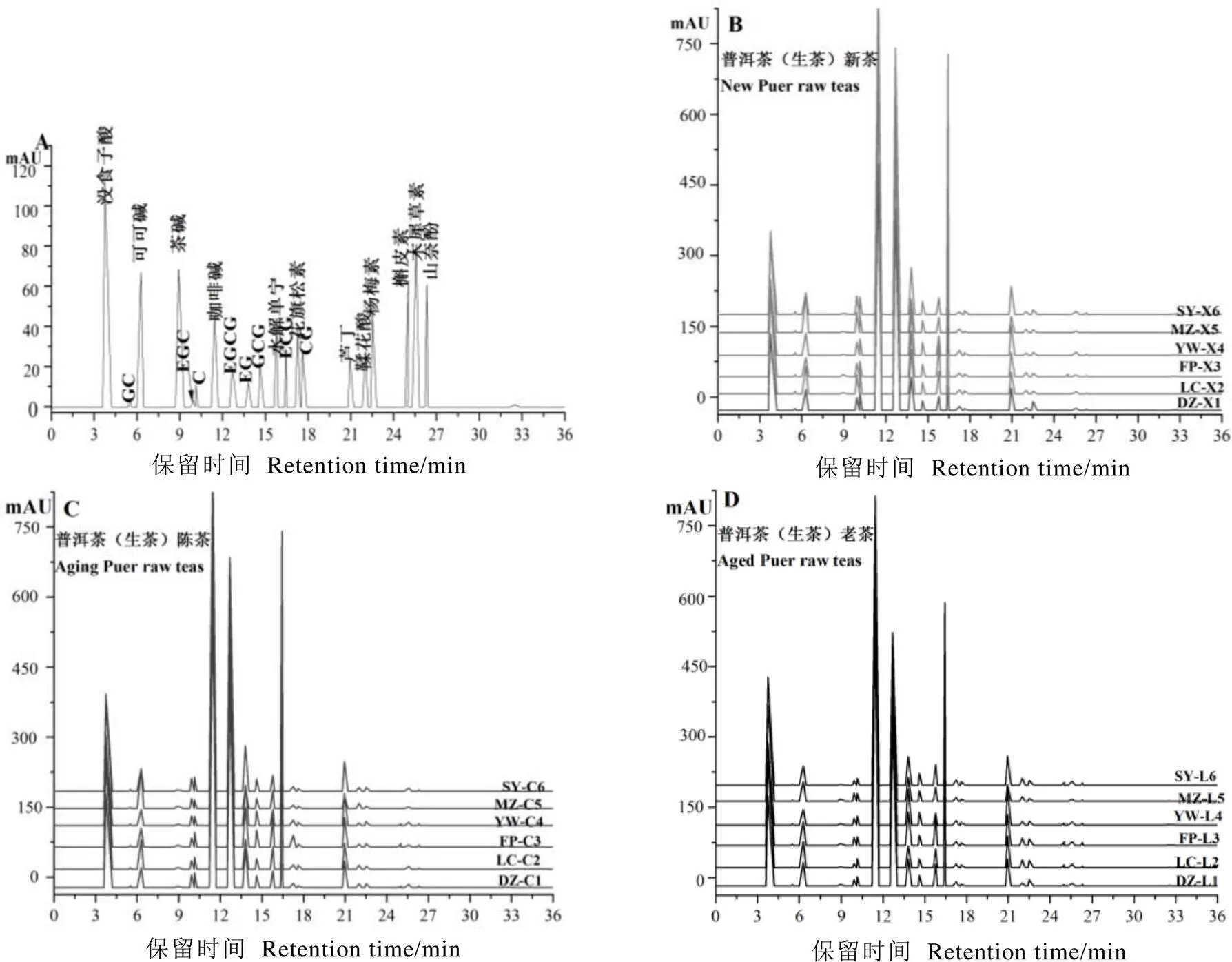
图1 20个标准品以及18个茶样的高效液相色谱图
感官审评结果如表2所示,显示了普洱茶(生茶)新茶、陈茶、老茶的品质特征。不同仓储期普洱茶(生茶)在汤色、香气、滋味、叶底等方面存在显著差异。普洱茶(生茶)仓储陈化过程中茶叶色泽由墨绿色转变为黑褐色;汤色由黄绿、绿黄向橙红、棕黄和栗红转变;清香逐渐消退,陈香逐渐显露;苦涩鲜醇味减退,向甜醇转变;叶底也由新茶的肥厚黄绿转变为青褐、黄褐,在老茶中部分茶梗出现木质化现象。通过感官审评的品质特征基本可区分新茶和老茶。高温高湿的仓储环境在一定程度上促进普洱茶(生茶)的陈化[4,8],广州等地仓储的普洱茶(生茶)陈茶外形、汤色、叶底更接近于老茶,然而在香气和滋味上与昆明等地仓储的普洱茶(生茶)老茶有一定差异。因此,根据不同仓储期普洱茶(生茶)的品质特征可将仓储陈化中的普洱茶(生茶)分为新茶、陈茶和老茶,同时发现仓储环境等因素对普洱茶陈化品质会产生影响。
2.2 不同仓储期普洱茶(生茶)的单因素方差分析
单因素方差分析显示(表3),除CG、芦丁、水解单宁、咖啡碱和可可碱在<0.05水平无显著差异,可溶性糖、杨梅素和木犀草素在<0.01水平无显著差异外,不同仓储期普洱茶(生茶)中的其他7种儿茶素、黄酮类、酚酸、氨基酸等品质成分均存在极显著差异(<0.01)。与普洱茶(生茶)新茶相比,普洱茶(生茶)仓储陈化过程中茶多酚、游离氨基酸均极显著降低(<0.01),而黄酮总量和没食子酸含量极显著增加(<0.01),这在一定程度上与Zhou等[8]和Xu等[4]研究结果相符。相对而言,咖啡碱、可可碱等嘌呤碱含量保持稳定,在<0.01水平无显著差异,这与Xu等[4]发现普洱茶仓储陈化中咖啡碱呈降低趋势不符。与普洱茶(生茶)新茶相比,普洱茶(生茶)老茶中酯型、非酯型儿茶素的降幅分别为31.56%和49.00%,而普洱茶渥堆发酵中酯型、非酯型儿茶素降幅均在75%以上,这主要与仓储陈化过程中微生物代谢强度较弱有关。
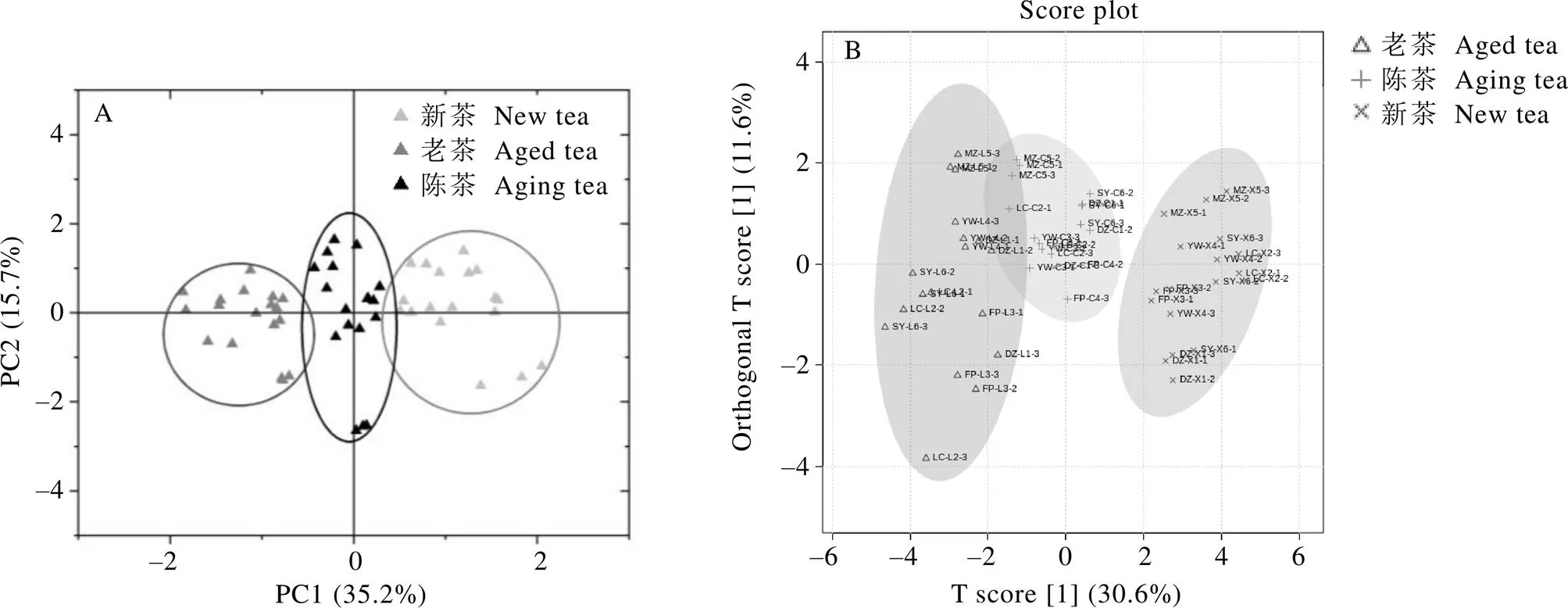
图2 不同仓储期普洱茶(生茶)的主成分分析(A)和正交偏最小二乘法-判别分析(B)

表2 不同仓储期普洱茶(生茶)的品质特征
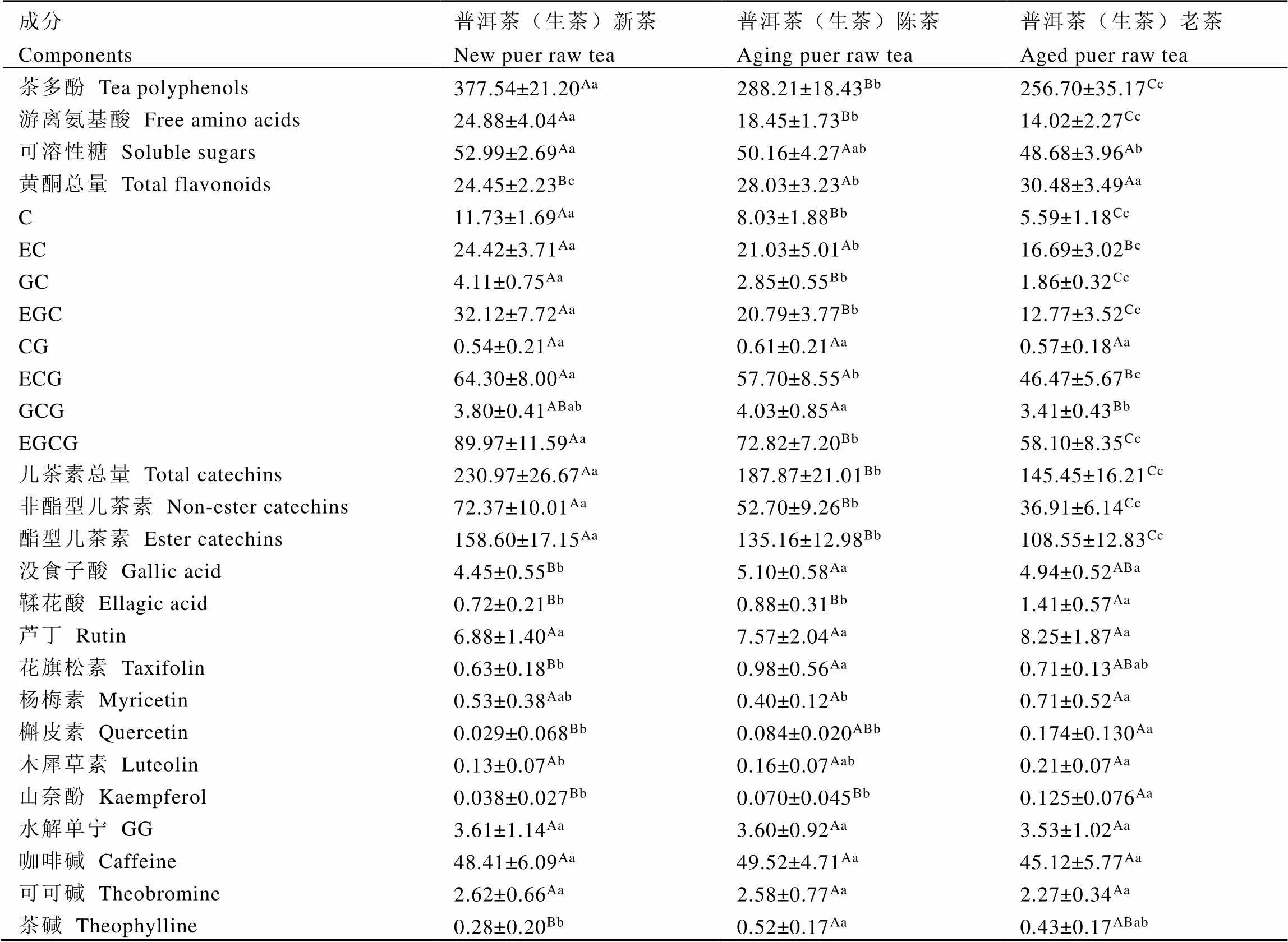
表3 不同仓储期普洱茶(生茶)中的酚类、嘌呤碱等品质成分含量及其差异
注:儿茶素总量为C、EC、GC、EGC、ECG、GCG、EGCG和CG等8种儿茶素含量的总和;酯型儿茶素含量为ECG、GCG、EGCG和CG等4种酯型儿茶素含量的总和;非酯型儿茶素含量为C、EC、GC和EGC等4种非酯型儿茶素含量的总和。下同。采用Tukey HSD检验进行单因素方差分析。同一行不同小写字母表示在<0.05水平存在显著性差异;不同大写字母表示在<0.01水平存在极显著性差异
Note: The total catechins were the summation of C, EC, EGC, GC, ECG, GCG, EGCG and CG contents. The total ester catechins were the summation of ECG, GCG, EGCG and CG contents. The total non-ester catechins were the summation of C, EC, GC and EGC contents. The same below. One way ANOVA was carried out by Tukey HSD test. The different lowercase letters in the same line represent significant differences at<0.05 level, while the different uppercase letters in same line represent highly significant differences at<0.01 level
本研究发现2种酚酸和6种黄酮类化合物在普洱茶(生茶)仓储陈化过程中或保持稳定(>0.01),或呈极显著(<0.01)增加趋势。在一定仓储陈化期内,普洱茶(生茶)中GCG、没食子酸、花旗松素和茶碱均呈先增加后减少的变化趋势,而鞣花酸、槲皮素、木犀草素和山奈酚含量在仓储陈化过程中呈增加趋势,在老茶中含量最高。这与普洱茶渥堆发酵中酚酸、黄酮类等酚类成分变化趋势存在一定差异。在普洱茶渥堆发酵中,EGCG等儿茶素显著降低[17-18],酚酸[19]和黄酮类[20]等酚类化合物均呈先增加后减少的变化趋势[21]。相反,作为主要的8-C N-乙基-2吡咯烷酮取代的黄烷-3-醇类,普洱茶素在普洱茶渥堆发酵初期显著增加[20-22]。单菌株真菌发酵揭示儿茶素和茶氨酸为普洱茶素(Puerins Ⅰ-Ⅷ)生物合成的前体物质[23]。普洱茶(生茶)仓储陈化过程中,C、EC、GC、EGC、ECG、GCG和EGCG等7种儿茶素以及游离氨基酸和可溶性糖含量显著(<0.05)或极显著(<0.01)降低,这与普洱茶渥堆发酵过程中的变化趋势基本一致[17-18]。在普洱茶(生茶)仓储陈化过程中普洱茶素的变化趋势尚不明确,值得借助靶标、非靶标代谢组学等现代研究手段进一步探究。
2.3 不同仓储期普洱茶(生茶)的体外抗氧化能力差异
如图3所示,本研究分别测定了不同仓储期普洱茶(生茶)的铁离子还原/抗氧化能力、DPPH自由基清除能力、ABTS自由基清除能力、羟基自由基清除能力和超氧阴离子自由基清除能力。结果表明,不同仓储期普洱茶(生茶)的铁离子还原/抗氧化能力、DPPH自由基清除能力、ABTS自由基清除能力和超氧阴离子自由基清除能力存在极显著差异(<0.01),而羟基自由基清除能力保持相对稳定,无显著变化(>0.05)。单因素方差分析显示,普洱茶(生茶)仓储陈化过程中,铁离子还原/抗氧化能力、DPPH自由基清除能力和ABTS自由基清除能力极显著降低(<0.01),而超氧阴离子自由基清除能力极显著增加(<0.01)。相对而言,普洱茶(生茶)新茶的铁离子还原/抗氧化能力、DPPH自由基清除能力和ABTS自由基清除能力最强,而老茶的超氧阴离子自由基清除能力较强。Zhang等[24]研究发现,普洱茶的DPPH自由基清除能力和ABTS自由基清除能力与儿茶素、黄酮类等酚类成分含量呈正相关。仓储陈化中酚类成分变化在一定程度上影响了普洱茶(生茶)的铁离子还原/抗氧化能力、DPPH自由基清除能力和ABTS自由基清除能力。而羟基自由基清除能力和超氧阴离子自由基清除能力受仓储陈化过程中酚类成分变化的影响较小。
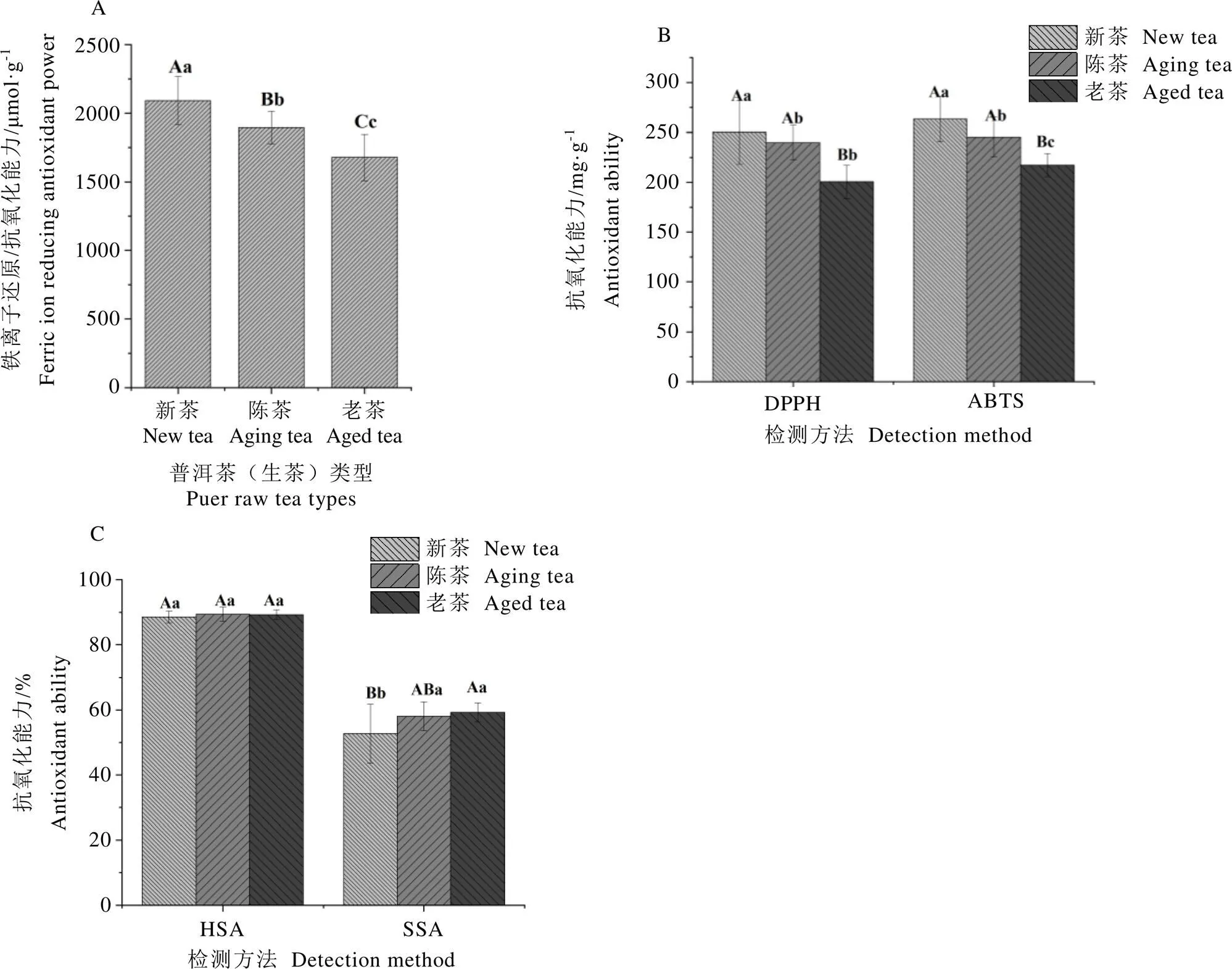
注:DPPH表示DPPH自由基清除能力测定法;ABTS表示ABTS自由基清除能力测定法;HSA表示羟基自由基清除能力测定法;SSA表示超氧阴离子自由基清除能力测定法。不同小写字母表示在P<0.05水平存在显著性差异;不同大写字母表示在P<0.01水平存在极显著性差异
2.4 酚类成分对普洱茶(生茶)抗氧化能力的影响
研究表明,茶叶微生物发酵过程中没食子酸和山奈酚含量的累积有助于其抗氧化能力的提升[22-23,25-26]。本研究结果显示(图4),铁离子还原/抗氧化能力、DPPH自由基清除能力和ABTS自由基清除能力之间存在极显著(<0.01)正相关,而铁离子还原/抗氧化能力与超氧阴离子自由基清除能力存在显著(<0.05)负相关。C、GC、EGC、ECG和EGCG等儿茶素与铁离子还原/抗氧化能力、DPPH自由基清除能力和ABTS自由基清除能力等抗氧化能力存在显著(<0.05)或极显著(<0.01)正相关,而槲皮素、木犀草素和山奈酚等黄酮类化合物与铁离子还原/抗氧化能力、DPPH自由基清除能力和ABTS自由基清除能力存在显著(<0.05)或极显著(<0.01)负相关。由此可知,儿茶素类、黄酮类等酚类化合物对仓储陈化过程中普洱茶(生茶)抗氧化能力的影响存在一定差异。没食子酸在一定程度上能显著(<0.05)提高仓储陈化中普洱茶(生茶)的羟基自由基清除能力,而对铁离子还原/抗氧化能力、DPPH自由基清除能力、ABTS自由基清除能力和超氧阴离子自由基清除能力无显著(>0.05)影响。整体来说,C、GC、EGC、ECG和EGCG等儿茶素为影响仓储陈化过程中普洱茶(生茶)铁离子还原/抗氧化能力、DPPH自由基清除能力、ABTS自由基清除能力的主要酚类成分。本研究仅发现GCG、没食子酸、GC、可可碱和茶碱对普洱茶(生茶)的羟基自由基清除能力或超氧阴离子自由基清除能力存在一定影响。
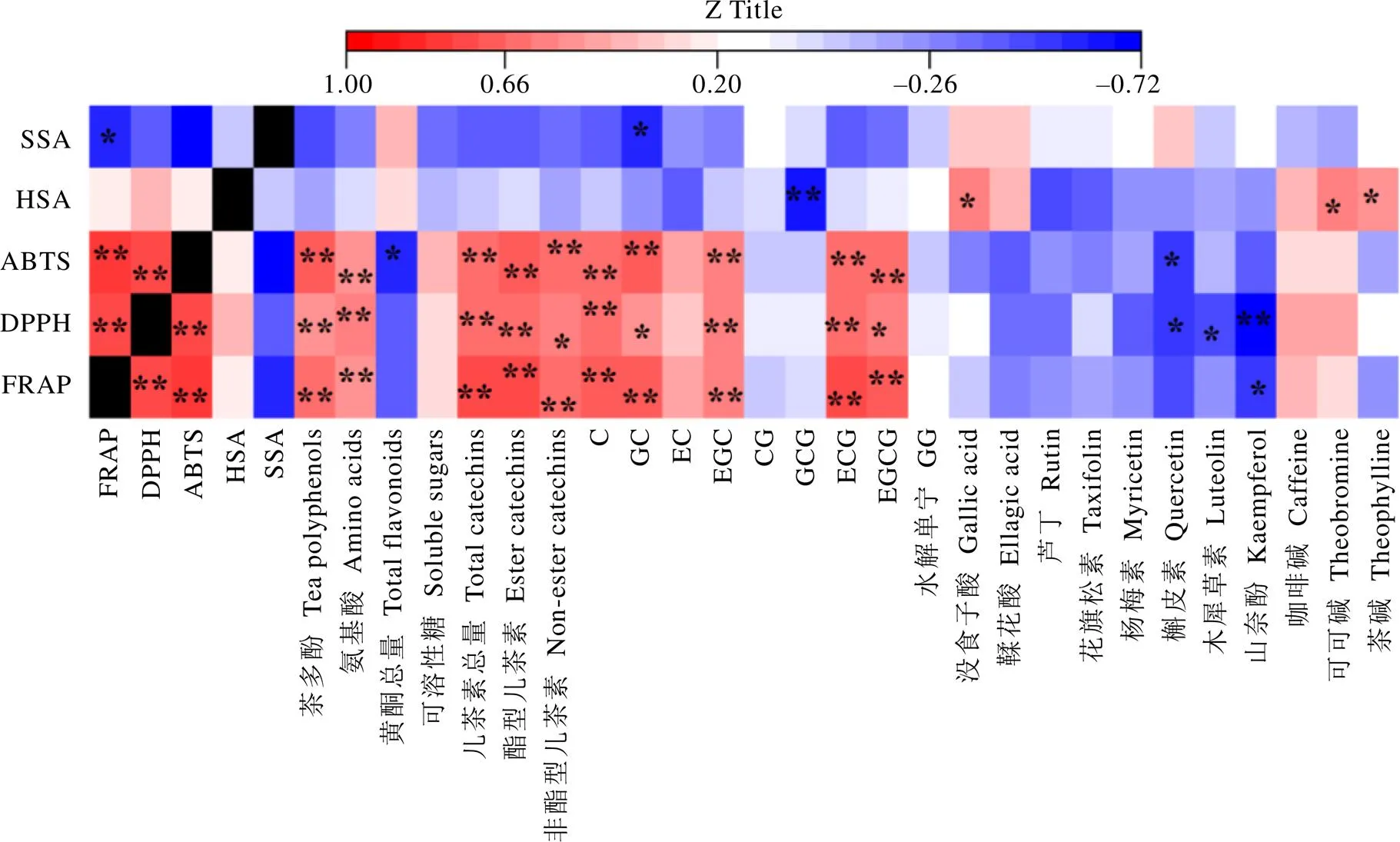
注:FRAP,铁离子还原/抗氧化能力;DPPH,DPPH自由基清除能力;ABTS,ABTS自由基清除能力;HSA,羟自由基清除能力;SSA,超氧阴离子自由基清除能力。*表明在P<0.05水平存在显著相关性;**表明在P<0.01水平存在极显著相关性
3 讨论与结论
普洱茶的仓储陈化受温度、湿度、氧气、光照等环境因素以及微生物代谢强度的综合影响[27-28],很难根据香气组分[29-30]或品质成分[3]完成仓储陈化时间的判定。本课题组前期提出的仓储陈化中普洱茶(生茶)新茶、陈茶、老茶的分类法同样受到茶叶原料和仓储环境等因素的影响[8]。本研究采用HPLC和紫外-可见分光光度计法,对6个系列3个不同仓储期的18款普洱茶(生茶)样品中的儿茶素、黄酮类、酚酸和嘌呤碱等活性成分以及茶多酚总量、可溶性糖、游离氨基酸和黄酮总量等主要品质成分进行定量测定。PCA和OPLS-DA可实现仓储陈化过程中普洱茶(生茶)分组的判别分析,感官审评揭示了普洱茶(生茶)新茶、陈茶和老茶的品质特征,基于普洱茶(生茶)仓储陈化过程中酚类成分变化与滋味差异,普洱茶(生茶)可按照仓储时间分为新茶、陈茶和老茶3组。
单因素方差分析显示,普洱茶(生茶)仓储陈化过程中除CG、芦丁、水解单宁、咖啡碱和可可碱无显著变化外,其他7种儿茶素含量均极显著降低(<0.01),没食子酸、花旗松素和茶碱呈先增加后减少的变化趋势,而鞣花酸、槲皮素、木犀草素和山奈酚等黄酮类化合物含量极显著增加(<0.01)。体外抗氧化能力分析显示,普洱茶(生茶)仓储陈化过程中,铁离子还原/抗氧化能力、DPPH自由基清除能力和ABTS自由基清除能力极显著降低(<0.01),超氧阴离子自由基清除能力极显著增加(<0.01),而羟自由基清除能力保持基本稳定(>0.05)。双变量相关性分析揭示C、GC、EGC、ECG和EGCG等儿茶素为影响仓储陈化中普洱茶(生茶)铁离子还原/抗氧化能力、DPPH自由基清除能力和ABTS自由基清除能力等抗氧化能力的主要酚类成分。
本研究借助HPLC等方法初步探明了不同仓储期普洱茶(生茶)中的酚类成分和抗氧化能力差异,以及酚类成分变化对体外抗氧化能力的影响,为仓储陈化过程中普洱茶(生茶)的分类比较提供了科学依据。
[1] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 地理标志产品普洱茶: GB/T 22111—2008[S]. 北京: 中国标准出版社, 2008.
State Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China, China National Standardization Administration Committee. Product of geographical indication Puer tea: GB/T 22111—2008 [S]. Beijing: China Standards Press, 2008.
[2] Zhou B X, Ma C Q, Ren X Y, et al. Correlation analysis between filamentous fungi and chemical compositions in a type pu-erh tea after a long-term storage [J]. Food Science & Nutrition, 2020, 8(5): 2501-2511.
[3] Wang T, Li X L, Yang H C, et al. Mass spectrometry-based metabolomics and chemometric analysis of Pu-erh teas of various origins [J]. Food Chemistry, 2018, 268: 271-278.
[4] Xu S, Wang J J, Wei Y, et al. Metabolomics based on UHPLC-Orbitrap-MS and Global Natural Product Social Molecular Networking reveals effects of time scale and environment of storage on the metabolites and taste quality of raw Pu-erh tea [J].Journal of Agricultural and Food Chemistry, 2019, 67(43): 12084-12093.
[5] Chen C S, Chan H C, Chang Y N, et al. Effects of bacterial strains on sensory quality of pu-erh tea in an improved pile-fermentation process [J]. Journal of Sensory Studies, 2009, 24: 534-553.
[6] Chen Y S, Liu B L, Chang Y N. Bioactivities and sensory evaluation of pu-erh teas made from three tea leaves in an improved pile fermentation process [J].Journal of Bioscience and Bioengineering, 2010, 109(6): 557-563.
[7] Ma C Q, Li X H, Zheng C Q, et al. Comparison of characteristic components in tea-leaves fermented byPT-3,PT-4 andPT-5 using LC-MS metabolomics and HPLC analysis [J]. Food Chemistry, 2021, 350: 129228. doi: 10.1016/j.foodchem.2021.129228.
[8] Zhou B X, Ma C Q, Wu T T, et al. Classification of raw Pu-erh teas with different storage time based on characteristic compounds and effect of storage environment [J]. LWT- Food Science and Technology, 2020, 133: 109914. doi: 10.1016/j.lwt.2020.109914.
[9] Zhang Y T, Li Q, Xing H, et al. Evaluation of antioxidant activity of ten compounds in different tea samples by means of an on-line HPLC-DPPH assay [J]. Food Research International,2013, 53(2): 847-856.
[10] Zhang C, Suen C L, Yang C, et al. Antioxidant capacity and major polyphenol composition of teas as affected by geographical location, plantation elevation and leaf grade [J]. Food Chemistry, 2018, 244: 109-119.
[11] Zhao C N, Tang G Y, Cao S Y, et al. Phenolic profiles and antioxidant activities of 30 teas infusions from green, black, oolong, shite, yellow and dark teas [J]. Antioxidants, 2019, 8(7): 215. doi: 10.3390/antiox8070215.
[12] 龚淑英, 周树红. 普洱茶贮藏过程中主要化学成分含量及感官品质变化的研究[J]. 茶叶科学, 2002, 22(1): 51-56.
Gong S Y, Zhou S H. Study on variation of the content of main chemical components and quality of Puer-tea during storage [J]. Journal of Tea Science, 2002, 22(1): 51-56.
[13] 国家质量监督检验检疫总局, 中国国家标准化管理员会. 茶游离氨基酸总量的测定: GB/T 8314—2013[S]. 北京: 中国标准出版社, 2014.
State Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China, China National Standardization Administration Committee. Tea—Determination of free amino acids content: GB/T 8314—2013 [S]. Beijing: China Standards Press, 2014.
[14] 何书美, 刘敬兰. 茶叶中总黄酮含量测定方法的研究[J]. 分析化学, 2007, 35(9): 1365-1368.
He S M, Liu J L. Study on the determination method of flavone content in tea [J]. Chinese Journal of Analytical Chemistry, 2007, 35(9): 1365-1368.
[15] Nian B, Chen L J, Yi C, et al. A high performance liquid chromatography method for simultaneous detection of 20 bioactive components in tea extracts [J]. Electrophoresis, 2019, 40(21): 2837-2844.
[16] 张洁, 陈思敏, 任小盈, 等. 22种不同来源信阳毛尖茶的分类比较[J]. 食品工业科技, 2021, 42(23): 34-40.
Zhang J, Chen S M, Ren X Y, et al. Classification and comparative analysis of 22 Xinyang Maojian teas with various origins [J]. Science and Technology of Food Industry, 2021, 42(23): 34-40.
[17] Zhao M, Su X Q, Nian B, et al. Integrated meta-omics approaches to understand the microbiome of spontaneous fermentation of traditional Chinese pu-erh tea [J]. MSystems, 2019, 4(6): e00680. doi: 10.1128/mSystems.00680-19.
[18] Zhao M, Zhang D L, Su X Q, et al.An integrated metagenomics/metaproteomics investigation of the microbial communities and enzymes in solid-state fermentation of Pu-erh tea [J]. Scientific Reports, 2015, 5: 10117. doi: 10.1038/srep10117.
[19] Ge Y H, Bian X Q, Sun B Q, et al. Dynamic profiling of phenolic acids during pu-erh tea fermentation using derivatization LC-MS approach [J]. Journal of Agricultural and Food Chemistry, 2019, 67(16): 4568-4577.
[20] Long P P, Wen M C, Granato D, et al. Untargeted and targeted metabolomics reveal the chemical characteristic of pu-erh tea () during pile-fermentation [J]. Food Chemistry, 2020, 311: 125895. doi: 10.1016/j.foodchem.2019.125895.
[21] Zhu M Z, Li N, Zhou F, et al. Microbial bioconversion of the chemical components in dark tea [J]. Food Chemistry, 2020, 312: 126043. doi: 10.1016/j.foodchem.2019.126043.
[22] Zhou Z H, Zhang Y J, Xu M, et al. Puerins A and B, two new 8-C substituted flavan-3-ols from Pu-er tea [J]. Journal of Agricultural and Food Chemistry, 2005, 53: 8614-8617.
[23] Wang W, Zhang L, Wang S, et al. 8-C N-ethyl-2-pyrrolidinone substituted flavan-3-ols as the marker compounds of Chinese dark teas formed in the post-fermentation process provide significant antioxidative activity [J]. Food Chemistry, 2014, 152: 539-845.
[24] Zhang H M, Wang C F, Shen S M, et al. Antioxidant phenolic compounds from Pu-erh tea [J]. Molecules, 2012, 17: 14037-14045.
[25] Wang Z H, Zheng C Q, Ma C Q, et al. Comparative analysis of chemical constituents and antioxidant activity in tea-leaves microbial fermentation of seven tea-derived fungi from ripened Pu-erh tea [J]. LWT-Food Science and Technology, 2021, 143: 111006. doi: 10.1016/j.lwt.2021.111006.
[26] Yao Y N, Wu M Y, Huang Y J, et al. Appropriately raising fermentation temperature beneficial to the increase of antioxidant activity and gallic acid content in-fermented loose tea [J].LWT-Food Science and Technology,2017,82: 248-254.
[27] 鲍晓华. 普洱茶贮藏年限的品质变化及种类差异研究[D]. 武汉: 华中农业大学, 2010.
Bao X H. Study of quality change and species diversities in puer tea during different storage time [D]. Wuhan: Huazhong Agricultural University, 2010.
[28] 管俊岭. 贮藏环境与普洱茶风味品质陈化相关性研究[D]. 广州: 华南农业大学, 2016.
Guan J L. Study on correlation between storage environments and flavor shifting during aging of two sorts of Puer tea [D]. Guangzhou: South China Agricultural University, 2016.
[29] 张灵枝, 王登良, 陈维信, 等. 不同贮藏时间的普洱茶香气成分分析[J]. 园艺学报, 2007, 34(2): 504-506.
Zhang L Z, Wang D L, Chen W X, et al. Determination of volatiles of Puer tea stored for different lengths of time [J]. Acta Horticulturae Sinica, 2007, 34(2): 504-506.
[30] 陈梅春, 刘晓港, 朱育菁, 等. 顶空固相微萃取-气质联用法测定不同陈化时间普洱茶香气成分[J]. 食品安全质量检测学报, 2016, 7(6): 2396-2413.
Chen M X, Liu X G, Zhu Y J, et al. Determination of aroma components of aged Pu-erh tea with different storage years based on solid phase microextraction-gas chromatography-mass spectrometry [J]. Journal of Food Safety and Quality, 2016, 7(6): 2396-2413.
Differences of Phenolic Components in Puer Raw Tea with Various Storage Periods and Their Effects on theAntioxidant Capacities
MA Bingsong1, WANG Jiacai1, XU Chengcheng1, REN Xiaoying2, A Cunqiang1,3*, ZHOU Binxing1*
1. Longrun Pu-erh Tea College, Yunnan Agricultural University, Kunming 650201, China; 2. Liaocheng Senior Financial Vocational School, Liaocheng 252000, China; 3. College of Horticulture and Forestry, Huazhong Agricutural University, Wuhan 430073, China
To explore the changes of phenolic compounds and other quality components and their influences on antioxidant abilities during the storage and aging of puer tea, contents of 17 phenolic compounds, 3 purine alkaloids and other quality components in 18 puer tea samples of 6 series with 3 different storage periods were determined by high performance liquid chromatography (HPLC) and other methods. Additionally,antioxidant abilities including ferric ion reducing antioxidant power (FRAP), DPPH scavenging ability (DPPH), ABTS free radical scavenging capacity (ABTS), hydroxyl radical scavenging ability (HSA) and superoxide anion radical scavenging ability (SSA) were determined in all puer raw teas. Combined with sensory evaluation results, multivariate statistical analyses includingprincipal component analysis (PCA) and orthogonal partial least square-discriminate analysis (OPLS-DA) were used to realize the discrimination between new and aged tea during the storage.One-way analysis of variance (ANOVA) showed 7 catechins were highly significantly (<0.01) decreased, while ellagic acid and flavonoids like quercetin, luteolin and kaempferol levels were also highly significantly (<0.01) increased during the storage and aging. And, new puer tea had the highest FRAP, DPPH, ABTS, but the lowest SSA compared with the aging and aged puer teas. Bivariate correlation analysis revealed that the catechins including catechin (C), gallocatechin (GC), epigallocatechin (EGC), epicatechin gallate (ECG) and epigallocatechin gallate (EGCG) impacted FRAP, DPPH and ABTS of puer raw tea during the storage and aging.
puer raw tea, storage and aging, antioxidants, catechins
S571.1
A
1000-369X(2022)01-051-12
2021-06-04
2021-09-29
国家自然科学基金(31960617)
马冰凇,男,硕士研究生,主要从事普洱茶加工与微生物发酵研究。*通信作者:macunqiang1208@aliyun.com;bxzhou01@126.com
(责任编辑:黄晨)

